国食药监械[2008]314号文
- 格式:doc
- 大小:296.50 KB
- 文档页数:8

医疗器械补充界定分类目录SFDA(2003.03.18-2008.09.27公布)2008年10月31日整理 QQ群:33370349 QQ:21722718,MSN:*****************※2003-12-07国食药监械[2003]333号,从2004年6月1日起执行调整的类别:十三、切片石蜡:用于人体组织切片。
不作为医疗器械管理。
二十一、生化试验用加样吸头:不作为医疗器械管理。
二十七、无菌接种环:用于接种标本。
不作为医疗器械管理。
二十八、厌氧指示条:用于指示环境中有无氧气存在。
不作为医疗器械管理。
二十九、磁性搅拌棒:用于试验中搅拌反应物。
不作为医疗器械管理。
三十、化学清洗液:用于清洗试验仪器。
不作为医疗器械管理。
三十一、样品杯:用于装试剂和样品。
不作为医疗器械管理。
※2004-08-31国食药监械[2004]433号,从2005年3月1日起执行:三、脂类检测试剂盒(甘油三脂检测试剂盒、总胆固醇检测试剂盒、高密度脂蛋白胆固醇检测试剂盒、低密度脂蛋白胆固醇检测试剂盒、脂蛋白检测试剂盒、载脂蛋白检测试剂盒):用于测定人血清或血浆中脂类含量,作为II类医疗器械管理。
四、肌酸激酶检测试剂盒、肌酸激酶同工酶检测试剂盒、乳酸脱氢酶检测试剂盒、a-羟丁酸检测试剂盒:用于诊断心肌疾病,作为II类医疗器械管理。
五、无机离子类检测试剂盒(氯检测试剂盒、钙检测试剂盒、磷检测试剂盒、镁检测试剂盒等):用于测定人血清或心血浆中无机离子的含量,作为II类医疗器械管理。
六、糖类检测试剂盒(葡萄糖检测试剂盒、果糖胺检测试剂盒等):用于测定人血清或血浆中葡萄糖或果糖胺的含量,作为II类医疗器械管理。
七、总胆红素检测试剂盒、直接胆红素检测试剂盒、尿酸检测试剂盒、尿素氮检测试剂盒、肌酐检测试剂盒:用于测定人血清或血浆中非蛋白氮类的含量,作为II类医疗器械管理。
八、淀粉酶检测试剂盒:用于测定人血清或血浆中淀粉酶的含量,作为II类医疗器械管理。

有源医疗器械风险管理报告(XXX型XX诊断仪)目录第一章综述 (3)第二章风险管理评审输入 (4)第三章风险管理评审 (5)第四章风险管理评审结论 (7)附录1 (8)附录2 (9)附录3 (13)附录4 (16)第一章综述1产品简介XXX型XX诊断仪其工作原理、产品组成、产品功能……。
(产品外形示意图)2风险管理计划及实施情况简述XXX型XX诊断仪于20XX年开始策划立项。
立项同时,我们就针对该产品进行了风险管理活动的策划,制定了风险管理计划(文件编号:XXXX 版本号:XX)。
该风险管理计划确定了XXX型XX诊断仪的风险可接受性准则,对产品设计开发阶段(包括试生产阶段)的风险管理活动以及生产和生产后信息的获得方法的评审要求进行了安排。
公司组成了风险管理小组,确定了该项目的风险管理负责人。
确保该项目的风险管理活动按照风险管理计划有效的执行。
3此次风险管理评审目的本次风险管理的评审目的是通过对XXX型XX诊断仪产品在上市前各阶段风险管理活动进行总体评价,确保风险管理计划已经圆满地完成,并且通过对该产品的风险分析、风险评价和风险控制,以及综合剩余风险的可接受性评价,证实对产品的风险已进行了管理,并且控制在可接受范围内。
4风险管理评审小组成员及其职责评审人员部门职务XXX 总经理评审组组长XXX 技术部组员XXX 生产部组员质量部组员XXXX 市场服务部(产品应用)组员临床专家(外聘)组员第二章风险管理评审输入1 风险可接受准则见附件12 风险管理文档风险管理计划文件编号:XXXX 版本号XXXXX型XX诊断仪安全性特征问题清单文件编号:XXXX 版本号XX初始危害判断及初始风险控制方案分析文件编号:XXXX 版本号XX风险评价表、风险控制措施记录表文件编号:XXXX 版本号XX……3 相关法规……关于执行 GB 9706.1-2007《医用电气设备第一部分:安全通用要求》有关事项的通知(国食药监械[2008]314号)……4相关标准GB 9706.1-2007GB 9706.15-1999YY 0505-2005……5相关文件和记录风险管理控制程序文件编号:XXXX 版本号XX产品设计开发文档(主要包括设计图纸、工艺、DFMEA表XXXXX、PFMEA表XXXXX等)……。


环保型输液(血)器用专用粘接剂(环己酮替代技术)环保型输液(血)器用专用粘接剂(环己酮替代技术)1、了解环己酮中文名称:环己酮英文名称:Cyclohexanone;KetohexamethyleneCAS No.:108-94-1分子式:C6H10O;(CH2) 5CO分子量:98.14外观与性状:无色或浅黄色透明液体,有强烈的刺激性臭味。
危险特性:易燃,遇高热、明火有引起燃烧的危险,与氧化剂接触猛烈反应。
致癌性:IARC致癌性评论:动物可疑阳性。
致畸性:大鼠吸入最低中毒浓度(TCL0):105 mg/m3,4 h(孕1~20 d用药),致植入前的死亡率升高。
小鼠经口最低中毒剂量(TDL0):11 g/kg(孕8~12 d 用药),影响新生鼠的生长统计(如体重增长的减少)。
致突变性:微粒体诱变,鼠伤寒沙门氏菌20 μl/L。
健康危害:本品具有麻醉和刺激作用,液体对皮肤有刺激性;眼接触有可能造成角膜损害;长期反复接触可致皮炎。
环境影响:对环境有危害,对水体应给予特别注意。
高浓度的环己酮有麻醉性,对中枢神经系统有抑制作用。
对皮肤和粘膜有刺激作用。
高浓度的环己酮发生中毒时会损害血管,引起心肌,肺,肝,脾,肾及脑病变,发生大块凝固性坏死。
通过皮肤吸收引起震颤麻醉、降低体温、终至死亡。
在25PPM的气氛下刺激性小,但在50PPM以上时,就难以忍受。
工作场所环己酮的最高容许浓度为200mg/m3。
中国职业接触限值(GBZ 2—2002)最高容许浓度(MAC)时间加权平均容许浓度(TWA)短时间接触容许浓度(STEL)— 50 mg/m3 100 mg/m3环境标准前苏联(1975) 居住区大气中有害物质的最高容许浓度0.04 mg/m3(最大值,昼夜均值)2、行业当前使用情况现状:我国大部分企业输液(血)器部件粘接剂采用的是环己酮,虽然有些企业对粘接剂进行了改良,加入一些其他改良剂,但配方中仍以环己酮为主,并且还有相当一部分企业在粘接时是直接蘸取环己酮,这样蘸取多少就会因人而异,甚至同一个人由于操作较快,也很难保证蘸取量的一致性,从而使管壁及内腔残留的环己酮较多且不均匀,造成产品只与只之间的差异。

新型环保无毒无味气输液(血)器(管、罩)用专用粘接剂据我司市场调查所了解,目前国内大部分医疗器械耗材制造厂家PVC类产品(如输液管,引流管,输液袋,导尿管,流食管,等低附加值的大众产品,甚至氧气面罩和呼吸类产品);基本上都是采用环已酮溶剂直接做粘合用,其中也有规模的厂家和上市公司;不过他们会采用2种溶剂(环已酮、四氢呋喃).生产过程中基本上是以环已酮为主,四氢呋喃只不过是在客户验厂,考查,出口申报的书面资料上备注是采用四氢呋喃。
以上2款溶剂据实验所了解,基本上都不是环保合格的产品,且在生产车间对工人的危害性大;现在企业基本上奉行以人为本的管理理念,所以以上2 款产品最终将会被更环保的产品所取代.环已酮和四氢呋喃且说是国家医疗部门所允许使用的,但在使用过程中,量的把控和残留及工人的操作规范都或多或少存在不尽人意的因素;据相关报道,原在浙江玉环就有一批因环已酮的残留量超标而被相关部门关停和整改的厂家.在化工业内有这么一句话“女怕呋喃,男怕吡啶”,现分析下环已酮和四氢呋喃的危害.第一章四氢呋喃一.四氢呋喃健康危害:具有刺激和麻醉作用,高浓度吸入后会引起上呼吸道刺激、恶心、头晕、头痛胸闷、胸痛、咳嗽、乏力、胃痛、口干、呕吐等症状和中枢神经系统抑制。
部分患者可能引起肝、肾损害。
液体或高浓度蒸气对眼有刺激性。
尿中THF浓度与环境中的THF浓度相关,还会流鼻血,可引起胃出血和溃疡;高剂量或反复接触,可出现肝脂肪浸润及细胞溶解。
20%水溶液直接涂于人皮肤可引起中度皮肤刺激,50% 水溶液可引起严重的腐蚀性损害。
20%水溶液用于人眼可引起严重的眼角膜损坏:长期接触会导致失去性功能、生育能力,或肾疾病!其他方面也就是呼吸道方面的了四氢呋喃微溶于水,能被代谢的.二.四氢呋喃物理特性四氢呋喃是一类杂环有机化合特。
它是强的极性醚类之一,在化学反应和萃取时用做一种中等极性的溶剂。
无色易挥发液体,有类似于乙醚的气体。
水、乙醇、乙醚、丙酮、笨等多数有机溶剂。
![国家食品药品监督管理局关于印发医疗器械生物学评价和审查指南的通知-国食药监械[2007]345号](https://uimg.taocdn.com/3de2cc3aabea998fcc22bcd126fff705cc175c07.webp)
国家食品药品监督管理局关于印发医疗器械生物学评价和审查指南的通知制定机关国家食品药品监督管理局(已撤销)公布日期2007.06.15施行日期2007.06.15文号国食药监械[2007]345号主题类别药政管理,专利申请效力等级部门规范性文件时效性现行有效正文:---------------------------------------------------------------------------------------------------------------------------------------------------- 国家食品药品监督管理局关于印发医疗器械生物学评价和审查指南的通知(国食药监械[2007]345号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局):为规范医疗器械生物学评价和审查工作,我局组织制定了《医疗器械生物学评价和审查指南》。
现印发给你们,请参照执行,并将有关事项通知如下:一、申请涉及生物学评价的产品注册的企业,可提供生物学评价报告(含支持性文件)代替产品注册检验报告中的生物学试验部分,或进行全项生物学试验。
二、国外企业提供的医疗器械生物学评价报告中含有生物学试验报告的,企业应提供生物学试验室所在国的GLP证明。
附件:1.医疗器械生物学评价和审查指南2.《医疗器械生物学评价报告》的出具与审查要点国家食品药品监督管理局二○○七年六月十五日附件1:医疗器械生物学评价和审查指南一、目的与范围为使GB/T 16886-ISO 10993系列标准能够正确而有效地实施,特制定本指南。
本指南为医疗器械评价者提供了生物学评价指南,为医疗器械的审查提供了生物安全性审查指南。
注:本指南不涉及微生物污染、灭菌(如“无菌”、“细菌内毒素”)、除菌和动物源性医疗器械的病毒去除与控制等方面的生物安全性。
二、术语(一)医疗器械:同《医疗器械管理管理条例》。
(二)制造者:医疗器械制造者或商标持有人/单位。

国家食品药品监督管理局关于发布《医用缝合针》等18项医疗器械行业标准的通知文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2005.07.18•【文号】国食药监械[2005]380号•【施行日期】2006.06.01•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】标准化正文国家食品药品监督管理局关于发布《医用缝合针》等18项医疗器械行业标准的通知(国食药监械[2005]380号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局),各医疗器械标准化技术归口单位:YY0043-2005《医用缝合针》等18项医疗器械行业标准已经审定通过,现予以发布。
该行业标准的编号、名称及实施日期如下:一、强制性行业标准1.YY0043-2005《医用缝合针》(替代YY0043-1991)2.YY0075-2005《泪道探针》(替代YY0075-1992)3.YY0167-2005《非吸收性外科缝线》(替代YY0167-1998)4.YY0174-2005《手术刀片》(替代YY/T0174-1994,YY0293-1997)5.YY0175-2005《手术刀柄》(代替YY/T0175-2005)6.YY0569-2005《生物安全柜》7.YY0570-2005《医用电气设备第二部分:手术台安全专用要求》8.YY0571-2005《医用电气设备第二部分:医院电动床安全专用要求》9.YY0572-2005《血液透析和相关治疗用水》10.YY0573.3-2005《一次性使用无菌注射器第3部分:自毁型固定剂量疫苗注射器》二、推荐性行业标准1.YY/T0177-2005《组织钳》(替代YY/T0177-1994)2.YY/T0173.4-2005《手术器械唇头钩唇头齿锁止牙蛋形指圈》(替代YY /T0173.4-1994,YY/T0173.5-1994,YY/T0173.6-1994,YY/T0173.8-1994)3.YY/T0179-2005《丁字式开口器》(替代YY/T0179-1994)4.YY/T0249.1-2005《外科器械金属材料第1部分:不锈钢》5.YY/T0295.1-2005《医用镊通用技术条件》(替代YY/T0295.1-1997)6.YY/T1000.1-2005《医疗器械行业标准的制定第1部分:阶段划分、代码和程序》7.YY/T1000.2-2005《医疗器械行业标准的制定第2部分:工作指南》8.YY/T1021-2005《拔牙钳》(替代YY91021-1999,YY91022-1999)以上标准自2006年6月1日起实施。
![国家食品药品监督管理局关于医用吸脂机等产品分类界定的通知-国食药监械[2008]115号](https://uimg.taocdn.com/26e7cefa534de518964bcf84b9d528ea81c72f07.webp)
国家食品药品监督管理局关于医用吸脂机等产品分类界定的通知正文:---------------------------------------------------------------------------------------------------------------------------------------------------- 国家食品药品监督管理局关于医用吸脂机等产品分类界定的通知(国食药监械[2008]115号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局),各医疗器械标准化技术委员会及归口单位:为适应医疗器械监督管理工作的需要,国家局组织有关专家对医用吸脂机等89种产品进行了分类界定。
现通知如下:一、医用吸脂机:由针具、手柄、控制器、脚踏开关及附件组成。
通过产生接近脂肪固有频率的机械共振波,选择性破碎、乳化脂肪细胞,并利用负压将脂肪吸出。
作为Ⅲ类医疗器械管理。
分类编码6823。
二、无创呼吸设备:用于治疗呼吸功能不全的产品,作为Ⅲ类医疗器械管理;若仅用于治疗阻塞性睡眠呼吸暂停综合症的产品,作为Ⅱ类医疗器械管理。
分类编码6854。
三、眼科断层成像仪:由一套光学照明系统和一套相干层析扫描光学系统组成,用于眼科疾病的检查。
作为Ⅲ类医疗器械管理。
分类编码6822。
四、还原离子治疗仪:采用高压元器件产生电子,经离子变换器产生负离子,负离子通过导子极板导入人体,从而抑制生物体内活性氧,用于疾病的辅助治疗。
作为Ⅲ类医疗器械管理。
分类编码6826。
五、输尿管镜:由转轴、工作通道、目镜、冲洗口、指示灯连接柱、数显镜头、光纤等组成,用于泌尿系统的检查和手术。
作为Ⅲ类医疗器械管理。
分类编码6822。
六、消化道粘液清洗剂:由碳酸氢钠溶液和链霉蛋白酶配制而成。
用于清洗消化道粘膜上的粘液,改善内窥镜下染色效果。
作为Ⅲ类医疗器械管理。
分类编码6822。
七、人工椎间盘:模拟正常人类椎间盘的特殊装置。

国食药监械[2008]314号关于执行GB 9706.1-2007《医用电气设备第一部分:安全通用要求》有关事项的通知各省、自治区、直辖市食品药品监督管理局(药品监督管理局),各医疗器械标准化技术委员会及归口单位:GB 9706.1-2007《医用电气设备第一部分:安全通用要求》(以下简称GB 9706.1-2007标准)已由国家标准化管理委员会发布,并将于2008年7月1日实施。
为了及时有效地贯彻标准,进一步保证上市医用电气设备的安全性能,现就有关事项通知如下:一、自GB 9706.1-2007标准实施之日起,各医用电气设备生产企业应按该标准的要求,组织生产医用电气设备。
二、对已注册的医用电气设备,各医用电气设备生产企业可在注册证书有效期届满前,按照GB 9706.1-2007标准的有关要求申请重新注册。
三、自GB 9706.1-2007标准实施之日起,各有关检测机构应按该标准进行检测并出具相关产品注册检测报告。
此前,有关医用电气设备已经按照原标准完成注册检测并取得注册检测报告的,其注册检测报告可以继续作为注册申请资料,其电气安全要求仍可按照原标准进行审查和审批。
四、自本通知发布之日起,医用电气设备的注册产品标准中,电气安全部分可不单独编制附录A,但须明确产品符合的电气安全国家标准或行业标准及产品主要安全特征(见附件),并按标准条款的顺序明确适用项。
五、GB 9706.1-2007标准中引用的YY 0505-2005《医用电气设备第1-2部分:安全通用要求-并列标准:电磁兼容要求和试验》,按照《关于延期实施YY0505-2005〈医用电气设备第1-2部分:安全通用要求并列标准:电磁兼容要求和试验〉行业标准的通知》(国食药监械〔2006〕499号)的有关规定执行;引用的IEC 60601-1-4:2004《医用电气设备第1-4部分:安全通用要求-并列标准-可编程医用电气系统》,待其转化为我国医疗器械标准发布实施后执行。
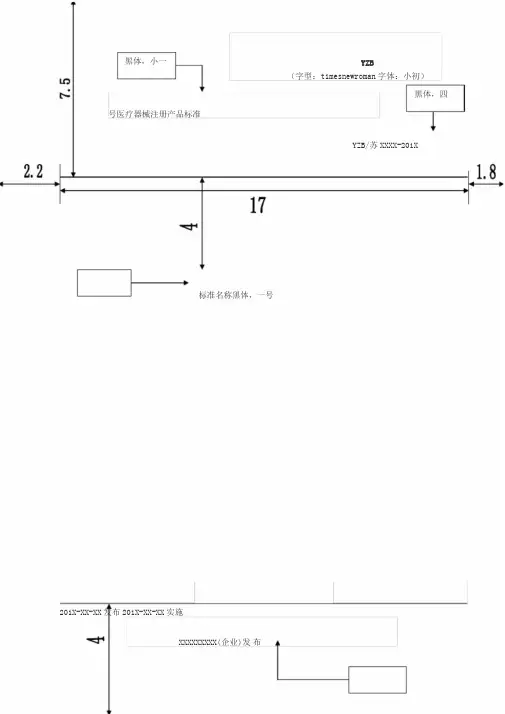
黑体,小一YZB(字型:timesnewroman字体:小初)黑体,四号医疗器械注册产品标准YZB/苏XXXX-201X标准名称黑体,一号201X-XX-XX发布201X-XX-XX实施XXXXXXXXX(企业)发布1黑体,四号前言主要给出下列信息:1、说明与对应的国家标准、行业标准或国际标准的一致性程度;2、说明本标准编写格式符合GB/T1.1的要求3、说明本标准与其它标准或前版标准的关系或代替情况(如有);4、必要时,说明本标准中的附录的性质。
5、目前该产品尚无国家标准、行业标准,为规范产品的技术特性,确保产品的安全有效,特制订本注册产品标准,作为生产质量控制的依据。
(此条款在无相应国家标准和行业标准时描述)举例如下:医用电气设备前言的描述XXXXXXXXXXXXXXXXX是本公司生产的产品。
根据《医疗器械监督管理条例》、《医疗器械标准管理办法》特制订本注册产品标准作为该产品生产、检验的质量依据。
本标准的内容遵循了国家及行业的有关XXXXXXXXX的X标准规定,标准主要技术参数的设定依据了XXXXX《XXXXXXXXXXX》X X和XXXXXXXXX《XXXXXXXXXXX》X等标准。
安全要求符合GB 9706.1-2007《医用电器设备第一部分:安全通用要求》、XXXXXXXXXXXXXXXXXXXX等X标XX准;相关参数值的确定参考了XXXXXXXX参X数。
本标准的格式符合GB/T1.1-2009《标准化工作导则第1部分:标准的结构和编写规则》的要求。
本标准的附录A为规范性附录。
本标准由XXXXXXXXXXX提X X出。
本标准起草单位:XXXXXXXXXXXXXXXXXXXXX起X草XX。
本标准主要起草人:XX、XXX。
本标准于XXXX年X月XXX日首次发布。
产品名称1范围本注册标准适用于XXXX(产品名称)。
本注册标准规定了XXXX(产品名称)的产品分类(如有)、要求,试验方法,检验规则,标志、包装、运输、贮存等内容。

我国医用氧气及分子筛制氧设备监管要求和对策氧气在临床医疗上广泛应用,其质量直接关系着患者的健康和安全。
曾报道医疗机构使用大量工业氧冒充医用氧的事件,国家监管部门从产品注册、使用等方而采取了一系列监管强化措施[2-5]。
目前我国医用氧和供氧源设备按不同类别管理,本文分析医用氧气的管理模式和质量要求,以期合理应用、监管医疗用氧。
1氧气的制备方法一般有化学法、电解法、固体膜分离法、吸附法、冷冻法等。
制造医用氧气常用后两法。
1.1低温空气分离法即深度冷冻法制氧,是将空气加压、冷却而液化,利用氧、氮等沸点的不同(氧气—182.98C%氮气:-195.8C%氮气:-185.7C。
),在精饰塔内经多次冷凝蒸发,高沸点的氧组分不断冷凝进入液相,低沸点的氮组分不断蒸发为气体,达到氧氮分离的目的。
1.2变压吸附法(PSA)以沸石分子筛为吸附剂,利用加压吸附,降压解吸的原理从空气中吸附和释放氧气,从而分离岀氧气。
沸石分子筛表而和内部布满微孔的球形颗粒状吸附剂,对氧气、氮气的分离作用是基于其动力学直径的微小差别,氮气分子在沸石分子筛的微孔中有较快的扩散速率, 被吸附;氧气分子扩散速率较慢,不被吸附;水和二氧化碳的扩散速率与氮气相近。
沸石分子筛吸附量具有随压力变化的特性,改变其压力,可使吸附与解吸交替操作,整个过程周期性地动态循环,最终富集出氧气。
2氧气的质量标准2.1GB/T 3863-2008适用于由深度冷冻法分离空气和电解水等方法制取的气态或液态氧,主要用于冶金、化工、环境、火焰加工等。
技术要求:氧含量(体积分数)分为不小于99.5%和gg.2%两种,均无游离水。
2.2 GB 8982-2009代替GB8982-1998«医用氧》和GB8983-1998«航空呼吸用氧》,适用于由分离空气制取的气态及液态医用氧、航空呼吸用氧。
主要用于医疗、制备潜水呼吸混合气、航空飞行呼吸等。
技术要求:无异味;氧含量(体积分数)不小于99.5%,水分含量(露点)不大于-43C°;二氧化碳含量(体积分数)不大于100x10- 6;一氧化碳含量(体积分数)不大丁5x10-6;总坯含量(体积分数)不大于60x10-6;固体物质粒度不大于100 ym,含量不大于1 mg/m3;气态酸性物质和碱性物质含量、臭氧及其他气态氧化物检验合格。
食品安全制度法规体系变迁的核心新中国成立以来,我国食品安全监管体制和机构经历了多次变迁,在法律法规、监管体制等方面也取得了重大成果。
2009 年《食品安全法》的正式实施,标志着我国食品监管理念从1995 年的保障“食品卫生”转变为保障“食品安全,保障公众身体健康和生命安全”。
2015 年新修订的《食品安全法》中首次出现保健食品、特殊医学用途配方食品、婴幼儿配方乳粉三大类食品为特殊食品的法律概念,具有划时代的里程碑意义。
特殊食品作为食品的重要组成部分,事关特定人群的身体健康和生命安全。
中国已经成为全球最大特殊食品消费市场,市场规模超过6000 亿元。
随着国民经济的发展和人民消费水平的不断提高,以营养保健为主的食品消费正逐步成为民众消费的主流,特殊食品市场需求在不断增长。
特殊食品正成为食品企业转型升级的新热点。
2019 年是新中国成立70 周年,亦是新《食品安全法》颁布施行第四年。
回首过去,我国的三类特殊食品监管工作爬坡过坎、滚石上山,经历了惨痛的教训,亦在发展中不断规范,在规范中谋求新的发展。
回顾和梳理新中国成立以来,我国三类特殊食品的监管法规体系演变历程,必将为推进新时期持续做好特殊食品安全性监管工作发挥积极的作用。
一新中国成立初期至2015年以前,中国三类特殊食品监管体系经历了混合过渡阶段,各自在阵痛中不断完成自我成长01 保健食品1 保健食品制度的确立(1)新中国成立初期国家经济委员会在协同劳动部对从事有毒有害、高温、井下作业工人的保健食品和矿山工人的粮食、营养补助食品的供应情况进行调查研究的基础上, 于1963年3 月向国务院总理写了《关于从事有毒有害、高温、井下作业工人的食品供应情况和意见的报告》, 国务院以国经周字216 号文件批转了这个报告 [2]。
根据此文件, 原劳动部、原卫生部等七部门于1963 年7 月19 日联合发布了《关于贯彻国务院批转国家经济委员会报告实行保健食品制度的联合通知》, 据此, 我国正式建立保健食品制度。
国家⾷品药品监督管理总局办公厅关于体外⾼频治疗机等47个产品分类界定的通知⽂号:⾷药监办械管[2013]31号颁布⽇期:2013-07-08执⾏⽇期:2013-07-08时效性:现⾏有效效⼒级别:部门规章各省、⾃治区、直辖市⾷品药品监督管理局(药品监督管理局):为适应医疗器械监督管理⼯作的需要,国家⾷品药品监督管理总局组织有关单位和专家对体外⾼频治疗机等47个产品的管理类别进⾏了界定。
现通知如下:⼀、作为Ⅲ类医疗器械管理的产品(4个)(⼀)体外⾼频治疗机:由⾼频功率源、操作台、治疗床等组成。
⽤于前列腺和前列腺增⽣、盆腔炎、附件炎等慢性炎症和癌症的辅助治疗。
分类编码6825。
(⼆)光学分⼦影像⼿术导航系统:由光学信号采集模块、光源模块、系统⽀撑模块以及计算机处理模块等组成。
⽤于辅助临床医⽣完成对乳腺癌等癌症前哨淋巴的术中准确定位和切除操作。
该产品不包含荧光染料。
分类编码6824。
(三)低频电刺激治疗仪:分为可移动式和便携式两种型号。
可移动式型号由主机、机架、储物台和输出电极夹组成,便携式型号由主机和输出电极组成。
通过输出⼀组特定电刺激波形,对患者脑部相关⽳位进⾏刺激。
⽤于改善⼈体抑郁、焦虑及失眠等症状。
分类编码6826。
(四)近红外光脑⾎肿检测仪:由脑⾎肿探测器、⼀次性防护套和座充组成。
⽤于辅助筛查评估疑似颅脑创伤颅内⾎肿(⾎量⼤于3.5毫升、距离⼤脑表⾯2.5厘⽶内)的成年患者。
分类编码6821。
⼆、作为Ⅱ类医疗器械管理的产品(15个)(⼀)腹腔镜线结推送器:由线结固定槽、推送杆和⼿柄组成,固定槽材料为304不锈钢。
⽤于将体外打结缝线放⼊腹腔镜术区中。
分类编码6822。
(⼆)腹腔镜组织袋导⼊器:由导⼊器和⼿柄组成,导⼊器材料为304不锈钢。
⽤于辅助导⼊组织袋。
该产品不含组织袋。
分类编码6822。
(三)臭氧消毒护理器:主要由臭氧消毒装置、吸引装置、污⽔桶、坐垫和腰垫等组成。
⽤于⼤⼩便不能⾃理的⼈员,⾃动吸取其便溺物,并对其私处进⾏清洗和消毒,具备预防褥疮的功能。
医疗器械风险管理报告(XXX型XX诊断仪)文件编号:批准人:批准日期:目录第一章综述 (3)第二章风险管理评审输入 (4)第三章风险管理评审 (5)第四章风险管理评审结论 (7)附录1 (8)附录2 (9)附录3 (13)附录4 (16)第一章综述1产品简介XXX型XX诊断仪其工作原理、产品组成、产品功能……。
(产品外形示意图)2风险管理计划及实施情况简述XXX型XX诊断仪于20XX年开始策划立项。
立项同时,我们就针对该产品进行了风险管理活动的策划,制定了风险管理计划(文件编号:XXXX 版本号:XX)。
该风险管理计划确定了XXX型XX诊断仪的风险可接受性准则,对产品设计开发阶段(包括试生产阶段)的风险管理活动以及生产和生产后信息的获得方法的评审要求进行了安排。
公司组成了风险管理小组,确定了该项目的风险管理负责人。
确保该项目的风险管理活动按照风险管理计划有效的执行。
3此次风险管理评审目的本次风险管理的评审目的是通过对XXX型XX诊断仪产品在上市前各阶段风险管理活动进行总体评价,确保风险管理计划已经圆满地完成,并且通过对该产品的风险分析、风险评价和风险控制,以及综合剩余风险的可接受性评价,证实对产品的风险已进行了管理,并且控制在可接受范围内。
4风险管理评审小组成员及其职责第二章风险管理评审输入1 风险可接受准则见附件12 风险管理文档风险管理计划文件编号:XXXX 版本号XXXXX型XX诊断仪安全性特征问题清单文件编号:XXXX 版本号XX初始危害判断及初始风险控制方案分析文件编号:XXXX 版本号XX风险评价表、风险控制措施记录表文件编号:XXXX 版本号XX……3 相关法规……关于执行 GB 9706.1-2007《医用电气设备第一部分:安全通用要求》有关事项的通知(国食药监械[2008]314号)……4相关标准GB 9706.1-2007GB 9706.15-1999YY 0505-2005……5相关文件和记录风险管理控制程序文件编号:XXXX 版本号XX产品设计开发文档(主要包括设计图纸、工艺、DFMEA表XXXXX、PFMEA表XXXXX等)……第三章风险管理评审1 风险管理计划完成情况评审小组对风险管理计划的完成情况逐一进行了检查,通过对相关风险管理文档的检查,认为XXX型XX诊断仪风险管理计划已基本落实实施。
病人监护仪注册申报的若干要求国家食品药品监督管理局医疗器械技术评审中心评审一处张嵩主要内容1 病人监护仪的特点及对申报2 注册申请表的基本要求3 说明书的基本要求4 临床资料的基本要求5 现阶段实行的国家标准和行业标准6 软件的要求7 报警的要求8 注册产品标准的若干要求病人监护仪的特点及对申报人员的要求1 技术成熟2 市场上市品种类较多3 功能丰富4 安全标准和性能标准较多5 具备工程技术、生理方面的基础知识6 了解申报产品,了解国行标要求7 认真细致8 沟通能力好注册申请表1 产品名称(1)监护还是测量?(2)可被称为“监护”必要条件:监护仪:±连续检测患者的生理指标,应大于等于24小时±实时显示患者的生理指标±提供生理报警2 例如:心电、血压(IBP 和NIBP)、血氧饱和度、脉搏、呼吸、体温、CO2、心排量等。
注册申请表3 产品名称(1) 监护仪还是监护系统(2) 医用电气系统:根据GB 9706。
15—2008,医用电气系统是多台设备的组合,其中至少有一台为医用电气设备,并通过功能连接或使用可移动式多孔插座互连。
(3)“监护仪(简称系统)”是错误的。
(4)在申报资料中,如注册申请表、注册产品标准、说明书等处,产品名称必须保持一致!注册申请表4型号、规格5产品性能、结构及组成(1) 明确产品的结构及详细组成,产品的各组件(含主机、部件、附件和软件组成)的名称、型号、规格、主要性能指标.如有外购件,应明确生产企业。
6 产品适用范围:应详细、确切,不应出现“等"字.7产品禁忌症:“无”禁忌症是不恰当的,可填“尚未明确".说明书8 应符合《医疗器械说明书、标签和包装标识管理规定》(国家局十号令)的要求。
9 根据国家局十号令第四条:(1)医疗器械说明书是指由生产企业制作并随产品提供给用户的,能够涵盖该产品安全有效基本信息并用以指导正确安装、调试、操作、使用、维护、保养的技术文件.(2)说明书应明确申报产品的详细的规格参数和性能指标.国家局十号令第七条要求:(1)产品名称、型号、规格.(2)生产企业名称、注册地址、生产地址、联系方式及售后服务单位.(3)医疗器械生产企业许可证》编号(第一类医疗器械除外)、医疗器械注册证书编号。
YZB/粤 -2008参考件——按照国食药监械〔2008〕314号文要求,以电刺激理疗仪为例
注:如果产品还涉及其他安全专用标准,建议以附录B的型式出现。
附录A
安全特征及适用性项目
A.1 刺激器主要安全特征
A.1.1 按防电击类型分类:Ⅰ类。
A.1.2 按防电击类型分类:具电刺激理疗功能,应用部分BF型。
A.1.3 按对进液的防护程度分类:IPX0(不防进液的封闭设备)。
A.1.4 按在与空气混合的易燃麻醉气或与氧或氧化亚氮混合的易燃麻醉气情况下使用时的安全程度分类:非AP/APG型。
A.1.5 按运行模式分类:连续运行。
A.1.6 刺激器的额定电压和频率:a.c.220V,50Hz。
A.1.7 刺激器的输入功率:60VA。
A.1.8 刺激器是否具有对除颤放电效应防护的应用部分:无。
A.1.9 刺激器是否具有信号输出或输入部分:无信号输出或输入部分。
A.1.10 永久性安装设备或非永久性安装设备:非永久性安装设备。
A.1.11 电气绝缘图:见图A.1。
A.1.12 GB9706.1-2007适用条款明细:见表A.2。
A.2 检验规则
A.2.1 刺激器的安全性能检验分出厂检验和型式检验。
A.2.2 出厂检验
出厂检验是刺激器交货时应进行的检验,应逐台进行,检验项目至少为GB9706.1-2007中18f)、
19、20,所检项目均应合格。
A.2.3 型式检验
型式试验样机为一台。
检验项目应包括GB9706.1-2007适用的全部项目,所检验项目均应符合本标准要求。
在检验的项目中若出现不符合本标准要求的项目时,应抽取双倍数量的刺激器,对不合格的项目进行重复检验,若仍有不符本标准的项目,则判为不合格。
绝缘图表
图A.1 绝缘图
表A.1 绝缘表
序号绝缘路径绝缘类型基准电压测试电压爬电距离电气间隙
①A-f B.I. 220 V~1500 V 3.0 mm 1.6 mm
②A-a1 B.I.. 220 V~1500 V 4.0 mm 2.5 mm
③A-a2 D./R.I. 220 V~4000 V 8.0 mm 5.0 mm
④B-a D./R.I. 220 V~4000 V 8.0 mm 5.0 mm
⑤B-d B.I. 220 V~1500 V 4.0 mm 2.5 mm
⑥A-a2 D./R.I. 12 V~500 V 3.4mm 1.6 mm
⑦A-a1 B.I. 12 V~500 V 1.7 mm 0.8 mm
⑧B-a D./R.I. 12 V~500 V 3.4 mm 1.6 mm
表A.2 GB9706.1-2007适用项目明细表
注解: 1. 表1中“√”代表此条款适用。
2. 表1中“----”代表无特殊说明。
A.3 电气安全要求的适用项目的试验方法
按照GB9706.1标准中规定的方法进行检测。