最新4蛋白组学翻译后修饰
- 格式:ppt
- 大小:1.37 MB
- 文档页数:7



蛋白质翻译后修饰的分子机制和调控蛋白质是构成生命体的重要分子之一,而蛋白质翻译后修饰则是蛋白质功能发挥的重要环节。
常见的蛋白质翻译后修饰包括磷酸化、乙酰化、甲基化、糖基化等,这些修饰可以改变蛋白质的结构和功能,从而调节基因表达、细胞周期和信号传导等生命活动。
蛋白质翻译后修饰的分子机制较为复杂,其中磷酸化是最为常见和重要的修饰形式之一。
磷酸化是向蛋白质分子中加入一个负电荷磷酸基团,使蛋白质分子带有电荷,从而改变分子的空间结构和功能。
磷酸化是由蛋白激酶、磷酸酰化酶、磷酸肽酶等酶催化的,这些酶在不同的细胞信号通路中发挥了重要作用。
例如,细胞周期中,CDK激酶和cyclin结合后可以磷酸化pRB蛋白,从而使其失去抑制作用,启动细胞进入有丝分裂期。
而P53蛋白在DNA受损时,ATM激酶可以磷酸化P53,使其起到维持基因组稳定性的作用。
乙酰化修饰是将乙酰基团加入到蛋白质分子的赖氨酸残基上,从而改变蛋白质的电荷状态和结构。
乙酰化修饰由组蛋白乙酰转移酶和去乙酰化酶等酶催化完成,常常参与染色质重塑和基因转录调控。
例如,组蛋白H3可以通过乙酰化修饰在启动子区域和增强子区域形成一个开放的染色质结构,从而让转录因子和RNA聚合酶进入DNA,启动基因转录。
甲基化修饰则是将甲基基团加在蛋白质分子的氨基酸残基上,从而不同程度改变蛋白质的活性和特异性。
甲基化修饰由甲基转移酶、甲基去除酶等酶催化完成,参与了基因表达、细胞周期控制和免疫调节等生命活动。
例如,DNA甲基化可以抑制基因转录,而细胞周期中某些细胞因子的甲基化修饰则可以促进细胞增殖和分化。
糖基化修饰是将糖基团加在蛋白质分子的羟基或氨基上,从而改变蛋白质的生物学功能和稳定性。
糖基化修饰由糖基转移酶、糖醛酸酶等酶催化完成,参与了免疫调节、细胞识别和信号转导等生命活动。
例如,IgG的糖基化状态可以决定其结合免疫细胞受体的亲和力和效力,从而调节免疫应答。
蛋白质翻译后修饰的调控非常重要,不同的酶家族、信号通路和细胞环境都可以影响蛋白质修饰的状态和效率。

翻译后修饰蛋白质功能的塑造蛋白质是生命体内最重要的分子之一,承担着许多生命活动的关键角色。
然而,蛋白质的功能远不止其原始氨基酸序列所决定的,翻译后修饰对蛋白质的结构和功能起着至关重要的作用。
本文将探讨翻译后修饰如何塑造蛋白质功能,并介绍其中几种常见的修饰方式。
一、磷酸化修饰磷酸化是蛋白质修饰中最常见的一种方式。
它通过酶的作用,在蛋白质上加上磷酸基团,从而改变蛋白质的电荷分布和构象。
这种修饰可以调节蛋白质的活性、稳定性和相互作用能力。
例如,在细胞信号传导过程中,磷酸化修饰可以激活或抑制关键的信号通路分子,从而影响细胞的生理状态。
二、甲基化修饰甲基化修饰是指在蛋白质上加上甲基基团。
这种修饰方式常见于蛋白质的氨基酸残基上,如赖氨酸和精氨酸。
甲基化修饰可以影响蛋白质的稳定性、相互作用和定位。
举个例子,组蛋白上的赖氨酸甲基化可以调节染色质的结构和基因的转录活性。
三、醋酸化修饰醋酸化修饰是指在蛋白质上加上乙酰化基团。
这种修饰方式可以发生在组蛋白和非组蛋白蛋白上,调节蛋白质的表观遗传状态、转录调控、DNA损伤修复等生物学过程。
醋酸化修饰可以改变蛋白质的电荷状态,从而影响蛋白质的结构和功能。
四、糖基化修饰糖基化修饰是指在蛋白质上加上糖基团。
这种修饰方式常见于细胞膜上的蛋白质,可以影响蛋白质的定位和识别。
糖基化修饰可以使蛋白质易于与其他蛋白质或细胞外分子相互作用,从而影响细胞间相互作用、细胞信号传导等过程。
总结起来,翻译后修饰蛋白质功能的塑造是通过改变蛋白质的结构和电荷状态,调节其活性、相互作用以及参与的生物学过程。
磷酸化、甲基化、醋酸化和糖基化是常见的修饰方式,它们在细胞信号传导、染色质结构调节、蛋白质定位和细胞间相互作用等方面发挥着重要的作用。
随着对蛋白质修饰研究的深入,我们对这些修饰方式的理解将进一步增加,为未来的生命科学研究和药物开发提供更多的可能性。

蛋白质翻译后修饰的功能调节蛋白质是生命体的基本构成单元,具有重要的生物学功能。
一个蛋白质的折叠状态、互作性质及其功能都与其翻译后修饰相关。
翻译后修饰包括糖基化、磷酸化、酰化和胺基酸甲基化等。
这些修饰可以调节蛋白质的功能,影响细胞内和与外界的相互作用。
糖基化是一种常见的修饰方式,它可以增加蛋白质的稳定性、降低其降解速率并影响其互作性质。
糖基化一般发生在蛋白质表面上的异位氨基酸上,形成糖链结构。
这种结构可以与其他蛋白质或脂质相互作用,形成复合物或是与细胞膜结合,进而参与细胞信号转导传递。
磷酸化是蛋白质翻译后的另一种常见的修饰方式,通过将磷酸基团添加到蛋白质的亲水性氨基酸上,调节蛋白质的构象、激活或是抑制其功能。
磷酸基团的添加和去除被称为激酶和磷酸酶催化,它们可以是细胞内的蛋白质,也可以是外源性因子。
磷酸化还可以直接或通过其他蛋白质结构影响各种细胞过程,如细胞周期、细胞凋亡、细胞迁移等。
另一种常见的修饰方式是酰化,它通过在蛋白质的侧链氨基酸上添加脂肪酸、羧酸或甲酰酰胺等分子,影响蛋白质的跨膜转运和细胞内运输。
酰化的添加和去除也是一种负责催化的细胞信号转导路径,这种过程可以参与胆固醇、抗生素和激素等药物的代谢过程。
最后一种常见的修饰方式是胺基酸甲基化,它通过在蛋白质侧链氨基酸上的甲基化,影响蛋白质的构象、稳定性和物理化学性质。
甲基化的分子有顺反异构型,不同的异构型会对不同的蛋白质产生不同的影响。
甲基化会影响蛋白质的交互作用,促进或是抑制复合物的形成。
翻译后修饰是一种组合使用的修饰方式,通常一个蛋白质需要多种修饰来发挥其完整的功能。
翻译后修饰的多样性和复杂性决定了它对生命体显著的影响,研究翻译后修饰对于理解蛋白质互作和重要的生物学功能具有举足轻重的作用。
总之,翻译后修饰是蛋白质的一个重要的调节机制,影响着蛋白质的生物学功能及其与外界的相互作用。
对于人类的生殖、生长及其健康和疾病的产生均有重要的作用。
虽然翻译后修饰对于生命的研究已有了很大进展,但仍然有很多因素需要探索和深入研究。



翻译后修饰蛋白质结构和稳定性蛋白质是生物体内最基本的生化分子之一,它们在细胞中扮演着多种功能和作用。
翻译后修饰是指蛋白质分子合成出来后,通过一系列化学反应和修饰过程,对其结构和稳定性进行调节和改变。
这些修饰可以改变蛋白质的功能、稳定性、局部配位环境以及相互作用,进而引发生物体内多种生物学过程的展开。
本文将探讨翻译后修饰蛋白质结构和稳定性的重要性以及几种常见的翻译后修饰方式。
一、磷酸化修饰磷酸化修饰是指通过添加磷酸基团到蛋白质分子中的一种修饰方式。
磷酸化修饰可发生在氨基酸残基的羟基上,如丝氨酸、苏氨酸、酪氨酸等处。
该修饰方式由多种激酶和磷酸酶参与,它在调控蛋白质稳定性、酶活性、细胞定位和相互作用等方面起到关键作用。
磷酸化修饰还参与了多种细胞信号传导途径和基因表达的调节。
二、甲基化修饰甲基化修饰是指在蛋白质分子上添加甲基基团的修饰方式。
甲基化修饰主要发生在精氨酸、赖氨酸和组氨酸等残基上,并由甲基转移酶参与该过程。
甲基化修饰可以改变蛋白质的构象、稳定性和相互作用,对蛋白质的功能发挥起到重要作用。
此外,甲基化修饰还和细胞发育、基因表达及疾病发生等密切相关。
三、糖基化修饰糖基化修饰是指在蛋白质分子上加入糖基,并形成糖蛋白复合物的修饰方式。
糖基化修饰参与了多种生物学过程,如细胞黏附、分泌、信号传导等。
此外,糖基化修饰还通过调节蛋白质的半衰期和稳定性,起到维持蛋白质结构完整性和活性的作用。
糖基化修饰异常与多种疾病的发生和发展有关。
四、乙酰化修饰乙酰化修饰是指在蛋白质分子上添加乙酰基的修饰方式。
乙酰化修饰在调控蛋白质的功能和稳定性方面具有重要作用。
乙酰化修饰通过改变蛋白质的电荷和构象,调控蛋白质的相互作用和转录调控,从而参与细胞生理和病理过程。
总结翻译后修饰蛋白质结构和稳定性是生物体中非常重要的调控机制。
通过磷酸化、甲基化、糖基化和乙酰化等多种修饰方式,蛋白质的功能和稳定性得以改变和调节,进而对生物体的生理和病理过程产生重要影响。

翻译后修饰蛋白组分析蛋白质翻译后修饰(PTMs)是指蛋白质在翻译中或翻译后的化学修饰过程。
蛋白质翻译后修饰(PTMs)通过给蛋白质添加磷酸酯,乙酸酯,酰胺基或甲基等官能团增加蛋白质组的功能多样性,并影响正常细胞生物学和发病机理的几乎所有方面。
蛋白质翻译后修饰在许多细胞过程中起着关键作用,如细胞分化、蛋白质降解、信号传导和调节过程、基因表达调节以及蛋白质相互作用。
蛋白质翻译后修饰PTMs通常包括磷酸化,糖基化,泛素化,亚硝基化,甲基化,乙酰化,脂质化和蛋白水解。
因此,PTM的特征(包括修饰类别和修饰位点)在细胞生物学以及疾病诊断和预防研究中至关重要。
蛋白质翻译后修饰(PTMs)受许多因素影响,鉴定过程比较繁琐。
例如:大多数翻译后修饰水平很低。
因此,在鉴定之前必须对修饰蛋白进行富集。
此外,修饰的稳定性以及质谱的检测效率也是PTMs分析过程中的关键因素。
百泰派克生物科技搭建有高级的分析平台,可用于表征各种翻译后修饰(PTM)。
BTP-蛋白质翻译后修饰鉴定能够解决的生物学问题百泰派克公司采用Thermo Fisher的Q ExactiveHF质谱平台,Orbitrap Fusion质谱平台,Orbitrap Fusion Lumos质谱平台结合Nano-LC,为广大科研工作者提供磷酸化/糖基化/泛素化/乙酰化/甲基化/二硫键/亚硝基化等翻译后修饰鉴定。
蛋白质氨基酸序列的特定位置可以与化学基团或者小分子量的蛋白共价结合从而发生蛋白质翻译后修饰(post-translational modifications,PTMs),相较于没有发生修饰的蛋白,PTMs会导致特定序列分子量的增加。
在蛋白翻译后修饰方式的鉴定过程中,蛋白会首先被酶切成肽段,然后进入质谱进行分析;通过质谱分析,得到的是一系列肽段的分子质量信息。
对于某一个特定肽段而言,在没有发生任何翻译后修饰的情况下,其序列信息和分子量是确定的;蛋白质翻译后修饰方式鉴定示意图当它发生了某种翻译后修饰之后,例如磷酸化修饰,由于序列信息和分子量是确定的,磷酸根的分子量也是确定的;在质谱检测过程中发现其中的部分肽段的分子量刚好增加了一个磷酸根的分子量,假设这个肽段就发生了磷酸化修饰,再通过二级质谱图进行二次确认。

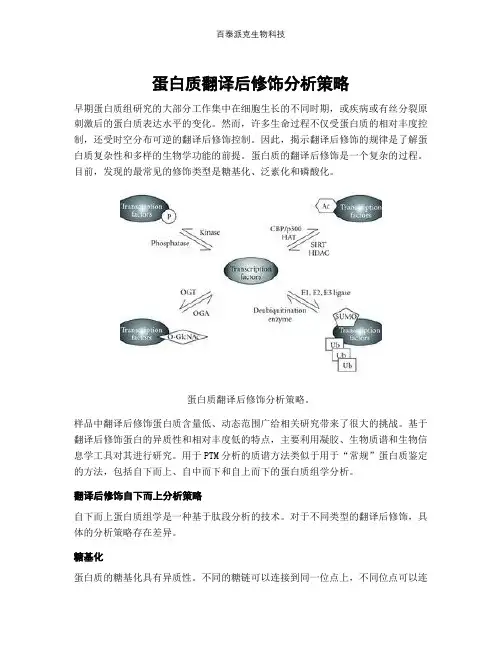
蛋白质翻译后修饰分析策略早期蛋白质组研究的大部分工作集中在细胞生长的不同时期,或疾病或有丝分裂原刺激后的蛋白质表达水平的变化。
然而,许多生命过程不仅受蛋白质的相对丰度控制,还受时空分布可逆的翻译后修饰控制。
因此,揭示翻译后修饰的规律是了解蛋白质复杂性和多样的生物学功能的前提。
蛋白质的翻译后修饰是一个复杂的过程。
目前,发现的最常见的修饰类型是糖基化、泛素化和磷酸化。
蛋白质翻译后修饰分析策略。
样品中翻译后修饰蛋白质含量低、动态范围广给相关研究带来了很大的挑战。
基于翻译后修饰蛋白的异质性和相对丰度低的特点,主要利用凝胶、生物质谱和生物信息学工具对其进行研究。
用于PTM分析的质谱方法类似于用于“常规”蛋白质鉴定的方法,包括自下而上、自中而下和自上而下的蛋白质组学分析。
翻译后修饰自下而上分析策略自下而上蛋白质组学是一种基于肽段分析的技术。
对于不同类型的翻译后修饰,具体的分析策略存在差异。
糖基化蛋白质的糖基化具有异质性。
不同的糖链可以连接到同一位点上,不同位点可以连接到同一蛋白质上的不同糖链上。
糖基化的异质性严重阻碍了糖蛋白的分离和分析。
不同糖类型的相同蛋白质,在电泳上会出现分散的条带,导致信号分散。
此外,对低丰度蛋白质的识别性差导致糖蛋白在色谱图中分离不佳,质谱中有一簇分子量不准确的分辨不清的峰。
目前,蛋白糖基化研究的主要策略是利用现有的技术体系对糖基化蛋白的糖基化肽段进行分离和富集,消除糖基化的异质性及其对质谱的影响,标记糖基化位点。
从而实现高通量糖蛋白和糖基化位点的识别。
常用的糖蛋白分离和富集技术有:a.凝集素亲和技术;b. 肼化学富集;c. 亲水性相互作用色谱法;d. β-消除/迈克尔加成反应。
基于质谱的糖蛋白鉴定和糖基化位点测定方法有:a. PNGase F酶法;b. Endo H酶法;c. 三氟甲烷磺酸(TFMS)法。
蛋⽩翻译后修饰(研究⽣⾼级⽣化)蛋⽩翻译后修饰(齐以涛⽼师)上课⽼师没说重点1.蛋⽩的概念:由许多氨基酸通过肽键相连形成的⾼分⼦含氮化合物。
2.蛋⽩后修饰概念和意义(PPT4-5)3.蛋⽩后修饰种类1. 切除加⼯2. 糖基化3. 羟基化4. 甲基化5. 磷酸化6. ⼄酰化7. 泛素化8. 类泛素化9. …200. …磷酸化修饰1.概念:磷酸化是通过蛋⽩质磷酸化激酶将ATP的磷酸基转移到蛋⽩的特定位点上的过程。
⼤部分细胞过程实际上是被可逆的蛋⽩磷酸化所调控的,⾄少有30%的蛋⽩被磷酸化修饰2.作⽤位点:丝氨酸、苏氨酸和酪氨酸是主要的磷酸化氨基酸,⼤多数磷酸化蛋⽩质都有多个磷酸化位点,并且其磷酸化位点是可变的。
3.实例(MAPK途径):分裂原活化的蛋⽩激酶(MAPK)、分裂原活化的蛋⽩激酶的激酶(MAPKK)、分裂原活化的蛋⽩激酶的激酶之激酶(MAPKKK)。
在真核细胞中,这3种类型的激酶构成⼀个MAPK级联系统(MAPK cascade),通过MAPKKK-MAPKK-MAPK逐级磷酸化,将外来信号级联放⼤并传递下去。
具体过程如下:MAPKKK位于级联系统的最上游,能够通过胁迫信号感受器或者信号分⼦的受体,或者其本⾝就直接感受胞外信号刺激⽽发⽣磷酸化?MAPKKK磷酸化后变为活化状态,可以使MAPKK磷酸化?MAPKK始终存在于细胞质中,MAPKK磷酸化以后通过双重磷酸化作⽤将MAPK激活MAPK被磷酸化后有3种可能的去向:(1)停留在细胞质中,激活⼀系列其它的蛋⽩激酶(2)在细胞质中使细胞⾻架成分磷酸化(3)进⼊细胞核,通过磷酸化转录因⼦,调控基因的表达4.功能和意义:⼀:调节酶蛋⽩及⽣理代谢①糖分解代谢中糖原磷酸化酶活性的调节,被磷酸化的酶具有活性,去磷酸化的酶⽆活性②磷酸化或去磷酸化使胞内已存在酶的活性被激活或失活,调节胞内活性酶的含量⼆:调节转录因⼦活性转录因⼦通常包含DNA结合结构域和转录激活结构域.转录因⼦在转录激活结构域或调控结构域发⽣磷酸化,直接影响其转录活性. c-Jun转录激活结构域的两个丝氨酸残基磷酸化,正调控c-Jun的转录活性.三:调节转录因⼦核转位TGF-b与其I型、II型受体结合,结合后的TGF-b I型受体识别R-Smad包括Smad2和Smad3,作⽤于C末端的丝氨酸使其磷酸化⽽被激活,激活后的R-Smad与Smad4结合转⼊细胞核内,发挥转录调节活性NF-kB与其抑制因⼦IkB形成复合体时存在于胞质。
蛋白质翻译后修饰与信号转导蛋白质是生命体中重要的分子之一,承担着细胞运转、物质代谢和信息传递等多种生理功能。
蛋白质在合成后并非最终形态,而是需要进行多种修饰后才能达到其最终功能。
这些修饰包括翻译后修饰和质抗修饰等。
本文将主要探讨蛋白质翻译后修饰与信号转导的关系。
一、蛋白质翻译后修饰的种类目前已知的蛋白质翻译后修饰种类非常多,包括糖基化、乙酰化、磷酸化、脂肪酰化、甲基化、磷酸亚化、氨基酸酰化、蛋白双硫键形成等等。
每种修饰都可以对蛋白质的功能、稳定性、定位和交互等方面产生影响。
其中,糖基化是最为常见的一种修饰方式,约有一半的蛋白质会在翻译后进行糖基化修饰。
糖基化的主要作用是改变蛋白质的电性、溶解性、稳定性和识别性,同时也有助于调控蛋白质的分泌、定位和交互等生物学特性。
二、蛋白质翻译后修饰与信号转导的联系信号转导是细胞内外环境信息传递的过程,参与者包括细胞膜、信号分子、受体蛋白和调节蛋白等。
蛋白质的修饰与信号转导密切相关,下面将介绍几种代表性的蛋白质修饰与信号转导的联系。
1. 磷酸化修饰与MAPK信号通路MAPK信号通路是一种从细胞膜向细胞核传递信号的过程,参与者包括受体酪氨酸激酶、MAPK激酶、MAPK底物、激酶激活剂等。
该信号通路在多种生物学过程中都起着重要作用,如细胞生长、细胞周期调节、细胞凋亡等。
MAPK信号通路的激活需要受体酪氨酸激酶经过自磷酸化后激活MAPK激酶,再由MAPK激酶对MAPK底物进行磷酸化,从而调节底物的活性。
而磷酸化修饰作为MAPK信号通路的重要环节,不仅能够调节MAPK蛋白的激活状态,还能够影响其交互伴侣的结合、转运和降解等。
例如,在细胞凋亡过程中,必须经过磷酸化修饰后才能激活MAPK-JNK蛋白,从而促进细胞凋亡。
2. 乙酰化修饰与转录调控转录是生命体中重要的基因表达过程,参与者包括转录因子、RNA聚合酶、启动子和顺式作用元件等。
转录调控是转录过程中重要的调控机制,调控因子包括乙酰化转录因子、去乙酰化酶、组蛋白转移酶等。
蛋白质翻译后修饰与细胞代谢的调控蛋白质翻译后修饰是指在蛋白质翻译完成后对蛋白质结构进行改变的一系列化学反应。
这些修饰对于细胞代谢调控起着至关重要的作用。
蛋白质翻译后修饰分为多种类型,包括磷酸化、甲基化、糖基化、乙酰化等。
这些修饰可以影响蛋白质的稳定性、功能、互作性以及定位等方面,从而影响细胞内复杂的代谢网络。
磷酸化是最常见的蛋白质修饰方式之一。
它是指通过酪氨酸、丝氨酸、苏氨酸等残基上的羟基与磷酸酯化剂进行反应,形成磷酸酯化产物。
这种修饰可以影响蛋白质结构,并实现多种生物学效应。
磷酸化可以影响蛋白质的酶活性、催化速率、互作性、定位和紧密程度等。
同时,与磷酸化相关的蛋白质激酶和蛋白质磷酸化酶等酶类在细胞代谢网络中也扮演着重要角色。
磷酸化反应不仅是一个信号传递的桥梁,也是研究人员设计新药物的目标。
甲基化是另一种常见的蛋白质修饰方式。
甲基化可以发生在蛋白质的天然残基上,也可以发生在人工合成的残基上。
甲基化可以影响蛋白质的结构和功能,并且还可以参与基因表达调控、DNA修复和染色质稳定性等过程。
甲基化还可以反向影响DNA甲基化和组蛋白修饰,从而影响基因表达。
因此,对于不同种类和位置的蛋白质甲基化修饰进行深入研究,一定程度上可以提高人类对诸如肿瘤、神经系统疾病等复杂疾病的诊断和治疗水平。
除了磷酸化和甲基化以外,糖基化和乙酰化也是重要的蛋白质修饰方式。
糖基化通常指的是糖基转移酶催化的一系列反应,使糖基连接到氨基酸残基上,形成糖基化产物。
糖基化可以影响蛋白质稳定性、功能和定位,并且可以参与细胞信号传导、免疫调节和细胞识别等过程。
例如,部分糖基化的细胞膜蛋白可以识别相应的抗原,从而触发免疫系统抗体的产生。
乙酰化则是将乙酰化剂与蛋白质残基进行反应,形成乙酰化产物。
乙酰化可以影响蛋白质的酶活性、稳定性和互作性,并且可以参与细胞代谢调控、染色质修饰和基因转录调控等过程。
需要注意的是,蛋白质翻译后修饰不仅发生在蛋白质本身,也可以发生在DNA和RNA等核酸分子上。
Chapter VChapter VPost‐translational ModificationOf ProteinsOne gene more proteinsOne gene, more proteins•蛋白质翻译后修饰(PTM)是指蛋白质在翻译中或翻译后经历的个共价加工过程,即通过1个或几个氨基酸残基加上修饰的一个基团或通过蛋白质水解剪去基团而改变蛋白质的性质。
•从定义的角度,可以如下理解蛋白质翻译后修饰:1. 对某氨基酸的修饰包括共价连接简单的官能团(如乙酰基或磷酸基)1对某一氨基酸的修饰包括和引入一些复杂结构,如脂类和糖类。
2. 将已经结束翻译的转录本产物切割成成熟的形式,如信号肽或活性肽的加工等。
3. 氨基酸的交联,如丝氨酸和酪氨酸。
•可以说,蛋白质组中任一蛋白质都能在翻译时或翻译后进行修饰。
不同类型的修饰都会影响蛋白质的电荷状态、疏水性、构饰不同类型的修饰都会影响蛋白质的象和(或)稳定性,最终影响其功能。
•诸多实例表明蛋白质的修饰都采取一种可逆模式‐“开”或“关”的状态行或者调节蛋白质的功能或者作为个真实的分的状态进行,或者调节蛋白质的功能,或者作为一个真实的分子开关。
•目前已发现300多种不同的翻译后修饰,主要形式包括磷酸化、糖基化、乙酰化、泛素化、羧基化、核糖基化以及二硫键的配对等。
等•加入官能团乙酰化—通常于蛋白质的N末端加入乙酰。
磷酸化—加入磷酸根至Ser、Tyr、Thr或His。
糖化—将糖基加入Asn、羟离氨酸、Ser或Thr,形成糖蛋白。
烷基化加入如甲基或乙基等烷基。
—甲基化—烷基化中常见的一种,在Lys、Arg等的侧链氨基上加入甲基。
生物素化—主要有组蛋白的生物素酰化修饰,由羧化全酶合成酶与组蛋白直接相互作用完成,以及生物素附加物令赖氨酸残基酰化。
以及生物素附加物令赖氨酸残基酰化谷氨酸化—谷氨酸与导管素及其他蛋白质之间建立共价键。
甘氨酸化—一个至超过40种甘氨酸与导管素的C末端建立共价键。
蛋白质翻译后修饰的分子机制及其调控蛋白质是生命体中最为重要的分子之一,其组成了细胞的大部分结构和功能,并参与到了许多生命过程中。
但是蛋白质并不会直接出现在细胞中,而是通过基因的转录和翻译来合成出来。
而蛋白质的翻译过程除了对基因信息的传递外,还需要进行修饰,以使蛋白质能够在正确的位置和时间发挥作用。
蛋白质的修饰主要分为两类:翻译后修饰和翻译前修饰。
其中翻译前修饰主要发生在蛋白质的合成过程中,而翻译后修饰则是在蛋白质合成完成后,由一系列酶的作用来改变蛋白质的性质和功能。
而本文将主要介绍蛋白质翻译后修饰的分子机制及其调控。
一、翻译后修饰的种类蛋白质的翻译后修饰种类繁多,其中较为重要的包括磷酸化、乙酰化、脱乙酰化、甲基化、泛素化、SUMO化、糖基化等。
下面将分别简要介绍这些修饰的特点和作用。
1. 磷酸化磷酸化是一种常见的蛋白质翻译后修饰方式,它是通过激酶将磷酸基团添加到蛋白质分子上,从而改变蛋白质的活性、局部结构以及相互作用。
磷酸化主要发生在蛋白质的氨基酸残基上,如丝氨酸、苏氨酸和酪氨酸等,称为磷酸化位点。
常见的磷酸化酶包括蛋白激酶A、蛋白激酶C、真核细胞激酶等。
2. 乙酰化和脱乙酰化乙酰化是一种通过酰化酶在赖氨酸残基上加入乙酰基的修饰方式,可以影响蛋白质的活性、进一步修饰和降解。
脱乙酰化是相反的过程,即将乙酰基从赖氨酸残基上去除。
乙酰化在许多生命过程中都有重要的作用,如基因转录、染色体修饰、周期性调控等。
3. 甲基化甲基化是一种将甲基基团加入蛋白质分子上的修饰方式,它主要发生在赖氨酸和精氨酸残基上。
甲基化可以影响蛋白质的稳定性、亲水性、生物活性等,还可以作为信号分子影响细胞过程。
4. 泛素化泛素化是一种将泛素蛋白加入到蛋白质分子上的修饰方式,它主要发生在拉链样蛋白和许多调节因子上。
泛素化可以作为信号分子引导受损蛋白质的降解、参与蛋白质的质量控制,同时也可以调节蛋白质的亲水性和亲脂性等生物学特性。
5. SUMO化SUMO化是一种将小泛素样修饰蛋白SUMO加入到蛋白质分子上的修饰方式。