高一化学元素周期律4
- 格式:pdf
- 大小:2.02 MB
- 文档页数:27
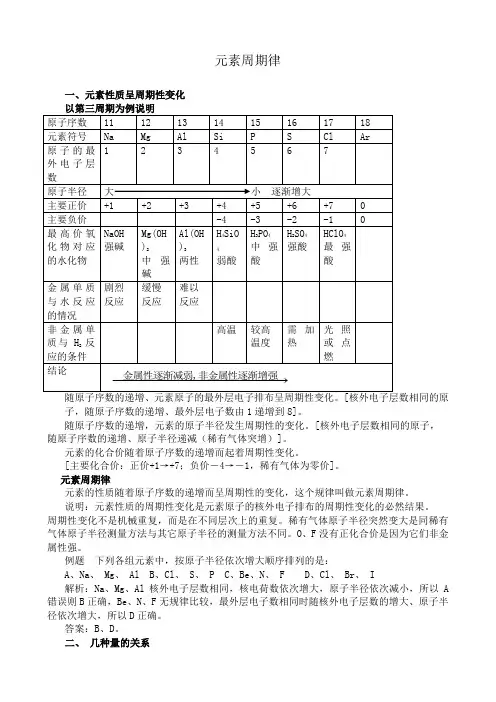
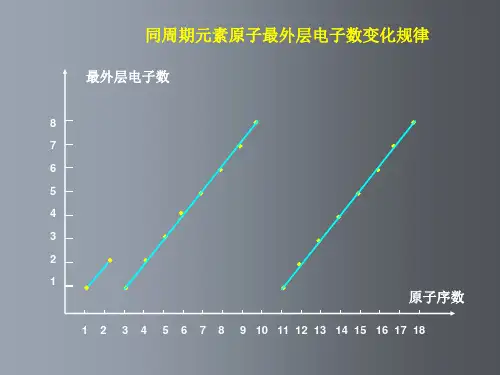
元素周期律一、元素性质呈周期性变化子,随原子序数的递增、最外层电子数由1递增到8]。
随原子序数的递增,元素的原子半径发生周期性的变化。
[核外电子层数相同的原子,随原子序数的递增、原子半径递减(稀有气体突增)]。
元素的化合价随着原子序数的递增而起着周期性变化。
[主要化合价:正价+1→+7;负价-4→-1,稀有气体为零价]。
元素周期律元素的性质随着原子序数的递增而呈周期性的变化,这个规律叫做元素周期律。
说明:元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
周期性变化不是机械重复,而是在不同层次上的重复。
稀有气体原子半径突然变大是同稀有气体原子半径测量方法与其它原子半径的测量方法不同。
O、F没有正化合价是因为它们非金属性强。
例题下列各组元素中,按原子半径依次增大顺序排列的是:A、Na、 Mg、 AlB、Cl、 S、 PC、Be、N、 FD、Cl、 Br、 I解析:Na、Mg、Al核外电子层数相同,核电荷数依次增大,原子半径依次减小,所以A 错误则B正确,Be、N、F无规律比较,最外层电子数相同时随核外电子层数的增大、原子半径依次增大,所以D正确。
答案:B、D。
二、几种量的关系(1)最外层电子数=最高正化合价(2)|最低负化合价|+最高正化合价=8例2、元素R 的最高价含氧酸的化学式为H n RO 2n -2,则在气态氢化物中R 元素的化合价为多少?解析:由H n RO 2n -2知R 的最高价为+(3n -4),R 在气态氢化物中为负价:-[8-(3n -4)]=-12+3n 。
三、两性氧化物和两性氢氧化物 (1)两性氧化物:既能与酸起反应生成盐和水,又能与碱起反应生成盐和水的氧化物。
例:A12O 3A12O 3+6HCl=2AlCl 3+3H 2O A12O 3+2NaOH=2NaAlO 2+H 2O(2)两性氢氧化物:既能跟酸起反应,又能跟碱起反应的氢氧化物。
例:Al(OH)3, 2Al(OH)3+3H 2SO 4=Al 2(SO 4)3+6H 2O A1(OH)3+NaOH =NaAlO 2+2H 2O 四、重点、难点突破2.微粒半径大小比较中的规律 (1)同周期元素的原子或最高价阳离子半径从左至右渐小(稀有气体元素除外) 如:Na>Mg>Al>Si ;Na +>Mg 2+>Al 3+。

第四章 物质结构元素周期律第一节 原子结构与元素周期表 .................................................................................. - 1 -第1课时 原子结构 .............................................................................................. - 1 - 第2课时 元素周期表 .......................................................................................... - 5 - 第3课时 核素 ...................................................................................................... - 8 - 第4课时 原子结构与元素的性质 .................................................................... - 10 - 第二节 元素周期律 .................................................................................................... - 16 -第1课时 元素性质的周期性变化规律 ............................................................ - 16 - 第2课时 元素周期表和元素周期律的应用 .................................................... - 19 - 第三节 化学键............................................................................................................ - 22 -第一节 原子结构与元素周期表第1课时 原子结构1.基础知识一、原子的构成 1.原子的构成原子⎩⎨⎧原子核⎩⎪⎨⎪⎧质子:带1个单位正电荷中子:不带电电子:带1个单位负电荷如碳原子的原子结构模型2.质量数(1)质量数:原子核内所有质子和中子的相对质量取近似整数值后相加所得的数值。


高一化学元素周期律知识点元素周期律是化学中重要的基础知识,它是按照原子核的电子结构和化学性质等规律性的变化,将元素有序地排列在一起的表格,可以为我们理解和记忆元素的性质提供便利。
下面将介绍高一化学中与元素周期律相关的几个重要知识点。
一、元素周期表的组成元素周期表是按照原子序数从小到大将元素排列在一起的表格。
它由横向的周期和纵向的族组成。
周期代表着元素原子核外层电子的能级,而族代表着元素原子核外层电子的数量。
二、元素周期表的周期规律1. 周期规律:元素周期表的横向周期呈现出一些规律性变化。
原子半径随周期增加而减小,电离能、电负性和原子的氧化态也呈现出周期性变化。
这些规律的存在,使我们能够根据元素在周期表中的位置推测其性质。
2. 原子半径的变化:从左到右,原子半径逐渐减小,原因是电子层不断填充,核电荷也逐渐增加,吸引外层电子的能力增强;从上到下,原子半径逐渐增大,原因是电子层增加,外层电子与原子核的吸引力减小。
3. 电离能的变化:从左到右,原子的电离能逐渐增加,即元素更难失去电子形成正离子;从上到下,原子的电离能逐渐减小,即元素较容易失去电子。
4. 电负性的变化:从左到右,原子的电负性逐渐增加,即元素更容易接受电子形成负离子;从上到下,原子的电负性逐渐降低,即元素较不容易接受电子。
三、元素周期表中的主要族元素周期表中的主要族包括:1. 碱金属族:位于周期表的第一组,具有非常活泼的金属性质,易与氧气和水反应。
2. 碱土金属族:位于周期表的第二组,比碱金属更活泼,但比较稳定。
3. 铁系过渡族:位于周期表中间,具有良好的导电性、机械性能和催化性能。
4. 卤素族:位于周期表的第七组,非常活泼,常以阴离子形式存在。
5. 惰性气体:位于周期表的第八组,具有极低的反应性,稳定性极高。
四、元素周期表的应用元素周期表的应用十分广泛,主要包括以下几个方面:1. 元素性质预测:根据元素在周期表中的位置,可以预测其一些基本性质,如电子亲和力、电离能等。

人教版高一化学知识点元素周期表
广大同学要想顺利通过高考,接受更好的高等教育,就要做好考试前的复习准备。
为大家整理了高一化学知识点元素周期表,希望对大家有所帮助。
元素周期律和元素周期表
1.元素周期律
元素的性质随着元素原子序数的递增而呈周期性变化的规律,叫做元素周期律。
元素周期律主要体现在核外电子排布的周期性变化、原子半径的周期性变化和元素主要化合价、金属性及非金属性等的周期性变化方面。
元素性质周期性变化的实质是由于元素原子核外电子排布的周期性变化。
2.元素周期表
元素周期表是元素周期律的具体表现形式。
3.元素周期表与原子结构的关系
周期序数=电子层数
主族序数=最外层电子数=元素的最高正化合价数
主族元素的负化合价数=8-主族序数。



高一化学知识点:元素周期表高一化学知识点:元素周期表一、元素周期表原子序数=核电荷数=质子数=核外电子数1、元素周期表的编排原则:①按照原子序数递增的顺序从左到右排列;②将电子层数相同的元素排成一个横行——周期;③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行——族2、周期序数=电子层数;主族序数=最外层电子数3、元素金属性和非金属性判断依据:①元素金属性强弱的判断依据:单质跟水或酸起反应置换出氢的难易;元素最高价氧化物的水化物——氢氧化物的碱性强弱;置换反应。
②元素非金属性强弱的判断依据:单质与氢气生成气态氢化物的难易及气态氢化物的稳定性;最高价氧化物对应的水化物的酸性强弱;置换反应。
4、核素:具有一定数目的质子和一定数目的中子的一种原子。
①质量数二二质子数+中子数:A==Z+N②同位素:质子数相同而中子数不同的同一元素的不同原子,互称同位素。
(同一元素的各种同位素物理性质不同,化学性质相同)二、元素周期律1、影响原子半径大小的因素:①电子层数:电子层数越多,原子半径越大(最主要因素)②核电荷数:核电荷数增多,吸引力增大,使原子半径有减小的趋向(次要因素)③核外电子数:电子数增多,增加了相互排斥,使原子半径有增大的倾向2、元素的化合价与最外层电子数的关系:最高正价等于最外层电子数(氟氧元素无正价)负化合价数=8—最外层电子数(金属元素无负化合价)3、同主族、同周期元素的结构、性质递变规律:同主族:从上到下,随电子层数的递增,原子半径增大,核对外层电子吸引能力减弱,失电子能力增强,还原性(金属性)逐渐增强,其离子的氧化性减弱。
七大方法助你告别化学“差生”一.尽快去找化学老师,让他告诉你以前学过的关键知识点,在短期内掌握,目的是能够大致跟上现在的教学进度,以听懂老师讲授的新知识。
要想进步,必须弄清楚导致化学成绩差的根本原因是什么?是常用的几个公式、概念没记住,还是很重要的几个基本解题方法不能熟练应用,或者是以前的一些重点知识没有理解透彻等等。