2氧化还原反应复习.docx
- 格式:docx
- 大小:129.46 KB
- 文档页数:17

氧化还原反应的综合考查一、氧化还原反应几组概念间的关系二、氧化还原反应的“四大规律”及其应用1.强弱律(1)氧化性:氧化剂>氧化产物常考物质氧化性强弱顺序:KMnO4>Cl2>Br2>Fe3+>Cu2+(2)还原性:还原剂>还原产物常考物质还原性强弱顺序:SO2>I->Fe2+>Br->Cl-(3)应用:比较物质氧化性或还原性强弱,判断反应能否进行2.价态律(1)氧化还原反应发生时,其价态一般先变为邻位价态(2)同种元素不同价态之间的反应,高价态的元素化合价降低,低价态的元素化合价升高,但升高与降低的化合价只接近而不交叉(3)应用:判断物质的氧化产物或还原产物3.优先律(1)同时含有几种还原剂加入氧化剂,按还原性由强到弱依次反应(如向FeI2溶液中通入少量Cl2,I-优先反应)(2)同时含有几种氧化剂加入还原剂,按氧化性由强到弱依次反应(如含Fe3+、H+的混合液中加入铁,Fe3 +优先反应)(3)应用:判断物质的稳定性及反应的先后顺序4.守恒律(1)内容:氧化剂得电子总数=还原剂失电子总数,即氧化剂降价总数=还原剂升价总数(2)应用:①直接计算参与氧化还原反应物质间的数量关系;②配平氧化还原反应方程式1(2023·浙江嘉兴·统考二模)关于反应S+2KNO3+3C=K2S+N2↑+3CO2↑,下列说法正确的是A.该反应的氧化剂是硝酸钾B.生成标准状况下2.24LN2,反应共转移1mol电子C.氧化产物与还原产物的物质的量之比为3∶1D.电负性:O>N>C>K【答案】D【详解】A.反应S+2KNO3+3C=K2S+N2↑+3CO2↑中,N和S元素化合价降低,该反应的氧化剂是S和KNO3,故A错误;B.生成标准状况下2.24LN2,物质的量为0.1mol,则生成0.3molCO2,C元素由0价上升到+4价,转移1.2mol电子,故B错误;C.反应S+2KNO3+3C=K2S+N2↑+3CO2↑中,N和S元素化合价降低,C元素化合价上升,CO2为氧化产物,K2S和N2为还原产物,则氧化产物与还原产物的物质的量之比为3∶2,故C错误;D.非金属性越强,电负性越强,所以电负性:O>N>C>K,故D正确;故选D。

一、基本概念复习1.特征(判别依据) 2.实质:3.概念体系4、与四种基本反应类型的关系5、氧化还原反应的表示方法:6、氧化还原反应的类型:二.常见的氧化剂和还原剂1.常见的氧化剂 2.常见的还原剂三、氧化还原反应规律1、遵循守恒原则2、价态规律3、反应顺序规律:4.“价态归中” 5、邻位不反应 6、邻位价态规律7、歧化原则 8、“二强”生成“两弱”原则:9、影响氧还反应发生和产物的因素:温度、浓度、酸碱性、有无催化剂影响四、氧化还原反应配平技巧五、氧化性、还原性相对强弱的判断六、氧化还原反应计算技巧一、基本概念复习1.特征(判别依据) :反应前后元素化合价有变化的反应练习1:判断下列反应是否属于氧化还原反应A. 2FeCl2+Cl2=2FeCl3 B. CaO+H2O=Ca(OH)2C. 2H2O2 = 2H2O + O2↑D. 2Al(OH)3 =Al2O3+3H2OE. 2Na+2H2O= 2NaOH+H2↑F. CuCl2+2NaOH==Cu(OH)2↓+2NaClG. Ba(OH)2+H2SO4=BaSO4 ↓+2H2O2.实质:电子转移3.概念体系[氧化反应]:失去电子的反应;[还原反应]:得到电子的反应。
[被氧化]:失去电子的变化过程;[被还原]:得到电子的变化过程。
[氧化产物]:还原剂在反应中失去电子后被氧化而形成的生成物;[还原产物]:氧化剂在反应中得到电子后被还原而形成的生成物。
[还原剂]:失去电子的物质;[氧化剂]:得到电子的物质。
[还原性]:还原剂具有的失去电子的性质;[氧化性]:氧化剂具有的得到电子的性质。
4、与四种基本反应类型的关系 (略)35、氧化还原反应的表示方法:双线桥: 表示同一元素得失电子变化情况。
箭头都是由反应物指向生成物,在线桥上一定要注明“得”或“失”。
单线桥:表示氧化还原反应中电子转移的方向和数目。
而且箭头方向一定是由还原剂指向氧化剂。
OH Cl KCl HCl KClO 223336+↑+=+6、氧化还原反应的类型: 1、分子间氧化还原反应 2、分子内氧化还原反应氧化剂和还原剂为同一种反应物,但被氧化、被还原的元素分别是不同的元素 3、自身氧化还原反应(或歧化反应) 4、有些物质部分作为氧化剂(或还原剂) 5、某种反应物既不是氧化剂又不是还原剂。
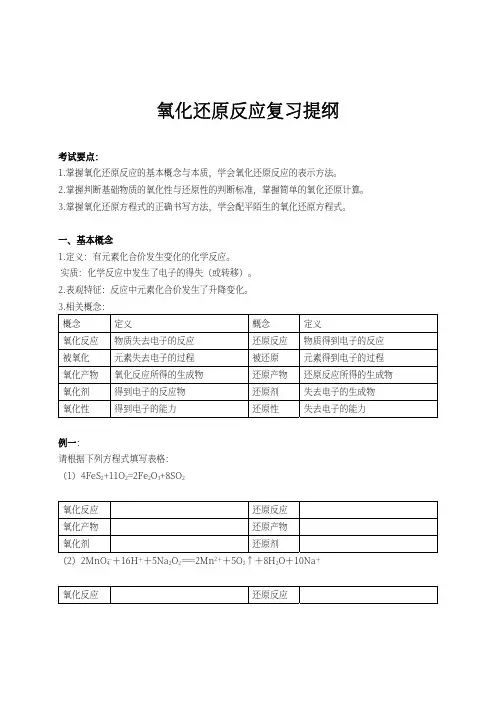
氧化还原反应复习提纲考试要点:1.掌握氧化还原反应的基本概念与本质,学会氧化还原反应的表⽰⽅法。
2.掌握判断基础物质的氧化性与还原性的判断标准,掌握简单的氧化还原计算。
3.掌握氧化还原⽅程式的正确书写⽅法,学会配平陌⽣的氧化还原⽅程式。
⼀、基本概念1.定义:有元素化合价发⽣变化的化学反应。
实质:化学反应中发⽣了电⼦的得失(或转移)。
2.表观特征:反应中元素化合价发⽣了升降变化。
3.相关概念:概念 定义 概念 定义氧化反应 物质失去电⼦的反应 还原反应 物质得到电⼦的反应 被氧化 元素失去电⼦的过程 被还原 元素得到电⼦的过程 氧化产物 氧化反应所得的⽣成物 还原产物 还原反应所得的⽣成物 氧化剂 得到电⼦的反应物 还原剂 失去电⼦的⽣成物氧化性 得到电⼦的能⼒ 还原性 失去电⼦的能⼒例⼀:请根据下列⽅程式填写表格:(1)4FeS2+11O2=2Fe2O3+8SO2氧化反应 还原反应氧化产物 还原产物氧化剂 还原剂(2)2MnO-4+16H++5Na2O2===2Mn2++5O2↑+8H2O+10Na+氧化反应 还原反应氧化产物 还原产物氧化剂 还原剂(3)CaCO3+2HCN = CaCN2+CO↑+H2↑+CO2↑氧化反应 还原反应氧化产物 还原产物氧化剂 还原剂⼆、氧化还原反应的电⼦转移1.电⼦转移数⽬的计算解题要点:注意反应中的元素化合价变化,判断出题⽬中的物质发⽣反应的物质的量,参与反应的物质1mol电⼦变化的物质的量。
例⼆:O2F2可以发⽣反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是 ( )A.氧⽓是氧化产物B.O2F2既是氧化剂⼜是还原剂C.若⽣成4.48 L HF,则转移0.8 mol电⼦D.还原剂与氧化剂的物质的量之⽐为1:4例三:已知反应:2Na+4NH4NO3=2NaNO3+N2O +N2+5H2O+2NH31 当有4mol NH4NO3 参与反应时,该反应转移⼏ mol 电⼦2 当有4mol NH4NO3 被还原时,该反应转移⼏ mol 电⼦3 当有4mol NH4NO3被Na还原时,该反应转移⼏ mol 电⼦2.表⽰⽅法——单线桥法/双线桥法例四:请分别⽤单线桥法和双线桥法表⽰下列反应中的电⼦转移:(1)3S+6KOH=2K2S+K2SO3+3H2O (单线桥)3S+6KOH=2K2S+K2SO3+3H2O (双线桥)(2)Fe+6HNO3(浓)=Fe(NO3)3+3NO2↑+3H2O (单线桥)Fe+6HNO3(浓)=Fe(NO3)3+3NO2↑+3H2O (双线桥)(3)H2S+H2SO4(浓)=S↓+SO2+2H2O (单线桥)H2S+H2SO4(浓)=S↓+SO2+2H2O (双线桥)三、氧化性与还原性强弱的判断1.根据元素的活动性顺序与其在周期表中的位置判断对于常⻅元素,⼀般而⾔越活泼的⾦属还原性越强,其阳离⼦的氧化性越弱,这其中更⾼价态的⾦属阳离⼦其氧化性越强。

《氧化还原反应》氧化还原知识点总结及训练氧化还原反应方程式的配平氧化还原反应:化合价升高→失电子→还原剂→氧化反应→氧化产物化合价降低→得电子→氧化剂→还原反应→还原产物本质:电子发生了转移;表现:化合价变化。
结论:电子转移总数相等,化合价升降总数也必然相等,据此我们可以用化合价升降法来配平氧化还原反应的化学方程式.一、氧化还原反应方程式的配平方法(一).化合价升降法(得失电子守恒法)1.配平的原则:(1).反应中还原剂化合价升高的总数和氧化剂化合价降低的总数相等(电子守恒).(2).反应前后各种原子的种类和个数相等(质量守恒).2.配平的步骤:(1).首先写出反应物、产物的化学式;(2).标出反应前后变化的元素化合价;(3).使化合价升降总数相等;(4).用质量守恒定律,观察法进行配平.例1:Fe2O3+CO→ Fe+CO2+3 0Fe →Fe 降3价×2=6+2 +4C → C 降2价×3=6例2:C +HNO3(浓→ H2O + NO2 + CO2练习:1、NH3+O2(纯)→N2+H2O2、Cu + HNO3→ Cu(NO3)2 + NO2 + H2O例3:价态归中的反应:H2S+SO2→ S+H2O练习:Fe+FeCl3→FeCl2KMnO4+ HCl →KCl + MnCl2+ Cl2↑+H2O+7 +2Mn →Mn 升5价×2=10-1 02Cl →Cl2降2价×5=10 (不能生成半个分子)例4:岐化反应:Cl2+ NaOH(浓)→ NaCl+ NaClO3 + H2O练习:S + KOH(浓)→K2S + K2SO3+ H2OP4+ NaOH + H2O →NaH2PO4+ PH3例5:多元素多价态反应:FeS2+ O2→ Fe2O3+ SO2练习:Cu2S + HNO3→Cu(NO3)2+ NO↑+ H2SO4+ H2O 课后练习:MnO2+ HCl(浓)―—MnCl2+ Cl2↑+ H2OAs2O3+ HNO3+ H2O →H3AsO4+ NOP + HNO3(浓)→H3PO4+ NO2↑+ H2OKMnO4+ KNO2+ H2SO4→MnSO4+ K2SO4+ KNO3+ H2OKMnO4+ HCl →KCl + MnCl2+ Cl2↑ + H2ONH4NO3―—N2+ HNO3+ H2OMnO4-+ H2O2+ H+―Mn2++ O2↑+(二)、待定系数法(适合陌生的化学方程式)例题1:配平aFeS2 +b O2—Fe2O3 + SO2步骤:1、设化合价改变的反应物的系数为a,b2、把假设的系数当作已知数,把其它物质的系数配好。

氧化还原反应复习1.学案导学⑴有关氧化还原反应的概念:氧化反应:物质所含元素化合价(电子或电子对)的反应。
还原反应:物质所含元素化合价(电子或电子对)的反应。
氧化还原反应:凡是物质所含元素化合价(或)的反应。
⑵氧化还原反应的特征和本质:氧化还原反应的特征是;氧化还原反应的本质是。
思考:四种基本反应类型与氧化还原反应的关系是什么?⑷氧化剂、还原剂;氧化产物、还原产物等概念:氧化剂:是电子(或电子对)的反应物。
还原剂:是电子(或电子对)的反应物。
还原产物:物质电子(或元素化合价)后的生成物。
氧化产物:物质电子(或元素化合价)后的生成物。
⑸氧化还原反应中的几对概念:[口诀:升失氧,降得还]氧化剂→()→()→()→()→()反应物→化合价变化→表现性质→变化过程→发生反应→所得产物还原剂→()→()→()→()→()⑹氧化还原反应氧化还原反应中:氧化剂总数目==还原剂总数目;中的元素的化合价总数== 中的元素的化合价总数。
⑺常见氧化剂:①活泼非金属单质,如:等;②含高价元素的含氧酸,如:等;③含高价元素的盐,如:等;④处于高价态的离子,如:等;⑤过氧化物,如:等。
⑻常见还原剂:①活泼金属单质,如:等;②元素处于低价态的离子,如:等;2、自学提升物质氧化性和还原性相对强弱的判断方法:①根据金属活动顺序进行判断(或置换反应)K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属性逐渐(还原性逐渐)K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ (H+) Cu2+ (Fe3+) Hg2+ Ag +氧化性逐渐越活泼的金属,金属性越强,单质的还原性越强,其对应离子氧化性越弱;反之,越不活泼的金属,单质的还原性越弱,其对应离子氧化性越强。
②根据非金属活动顺序进行判断(或置换反应)F2Cl2Br2I 2S F—Cl—Br—I—S2—氧化性逐渐还原性逐渐非金属性越强,单质的氧化性越强,对应离子的还原性越弱;非金属性越弱,单质的氧化性越弱,对应离子的还原性越强;③根据氧化还原反应的发生规律判断氧化还原反应发生规律可用如下式子表示:氧化性:氧化剂氧化产物还原性:还原剂还原产物即:强氧化剂+强还原剂==弱氧化剂(氧化产物)+弱还原剂(还原产物)④根据氧化还原反应发生反应条件的不同进行判断如:Mn02十4HCl(浓)△MnCl2+C12↑+2H20 2KMn04十16HCl(浓)=2MnCl2+5C12↑+8H2O后者比前者容易反应(不需要加热),可判断氧化性KMn04Mn02⑤根据被氧化或被还原的程度的不同进行判断Cu+Cl2 △CuCl2 2Cu+S△Cu2SC12可把Cu氧化到Cu(+2价),而S只能把Cu氧化到 Cu(+1价),这说明氧化性Cl2 S其它方面:如浓度、温度等的影响浓度:氧化性HNO3(浓)HNO3(稀)H2SO4(浓)H2SO4(稀)还原性HCl(浓)HCl(稀)温度:同一物质,温度越高,氧化性或还原性越强。


氧化还原反应(专题复习)★内容《氧化还原反应》专题内容分两课时完成,第一课时主要完成前五个考点。
★教学目标1.了解氧化还原反应的本质是电子的转移。
2.了解常见的氧化还原反应,能判断反应中的氧化剂和氧化产物、还原剂和还原产物。
3.能判断氧化还原反应中电子转移的方向和数目。
4.掌握物质氧化性、还原性强弱的比较方法。
5.能运用质量守恒、电子守恒、电荷守恒,进行氧化还原反应的有关计算。
★主题阐明根据学校“提升高中课堂教学有效性”研究课题要求,结合高三化学复习的实际,我们高三化学二轮复习过程中采用专题复习的形式进行。
在专题复习中,采用“练—想—联—结”的教学方式,即通过练一道题能想到考试内容的知识点,通过考点联想教材知识内容,通过知识内容的归纳总结,得出一些规律及结论。
在课堂教学中以教师为主导,以学生为主体,调动学生学习的主动性,有效地引导学生开展学习活动,以达到提高课堂效率的目的。
针对高考考试热点的专题复习,旨在通过练习、评讲一道题,学会一类题,以点带面,从而提高学生在高考中得分率。
★教学内容:一、考点内容:考点一、基本概念及电子转移数目的计算考点二、常见的氧化剂和还原剂考点三、氧化性和还原性强弱的判断考点四、氧化还原方程式的配平考点五、有关氧化还原反应的计算考点六、有关氧化还原反应的综合应用二、知识点归纳:1.基本概念(1)氧化还原反应的特征:元素化合价发生变化。
(2)氧化还原反应的实质:发生了电子的转移(得失或偏移)(3)掌握好如下四对概念:①氧化反应与还原反应②氧化产物与还原产物③氧化剂与还原剂④氧化性与还原性2.氧化还原反应的表示方法(1)双线桥法(2)单线桥法3.常见的氧化剂和还原剂(1)常见的氧化剂——三类五种(2)常见的还原剂——三类六种4.氧化性、还原性强弱的判断方法(1)根据反应方程式进行判断(2)根据物质活动性顺序进行判断①根据金属活动性顺序进行判断②根据非金属活动性顺序进行判断③根据元素周期表进行判断④根据反应进行的难易程度(反应条件)进行判断⑤根据价态进行判断:a.当变价的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态的高低来判断氧化剂氧化性的强弱。


氧化还原反应专题复习一.知识点梳理一、概念:氧化还原反应的实质------电子的转移(电子的得失或共用电子对的偏移口诀:失.电子,化合价升.高,被氧.化(氧化反应),还原剂;得.电子,化合价降.低,被还.原(还原反应),氧化剂氧化还原反应和其他反应的关系:①复分解反应不是氧化还原反应②置换反应一定是氧化还原反应,化合和分解反应不一定是氧化还原反应。
③有单质参加的化合反应一定是氧化还原反应④有单质生成的分解反应一定是氧化还原反应,但有单质参与的反应不一定是氧化还原反应(如石墨变成金刚石,氧气变臭氧)。
氧化还原反应中电子转移的表示方法(1) 双线桥法---表示电子得失结果(2) 单线桥——表示电子转移情况常见的氧化剂与还原剂a、常见的氧化剂(1) 活泼的非金属单质:O2、Cl2、Br2(2) 含高价金属阳离子的化合物:FeCl3(3) 含某些较高化合价元素的化合物:浓H2SO4、HNO3、KMnO4、MnO2b、常见的还原剂:(1) 活泼或或较活泼的金属:K、Ca、Na、Al、Mg、Zn (按金属活动性顺序,还原性递减)(2) 含低价金属阳离子的化合物:Fe2+(3) 某些非金属单质:C、H2(4) 含有较低化合价元素的化合物:HCl 、H2S、HI、KI二、氧化-还原反应、氧化剂和还原剂、氧化产物和还原产物的判断1、根据氧化还原反应方程式氧化剂+在同一氧化还原反应中,氧化性:氧化剂>氧化产物还原性:还原剂>还原产物氧化剂的氧化性越强,则其对应的还原产物的还原性就越弱;还原剂的还原性越强,则其对应的氧化产物的氧化性就越弱。
例:2Cl2+2NaBr===2NaCl+Br2 2、根据金属活动性顺序表在金属活动性顺序表中,金属的位置越靠前,其还原性就越强(铂金除外);金属的位置越靠后,其阳离子的氧化性就越强。
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au3、根据元素周期表同周期元素,随着核电荷数的递增,其单质氧化性逐渐增强,还原性逐渐减弱。
明士教育集团高一化学讲学案课题氧化还原反应复习课次第5次授课教师刘伟洋上课学生应到人,实到人教学形式一对一课室上课H期和时段学牛签名李厂氧化还原复习提纲及例题一、概念及与其他四大基本化学反应之间的关系(表现形式、实质)例1、判断下列说法正误I、氧化还原的实质是电了的得失。
2、氧化还原的实质是化合价的变化。
3、得电了越多的物质其氧化性越强。
4、失得电了越多的物质其还原性越强。
5、氧化还原反应屮肯定有一种元素被氧化,另一种元素被还原。
6、氧化还原反应小,非金属单质不一定是氧化剂。
7、阳离子只有氧化性,阴离子只有还原性。
8、氧化还原反应的实质是冇氧元素的得失。
9、物质所含元素化合价升高的反应是还原反应。
10、某元素在化学反应屮由化合态变为游离态,则该元素一定被氧化。
II、在氧化还原反应屮不一定所有元索化合价都发牛变化。
12、失电子难的原子获得电子的能力就强。
13、氧化剂在同一反应中既可以是反应物,也可以是牛成物。
14、在化学反应中某元素山化合态变为游离态,该元素一定被还原了。
二、氧化还原反应与四种基本反应类型的关系及氧化还原反应的判断例1、下列化学反应中,不属于四种基本反应类型的是()A. 2FeCl3+Cu=2FeCl2+CuCl2B. Fe + H2SOi=FeSO4 + H2 tC. 4Fe (OH)2+02+2H20= 4Fe (OH)3D. CaC03+2HCl = CaCi2+H20+C02 f例2、下列化学反应基木类型中一定是氧化还原反就的是()A.化合反应B.分解反应C.复分解反应D.置换反应例3、下列反应属于氧化还原反应的是()A.Fe203+ 6HCl=2FeCl3 + 3H20 •B. CuO + C0= Cu + C02C. Ca(0H)2 + C02—CaC03|+ H20D. 3Fe + 202 =Fe304例4、下列反应中,属于氧化还原反应的是A. Na2C03+2HCl==2NaCl+ H 20+ C021例5、下列反应不属于氧化述原反应的是例6、不属于氧化还原反应的是三、与氧化还原有关的生活知识1、食物的腐败2、金属的腐蚀3、食品屮抗氧化剂(维生素C 、铁粉包)(注意:抗氧化剂表现的是还原性)四、单、双线桥的使用① 单线桥法。
从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数冃,不盂注明得失。
例:▼ AMnO 2+4HCl (浓) =MnCl 2+Cl 21 +2H 20② 双线桥法。
得失电子分开注明,从反应物指向牛•成物(同种元素)注明得失及电子数。
例:MnO 2+4HCl (浓) =MnCl 2+Cl 2 f +2出0失2&两类特殊的化学反应① 歧化反应,同种元素同价态在反应中部分原子化合价升高,部分原子化合价降低。
例:得5Xe3C 12+6KOH= KC1 Os+5KC 1+3H 20丨4失5e② 屮反应。
不同价态的同种元索的原子在反应小趋于小问价态,解此类题最好将该元索的不同价态用C. 4HC1 (浓)+MnO2二二MnCL+CL f +2H.0D. CaCO ;?Ca0+C02tB. SO3 + H 2O==H 2SO 4 A 、工业利川电解饱和食盐水的产物制盐酸 B 、 加热使碳酸氢钠分解 C 、实验室制取氯气D 、 铝片投入过最的NaOH 溶液屮A 、2Al+Fe 2O3' 2&+AI2O3B 、2Mg+CO 2 空^2MgO+CC 、N2+3H22NH 3D 、Si ()2+Ca (丄丄 CaSiCh数轴标出,变化的区域只靠拢,不重叠。
例:得5eKC1O3+6HC1=:3C12+ 6KC1 f +3H 20例3、下列各反应中,水只做氧化剂的是(例4.下列反应屮,水作为还原剂的是(2MnCl 2+2KC 1+5012 f +8H2O 中,氧化剂是氧化产物是 __________ ,还原产物是__________ O例6、在下列反应中,氨做氧化剂的是 _______________ ,氨做还原剂的是 _____________A. 3C12+8NH :, 6NH4CI+N2 B ・ 2NH3+H2SO1 (NHJ2SO1 C. 2NH 3+2Na2NaNH 2+H 2D. NH3+N2HN3NH2+H2例7、在反应FeO + 3C0 === 2Fe + 3CO2中, ___ 是氧化剂, _____ 是还原剂; ____ 元素被氧化, ____ 元 素被还原; ____ 是氧化产物, ____ 是还原产物。
例8、在反应3CL+6K0H (浓)^^KC1O3 + 5KC1 + 3H 2O 中,氧化剂与还原剂物质的量之比为()A. 1: 5B. 4: 1C. 5: 1D. 1: 4六、需要加入氧化剂或还原剂才能实现的例1、使用双线桥注明电了得失方向和数冃1、C U +4HN03 (浓)=Cu (NOJ 2+2 N02 f2、C+2 H2SO4 == C02 t +2 SO. t +2也03、K2S2O7 + 14HC1 = 2KC1 + 2 CrCl 3+ 3C121 + 7H 204、2Cl z +2Ca (OH) 2=CaCl 2+Ca (CIO) 2+2H 20例2、使用单线桥注明电子得失方向和数bl1、Mn02+4HCl-MnC12+2H20+C12 t2、2H 2S+SO 2=3S+2H 2O五、氧化剂.还原剂.氧化产物.还原产物的确定例1、下列反应中有一种物质既是氧化剂又是述原剂的是()A. 2KI + Br 2=2KBr+I 2B. 2AgN03=2Ag+2N02 t +02 tC. C U 2(OH)2CO3=2C U O+CO 2 f +H 20D. 2Na>0>+2H20=4Na0H+02 f例2、下列反应屮,水既不是氧化剂,也不是还原剂, 但反应是氧化还原反应的是()A. 2Na 202+2H20=4Na0II+02 tB. C+II 2O=CO+H 2C.Cl 2+H 20=HCl+HC10 D. 2F 2+2H 20=4HF+02A. C+ H 20 = CO 卜 1【2B. 2 H 20 = 2 H 21 + 02 tC. Na 20 + H2O =2NaOHD. CuO+ H2 = Cu+ H 20A 、Cl 2 + H.0 二 HC1 + HC1OB 、2N 创0? + 2H.0 =4NaOH + 021C 、2F2 + 2H>0 = 4HF + O2ID 、2Na + 4H 20 = 2NaOH + H 21例 5、反应 2KMnO.i+16HCl失5X0A、CuO f CuS04B、CO2 f CO C、KC103^02 D.Fe f卩巳3。
4例2、下列变化中, 需要加入氧化剂的是()A. 2cr-*ci2B. Fe3+->Fe +C■Cu2+~**Cu D.Mn04->MnO例3、下列变化需要加入还原剂才能实现的是()A、MnO-, - MnO,B、Cl- - Cl2C、H2S - SO,D、Fe2+ -* Fe例4、下列变化需要加入还原剂才能实现的是()A. Na2SO3------- SO2B. HC1 ------- Cl2C. H2SO1(浓) ------ S02D. S02------------ S例5、需加入还原剂才能实现的是()A. MrAf MnOrB. A1O,_->A1 (0H)3C. AsO?"- AsO:厂D. S?0广一SO:厂例6、维生素C 乂称抗坏血酸,能够将12转化为I",说明维生索CA.易溶于水B.受热易分解是C.具有述原性D.可由人体口身合成七、根据化合价的位置判断某粒子具有氧化性还是还原性解题关键:能够分析需要探讨的元素现侑的化合价处在什么位置例1、下列粒子小,既具有氧化性,乂具有还原性的是()A.Mg B. Zn2+ C. Fe2+ D. HC1例2、下列粒子中,只具有氧化性的是()A. Mg B. Zn2+ C. Fe24 D. HC1例3、在氧化还原反应中,下列各组物质均可作氧化剂的是()A.厂、广、S2_B. MnO2x HNOsC. Fe3\ II2O2、Cl2D. HC1O、H2SO^ Mg八、氧化性、还原性的比较物质的氧化性强弱、还原性强弱的比较1•根据金属活动性顺序来判断:一般来说,越活泼的金属,失电子氧化成金属阳离子越容易,其阳离子得电子还原成金属单质越难,氧化性越弱;反之,越不活泼的金属,其阳离子得电子述原成金属单质越容易,氧化性越强。
加g,Ai,2n,FeHg,Pt,Au v金隔的活动性腳減弱陆原性逐渐減弱)~~»匕幺"应地卅:曲+,刃,(胪)0?,亦匕虫I2.根据非金加活动性顺序来判断:一•般来说,越活泼的非金属,得到电了还原成非金属阴离子越容易,其阴离子失电子氧化成单质越难,还原性越弱。
非金厲原子的氧化性减弱☆ 3.根据氧化还原反应发生的规律来判断:氧化还原反应可用如下式子表示:失电=?•化合价升高.被氣化I还原剂+窜化剂==氧化产物+还原产物I _____________________1得电不.化合升隆低.祓还徵(还原性强)(氧化性强)(氧化性较弱)还原性较弱)<图3)规律:反应物中氧化剂的氧化性强于牛成物中氧化产物的氧化性,反应物中还原剂的还原性强于 生成物中还原产物的述原性。
4. 根据氧化述原反应发生的条件来判断:如:MnO 2+4HCl (—= MnCl 2+Cl 21 +2H 20 2KMnO 4+16HCl (浓)=2MnCl 2+5Cl 2 t +8H 20后者比前者容易(不需要加热),可判断氧化性KMnO»>MnO,5. 根据反应速率的人小来判断:如:2N&2SO3+O2二2Na2S0K 快),2H2SO3+O2二2朋0』(慢),2S0 , + 0,里聖工2S0 .,还原性:N^SOAHzSOQSO?6. 根据被氧化或被还原的程度来判断:女U : C U + CI 2^B CU CI 2,2C U + S^=C U 2S , 即氧化性:CJ>S 。
又如:2HBr + H 2SO 4^}^=Br 2 +S02 T+2H 2O , 8HI + H 2SO 4(iti ) = 4I 2 + H 2S T +4H 2O ,还原性:HI > HBr 。
*7.根据原电池的正负极来判断(略):*8.根据电解池小溶液里阴、阳离子在两极放电顺序來判断。
(略) 9. 根据元素在周期表中位置判断:(1) 对同一周期金属而言,从左到右其金属活泼性依次减弱,其还原性也依次减弱。