有机化学第16章课后习题答案(第二版 王积涛等)
- 格式:ppt
- 大小:1.31 MB
- 文档页数:22

徐寿昌编《有机化学》第二版习题参考答案第二章烷烃1、用系统命名法命名下列化合物(1)2,3,3,4-四甲基戊烷(2)3-甲基-4-异丙基庚烷(3)3,3,-二甲基戊烷(4)2,6-二甲基-3,6-二乙基辛烷(5)2,5-二甲基庚烷(6)2-甲基-3-乙基己烷(7)2,2,4-三甲基戊烷(8)2-甲基-3-乙基庚烷2、试写出下列化合物的结构式(1) (CH3)3CC(CH2)2CH2CH3(2) (CH3)2CHCH(CH3)CH2CH2CH2CH3 (3) (CH3)3CCH2CH(CH3)2(4) (CH3)2CHCH2C(CH3)(C2H5)CH2CH2CH3(5)(CH3)2CHCH(C2H5)CH2CH2CH3(6)CH3CH2CH(C2H5)2(7) (CH3)2CHCH(CH3)CH2CH3(8)CH3CH(CH3)CH2CH(C2H5)C(CH3)33、略4、下列各化合物的系统命名对吗?如有错,指出错在哪里?试正确命名之。
均有错,正确命名如下:(1)3-甲基戊烷(2)2,4-二甲基己烷(3)3-甲基十一烷(4)4-异丙基辛烷(5)4,4-二甲基辛烷(6)2,2,4-三甲基己烷5、(3)>(2)>(5)>(1) >(4)7、用纽曼投影式写出1,2-二溴乙烷最稳定及最不稳定的构象,并写出该构象的名称。
8、构象异构(1),(3)构造异构(4),(5)等同)2),(6)9、分子量为72的烷烃是戊烷及其异构体(1) C(CH3)4(2) CH3CH2CH2CH2CH3 (3) CH3CH(CH3)CH2CH3(4) 同(1)10、分子量为86的烷烃是己烷及其异构体(1)(CH3)2CHCH(CH3)CH3(2) CH3CH2CH2CH2CH2CH3 , (CH3)3CCH2CH3(3)CH3CH2CH(CH3)CH2CH3(4)CH3CH2CH2CH(CH3)214、(4)>(2)>(3)>(1)第三章烯烃1、略2、(1)CH2=CH—(2)CH3CH=CH—(3)CH2=CHCH2—3、(1)2-乙基-1-戊烯(2) 反-3,4-二甲基-3-庚烯(或(E)-3,4-二甲基-3-庚烯(3) (E)-2,4-二甲基-3-氯-3-己烯(4) (Z)-1-氟-2-氯-2-溴-1-碘乙烯(5) 反-5-甲基-2-庚烯或(E)-5-甲基-2-庚烯(6) 反-3,4-二甲基-5-乙基-3-庚烯(7) (E) -3-甲基-4-异丙基-3-庚烯(8) 反-3,4-二甲基-3-辛烯5、略6、7、活性中间体分别为:CH3CH2+CH3CH+CH3(CH3)3C+稳定性: CH3CH2+>CH3CH+CH3>(CH3)3C+反应速度: 异丁烯>丙烯>乙烯8、略9、(1)CH3CH2CH=CH2(2)CH3CH2C(CH3)=CHCH3(有顺、反两种)(3)CH3CH=CHCH2CH=C(CH3)2(有、反两种)用KMnO4氧化的产物: (1) CH3CH2COOH+CO2+H2O(2)CH3CH2COCH3+CH3COOH(3) CH3COOH+HOOCCH2COOH+CH3COCH310、(1)HBr,无过氧化物(2)HBr,有过氧化物(3)①H2SO4,②H2O(4)B2H6/NaOH-H2O2(5)①Cl2,500℃②Cl2,AlCl3(6)①NH3,O2②聚合,引发剂(7)①Cl2,500℃,②Cl2,H2O ③NaOH11、烯烃的结构式为:(CH3)2C=CHCH3。

[键入公司名称]2011/4/26有机化学笔记目录引言 (1)第二章烷烃(alkane) (4)第三章烯烃(alkene) (7)第四章炔烃和二烯烃(alkyne&alkadiene) (9)第五章脂环烃(alicylic hydrocarbon) (11)第六章芳烃(aromatic hydrocarbon) (13)第七章立体化学(stereochemistry) (16)第八章卤代烃(halide hydrocarbon) (17)课本笔记及自学心得第九章醇和酚(alcohol&phenol) (23)第十章醚和环氧化合物(ether&epoxide) (28)第十一章醛和酮(aldehyde&ketone) (30)第十二章核磁共振(NMR) (39)第十三章红外与紫外光谱(IR&UV) (41)第十四章羧酸(carboxylic acid) (41)第十五章羧酸衍生物(Carboxylic acid derivatives) (44)第十六章碳负离子反应(carbanion reaction) (45)第十七章胺(amine) (48)引言有机化学:研究有机化合物的组成、结构、性质及其变化规律的科学。
有机化合物:碳氢化合物及其衍生物简单的含碳化合物如CO2、CO、碳酸盐金属氧化物等不属于有机化合物,而CF2=CF2、B3N3等由于具有有机化合物的性质而属于有机化合物。
有机化合物的特性:①原子之间主要通过共价键连接②多数有机化合物熔点低、易燃烧(CCl4)除外③大多数有机化合物不易溶于水(低分子量的醇、醛、酮、羧酸、氨基酸和糖类等易溶于水)④多数有机化合物反应速率慢、副反应多分子键:分子内原子间的作用力。
决定物质的化学性质常见的分子键又共价键、离子键、配位键共价键是由成键原子的电子云相互重叠形成的。
重叠越多,键越稳定①键长:成键的两个原子核之间的距离②键能:成键时释放的能量或断键时吸收的能量③键角:分子内原子与另外两个原子形成的共价键在空间上的夹角④键的极性:成键原子的电负性不同,电负性大的原子带有部分负电荷,电负性小的原子带有部分正电荷,也即键的极化;键的极性由偶极距来衡量(μ=q。

有机化学课后习题答案第10-16章第十章醇和醚比较下列化合物在水中的溶解度,并说明理由4. CHOHCHOHGOH5.CH 3CfCH3而丙烷不能。
四、区别下列化合物。
1.CH 二CHCHOH 2.CH 3CHCHOH 3.CH 3CHCHCI 解:烯丙醇丙醇 1-氯丙烷烯丙醇内醇 1 —氯丙烷溴水褪色不变不变浓硫酸溶解不溶CfCf CfCfOH (CH 3) 3COH1 —丁醇 2—甲基一2—丙醇OH1 2.CH3 ICH3- - CHO H3.OH仲醇,2—戊醇叔醇, 叔丁醇叔醇, 3, 5—二甲基一3—己醇4. I5.6.HOCH 2CH 2CH 2OH仲醇,4—甲基一2—己醇伯醇1—丁醇OH8?仲醇,2—壬烯—5—醇1 .正丙醇2. 2 —甲基一2—戊醇3.二乙基甲醇1. CfCfCfOH2- HOCHCH 2CH 2OH3. CH 3OCHCH3解:溶解度顺序如右:4> 2> 1> 3>5理由:羟基与水形成分子间氢键,羟基越多在水中溶解度越大,醚可与水形成氢键,2. CHjCfCHOHCH 解:2—丁醇将下列化合物按伯仲叔醇分类,并用系统命名法命名。
伯醇1, 3 —丙二醇仲醇,异丙醇仲醇,1—苯基乙醇、预测下列化合物与卢卡斯试剂反应速度的顺序。
解:与卢卡斯试剂反应速度顺序如下:2—甲基—2 —戊醇>二乙基甲醇>正丙醇a —苯乙醇立即变浑, 3 —苯乙醇加热才变浑。
合物的脱水产物。
3-丁烯-2-醇与溴化氢作用可能生成那些产物?试解释之。
解:反应产物和反应机理如下:2—」醇1—」醇2—甲基一2—丙醇卢卡斯试剂十分钟变浑加热变浑立即变浑3 —苯乙醇3. a 一苯乙醇解:与卢卡斯试剂反应,CH B CH2C(CH3)2 IAl 2O 3CH 3CH=C(CH )22.H 2SQ 厶(CH 3) 2CCHCHOHJ—■ /(CH 3)2C=CHCHOH3.4.5.七、 1 moleH 2O屮八 W^x^CH=CHCHCh 3CH?C (CH 3)C (CH3)CH 2CH BOH OHH +Al 2O 3比较下列各组醇和溴化氢反应的相对速度。
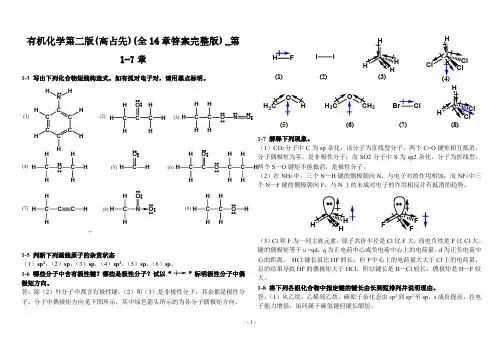

有机化学(第二版)课后答案第一章绪论1-1扼要解释下列术语.(1)有机化合物(2)键能、键的离解能(3)键长(4)极性键(5)σ键(6)π键(7)活性中间体(8)亲电试剂(9)亲核试剂(10)Lewi碱(11)溶剂化作用(12)诱导效应(13)动力学控制反应(14)热力学控制反应答:(1)有机化合物-碳氢化合物及其衍生物(2)键能:由原子形成共价键所放出的能量,或共价键断裂成两个原子所吸收的能量称为键能。
键的离解能:共价键断裂成两个原子所吸收的能量称为键能。
以双原子分子AB为例,将1mol气态的AB拆开成气态的A和B原子所需的能量,叫做A—B键的离解能。
应注意的是,对于多原子分子,键能与键的离解能是不同的。
分子中多个同类型的键的离解能之平均值为键能E(kJ.mol-1)。
(3)键长:形成共价键的两个原子核之间距离称为键长。
(4)极性键:两个不同原子组成的共价键,由于两原子的电负性不同,成键电子云非对称地分布在两原子核周围,在电负性大的原子一端电子云密度较大,具有部分负电荷性质,另一端电子云密度较小具有部分正电荷性质,这种键具有极性,称为极性共价键。
(5)σ键:原子轨道沿着轨道的对称轴的方向互相交叠时产生σ分子轨道,所形成的键叫σ键(6)π键:由原子轨道侧面交叠时而产生π分子轨道,所形成的键叫π键(7)活性中间体:通常是指高活泼性的物质,在反应中只以一种”短寿命”的中间物种存在,很难分离出来,,如碳正离子,碳负离子等。
(8)亲电试剂:在反应过程中,如果试剂从有机化合物中与它反应的那个原子获得电子对并与之共有形成化学键,这种试剂叫亲电试剂。
(9)亲核试剂:在反应过程中,如果试剂把电子对给予有机化合物与它反应的那个原子并与之共有形成化学键,这种试剂叫亲核试剂。
(10)Lewi碱:能提供电子对的物种称为Lewi碱。
(11)溶剂化作用:在溶液中,溶质被溶剂分子所包围的现象称为溶剂化作用。
(12)诱导效应:由极性键的诱导作用而产生的沿其价键链传递的电子对偏移(非极性键变成极性键)效应称为诱导效应。
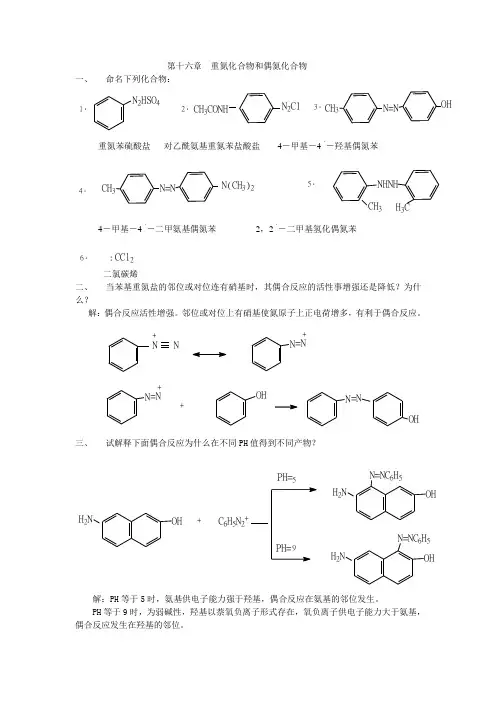
第十六章 重氮化合物和偶氮化合物一、 命名下列化合物:1.N 2HSO42.CH 3CONHN 2Cl3.CH 3N=NOH4.36..CCl2.二氯碳烯二、 当苯基重氮盐的邻位或对位连有硝基时,其偶合反应的活性事增强还是降低?为什么?解:偶合反应活性增强。
邻位或对位上有硝基使氮原子上正电荷增多,有利于偶合反应。
N N+N =N+N =N++OHN =NOH三、 试解释下面偶合反应为什么在不同PH 值得到不同产物?H 2NOH+C 6H 5N 2+PH=5H 2NOHN=NC 6H 5H 2NOHN=NC 6H 5解:PH 等于5时,氨基供电子能力强于羟基,偶合反应在氨基的邻位发生。
PH 等于9时,为弱碱性,羟基以萘氧负离子形式存在,氧负离子供电子能力大于氨基,偶合反应发生在羟基的邻位。
四、 完成下列反应式:C H 3=N NaNO 2,HClFe,HClN 2ClNH 2NO 2CH 3CH 3CH 31.2.OHOCH3+CH 2N 23.CH 33(CH 3)3COKCH 3Cl Cl4.CH 3CH 2CH 2C=C CH 2CH 2CH 3HH+CH 2..CH 2CH 2CH 3CH 2CH 2CH 3HH五、 指出下列偶氮染料的重氮组分和偶连组分。
解: 重氮组分 偶连组分1.N=NHSO3N(CH 3)2HSO3N 2+N(CH 3)22.N=N N=NOHN=N N 2+OH3.CH 3CONHN=NCH 3OH CH 3CONHN 2+HOCH 34.NaSO3N=NHONaSO3N 2+HO5.SO 3HNH 2N=NSO 3HN 2N=NNH 2SO 3HN 2++NH 2六、 完成下列合成:1.NO 2ClClClNO 2ClClNH 2NH 2N 2ClFe/HCl3Cl ClClClNaNO 2,HClClCl ClH 3PO 2Cl2.CH 3CH 3Br BrCH 3CH 3CH 3CH 33H 2SO 4NO 2NH 2NH 2Br[H]2Br 2BrCNCNNO 2NO 2NH 2NH 2N 2Cl N 2ClCNCNNaNO 2,HCl KCN,CuCN 3.NHCOCH3OHBrNHCOCH3Br 2NHCOCH3Br BrBrNH 2N 2HSO4H 2O,H+NaNO2H 2SO 450H SO OHBr4.5.CH 3CH 3NO 2CH3CH 3CH 3NO 2NH 2NHCOCH3[H]CH 3COClHNOH 2SO 4CH 3NO 2CH 3NHCOCH3NO 2CH 3H O,H +NH 2N 2ClNaNO 2NO 2CH 3NO 2H 3PO 26.NH 2NO 2BrBrNH 2CH 3COClNHCOCH33H 2SO 4NHCOCH3NO 2NHCOCH3NO 2Br BrBrNO 2BrBrH O,H+NH 2NO 2BrBrNaNO 2HClN 2ClNO 2BrBrH 3PO 27.NH 2BrCOOHBrNH 2NH2NH 2H 2SO 4SO 3H22BrBrNH2SO 3HH O,H+BrBrBrBrNaNO 2,HClN 2ClKCN/CuCNBrBr BrBrCNCOOHH 2O,H+七、 以苯,甲苯,萘和小于或等于两个碳原子的有机化合物为原料合成下列化合物:1.(CH 3)2NN=N3H 2SO 4NO 2[H]NH 2N(CH3)23NH 2HNO2N 2ClN(CH3)2N 2Cl+(CH 3)2NN=N2.CH 3N=NH 2N NH 2CH 33H 2SO 4NO2CH 3CH3[H]NH 2CH32HClN 2Cl3H 2SO 42NO 2O 2NH 2NNH 2[H]CH 3N 2ClCH 3N=NH 2NNH 23.OHCH 3N=NCH 3CH 3SO 3HCH3CH 3H SO NaOHONaCH 3H 3O+OHCH 3HNO3H 2SO 4CH 3CH 3NO 2NO 2+CH 3NO 2[H]CH 3CH 3NH 2N 2Cl2HClCH 3OH+OHCH 3N=NCH 3N=N4.HSO3OHNH 2H SONH 2SO 3HHNOSO 3HN 2Cl+H 2SO 4<65CSOOHOHSO 3HN 2Cl+N=NHSO3OH5.(CH 3)2NN=NNO 2NO 2NH 2NHCOCH3NO 2NHCOCH3NO 2NO2NH 2N 2ClN(CH )2(CH 3)2NN=N NO 2NH 22CH3IN(CH 3)2N=NCH 3CH3CH 3NO 22ZnNaOH/C2H 5OHN=NCH 3CH 36.7.COONaN=N NaSO3OH OH+CO 2OHCOONaN 2ClCOONaN=N NaSO 3OH 8.N=NCH 3HOCH 3OHCH 3+ClN2CH 3N=NHOCH 3CH 3八、推测下列化合物的结构: 1,某芳烃分子式为C 6NO 2ClBrOC 6H 3OHCl NO 2NO 22、某芳香性族化合物分子式为 ,,C6H4NO2CH322+4COCOONO2CH3NH2CH3CH3CH3CH3OCOOFe,HCl2N2ClCN2+COOHKMnOCOOH九、下列结构的偶氮染料,以氯化亚锡-盐酸溶液还原分解后,生成那些化合物?1.N=N(CH3)2N SO3H(CH3)2N NH2H2N SO3HS n C l2,H C lN=NS n C l2,H C lHSO3NH2SO3H2.HSO3NH2NH2SO3HH2N+N=NS n C l2,H C lNH2H2N+3.CH3OH CH3OH十、某化合物以氯化亚锡盐酸还原可得对甲基苯胺和N,N-二甲基对苯二胺,试推测原化合物的结构,并以苯,甲苯及甲醇为原料合成之。
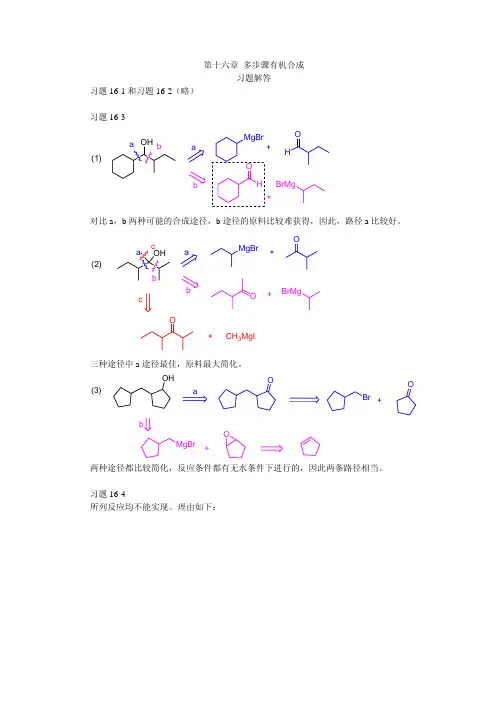
第十六章 多步骤有机合成习题解答习题16-1和习题16-2(略)习题16-3OH (1)OH +MgBrH O +BrMg a bab对比a ,b 两种可能的合成途径,b 途径的原料比较难获得,因此,路径a 比较好。
(2)OH ababMgBr+O+BrMg Oc cO+CH 3MgI三种途径中a 途径最佳,原料最大简化。
(3)OHOBr O+MgBr+Oab两种途径都比较简化,反应条件都有无水条件下进行的,因此两条路径相当。
习题16-4所列反应均不能实现。
理由如下:(1)主要形成O(2)缩酮将水解O O或(3)分子内反应为主,生成O O(4)醇将脱水(5)羰基也将被还原OH(6) 醇羟基存在下无法制备格氏试剂(7)醇将水解BrCOO习题16-5机理:OOHR16-6R NH COOH ROHR C OH2OHH- H COHOH R2+CHOOHOH这里相当于一个酰胺水解。
一般总成本在酸性条件下也能进行羰基质子化和接受H2O 的进攻,但烃基是难以离去的。
习题16-7(略)习题16-8(A) H OHCH3CH2CH3Br HCH32CH3PBr3(S)-2-丁醇(R)-2-三溴丁烷(B) H OHCH32CH3H OTsCH32CH3AcO HCH32CH3 TsClpyridineCH3COO(S)-2-丁醇TsO HCH3CH2CH3H BrCH3CH2CH3(1)H2O+OH PBr3习题16-9CH3CH2C CH NaNH2BrCH2CH3CH3CH2C C NaCH3CH2C CCH2CH3HH3CH2C HCH2CH3HH3CH2C CH2CH3H习题16-10(略)习题16-11(P664)(书中题号为16-8)ONO(1)CH 3MgBr 3+习题16-12(P668)(书中题号为16-9)(以R 代表支链)O RCr OO HO 铬酸酯(连氧碳上无H)重排OHOHO Cr OO++H 3O习题16-13(P671)(书中题号为16-10)COOHPhCOOEtPhCH 3COOMe2COOMePh(交叉酯缩合)MeOHSSH2CH 2CH 2COOMePhh vEtO习题16-14(P671)(书中题号为16-11)(逆向思考)1 231'2'3'1233'2'1'OH习题16-15(P671)(书中题号为16-12)OH O+OHTetrahedron Letters, 1993, 34(2), 247~250Tara J. Spules, Jason D. Galpin and Dwight MacdonaldChange-accelerated cope rearrangements of 3-amino-1,5-dienes显然,上述桥环化合物更容易合成得到,可见,重排反应使后一个化合物的合成简化。
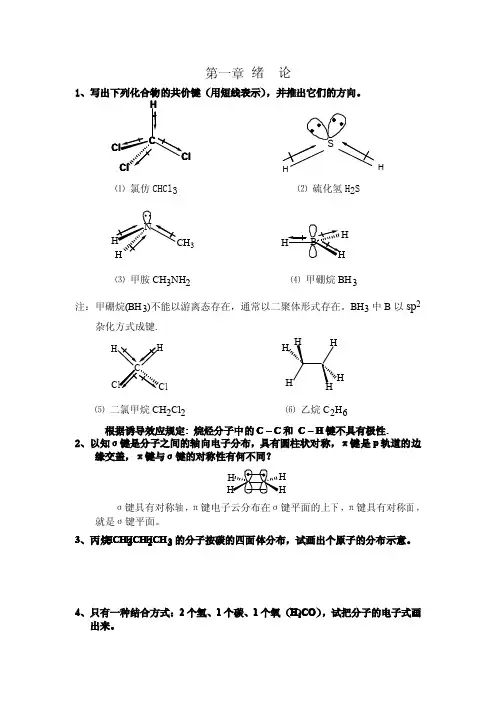
第一章绪论1、写出下列化合物的共价键(用短线表示),并推出它们的方向。
lCH⑴氯仿CHCl 3⑵硫化氢H 2S3H⑶甲胺CH 3NH 2⑷甲硼烷BH 3注:甲硼烷(BH 3)不能以游离态存在,通常以二聚体形式存在。
BH 3中B 以sp2杂化方式成键.l⑸二氯甲烷CH 2Cl 2⑹乙烷C 2H 6根据诱导效应规定:烷烃分子中的C–C 和C –H 键不具有极性.2、以知σ键是分子之间的轴向电子分布,具有圆柱状对称,π键是p 轨道的边缘交盖,π键与σ键的对称性有何不同?σ键具有对称轴,π键电子云分布在σ键平面的上下,π键具有对称面,就是σ键平面。
3、丙烷CH C H 3CH C H 2CHC H 3的分子按碳的四面体分布,试画出个原子的分布示意。
4、只有一种结合方式:2个氢、1个碳、1个氧(H 2CO C O ),试把分子的电子式画出来。
5、丙烯CH 3CH =CH 2中的碳,哪个是sp 3杂化,哪个是sp 2杂H OH 化?33226、试写试写出丁二烯分子中的键型:CH 2 = CH __ CH = CH 2σ-σ- σ- π-π- 7、试写出丙炔CH 3C≡CH中碳的杂化方式。
你能想象出sp 杂化的方式吗?332根据杂化后形成的杂化轨道有着最佳的空间取向,彼此做到了最大程度的远离,可想像2个sp 杂化轨道之间的夹角应互为1800,sp 杂化的碳原子应为直线型构型。
8、二氧化碳的偶极矩为零,这是为什麽?如果CO 2遇水后形成HCO 3-或H 2CO 3,这时它们的偶极矩还能保持为零吗?碳酸分子为什麽是酸性的?化合物分子的偶极矩是分子中所有键偶极矩的矢量和,二氧化碳分O = C = O 子中两个碳氧键的偶极矩大小相等、方向相反,故二氧化碳分子的偶极矩为零。
C -O O O -C HO O O H-2H+-O H 碳酸和碳酸氢根的偶极矩不为零。
碳酸根中的氧电负性比较大,具有容纳负电荷的能力。
换言之:碳酸失去H +后形成的共轭碱碳酸根负离子比较稳定,所以碳酸分子显示酸性。



第一章绪论 (1)第二章饱和烃 (3)第三章不饱和烃 (7)第四章环烃 (14)第五章旋光异构 (22)第六章卤代烃 (27)第七章波谱分析 (33)第八章醇酚醚 (34)第九章醛、酮、醌 (41)第十章羧酸及其衍生物 (50)第十一章取代酸 (58)第十二种含氮化合物 (65)第十三章含硫和含磷有机化合物 (72)第十四章碳水化合物 (74)第十五章氨基酸、多肽与蛋白质 (78)第十六章类脂化合物 (82)第十七章杂环化合物 (88)第一章绪论1.1 扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
1.2是否相同?如将CH4 及CCl4各1mol混在一起,与CHCl3及CH3Cl各1mol的混合物是否相同?为什么?答案:NaCl与KBr各1mol与NaBr及KCl各1mol溶于水中所得溶液相同。
因为两者溶液中均为Na+ , K+ , Br-, Cl-离子各1mol。
由于CH4 与CCl4及CHCl3与CH3Cl在水中是以分子状态存在,所以是两组不同的混合物。
1.3 碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624HCCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2p y2p z2p x2sH1.4 写出下列化合物的Lewis 电子式。
a. C 2H 4b. CH 3Clc. NH 3d. H 2Se. HNO 3f. HCHOg. H 3PO 4h. C 2H 6i. C 2H 2j. H 2SO 4答案:a.C C H H H HCC HH HH或 b.H C H H c.H N HHd.H S He.H O NO f.O C H Hg.O P O O H H Hh.H C C HHH H HO P O O H HH或i.H C C Hj.O S O HH OO H H或1.5 下列各化合物哪个有偶极矩?画出其方向。
第十六章元素有机化合物
1、解释下列名词,并举例说明之:
(1)金属有机化合物(2)∏络合物(3)金属化合物(4)氢金属化合物(5)氧化-加成反应(6)羰基化反应
答案:
2、命名下列各化合物:
(1) (CH3)3Si O Si(CH3)3 (2) CH2CH Si(CH3)2
(3) (C6H5)SiOH (4) (CH3)2BCH(CH3)2
(4) CH3OBCL2 (6) (C6H6)2Cr
答案:
3、写出下列物质的结构式:
(1)齐格勒-纳塔催化剂(2)9-BBN (3)三甲硅基烯醇醚(4)三苯膦羰基镍(5)蔡塞盐(6)威尔金逊催化剂答案:
4、写出下列各反应的主产物:
(1) CH 3Li + CuI (2) (CH 3)3B + CH 3Li
(3)4n -C 4H 9Li + SnCL 4(4)Mn(CO)5 + CH 3Br
(5) Ni(CO)4 + (C 6H 5)3
(6) + NiCL 2 + Na 答案:
5、完成下列转化:
(1) (CH 3)4(CH 3)3CCH 2COOH
(2) CH 3OH (CH 3)2CH C O
OCH 3(3)CH 3O
O
答案:
6、对下列化合物,你能提出哪几种合理的合成步骤。
分别用反应式表示。
(1) CH 3C O
CH 2
(2) (CH 3CH 2)2CH COOH
(3) C 6H 5CH CH C O
C 6H 5
答案:。
第十六章 不饱和羧酸和取代羧酸§1. 不饱和酸酸1. α,β-不饱和羧酸的制法⑴ 卤代酸去卤化氢 α-卤代酸酯在碱性试剂存在下脱去卤化氢,生成α,β-不饱和羧酸酯。
例如:CH 3(CH 2)92CH 3CH 3Br160~170C H 3C(H 2C)9HC 2CH 3CH 3⑵ 芳香醛的缩合① Knoevenagel 反应: 芳醛在含少量的六氢吡啶的吡啶催化下,与丙二酸一起回流,直接得到α,β-不饱和羧酸。
C 6H 5CHO + CH 2(CO 2H)2pyridinepiperidine,110C,1hC 6H 5HC CHCO 2H + CO 2 + H 2O② Perkin 反应:C 6H 5CH=O +C O O H 3C C OCH 332-+C 6H 5HC CHCO 2H2. α,β-不饱和羧酸的反应① 1,4-加成H 2C CHCOHOO2CH 2CO 2H)2② 与共轭二烯烃反应+CO 2CH 2CH 3§2 卤代酸1. 卤代酸的制法① α-卤代酸用郝尔-沃耳霍德-泽林斯基反应制备,例如:CH 2O HBr,NBSCHCCl O CHCOR O② β-卤代酸由α,β-不饱和羧酸与卤代氢的加成得到:RHC O+ HXRCHCH 2COOH2. 卤代酸的反应α-卤代酸及其衍生物中路原子在羰基的影响下,活性增强,容易与各种亲核亲核试剂起S N 2反应,生成α-取代羧酸。
ClCH 2COR O+ Nu -NuCH 2COR O+ Cl -Nu - = HO - ,-CN , -NHR'§3. 醇 酸羧酸分子中饱和碳原子上有羟基的称谓醇酸。
一般根据其来源命名 如:CH 3CH(OH)COOHC 6H 5CH(OH)COOHHOOCH(OH)CH2COOHHOOCCH(OH)CH(OH)COOHHOOCCH 2COH(COOH)CH 2COOH乳酸扁桃酸苹果酸酒石酸柠檬酸1. 醇酸的性质和反应:醇酸分子中含有两个或两个以上的能参与氢键形成的官能团。
有机化学第二版答案引言有机化学是研究碳基化合物的化学性质和反应机理的一门学科。
它在化学领域中占有重要的地位,涉及到药物、合成材料、能源等诸多领域。
本文档将提供《有机化学第二版》中各章节的答案,以帮助读者更好地学习和掌握有机化学的知识。
第一章:有机化学导论问题1:定义有机化学并描述其研究对象。
有机化学是研究碳元素相关的化合物的化学行为和反应机理的学科。
它主要研究有机物的结构、性质和合成方法。
问题2:简述有机化合物的特点。
有机化合物的主要特点包括:•含有碳元素,且通常与氢元素相连形成碳氢键;•可以形成多样的结构和化学键;•具有多样的物理性质,如熔点、沸点等。
问题3:列举常见的有机化合物。
常见的有机化合物包括烃类(烷烃、烯烃、炔烃)、醇、醚、酮、酸、酯、胺等。
第二章:有机化合物的结构和性质问题1:说明有机化合物的结构式表示法。
有机化合物的结构式表示法通过连接线、角标等方式来反映出分子中的原子之间的连接关系和空间构型。
问题2:解释分子式和结构式的区别。
分子式指的是表示化合物种类和组成的化学式,只能提供有机物的整体元素比例关系,不能提供具体的分子结构信息。
而结构式包括结构式式样(线角式、骨架式、立体式等)和结构式种类(分子式、简式、全式等),可以提供分子结构、空间构型等信息。
问题3:阐述立体化学的概念及其在有机化学中的重要性。
立体化学是研究分子或离子的三维空间构型及其对化学性质的影响的学科。
在有机化学中,分子的立体构型直接影响着其物理性质和化学反应。
例如,同分异构体的存在就是立体化学的重要概念之一。
第三章:烃类和可代替烃类问题1:列举并解释烃类的分类。
烃类可以分为以下几类:•烷烃:只含有碳碳单键的烃。
•烯烃:含有至少一个碳碳双键的烃。
•炔烃:含有至少一个碳碳三键的烃。
问题2:简述杂环烃的特点及其命名规则。
杂环烃是指由碳和非碳原子构成的环状化合物。
杂环烃的命名规则与脂环烃类似,不同原子的名字前面加上指示原子种类和数目的前缀,并用短划线连接。