碘量法-亚硝酸钠法
- 格式:ppt
- 大小:3.89 MB
- 文档页数:2

2021药学专业知识-药物分析:氧化还原滴定自己整理的2021药学专业知识-药物分析:氧化还原滴定相关文档,希望能对大家有所帮助,谢谢阅读!氧化还原滴定氧化还原滴定是基于氧化还原反应的滴定方法。
指示剂:自指示剂、特殊指示剂、氧化还原指示剂。
氧化还原滴定广泛应用于药品检验:碘量法、铈滴定法、亚硝酸钠滴定法。
测试点1:碘量法1.直接碘量法:滴定反应:标准I2溶液还原药物2I-滴定溶液:三氧化二砷,碘滴定溶液——校准的标准物质终点判断:淀粉指标;I2本身滴定条件:中性、酸性和弱碱性2.间接碘量法:(1)置换碘量法:氧化性药物I-I2(过量KI)I2 Na2S2O3Na2S4O6 2I-滴定溶液:硫代硫酸钠滴定剂——,用于校准的标准物质,重铬酸钾终点判断:淀粉指示剂(添加在终点附近)(2)残留碘量法:强还原性药物I22I-(过量) I2(残留)Na2S2O3Na2S4O6 2I-滴定溶液:碘滴定溶液硫代硫酸钠滴定溶液终点判断:淀粉指示剂(添加在终点附近) 碘量法分析的药物:维生素c。
测试地点2:铈测量方法滴定反应:Ce4 e Ce3淡黄色无色滴定溶液:硫酸铈滴定溶液——,用于校准的标准物质,三氧化二砷终点判断:自我指标;邻菲罗啉亚铁反应条件:酸度铈定量法分析药物:硝苯地平测试点3:亚硝酸钠滴定滴定反应:ar-NH2 nano 22 HCl [ ar-nn]clnac l2h2o芳香伯胺重氮化反应滴定溶液:亚硝酸钠滴定溶液——校准用标准物质:对氨基苯磺酸终点判断:永久滴定法、外指示剂法(碘化钾-淀粉试纸)反应条件:(1)酸的种类和浓度:HBr HCl H2S04或HN03的酸度不宜过高。
(2)反应温度和滴定速度:温度过高,亚硝酸会挥发分解;温度太低,反应速度太慢。
滴定速度在:前快后慢(3)添加溴化钾的作用:加速重氮化反应亚硝酸盐滴定法分析的药物:盐酸普鲁卡因、磺胺甲恶唑、磺胺嘧啶、用氢氧化钠滴定溶液(0.1000 mol/L)滴定20.00ml盐酸溶液(0.1000 mol/L),滴定突跃范围的pH值为A.1.00~3.00B.3.00~4.30C.4.30~9.70D.8.00~9.70E.9.70~10.00“正确答案”c“答案分析”氢氧化钠滴定盐酸如同强碱滴定强酸,PH值突跃范围应跨越酸碱范围,只有C符合。

碘量法测亚硝酸盐的含量1实验原理(1)采用间接碘量滴定法测定腌制蔬菜中亚硝酸盐含量变化,主要是利用了亚硝酸盐在酸淀性(Ph=4)[6]条件下具有氧化性,可以把碘离子还原成为为碘单质。
碘单质与粉溶液形成蓝色物质,同时淀单质与硫代硫酸钠发生反应,使蓝色物质褪色。
根据这个特点,用硫代硫酸钠来滴定还原出来的碘单质,计算出碘单质的质量,再间接计算出样品中亚硝酸盐的质量。
2计算公式X=2(V1-V2)×C×M×103/m式中:X---试样中亚硝酸盐(NaNo2计算)总含量,单位为毫克每千克(mg/g)V1---滴定式样所用硫代硫酸钠标液的体积V2---滴定试剂空白所用硫代硫酸钠标液的体积C---硫代硫酸钠标准溶液的浓度,单位为摩尔每升(mol/L)M---亚硝酸钠的摩尔质量(69g/mol)单位为克每摩尔(g/mol)m---式样质量,单位为克(g)3材料与方法3.1实验材料不同时期腌制的萝卜3.2实验仪器绞肉机、分析天平、滴定管、移液管(20ML)、容量瓶(500ML)、锥形瓶、烧杯、玻璃棒、滤纸、pH试纸3.3实验试剂(1)盐酸溶液(1:1):量取250毫升的浓盐酸,稀释至500毫升。
(2)碘化钾溶液:称取碘化钾10克,置于50毫升烧杯中加水溶解,然后洗入100毫升容量瓶中,定溶,摇匀,备用。
(3)淀粉溶液(0.5%):称取2.5克的淀粉,用水稀释至500毫升,加热溶解。
(4)硫代硫酸钠标准溶液(0.1mol/L):称取25克硫代硫酸钠置于1000ML新煮沸经冷却的蒸馏水中,待完全溶解后加入约0.2克的碳酸钠(Na2Co3),摇匀,置于棕色瓶中,放于暗处7天后标定。
4实验步骤4.1数据计算经过对文献的阅读参考发现,对测定食品和腌制蔬菜中亚硝酸盐的含量的方法很多,其中以分光光度法居多,但也有其他方法。
并且间接碘量滴定法一般都用于对蔬菜、水果、饮料中维生素C的测定。
而运用这种方法测食定食品蔬菜中亚硝酸盐含量的文献只有一篇,既周石洋和陈玲的《滴定法测定食品中亚硝酸盐含量的研究》。

简述碘量法的原理及其应用1. 碘量法原理碘量法是一种常用于分析物质中含碘量的方法,它基于碘在溶液中与物质发生化学反应的特性。
碘量法的原理可简述如下:1.碘-亚碘溶液反应原理:碘和亚碘溶液之间存在可逆反应,即: I2 +I- ⇌ I3- 碘(I2)可以与碘离子(I-)反应生成三碘化离子(I3-),反应过程中溶液的颜色由无色或黄色变为深蓝色。
2.碘与被测物质反应:碘与许多有机物和无机物质均可发生反应。
碘量法利用了这种特性,在反应过程中测定溶液中的碘含量。
3.碘滴定法:碘量法中常用的方法是使用亚碘酸钠(NaI3O6)作为滴定剂,将溶液滴加到含有淀粉指示剂的样品中,直到溶液颜色由蓝色变为无色。
滴定过程中所使用的溶液体积即为所用的碘量。
2. 碘量法的应用碘量法在实际应用中具有广泛的用途。
下面列举了一些常见的应用领域及实例:2.1 食品安全检测•碘含量分析:碘在食品中的含量对人体健康至关重要。
碘量法可以用于测定食品中的碘含量,如海产品、食盐、蔬菜等。
通过监测食品中的碘含量,可以评估人们膳食中碘摄入的情况,从而制定相应的健康策略。
•防腐剂检测:碘是一种常用的食品防腐剂,用于防止食品腐败。
使用碘量法可以对食品中的碘含量进行测定,确保食品中防腐剂的合理使用,保证食品的安全性。
2.2 环境监测•水质检测:水中含有的碘物质对人体健康影响重大。
通过碘量法可以测定水中的碘含量,例如测定饮用水中的碘含量,从而评估水质是否符合标准,保障人们的健康。
•气体检测:碘量法可以用于检测大气中的碘含量。
例如,在核电站事故发生后,可以采集空气样品,使用碘量法测定空气中的碘含量,评估事故对环境的影响程度。
2.3 医药领域•药物分析:碘量法可以应用于药物分析中,例如测定药物中的碘含量。
这对于评估药物的质量、确定药物成分以及监测药物稳定性等方面具有重要意义。
•甲状腺功能检测:碘在人体内起着关键的甲状腺代谢作用。
在医学领域中,碘量法可以用于检测甲状腺功能异常,如测定血液中的甲状腺激素含量,评估甲状腺功能的正常与否。

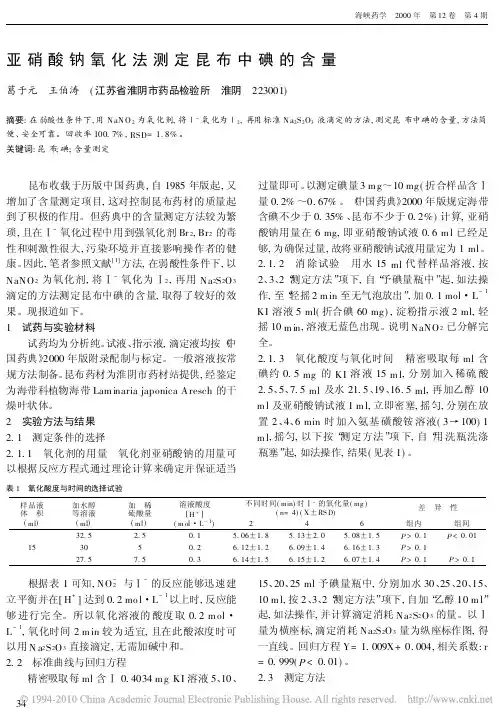
亚硝酸钠氧化法测定昆布中碘的含量葛于元 王伯涛 (江苏省淮阴市药品检验所 淮阴 223001)摘要:在弱酸性条件下,用N aN O2为氧化剂,将Ⅰ-氧化为Ⅰ2,再用标准N a2S2O3液滴定的方法,测定昆布中碘的含量,方法简便、安全可靠。
回收率100.7%,RSD=1.8%。
关键词:昆布;碘;含量测定 昆布收载于历版中国药典,自1985年版起,又增加了含量测定项目,这对控制昆布药材的质量起到了积极的作用。
但药典中的含量测定方法较为繁琐,且在Ⅰ-氧化过程中用到强氧化剂Br2,Br2的毒性和刺激性很大,污染环境并直接影响操作者的健康。
因此,笔者参照文献[1]方法,在弱酸性条件下,以NaNO2为氧化剂,将Ⅰ-氧化为Ⅰ2,再用Na2S2O3滴定的方法测定昆布中碘的含量,取得了较好的效果。
现报道如下。
1 试药与实验材料试药均为分析纯。
试液、指示液,滴定液均按《中国药典》2000年版附录配制与标定。
一般溶液按常规方法制备。
昆布药材为淮阴市药材站提供,经鉴定为海带科植物海带Lam inaria japonica Aresch的干燥叶状体。
2 实验方法与结果2.1 测定条件的选择2.1.1 氧化剂的用量 氧化剂亚硝酸钠的用量可以根据反应方程式通过理论计算来确定并保证适当过量即可。
以测定碘量3m g~10mg(折合样品含Ⅰ量0.2%~0.67%。
《中国药典》2000年版规定海带含碘不少于0.35%、昆布不少于0.2%)计算,亚硝酸钠用量在6mg,即亚硝酸钠试液0.6m l已经足够,为确保过量,故将亚硝酸钠试液用量定为1ml。
2.1.2 消除试验 用水15ml代替样品溶液,按2、3、2“测定方法”项下,自“予碘量瓶中”起,如法操作,至“轻摇2m in至无气泡放出”,加0.1mol・L-1 KI溶液5ml(折合碘60mg),淀粉指示液2ml,轻摇10m in,溶液无蓝色出现。
说明NaNO2已分解完全。
2.1.3 氧化酸度与氧化时间 精密吸取每ml含碘约0.5mg的KI溶液15m l,分别加入稀硫酸2.5、5、7.5ml及水21.5、19、16.5ml,再加乙醇10 m l及亚硝酸钠试液1m l,立即密塞,摇匀,分别在放置2、4、6min时加入氨基磺酸铵溶液(3→100)1 m l,摇匀,以下按“测定方法”项下,自“用洗瓶洗涤瓶塞”起,如法操作,结果(见表1)。


亚硝酸钠的标定结果判断【原创实用版】目录1.亚硝酸钠的概述2.亚硝酸钠的标定方法3.标定结果的判断4.标定结果的误差分析5.结论正文一、亚硝酸钠的概述亚硝酸钠(NaNO2)是一种无色或浅黄色的晶体,具有咸味,易溶于水。
在工业和生活中,亚硝酸钠被广泛应用于肉类食品的防腐、保鲜等领域。
然而,亚硝酸钠对人体具有一定毒性,因此对其含量的检测至关重要。
二、亚硝酸钠的标定方法亚硝酸钠的标定方法通常采用滴定法。
滴定法是一种通过向待测溶液中加入已知浓度的标准溶液,根据加入的标准溶液的体积和浓度计算待测溶液中物质含量的方法。
对于亚硝酸钠的标定,常用的是碘量法,即用碘液作为标准溶液进行滴定。
三、标定结果的判断标定结果的判断主要依据碘液的消耗量。
在滴定过程中,当亚硝酸钠与碘液完全反应时,溶液的颜色由无色变为黄色,且半分钟内不恢复原色,这说明亚硝酸钠已被完全氧化。
此时,通过测量消耗的碘液体积,可以计算出亚硝酸钠的含量。
四、标定结果的误差分析在标定过程中,可能会出现误差。
常见的误差有:1.操作误差:如滴定过程中读数不准确、体积计量误差等。
2.试剂误差:如标准溶液浓度不准确、试剂不稳定等。
3.待测液误差:如待测液的 pH 值、温度等条件对滴定结果产生影响。
为减小误差,可以采取以下措施:1.严格执行操作规程,提高操作技能。
2.选择合适的标准溶液,定期检查和调整浓度。
3.对待测液进行充分的预处理,保证滴定条件稳定。
五、结论亚硝酸钠的标定结果判断对于确保食品安全具有重要意义。
通过采用滴定法,可以较为准确地测定亚硝酸钠的含量。




Advances in Analytical Chemistry 分析化学进展, 2020, 10(3), 74-79Published Online August 2020 in Hans. /journal/aachttps:///10.12677/aac.2020.103011The Method of Measuring Nitriteby IodometryXiuhong Tian, Yanying Yan, Feng Yan*College of Preschool Education, Hebei Normal University, Shijiazhuang HebeiReceived: Jul. 23rd, 2020; accepted: Aug. 5th, 2020; published: Aug. 12th, 2020AbstractThe purpose for this article is to analyze the influence for the recovery rate by using iodometry to measuring the nitrite under different conditions. In general, Ph value, starch amount, temperature and time are all key points to influence this experiment. After test on these points, we find the op-timal experimental conditions: adjust the Ph value of the nitrite solution to 4, add an excess of 0.01 mg/ml potassium iodide, react for 4 minutes, add sodium thiosulfate until the yellow color be-comes light, then add 4 ml 0.5% starch solution, and continue to add sodium hyposulfite until blue turns to colorless. In this paper, we further studied that the application range of nitrite under the optimum conditions was to be 0.01 - 0.2 g/l.KeywordsIodine Quantity Method, The Determination of Nitrite, Recovery Rate碘量法测亚硝酸盐的方法研究田秀红,颜艳英,闫峰*河北师范大学,学前教育学院,河北石家庄收稿日期:2020年7月23日;录用日期:2020年8月5日;发布日期:2020年8月12日摘要本文主要是对碘量法测亚硝酸盐的方法进行了研究,分析了碘量法测亚硝酸盐在不同条件下对回收率的影响,一般来说,影响碘量法测亚硝酸盐的因素主要有:Ph值、淀粉的用量、温度、时间等。
第八节 碘量法 碘量法的特点碘量法是基于I2氧化性及I-的还原性所建立起来的氧化还原分析法。
I2+ 2e = 2I-, EI2 /I- = 0.535 V I3-+ 2e = 3I-, EI3-/I- = 0.545 VI2是较弱的氧化剂,I- 是中等强度的还原剂;¾ 用I2标准溶液直接滴定较强还原剂的方法是直接碘法;¾ 利用I-与一般氧化剂作用生成定量的I2,再用还原剂标 准溶液与I2反应,测定氧化剂的方法称为间接碘法(碘量法)。
注:pH < 9 时,不受酸度影响,应用范1 围更为广泛School of Chemical Engineering, HFUT合肥工业大学 化工学院(一)直接碘量法:利用I2的弱氧化性质滴定还原物质测定物:具有还原性物质ϕ < ϕ θ 'θ'I− 3I−¾ 可测:S2-,Sn(Ⅱ),S2O32-,SO32酸度要求:弱酸性,中性,或弱碱性 (pH小于9)• 强酸性介质:I-发生氧化导致终点拖后; 淀粉水解成糊精导致终点不敏锐• 强碱性介质:I2发生歧化反应4I-+O2 + 4H+ 3I2 + 6OH-2I2 + 2H2O(氧化反应) 5I- + IO3- + 3H2O(歧化反应)School of Chemical Engineering, HFUT(二)间接碘量法:合肥工业大学 化工学院利用I-的中等强度还原性滴定氧化性物质测定物:具有氧化性物质2I- - 2e-I2ϕ θ '较高I2 + 2S2O32-S4O62- + 2I-¾ 可测:MnO4-,Cr2O7-,CrO4-,AsO43-,BrO3-, IO3-,H2O2,ClO-,Cu2+酸度要求:中性或弱酸性• 强酸性介质:S2O32-发生分解导致终点提前; I-发生氧化导致终点拖后• 碱性介质: I2与S2O32-发生副反应,无计量关系S2O32- + 2H+SO2 ↑+ S↓+ H2O(分解)4 I2 + S2O32- + 10 OH-8I- + 2SO42-+5H2OnextSchool of Chemical Engineering, HFUT(三)碘量法误差的主要来源合肥工业大学 化工学院1.碘的挥发 ¾ 预防: 1)过量加入KI——助溶,防止挥发增大浓度,提高速度 2)溶液温度勿高 3)碘量瓶中进行反应(磨口塞,封水) 4)滴定中勿过分振摇2.碘离子的氧化(酸性条件下) ¾ 预防: 1)控制溶液酸度(勿高) 2)避免光照(暗处放置) 3)I2完全析出后立即滴定 4)除去催化性杂质(NO3-,NO,Cu2+)School of Chemical Engineering, HFUT(四)标准溶液的配制与标定 1.Na2S2O3溶液 A.配制:合肥工业大学 化工学院① 含结晶水的Na2S2O3·5H2O容易风化潮解,且含少量杂 质,不能直接配制标准溶液。
.
;. 水质亚硫酸盐的测定 碘量法
1、主要内容
在酸性溶液中,碘酸钾和碘化钾作用后析出的游离碘,将水中的亚硫酸盐氧化成硫酸盐,过量的碘和淀粉作用呈现蓝色终点。
此法使用于亚硫酸盐含量大于1mg/L 的水样。
2、试剂
2.1碘酸钾-碘化钾标准溶液(1ml 相当于1mg 亚硫酸根):依次精确称取优级纯碘酸钾0.8918g ,碘化钾7g ,碳酸氢钠0.5g ,用蒸馏水溶解后移入1000ml 容量瓶中并稀释至刻度线。
2.2 1%淀粉指示剂
2.3 1+1盐酸溶液
3、分析步骤
取100ml 水样注入锥形瓶中,加1ml 淀粉指示剂和1ml 盐酸溶液。
摇匀后,用碘酸钾-碘化钾标准溶液滴定至微蓝色,即为终点。
记录消耗碘酸钾-碘化钾标准溶液的体积(V 1)。
测定的同时,进行空白试验,作空白实验时记录消耗碘酸钾-碘化钾标准溶液的体积(V 2)
4、结果的表述
C(SO 32-)=
10000.1)(21⨯⨯-V V V 式中;
v 1——————水样消耗碘酸钾-碘化钾标准溶液的体积,ml
V 2——————空白消耗碘酸钾-碘化钾标准溶液的体积,ml
1.0—————1ml 碘酸钾-碘化钾标准溶液相当于亚硫酸盐毫克数
V ——————水样的体积,ml
5、注意事项和说明
5.1 在取样和滴定时均应迅速,以减少亚硫酸盐被空气氧化
5.2 水样温度不可过高,以免影响淀粉指示剂的灵敏度而使结果偏高。
碘量法的原理和操作方法碘量法(Iodometric Method)是一种常用的分析化学方法,用于测定溶液中碘的含量。
它的原理是基于碘与亚硫酸根离子(I- )进行氧化还原反应的性质,根据反应过程中物质的计量关系,通过滴定的方法计算出溶液中碘的浓度。
碘量法的操作方法如下:1. 实验前的准备:a. 准备所需的试剂和仪器,包括含有溶液样品的容器、亚硫酸钠和淀粉试剂的溶液、硝酸亚铁钾的标准溶液、滴定管、移液管等。
b. 仔细清洗和消毒所有的实验器皿,以避免可能的干扰。
2. 样品的处理:a. 将待测溶液适量取出,加入干燥的100毫升锥形瓶中。
b. 若溶液中的物质较多,可适当稀释。
c. 若溶液呈酸性,需加入适量的硝酸使其酸碱度接近中性。
3. 硝酸亚铁钾滴定的操作:a. 分别用滴定管分别将硝酸亚铁钾标准溶液和碘化钾溶液吸入移液管中。
b. 将溶液容器上的活塞取出,滴定管插入并调整活塞的高度,将各移液管中的溶液仔细滴入容器中。
c. 滴定过程中,需轻轻摇晃瓶子,促使反应更加充分。
d. 当滴定溶液的颜色由蓝色转变为无色时,表示滴定结束。
4. 重复实验:a. 若初始测量结果较大,可以重复进行滴定,获取更精确的结果。
b. 重复实验结果应基本一致,若有较大偏差,则需排除可能的因素干扰。
5. 数据的处理和计算:a. 记录滴定过程中滴定剂的消耗量,根据溶液的浓度计算出所需物质的含量。
b. 根据滴定剂的计量关系,计算出待测溶液中碘的浓度。
c. 通过相关的计算公式,可进一步计算出溶液中其他物质的含量。
碘量法的优点是操作简单、结果准确可靠,且适用于各种溶液体系。
但也存在一些注意事项和限制:1. 溶液样品中不能有与亚硫酸根离子发生反应的物质,否则会影响滴定结果。
2. 滴定剂的浓度和滴定速度应适宜,过程中需细心观察指示剂的颜色变化。
3. 温度对滴定结果有一定影响,需在一定的环境条件下进行实验。
4. 确保实验操作的严密性,避免氧气的进入和碘的挥发,否则会导致滴定结果偏低。
(1) 制备无氯二次蒸馏水(蒸馏水中加入亚硫酸钠,将余氯还原为氯离子,并以DPD 检查不显色,再进行蒸馏,即得)。
配制并标定0.1mol/L硫代硫酸钠滴定液(见2.2.1.3.1)。
配制并标定0.01mol/L硫代硫酸钠滴定液(临用时现配)。
配制5g/L淀粉溶液,2.5 mol/L盐酸溶液,100g/L碘化钾溶液(称取10g碘化钾溶于100ml蒸馏水中,储于棕色瓶中,避光保存于冰箱中,若溶液变黄需重新配制),饱和磷酸氢二钠溶液,pH = 7磷酸盐缓冲溶液(溶解25.4g无水KH2PO4和86.0gNa2HPO4·12H2O于800ml蒸馏水中,用水稀释成1000ml),50g/L溴化钾溶液(溶解5g溴化钾于100ml水中,储于棕色瓶中,每周重配一次)。
(2)在500ml的碘量瓶中加200ml蒸馏水、1ml磷酸盐缓冲液,吸取1.0ml~10.0 ml二氧化氯溶液或稀释液于碘量瓶中,再加入10ml碘化钾溶液,混匀。
用0.01mol/L硫代硫酸钠滴定液滴定至淡黄色时,加1ml淀粉溶液,继续滴至蓝色刚好消失为止,记录读数为A。
(3)在上述滴定出A值的溶液中再加入2.5 mol/L盐酸溶液2.5ml,并放置暗处5min。
用0.01mol/L硫代硫酸钠滴定液滴定至蓝色消失,记录读数为B。
(4)在500ml碘量瓶中加200ml蒸馏水、1ml磷酸盐缓冲液,吸取1.0ml~10.0ml二氧化氯溶液或稀释液加于碘量瓶中,然后通入高纯氮气吹至黄绿色消失,再加入10ml碘化钾溶液,用硫代硫酸钠滴定液滴定至淡黄色时,加1ml淀粉溶液,继续滴至蓝色刚好消失为止,记录读数为C。
(5)在上述滴定出C值的溶液中再加入2.5 mol/L盐酸溶液2.5ml,并放置暗处5min。
用0.01mol/L硫代硫酸钠滴定液滴定至蓝色消失,记录读数为D。
(6)在50ml碘量瓶中加入1ml溴化钾溶液和10ml浓盐酸,混匀并再加1.0ml~10.0ml 二氧化氯溶液,立即塞住瓶塞并混匀。