2020年高考化学命题热点《反应历程:活化能、催化剂和能量》微专题复习
- 格式:docx
- 大小:147.09 KB
- 文档页数:7

2020高考热点训练活化能与催化剂机理一、活化能和有效碰撞理论1.有效碰撞:使分子间发生化学反应的碰撞。
2.有效碰撞的条件:发生碰撞的分子具有足够的能量(活化分子);有合适的取向。
特别提醒:不是所有的活化分子之间的碰撞是有效碰撞。
3.活化分子:具有较高能量,能够发生有效碰撞的分子。
4.活化能:活化能是指化学反应中,由反应物分子到达活化分子所需的最小能量。
即活化分子高出反应物分子平均能量的部分。
如图:E1为正反应的活化能,E2为逆反应的活化能,即E1-E2=ΔH。
结论:5.活化能对反应速率的影响化学反应速率方程是由实验测定的。
例如aA+bB=cC的速率公式可表示为:v=kc m(A)c n(B),式中k为反应速率常数,瑞典的阿伦尼乌斯创立了化学反应速率常数经验公式k=Ae-Ea/RT,由次可以得出以下结论:(1)活化能Ea的高低对反应速率的影响极大。
催化剂通过降低活化能而影响到速率常数,进而影响反应速率。
(2)活化能越低,单位体积活化分子数越多,单位时间内有效碰撞次数越多,反应速率越快。
(3)k值的大小与浓度无关,浓度的大小能影响化学反应速率的大小,但对速率常数没有影响。
(4)k值随温度升高而增大,这与平衡常数不同,速率常数对温度非常敏感,每升高10度,速率会增加2-4倍。
(5)速率方程是由实验测定的经验方程,不一定和反应计量系数呈对应关系。
(6)多步反应中,决定总反应速率的是慢反应(决速步骤),其反应物浓度影响总反应的速率。
二、催化剂1.催化剂:在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂,又叫触媒。
催化剂在化学反应中所起的作用叫催化作用。
特别提醒:催化剂同等程度的改变正、逆反应速率。
2.催化机理:(1)催化剂通过参与化学反应,改变反应历程,降低反应的活化能(能垒),提高活化分子百分数,增加单位体积内有效碰撞次数,从而加快反应速率。
如图:(2)催化剂参与反应的形式:①均相催化(催化剂和反应物同为气体或液体)时,通常催化剂跟反应物分子或离子通常结合形成不稳定的中间态即活化络合物。
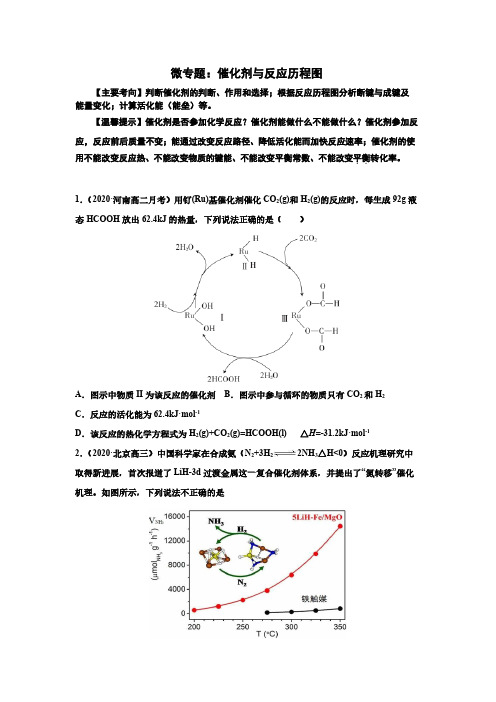
微专题:催化剂与反应历程图【主要考向】判断催化剂的判断、作用和选择;根据反应历程图分析断键与成键及能量变化;计算活化能(能垒)等。
【温馨提示】催化剂是否参加化学反应?催化剂能做什么不能做什么?催化剂参加反应,反应前后质量不变;能通过改变反应路径、降低活化能而加快反应速率;催化剂的使平衡.转化率。
用不能改变反应热、不能改变物质的键能、不能改变平衡常数、不能改变.1.(2020·河南高二月考)用钌(Ru)基催化剂催化CO2(g)和H2(g)的反应时,每生成92g液态HCOOH放出62.4kJ的热量,下列说法正确的是()A.图示中物质II为该反应的催化剂B.图示中参与循环的物质只有CO2和H2C.反应的活化能为62.4kJ·mol-1D.该反应的热化学方程式为H2(g)+CO2(g)=HCOOH(l) △H=-31.2kJ·mol-1 2.(2020·北京高三)中国科学家在合成氨(N 2+3H22NH3△H<0)反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理。
如图所示,下列说法不正确的是A.转化过程中有非极性键断裂与形成B.复合催化剂降低了反应的活化能C.复合催化剂能降低合成氨反应的焓变D.低温下合成氨,能提高原料转化率3.(2019·陕西高三)氮及其化合物的转化过程如图所示。
下列分析不合理的是A.催化剂a 表面发生了非极性共价键的断裂和极性共价键的形成B.催化剂不能改变反应焓变但可降低反应活化能C.在催化剂b 表面形成氮氧键时,涉及电子转移D.催化剂a、b 能提高反应的平衡转化率4.(2020·山东章丘四中高三月考)二氧化碳用不同催化剂催化生成一氧化碳的历程中能量的转变如图所示,(吸附在催化剂表面的用“·”表示)下列说法错误的是()A.使用催化剂NiPc需要的条件更高B.·COOH经过还原反应得到COC.反应过程中存在极性键的断裂和生成D.相同微粒吸附在不同的催化剂时能量相同5.(2020·山东省莱西市第一中学高三月考,双选)废水对自然环境有严重的破坏作用,水污染治理刻不容缓,BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。

2020年高考化学命题热点:反应历程试题(过渡态理论、活化能、能垒)课程标准要求:了解反应活化能的概念,了解催化剂的重要作用。
高考题中通过反应历程图考查催化剂是一个什么的演变过程,下面通过一系列的高考题就可以看出一点端倪。
一、题源——教材中的示意图1、苏教版如图:图中:Ea为正反应的活化能,Ea′为逆反应的活化能,反应热为△H =Ea-Ea′。
注意:图中使用催化剂时的活化能为Ea1。
示意图中有两个峰。
2、人教版、鲁科版二、高考题考查的演变1、(2011全国大纲卷,T9)反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0)。
下列示意图中,能正确表示总反应过程中能量变化的是【答案】D【解析】由反应A+B→C(△H<0)分两步进行①A+B→X(△H>0)②X→C(△H<0)可以看出,A+B→C(△H<0)是放热反应,A和B的能量之和C,由①A+B→X(△H>0)可知这步反应是吸热反应,X→C(△H<0)是放热反应,故X的能量大于A+B;A+B的能量大于C,X的能量大于C。
2、(2011江苏卷,T4)某反应的反应过程中能量变化如图1所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。
下列有关叙述正确的是A.该反应为放热反应B.催化剂能改变该反应的焓变C.催化剂能降低该反应的活化能D.逆反应的活化能大于正反应的活化能【答案】C【解析】A项,从图中看,反应物的总能量低于生成物的能量,故为吸热反应,错;B项,焓变是指反应物与生成物之间的能量差值,与反应过程无关,错;C项,加入催化剂之后,E2变小,说明活化能减小了,正确;D项,正、逆反应的活化能大小不变,错。
3、(2014·海南单科化学卷,T8)某反应过程能量变化如图所示,下列说法正确的是A、反应过程a有催化剂参与B、该反应为放热反应,热效应等于△HC、改变催化剂,可改变该反应的活化能D、有催化剂的条件下,反应的活化能等于E1 E2【答案】BC【解析】A、由图可知,反应过程a需要的活化能比b要高,所以a没有催化剂参与,A错误;B、由图可知,该反应中,反应物的总能量大于生成物的总能量,所以该反应属于放热反应,反应的热效应等于反应物与生成物能量之差,即△H,B正确;C、使用催化剂,改变了反应进行的途径,降低了反应的活化能,C正确。

2020年高考化学考点高中化学有许多需要记忆的知识,例如化学方程式、化学实验、化学元素等等,经常会让同学们非常苦恼。
接下来是小编为大家整理的2020年高考化学考点,希望大家喜欢!2020年高考化学考点一化学能与热能1、在任何的化学反应中总伴有能量的变化.原因:当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量.化学键的断裂和形成是化学反应中能量变化的主要原因.一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小.E反应物总能量>E生成物总能量,为放热反应.E反应物总能量2、常见的放热反应和吸热反应常见的放热反应:①所有的燃烧与缓慢氧化.②酸碱中和反应.③金属与酸反应制取氢气.④大多数化合反应(特殊:C+CO22CO是吸热反应).常见的吸热反应:①以C、H2、CO为还原剂的氧化还原反应如:C(s)+H2O(g)CO(g)+H2(g).②铵盐和碱的反应如Ba(OH)28H2O+NH4Cl=BaCl2+2NH3↑+10H2O③大多数分解反应如KClO3、KMnO4、CaCO3的分解等.3、能源的分类:形成条件\x09利用历史\x09性质一次能源常规能源\x09可再生资源\x09水能、风能、生物质能不可再生资源\x09煤、石油、天然气等化石能源新能源\x09可再生资源\x09太阳能、风能、地热能、潮汐能、氢能、沼气不可再生资源\x09核能二次能源\x09(一次能源经过加工、转化得到的能源称为二次能源) 电能(水电、火电、核电)、蒸汽、工业余热、酒精、汽油、焦炭等[思考]一般说来,大多数化合反应是放热反应,大多数分解反应是吸热反应,放热反应都不需要加热,吸热反应都需要加热,这种说法对吗?试举例说明.2020年高考化学考点二考点1:化学反应速率1、化学反应速率的表示方法___________。
化学反应速率通常用单位时间内反应物浓度和生成物浓度的变化来表示。

2020年高考化学命题热点:反应历程试题(过渡态理论、活化能、能垒)课程标准要求:了解反应活化能的概念,了解催化剂的重要作用。
高考题中通过反应历程图考查催化剂是一个什么的演变过程,下面通过一系列的高考题就可以看出一点端倪。
一、题源一一教材中的示意图1、苏教版如图:图2-7正反应与逆反应的活化件图中:Ea为正反应的活化能,Ea'为逆反应的活化能,反应热为AH=Ea-Ea,0注意:图中使用催化剂时的活化能为EaL示意图中有两个峰。
如图2210所示:反应A+B-AB的活化能为&,加入依化剂K后,反应分两步进行:①A+K-AK活化能为%(慢反应)②AK+B-AB+K活化能为&(快反应)总反应:A+B^-AB活化能为%可以看出,加入催化剂K后,两步反应的活反应所会图2-2-10化能%和£>2均小丁•原反应的活化能&,因此反应速率加快。
仔细分析这两步反应可以看出:由T£»l>Eq,第1步反应是慢反应,装决定整个反应快慢的步骤,称为“定速步骤”或“决速步骤”,第1步反应越快,则整体反应速率就越快。
因此对总反应来说,笫一步反应的活化能晶就是在催化条什卜总反t豚I了化学应的活化能。
2、人教版、鲁科版二、高考题考查的演变1、(2011全国大纲卷,T9)反应A+B^C(AH<0)分两步进行:①A+B t XOH>0),@X->C(AH<0)o下列示意图中,能正确表示总反应过程中能量变化的是【答案】D【解析】由反应A+B^C(AH<0)分两步进行®A+B->X(AH>0)②X t COHVO)可以看出,A+ B->C[AH<0)是放热反应,A和B的能量之和C,由①A+B t X(2\H>0)可知这步反应是吸热反应,X^C[AH<0)是放热反应,故X的能量大于A+B;A+B的能量大于C,X的能量大于C。

2020高考热点训练活化能与催化剂机理一、活化能和有效碰撞理论1.有效碰撞:使分子间发生化学反应的碰撞。
2.有效碰撞的条件:发生碰撞的分子具有足够的能量(活化分子);有合适的取向。
特别提醒:不是所有的活化分子之间的碰撞是有效碰撞。
3.活化分子:具有较高能量,能够发生有效碰撞的分子。
4.活化能:活化能是指化学反应中,由反应物分子到达活化分子所需的最小能量。
即活化分子高出反应物分子平均能量的部分。
如图:E1为正反应的活化能,E2为逆反应的活化能,即E1-E2=ΔH。
结论:5.活化能对反应速率的影响化学反应速率方程是由实验测定的。
例如aA+bB=cC的速率公式可表示为:v=kc m(A)c n(B),式中k为反应速率常数,瑞典的阿伦尼乌斯创立了化学反应速率常数经验公式k=Ae-Ea/RT,由次可以得出以下结论:(1)活化能Ea的高低对反应速率的影响极大。
催化剂通过降低活化能而影响到速率常数,进而影响反应速率。
(2)活化能越低,单位体积活化分子数越多,单位时间内有效碰撞次数越多,反应速率越快。
(3)k值的大小与浓度无关,浓度的大小能影响化学反应速率的大小,但对速率常数没有影响。
(4)k值随温度升高而增大,这与平衡常数不同,速率常数对温度非常敏感,每升高10度,速率会增加2-4倍。
(5)速率方程是由实验测定的经验方程,不一定和反应计量系数呈对应关系。
(6)多步反应中,决定总反应速率的是慢反应(决速步骤),其反应物浓度影响总反应的速率。
二、催化剂1.催化剂:在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂,又叫触媒。
催化剂在化学反应中所起的作用叫催化作用。
特别提醒:催化剂同等程度的改变正、逆反应速率。
2.催化机理:(1)催化剂通过参与化学反应,改变反应历程,降低反应的活化能(能垒),提高活化分子百分数,增加单位体积内有效碰撞次数,从而加快反应速率。
如图:(2)催化剂参与反应的形式:①均相催化(催化剂和反应物同为气体或液体)时,通常催化剂跟反应物分子或离子通常结合形成不稳定的中间态即活化络合物。
2020年高考化学复习微专题《催化剂、反应历程、能垒及速率与平衡》1.某反应的反应机理、能量与反应进程的关系如图所示,下列说法正确的是()A.Fe2+是该反应的催化剂B.第一步反应的能垒比第二步反应的小C.S2O82-在第一步反应中作还原剂D.两步反应都是放热反应2、我国科学家在绿色化学领域取得新进展。
利用双催化剂Cu 和Cu2O,在水溶液中用H 将CO2 高效还原为重要工业原料之一的甲醇,其反应机理如图所示。
则下列有关说法不正确的是()A.CO2生成甲醇是通过多步氧化反应实现的B.该催化反应过程中涉及了化学键的形成及断裂C.有可能通过调节控制反应条件获得甲醛等有机物D.催化剂Cu 结合氢原子,催化剂Cu2O 结合含碳微粒3.研究发现Pd2团簇可催化CO的氧化,在催化过程中路径不同可能生成不同的过渡态和中间产物(过渡态已标出),下图为路径1和路径2催化的能量变化。
下列说法错误..的是A.CO的催化氧化反应为2CO+O2=2CO2B.反应路径1的催化效果更好C.路径1和路径2第一步能量变化都为3.22 eVD.路径1 中最大能垒(活化能)E正=1.77 eV4.乙炔在Pd 表面选择加氢的反应机理如图所示。
其中吸附在Pd 表面上的物种用*标注。
下列有关说法正确的是()A.吸附反应为吸热反应B.该正反应历程中最大能垒(活化能)为85kJ·mol-1C.Pd 为固体催化剂,其表面积大小对催化效果无影响D.C2H2* +H*→C2H3* 只有化学键的形成过程5.二氧化碳用不同催化剂催化生成一氧化碳的历程中能量的转变如图所示,(吸附在催化剂表面的用“·”表示)下列说法错误的是()A.使用催化剂N iPc 需要的条件更高B.·COOH经过还原反应得到COC.反应过程中存在极性键的断裂和生成D.相同微粒吸附在不同的催化剂时能量相同6.中国科学家在合成氨(N 2+3H22NH3△H<0)反应机理研究中取得新进展,首次报道了LiH-3d 过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理。
1. 炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果 如图所示,活化氧可以快速氧化二氧化硫。
下列说法错误的是()A. 氧分子的活化包括0—0键的断裂与C —O 键的生成B. 每活化一个氧分子放出0.29eV 的能量C. 水可使氧分子活化反应的活化能降低0.42eVD. 炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂【答案】C【解析】A 项,由图可知,氧分子的活化是0—0键的断裂与C —0键的生成过程,正确;B 项,由图可知,反应物的总能量高于生成物的总能量,因此每活化一个氧分子放出0.29eV 的能量,正确;C 项,由图可知,水可使氧分子活化反应的活化能降低0.18eV ,错误;D 项,活化氧可以快速氧化二氧化硫,而炭黑颗粒可以活化氧分子,因此炭黑颗粒可以看作大气中二氧化硫转化为三氧化硫的催化剂,正确。
2. 水煤气变换反应为:CO(g)+H 2O(g)=CO2(g)+H 2(g)o 我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用•标注。
下列说法正确的是A.O水煤气变换反应的AH>0B. 步骤③的化学方程式为:CO・+OH・+H2O(g)=COOH・+H2O・C. 步骤⑤只有非极性键H-H 键形成D. 该历程中最大能垒(活化能)E E =1.70eV【答案】B【解析】A 项,图象分析可知水煤气的生成过程经过了过渡态1和过渡态2,最后生成产物的能量低于反应物,反应的嬉变AH 小于0,错误;B 项,结合此图分析判断,③是发生的过渡反应:CO・+OH・+H2O(g)=COOH・+H2O ・,正确;C 项,步骤⑤中H-0键原反应物中已经存在,则形成的化学键包括极性键C=O,非极性键H-H 键形成,错误;D 项,该历程中最大能垒(活化能)E I =1.86eV-(-0.16eV)=2.02eV,错误。
2020年高考化学命题热点
《反应历程:活化能、催化剂和能量》微专题复习
在基于真实情境考查学生综合运用知识的能力的考试理念引导下,与化工生产关系密切的催化剂备受青睐,成了热门考点。
从考查的知识看,主要从反应历程、活化能、速率、平衡移动等角度考查催化剂对反应的影响。
从试题形式上看,常常融合图像、表格等信息呈现形式,考查学生吸收和整合陌生信息的能力。
一、催化剂与反应历程
催化剂如何影响化学反应?有一个熟悉的例子:Cu催化乙醇的氧化反应。
2Cu+O2=加热=2CuOCH3CH2OH+CuO -加热-> CH3CHO+Cu+
H2O催化剂Cu先参与反应后又重新生成,它经历了Cu→CuO→Cu的变化历程。
[例1]用NaClO3、H2O2和稀硫酸制备ClO2。
反应开始时加入少量盐酸,ClO2的生成速率大大提高(Cl-对反应有催化作用)。
该过程可能经两步反应完成,将其补充完整:①
_______________________________________________(用离子方程式表示);②
H2O2+Cl2=2Cl-+O2+2H+。
[解析] 第②步中Cl2生成Cl-,可知催化剂Cl-的变化历程是Cl-→Cl2→Cl-,即Cl-在第①步中变成Cl2。
由题给信息及氧化还原知识可知,氧化剂是ClO,且ClO反应后生成ClO2。
离子方程式:2ClO+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O。
[答案] 2ClO+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O
二、催化剂与活化能、焓变
【备注】甲醇选择性:转化的CO2中生成甲醇的百分比。
OH的CO占全部CO的百分比。
[答案]
[解析] 先比较实验Ⅰ、Ⅱ:实验Ⅱ的催化剂比表面积大,故实验Ⅱ的反应速率大;因催化剂不影响平衡移动,故达到平衡后,实验Ⅰ、Ⅱ的c(NO)相同。
再比较Ⅱ、Ⅲ:实验Ⅲ的温度高,故实验Ⅲ的反应速率大;因温度升高,平衡左移,故平衡时c(NO)较大。
四、温度与催化剂活性
催化剂具有一定范围的活化温度,过高或过低,都会导致催化剂的活性降低。
如生物催化剂酶,对温度就非常敏感。
[例4](2017·高考天津卷节选)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放生物脱H2S的原理为
H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O
硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是________。
若反应温度过高,反应速率下降,其原因是
___________________________________。
[解析] 因为硫杆菌能显著加快反应速率,故它是反应的催化剂。
当反应温度过高时,硫杆菌会因蛋白质变性而失去了催化性能,反应速率明显下降。
[答案] 催化剂硫杆菌因蛋白质变性而失去了催化性能。
五、催化剂的来源问题
化学中有一类特殊反应,叫自催化反应,该类反应中的生成物对反应有催化作用。
它的特点之一是开始反应速率很小,随着起催化作用的产物的积累速率迅速增大。
[例5]向三颈烧瓶中加入一定量的MnO2和水,搅拌,通入SO2和N2混合气体,恒温下发生反应:MnO2+H2SO3=MnSO4+H2O。
若将N2换成空气,测得c(Mn2+)、c(SO42-)随时间t的变化如图所示。
导致c(Mn2+)、
c(SO42-)变化产生明显差异的原因是
________________________________________________________________________。
[解析] 由图可知,“N2换成空气”发生了副反应:O2+2H2SO3=2H2SO4。
表示c(SO42-)的曲线斜率逐渐增大,说明SO的生成速率逐渐增大。
因反应物浓度、压强、温度、接触面积等维持不变,所以导致SO的生成速率加快的因素应是催化剂,而且催化剂是某种生成物,应是Mn2+。
[答案]Mn2+对O2和H2SO3的反应有催化作用[归纳小结]判断一个化学反应是否是自催化反应,先要排除温度、浓度、压强、接触面积等的影响,然后再分析是何种生成物具有催化作用。
六、催化剂、温度对平衡的综合影响
[例6]NH3催化还原氮氧化物技术是目前应用最广泛的烟气脱氮技术:4NH3(g)+6NO(g) ⇌5N2(g)+6H2O(g) ΔH<0。
密闭容器中,在相同时间内,在催化剂A作用下脱氮率随温度变化如图所示。
现改用催化能力稍弱的催化剂B进行实验,请在图中画出在催化剂B作用下的脱氮率随温度变化的曲线(不考虑温度对催化剂活性的影响)。
[解析] 先分析催化剂A作用下的脱氮率为什么会先增大后减小。
低于300 ℃时,温度越高,反应速率越快,相同时间内消耗的NO越多,所以脱氮率增大。
高于300 ℃时,因为温度升高,平衡逆向移动,消耗的NO减小,所以脱氮率下降。
改用催化剂B,就涉及催化剂和温度两个变量,在解题时要分别考虑。
①B催化下,随着温度的升高,脱氮率也应先增大后减小。
②达到曲线最高点之前,B的催化能力弱,相同温度时的脱氮率要小于A。
即所画曲线应在A的下方。
③B催化下在相同时间内达到平衡,则曲线最高点应出现在高于300 ℃的位置。
④当A、B均达到平衡后,平衡脱氮率只与温度有关,所以两条曲线重合。
[概括整合] 催化剂通过参与化学反应,改变反应历程,从而降低活化能,加快反应速率,到达平衡所需的时间减少。
但催化剂不能改变焓变,也不能使平衡移动。
催化剂的催化性能也会受外界条件的影响,如温度、表面积等。