人教版初三化学下册常见的酸和碱
- 格式:docx
- 大小:80.56 KB
- 文档页数:11


第十单元酸和碱课题一、常见的酸和碱一、酸、碱、盐的组成及其电离方程式:1、【酸==H++酸根离子】如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)、CH3COOH(醋酸,又名乙酸)、碳酸(H2C O3) HCl = H+ + Cl-,H2SO4 = 2H+ + SO42-HNO3 = H+ + NO3-H 2C O3= 2H+ + C O32-CH3COOH = CH3COO-+ H+2、【碱==金属阳离子/ NH4++ OH-】如:KOH(氢氧化钾)、NaOH(氢氧化钠)、Ca(OH)2(氢氧化钙)、Ba(OH)2(氢氧化钡)KOH = K++ OH-NaOH = Na++ OH-Ca(OH)2= Ca2++ 2OH-Ba(OH)2 = Ba2++ 2 OH-NH3·H2O=NH4++ OH-3、【盐==金属阳离子/ NH4++酸根离子】如:氯化钠NaCl、碳酸钠Na2CO3、硫酸铜CuSO4硝酸钡Ba(NO3)2 硫酸铵(NH4)2SO4 硫酸铁Fe2(SO4)3NaCl = Na++Cl-Na2CO3 =2Na++CO32-CuSO4 =Cu2++ SO42-Ba(NO3)2 = Ba2++2NO3-(NH4)2SO4 = 2NH4+ + SO42- Fe2(SO4)3= 2Fe3++ 3SO42-【小结:因为酸、碱、盐的水溶液都能离解成自由移动的阴、阳离子,所以它们的水溶液都能导电】二、酸碱指示剂●定义:像石蕊、酚酞溶液一样能跟酸或碱的溶液起作用而显示不同颜色的物质叫做酸碱指示剂。
●在氨分子运动、CO2与水的反应等实验探究中我们分别用过紫色石蕊溶液和无色酚酞溶液。
●某些植物的花瓣或果实(如牵牛花、月季花、紫卷心菜等)也可用作酸碱指示剂。
●紫色石蕊溶液遇酸溶液(含H+)变红,遇碱溶液(含OH-)变蓝,在中性溶液中呈紫色。
无色酚酞溶液遇酸溶液不变色,在中性溶液中不变色,遇碱溶液变红。
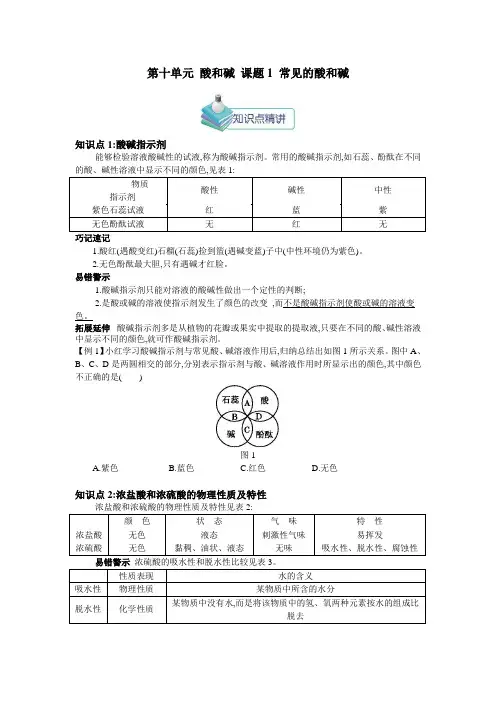
第十单元酸和碱课题1 常见的酸和碱知识点1:酸碱指示剂能够检验溶液酸碱性的试液,称为酸碱指示剂。
常用的酸碱指示剂,如石蕊、酚酞在不同的酸、碱性溶液中显示不同的颜色,见表1:物质指示剂酸性碱性中性紫色石蕊试液红蓝紫无色酚酞试液无红无巧记速记1.酸红(遇酸变红)石榴(石蕊)捡到篮(遇碱变蓝)子中(中性环境仍为紫色)。
2.无色酚酞最大胆,只有遇碱才红脸。
易错警示1.酸碱指示剂只能对溶液的酸碱性做出一个定性的判断;2.是酸或碱的溶液使指示剂发生了颜色的改变,而不是酸碱指示剂使酸或碱的溶液变色。
拓展延伸酸碱指示剂多是从植物的花瓣或果实中提取的提取液,只要在不同的酸、碱性溶液中显示不同的颜色,就可作酸碱指示剂。
【例1】小红学习酸碱指示剂与常见酸、碱溶液作用后,归纳总结出如图1所示关系。
图中A、B、C、D是两圆相交的部分,分别表示指示剂与酸、碱溶液作用时所显示出的颜色,其中颜色不正确的是()图1A.紫色B.蓝色C.红色D.无色知识点2:浓盐酸和浓硫酸的物理性质及特性浓盐酸和浓硫酸的物理性质及特性见表2:颜色状态气味特性浓盐酸无色液态刺激性气味易挥发浓硫酸无色黏稠、油状、液态无味吸水性、脱水性、腐蚀性易错警示浓硫酸的吸水性和脱水性比较见表3。
性质表现水的含义吸水性物理性质某物质中所含的水分脱水性化学性质某物质中没有水,而是将该物质中的氢、氧两种元素按水的组成比脱去【例2】若将浓盐酸和浓硫酸敞口放置在空气中,一段时间后,可以肯定的是()A.溶质质量都减少B.溶剂质量都增大C.溶液质量都增大D.溶质的质量分数都减小知识点3:浓硫酸的稀释实验室中常备有浓硫酸,在具体的化学实验中常用到稀硫酸,需将浓硫酸进行稀释(见表4)。
操作现象解释图(a)操作错误。
为说明错误操作的危害,在图(b)特定的装置内把少量水滴进浓硫酸中液滴四溅水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅,这是非常危险的图(c)操作正确。

常见的酸和碱1、(1)酸碱指示剂定义:跟酸和碱作用显示不同颜色的物质叫做酸碱指示剂。
紫色石蕊试液和无色酚酞试液是常见的酸碱指示剂。
(2)酸碱指示剂与酸碱作用:紫色石蕊试液遇酸变红,遇碱变蓝;无色酚酞试液遇酸不变色,遇碱变红色。
一、酸2、常见的酸:盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、醋酸(CH3COOH)。
(1)盐酸:纯净的盐酸是无色有刺鼻性气味,有酸味的液体,工业盐酸因含 FeCl3呈黄色,浓盐酸具有挥发性,打开盛浓盐酸的试剂瓶,瓶口会有白雾产生(浓盐酸具有挥发性,挥发出的氯化氢气体溶解在空气中的水蒸气中,形成了盐酸小液滴,瓶口的白雾就是盐酸小液滴),能与水任意比互溶。
用途:金属除锈、制药、人体胃液中的胃酸的主要成分,帮助消化。
(2)硫酸:无色黏稠状液体,无气味,能溶于水,溶于水时放出大量的热。
用途:重要的化工原料、金属除锈、实验室中的干燥剂。
浓硫酸的性质:A:浓硫酸具有很强的腐蚀性,它能夺取纸张、木材、布料、皮肤等物质中的水分(把物质中的氢氧元素按水的组成比脱去),生成炭黑,故使用浓硫酸时应特别注意。
B:吸水性:浓硫酸具有将强的吸水性,能够吸取空气中的水蒸气,故长时间放在空气中的浓硫酸质量会增重,浓度会变稀。
故浓硫酸可以用来干燥一些气体。
C:浓硫酸具有强氧化性。
浓硫酸的稀释:稀释浓硫酸时不能见水往浓硫酸中加(浓硫酸溶于水时放出大量的热,足以使溶液沸腾,液体溅出伤人),应把浓硫酸往水中加,边加边用玻璃棒(玻璃棒作用:散热)搅拌,如不慎将浓硫酸沾到皮肤或衣服上,应先用大量水冲洗,再涂上的碳酸氢钠溶液( H2SO42NaHCO3Na2SO42CO22H2O),稀硫酸沾到皮肤上或衣服上也要这样处理(因为稀硫酸水分蒸发后也会变成浓硫酸)。
3、酸的化学性质:(1)酸与酸碱指示剂作用,酸能使紫色石蕊试液变红,无色酚酞试液遇酸不变色。
(2)酸与金属的反应:与盐酸的反应与硫酸的反应镁Mg 2HCl MgCl 2 H2Mg H2SO4MgSO4H2铁Fe 2HCl FeCl 2 H 2 Fe H2SO4FeSO4H2锌Zn 2HCl ZnCl 2 H 2 Zn H2SO4 ZnSO4 H2铝2Al 6HCl 2AlCl3 3H2 2Al 3H2SO4Al2SO433H2(3)酸与金属氧化物的反应:Fe2O3Fe2O36HCl 33H2OFe2O33H2SO4Fe3SO423H2O 2FeClMgOCuOCaO3%-5%(4)和碱的反应:NaOHCaOH 2NH3.H2O4、为什么酸具有相同的化学性质:因为酸中具有相同的H ,但并不是所有的酸都具有向的化学性质,不同的酸含有不同的酸根离子,故性子也有差异,即物质的组成决定物质的性质。






教学目标
1、了解酸碱指示剂的变色情况,并能够把宏观的现象与微观的结构联系起来
2、了解浓硫酸、浓盐酸的各种性质上的区别,并知道鉴别他们的方法
3、知道浓硫酸与稀硫酸;浓盐酸和稀盐酸的性质上的差异,并知道鉴别他们的方法
4、了解酸的通性,并知道造成酸的通性的原因
5、了解酸与各类物质发生反应的现象,并知道造成这种现象的微观粒子在成分上的变化
6、了解碱的通性,并知道造成碱的通性的原因
7、了解碱与各类物质发生反应的现象,并知道造成这种现象的微观粒子在成分上的变化
教学过程
一、酸、碱与指示剂的作用
巩固练习
1、往盐酸中滴入石蕊,然后再向溶液中逐滴滴入氢氧化钠溶液,观察溶液的颜色变化, 并推测溶
液中离子成分的变化
二、几种常见的酸
1、浓盐酸和浓硫酸
1)把下列几种物质按类别填空:
①盐酸、②硫酸、③浓盐酸、④浓盐酸、⑤稀盐酸、⑥稀硫酸
属于混合物的是_______________ ,属于纯净物的是
2、盐酸与稀硫酸共有的性质
练习3:
往下图所示的盐酸中滴入适量的CaC03,恰好完全反应,请完成下图。
若再加入过量的CaC03,请继续完成下图
3、生活中常见的酸与某些酸的用途1
2
酸
二、常见的碱
1、氢氧化钠与氢氧化钙的性质
2、氢氧化钠与氢氧化钙的用途以及常见的碱
3、碱的化学性质
1
(接上表)
3、氢氧化钠与氢氧化钙的性质上的差别
氢氧化钠(固体)氢氧化钙(固体)
物理性质颜色、状态
吸水性
水溶性
溶于水的吸放
热情况
化学性质与二氧化碳反应
利用氢氧化钠与氢氧化钙在性质上的不同请你设计5种鉴别他们的方法。
课后拓展一、需要密封保存的物质的总结与不密封保存的后果
浓硫酸——导致变成稀硫酸,质量增大
氢氧化钠固体(溶液不具有吸水性)
吸水性
挥发性浓盐酸——导致变成稀盐酸,质量减少
氢氧化钠固体(或氢氧化钠溶液)变成
碳酸钠
与二氧化碳反应< =
三、溶液的导电性
物质 能否导电
原因
电离方程式
总结
盐酸
硫酸
氢氧化钠溶液
氢氧化钙溶液
蒸馏水
乙醇
'''''—
F 列物质的水溶液,不能导电的是 NaCI B . H 2SO 4
C . C 2H 5OH
F 列物质溶于水,解离出的阳离子只有 NaOH
B . HCI
C . NH 4C1 F 列物质中,属于碱的是
②ZnSO 4 B .②④
1. A . D . KOH H +的是 D . Ca(OH) ④ HNO 3 ⑤ K 2CO 3
②⑤
完成教科书上的实验•并认真填写下表
2.
A.
3.
①NaOH ②ZnSO4 ③“出?出0
A .④
B .②④ C.①③D.
4 .下列物质的电离方程式,书写正确的是
2- + +2 -
A . NaOH=Na++O +H
B . Zn Cl 2=Zn +2C1
+ 2-3+
C . K2CO3=K2 +CO3
D . Fe2(SO4)3=2Fe +3 SO4
5.写出下列物质的电离方程式。
硫酸:;氢氧化钙:
硝酸铜:__________________________ ;氯化镁:—
碳酸钠:;硫酸铵:
6 .饱和氯化钠溶液中存在的微小粒子有______________。