九年级下册化学 盐的化学性质(教案)
- 格式:doc
- 大小:212.37 KB
- 文档页数:5

3、
盐与金属反应的知识点中,盐必须是溶液、金属单质必须在盐中金属的前面,金属除钾、钙、钠、钡之外是学生较容易忽略的问题。
ﻭ
2、
难点:盐的化学性质;爱国主义和辩证观的情感体验与升华;对学习方法的培养,特别是强调学习对比的实验方法。
5)通过本节学习,使学生认识量变到质变的具体事例,初步揭示从量变到质变的规律,同时培养学生的分析归纳能力。
6)通过铁与硫酸、铜与硝酸银反应的实验的分析,使学生树立外因和内因辩证统一的观点;使学生逐步体验到物质、条件、环境之间相互制约的辩证唯物主义观点的普遍性.ﻭ
思想教育:培养学生用辩证的观点来认识物质的共性与个性及其它之间的区别。
培养学生依据事实解决问题的科学态度。
ﻭ。

盐的化学性质教案一、教学目标1. 知识与技能:(1)了解盐的概念和分类;(2)掌握盐的化学性质,能够运用相关知识解释一些实际问题。
2. 过程与方法:(1)通过实验观察和分析,探究盐的化学性质;(2)培养学生的实验操作能力和观察能力。
3. 情感态度与价值观:(1)培养学生对化学实验的兴趣和好奇心;(2)培养学生勇于探究、积极思考的科学精神。
二、教学重点与难点1. 教学重点:(1)盐的概念和分类;(2)盐的化学性质。
2. 教学难点:(1)盐的化学性质的微观解释;(2)如何运用盐的化学性质解决实际问题。
三、教学准备1. 实验器材:试管、酒精灯、镊子、滴管、试管架、试管刷等。
2. 实验试剂:氯化钠、硫酸铜、硝酸银、氢氧化钠、稀盐酸等。
3. 课件和教学素材。
1. 导入新课:(1)通过展示一些生活中的盐制品,如食盐、白糖、酱油等,引导学生思考:这些物质有什么共同特点?(2)学生回答后,教师总结:这些物质都是盐,今天我们要学习盐的化学性质。
2. 自主学习:(1)学生阅读教材,了解盐的概念和分类;(2)教师提问,检查学生的学习效果。
3. 实验探究:(1)学生分组进行实验,观察和记录实验现象;(2)教师巡回指导,解答学生的疑问。
4. 总结与讲解:(1)学生汇报实验结果,教师引导学生总结盐的化学性质;(2)教师讲解盐的化学性质的微观解释。
5. 应用拓展:(1)学生运用所学知识解释一些实际问题,如食盐为什么能防腐?(2)教师点评学生的回答,引导学生思考盐的化学性质在生活中的应用。
五、课后作业1. 完成教材后的练习题;2. 调查生活中盐的应用,下节课分享。
1. 知识与技能:(1)能够准确地描述盐的概念和分类;(2)能够运用盐的化学性质解释一些实际问题。
2. 过程与方法:(1)能够独立完成实验,并正确观察和记录实验现象;(2)能够运用实验结果,总结盐的化学性质。
3. 情感态度与价值观:(1)对化学实验感兴趣,具有好奇心;(2)勇于探究,积极思考,表现出科学的探究精神。

初中化学盐教案主题:化学中的盐教学目标:1. 了解什么是盐2. 掌握盐的分类及性质3. 能够运用所学知识解决相关问题教学重点和难点:重点:盐的分类及性质难点:化学方程式的写法和解读教学准备:实验器材:试管、试管夹、试管架、烧杯等实验药品:氯化钠、硫酸、氢氧化钠等教学步骤:一、导入1. 引入化学盐的概念,并让学生猜想盐的分类及性质是什么。
2. 提问:生活中有哪些常见的盐?它们是如何制备的?二、学习盐的分类及性质1. 介绍盐的分类:无机盐、有机盐,并展示不同类型的盐的化学结构式。
2. 讲解盐的性质:溶解性、晶体形状、溶解热等。
三、实验探究1. 实验一:氯化钠与硫酸反应制备氯化钠。
**实验步骤:**a. 取一定量氯化钠溶液倒入试管中。
b. 加入硫酸,观察气体的产生。
c. 滴加氢氧化钠,观察沉淀的生成。
d. 用化学方程式表示该反应。
2. 实验二:氯化钠的熔融导电性实验。
**实验步骤:**a. 将氯化钠加热至熔融状态。
b. 用导电实验仪器测试其导电性。
c. 观察氯化钠导电的现象。
四、总结归纳1. 回顾盐的分类及性质,让学生总结本节课的重点内容。
2. 督促学生完成相关练习题,巩固所学知识。
五、作业布置1. 完成课后作业《盐化学方程式填空题》。
2. 预习下节课内容《盐的应用领域及环境问题》。
教学反思:本节课设计了实验环节,让学生通过实际操作感受盐的性质,加深对化学知识的理解。
同时,通过提问、讨论等方式激发学生的学习兴趣,提高课堂互动性。
在教学中注重培养学生的实验能力和解决问题的能力,帮助学生更好地掌握化学知识。
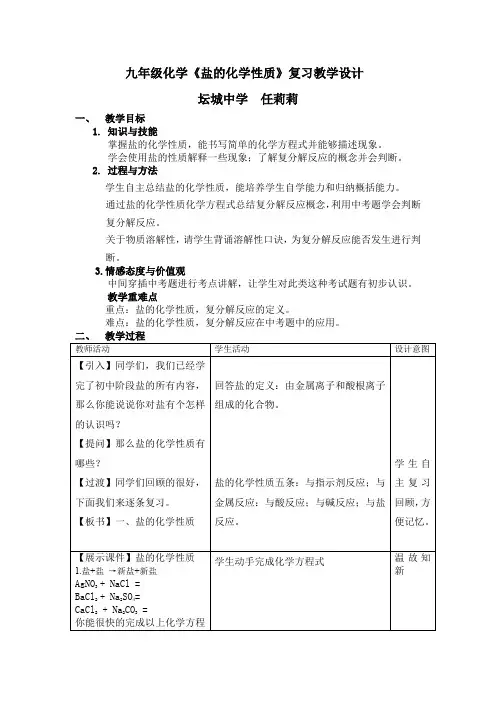
九年级化学《盐的化学性质》复习教学设计
坛城中学任莉莉
一、教学目标
1.知识与技能
掌握盐的化学性质,能书写简单的化学方程式并能够描述现象。
学会使用盐的性质解释一些现象;了解复分解反应的概念并会判断。
2.过程与方法
学生自主总结盐的化学性质,能培养学生自学能力和归纳概括能力。
通过盐的化学性质化学方程式总结复分解反应概念,利用中考题学会判断复分解反应。
关于物质溶解性,请学生背诵溶解性口诀,为复分解反应能否发生进行判
断。
3.情感态度与价值观
中间穿插中考题进行考点讲解,让学生对此类这种考试题有初步认识。
教学重难点
重点:盐的化学性质,复分解反应的定义。
难点:盐的化学性质,复分解反应在中考题中的应用。
一、盐的化学性质
二、复分解反应。

盐的性质 - 北京版九年级化学下册教案一、教材要求1.1 教学内容本节课教学内容为盐的性质,主要包括盐的物理性质、化学性质以及在日常生活中的应用。
1.2 知识要求学生需要具备以下基础知识: - 离子的概念 - 离子键和共价键的特点 - 电解质和非电解质的区别 - 酸和碱的性质及反应二、教学目标2.1 概念理解1.掌握盐的基本概念;2.理解盐的物理性质和化学性质;3.理解盐在日常生活中的应用。
2.2 能力培养1.运用理论知识分析盐的物理性质和化学性质;2.学习盐的制备和应用。
2.3 情感态度培养学生对盐的认识和探究兴趣,增强学生归纳总结和创新能力。
三、教学内容及安排3.1 教学内容1.盐的基本概念2.盐的物理性质3.盐的化学性质4.海水的提纯制盐5.盐的应用3.2 教学安排时间教学内容教学方法10 min 盐的基本概念教师讲解20 min 盐的物理性质学生小组探究20 min 盐的化学性质学生小组讨论30 min 海水的提纯制盐教师示范+学生操作20 min 盐的应用学生提出应用情况四、教学重点难点4.1 教学重点1.盐的物理性质2.盐的化学性质4.2 教学难点1.盐的制备方法2.盐的应用情况五、教学评价5.1 评价方式考查学生的理论知识及实验操作能力。
5.2 评价标准1.理论知识掌握:答题准确性、答题全面性;2.实验操作能力:实验操作规范性、实验数据准确性;3.创新能力:创造性思维、创新性实验设计。
六、教学资源6.1 教材北京版九年级化学下册6.2 教具和材料1.海水、盐、烧杯、过滤器、瓷漏斗、手套、眼镜、试管、蒸馏水、三脚架等实验器材。
2.PPT讲解资料3.摄像头、麦克风等教学设备七、教学后记本课程主要讲解了盐的性质和应用。
在教学过程中,我注重学生的互动和参与,通过小组讨论、实验操作等方式激发学生的学习兴趣,提升学生的实践能力和创新意识。
学生通过实验操作,深入了解了盐的制备方法和应用情况,达到了预期的教学目标。

初中化学教案盐
主题:盐
一、教学目标:
1. 掌握盐的定义及分类;
2. 了解盐的制备方法;
3. 理解盐的性质及应用。
二、教学重点:
1. 盐的定义;
2. 盐的分类;
3. 盐的制备方法。
三、教学难点:
1. 盐的性质及应用;
2. 盐的实验室制备方法。
四、教学过程:
1. 盐的定义及分类(10分钟)
- 介绍盐是由金属离子与非金属离子组成的化合物;
- 分类:氯化物、硫酸盐、亚硝酸盐、硝酸盐等。
2. 盐的制备方法(15分钟)
- 溴化钾的制备:用氢溴酸和氢氧化钾反应;
- 碳酸钙的制备:用盐酸和碳酸钠反应;
- 硫酸铜的制备:用硫酸和铜粉反应。
3. 盐的性质及应用(15分钟)
- 盐的溶解性:大部分盐可溶于水,但也有不溶于水的盐;- 盐的应用:食盐用于烹饪,氯化钠用于工业等。
4. 实验演示(20分钟)
- 实验1:氯化钠的制备
- 实验2:氯化铵的制备
五、归纳总结(10分钟)
- 总结盐的定义、分类、制备方法、性质及应用。
六、作业布置:
1. 完成课堂练习题;
2. 阅读相关课外资料,了解更多有关盐的知识。
七、教学反思:
通过本节课的教学,学生对盐的定义、分类、制备方法及性质有了更深入的了解。
为了巩固学生的知识,可以设计更多实验,让学生动手操作,加深记忆。
同时,建议学生多做练习题,巩固所学知识。

初三化学盐的性质一. 本周教学内容:盐的性质1. 盐的化学性质2. 复分解反应发生的条件3. 金属活动顺序表的应用4. 化学肥料二. 重点和难点1. 盐的化学性质2. 复分解反应发生的条件三. 教学过程1. 盐的化学性质⑴盐与金属起置换反应,生成另一种金属和另一种盐反应条件:在金属活动性顺序中,排在前面的金属可以把排在后面的金属从它的盐溶液中置换出来,反应物中的盐一般溶于水。
例Cu + 2AgNO3 ==== Cu(NO3)2 + 2AgFe + CuSO4 ==== FeSO4 + Cu注意:①单质铁与溶液发生置换反应时总是生成二价亚铁盐。
②K、Na、Ca 是很活泼的金属,投入盐溶液中不置换金属,而是与水起置换反应生成氢气。
⑵盐与酸反应生成另一种盐和另一种酸。
例HCl + AgNO3 ==== AgCl↓+ HNO3⑶盐与碱反应生成另一种盐和另一种碱。
例CuSO4 + 2NaOH ==== Cu(OH)2↓+ Na2SO4⑷盐与盐反应,生成另外两种盐。
例NaCl + AgNO3 ==== AgCl↓+ NaNO32. 复分解反应发生的条件酸、碱、盐之间的复分解反应,实质上是两种物质在溶液中相互交换离子。
复分解反应发生的条件是:生成物中如果有沉淀析出,有气体放出,有水生成,三种情况只要有一种情况存在就可以发生。
对于碱和盐、盐和盐的反应还要求反应物都必须是可溶的。
判断复分解反应能否发生经常要联系酸、碱、盐的溶解性。
通常钾盐、钠盐、铵盐、硝酸盐都易溶,AgCl、BaSO4、CaCO3、BaCO3、Mg(OH)2是白色沉淀,其中AgCl、BaSO4既不溶于水也不溶于酸。
Cu(OH)2是蓝色沉淀,Fe(OH)3是红褐色沉淀。
3. 化学肥料钾肥、氮肥、磷肥、复合肥、微量元素肥料。
【典型例题】例1. X、Y、Z三种金属,将Y、Z分别放入稀硫酸中,Y溶解,Z不溶解;将Z放入X的盐溶液中,Z表面有X析出。
则这三种金属的活动性由强到弱的顺序是A. XYZB. YZXC. ZYXD. XZY分析:此题是根据金属与酸、金属与盐溶液起置换反应的规律来判断金属活动性顺序。


盐的性质——初中化学第二册教案盐的性质——初中化学第二册教案盐的性质教案教学目标:1、知识目标:(1)了解盐的溶解性和化学性质。
(2)学会运用金属活动性顺序判断金属与盐溶液的反应。
(3)了解复分解反应发生的条件。
2、能力目标:培养学生的实验动手能力和观察分析能力。
3、思想目标:通过实验对比,初步学会观察、对比、归纳的学习方法。
教学重点:盐的溶解性、盐的化学性质、复分解反应发生的条件教学方法:讨论法、引导探究法教学用品:仪器:试管镊子药品:Fe Cu CuSO4溶液 FeCl3溶液 AgNO3溶液 BaCl2溶液 CaCO3固体NaOH溶液盐酸硫酸其它:投影仪学生背景:1、知识背景:掌握了铁的性质、酸碱的性质、金属活动性顺序。
2、能力背景:基本会用离子的观点分析溶液的.组成;掌握了试管实验的基本操作。
3、学习动机:对生活化学和动手操作较感兴趣。
教学过程:环节教师活动学生活动提问导入讨论实验得出结论提出问题通过实验得出结果讨论应用问题:1、酸和碱为什麽具有通性呢?2、上节课我们学习了哪些盐?3、它们是否会象酸类和碱类那样具有通性呢?引言:盐的组成中没有相同的成分,所以没有通性但由于组成的相似,却具有相似的性质这节课我们学习盐的性质二、盐的性质1、溶解性学生先总结,然后投影展示a钾盐、钠盐、铵盐、硝酸盐都易溶于水b盐酸盐中只有AgCl不溶于水c硫酸盐中只有BaSO4不溶于水d碳酸盐大都不溶于水,除钾、钠、铵盐外2、盐的化学性质学生实验:找出有盐类参加的反应1、①、展示药品(投影展示药品名)2、②、小组讨论(找出有盐参加的反应)③、请学生演示实验(说明现象写方程式)④、得出结论(盐的3条性质)(1)盐与金属的反应反应的条件:金属:金属活动性顺序中排在前面的金属能置换排在后面的金属盐:必须是盐溶液(2)盐与酸的反应(3)盐与碱的反应盐与盐之间能反应吗?实验:硝酸银与氯化钡反应结论:有白色沉淀,能反应4、盐与另一种盐的反应请判断以上反应有哪些类型?酸、碱、盐等物质之间是不是都能发生复分解反应呢?三、复分解反应发生的条件生成物中如果有沉淀析出,有气体放出,或有水生成那麽复分解反应就可以发生。

一、教学目标1、掌握盐的物理性质和化学性质的概念。
2、了解不同盐的化学和物理性质差异。
3、学习盐的结构和组成,以及它们如何在无机化学中使用。
二、教学步骤1、知识导入在开始教育课程之前,要确保学生通过实验、观察和研究的方式得到一些初步的关于盐的概念。
2、盐的基本定义在描述盐的化学和物理性质之前,学生应该了解盐的物质是什么。
可以通过介绍盐的化学结构和组成来实现。
3、盐的物理性质盐的物理性质有哪些?以NaCl为例子, NaCl的物理性质比较外显,它是一种具有晶体结构的化合物,呈白色小圆形晶体,具有脆性,比水重,其晶体的硬度极大,它可以溶于水,也可以溶于一些有机溶剂中,如无水乙醇、甲醇、丙酮和乙腈等。
在高温下,NaCl具有较强的电导性质,熔点为801℃,沸点为1465℃,具有较强的热稳定性。
4、盐的化学性质盐的化学性质如何说明?包括在水中的化学反应、与其他物质反应的性质等。
以NaCl为例,它可以在水中进行电离反应,形成Na+(氢氧化合物)、Cl-(氢氧化合物)的离子,这些离子也可以参与其他的化学反应中。
主要的化学反应包括与碳酸反应、与硫酸反应、与银盐反应、与硫化氢反应、与氯化银反应、以及与其他塩类反应等等。
5、盐在无机化学中的应用了解盐的物理和化学性质之后,学生应该学习有关盐在无机化学中的应用。
此时,可以向学生介绍一些应用最广泛的盐类,如NaCl、KCl、CaCl等,并指示它们在实际情况中如何被使用。
三、教学亮点1、打造生动的教学环境,结合实例的方式深入浅出地引入新知识。
2、以实验为主线,更好地让学生理解盐的物理和化学性质。
4、通过讲解衍生性的实例,让学生更深入地理解盐在无机化学中的应用。
5、考虑到学生的需求,本教学课程非常适合灵活性高的融合式课程。
四、教学后记在掌握盐的物理和化学性质后,学生应该可以自信地运用这些知识来实现有意义和有成效的实验。
在任何课程中,都要记住开展分析性思维和开放性问题的实习,这样学生才能真正学到知识并应用于实践中。

初中物理盐的化学性质教案
一、教学目标:
1.了解盐的化学性质及其在生活中的应用。
2.掌握盐在溶液中的电离过程。
3.能够根据实验现象和化学方程式来解释盐的化学性质。
4.培养学生观察实验现象、提出问题和解决问题的能力。
二、教学重点与难点:
1.掌握盐在水中的溶液电离过程。
2.理解盐的溶液与酸碱性质的联系。
3.能够根据实验现象解释盐的性质。
三、教学过程:
1.导入:通过展示一些常见的盐和盐的应用,帮助学生理解盐在生活中的重要性,引起学生的学习兴趣。
2.正文:
(1)实验观察:进行盐在水中的电离实验,观察溶液的性质变化,引导学生思考盐在水中的电离过程。
(2)实验解释:结合实验现象和离子方程式,帮助学生理解盐在溶液中的电离过程及离子的作用。
(3)探究问题:提出问题,让学生通过实验和讨论来解决,如盐在溶液中的电导实验、盐的酸碱性质等。
3.总结与拓展:
(1)总结盐的化学性质及其在生活中的应用。
(2)拓展盐与其他物质的反应,如盐的加热、加酸等实验。
四、教学评价:
1.观察学生实验操作过程,评价学生的实验能力和观察力。
2.听取学生的实验解释和讨论,评价学生的思维逻辑和表达能力。
3.通过课后作业或测验,评价学生对盐的化学性质的掌握程度。
五、教学反思:
1.针对学生实验操作时的常见错误和困惑,及时进行纠正和解释。
2.鼓励学生提出问题和探索,培养学生的实验设计和解决问题能力。
3.激发学生的学习兴趣,让学生愿意主动参与实验和讨论,提高学生的学习积极性。
第3课时盐的化学性质物以类聚,人以群分。
《易经》原创不容易,【关注】店铺,不迷路!【教学目标】1.知识与技能(1)能根据复分解反应的条件判断酸、碱、盐之间的反应能否发生。
(2)归纳盐的相似化学性质。
(3)根据不同标准将物质分类。
2.过程与方法(1)会对实验中出现的问题进行分析、归纳。
(2)会观察实验现象,并能通过讨论、归纳整理实验现象。
3.情感态度与价值观(1)意识到化学与生产、生活的关系。
(2)进一步增强学好化学的信心,树立为民族振兴、为社会进步而学习的志向。
【教学重点】1. 盐的相似化学性质。
2. 物质的分类。
【教学难点】盐的化学性质。
【教具准备】大理石(或石灰石)、稀盐酸、碳酸钠、碳酸氢钠、试管(若干)、澄清石灰水、带橡皮塞的导管、多媒体课件等。
【导入新课】上一节课我们学习了生活中几种常见的盐及C032-(或gC12+Zn——⑤BaC12+g(0gS04=Na2S04+Mg(0H)2↓(白色沉淀)4. 盐+盐=新盐+新盐(两者都要可溶)AgN03+NaC1=AgC1↓+NaN03(检验C1-)BaC12+Na2S04=BaS04↓+2NaC1(检验S042-)二、物质的分类此节课理论性比较强,涉及的知识在整个初中化学中比较重要,教师应充分利用讨论,培养学生观察、分析、归纳实验现象的能力和习惯。
同时通过师生交流,生生交流,充分开发学生的智力,挖掘学生的潜能,使学生形成爱化学,爱探究的良好情感态度。
【素材积累】岳飞应募参军,因战功累累不断升职,宋高宗亲手写了“精忠岳飞”四个字,制成旗后赐给他。
又召他到寝阁,对他说:“中兴的大事,全部委托给你了。
”金人攻打拱州、亳州,刘锜向朝廷告急,宋高宗命令岳飞火速增援,并在赐给岳飞的亲笔信中说:“设施之事,一以委卿,朕不遥度。
”岳飞于是调兵遣将,分路出战,自己率领轻装骑兵驻扎在郾城,兵锋锐气十足。
但是,后来高宗和秦桧决定与金议和,向金称臣纳贡。
就在岳飞积极准备渡过黄河收复失地的时候,高宗和秦桧却连发12道金字牌班师诏,命令岳飞退兵。
盐的化学性质
教学目标:1、能对盐的一些化学性质进行归纳整理,使其系统化,方便记忆和运用,并能写出相关反应的化学方程式。
2、知道复分解反应发生的条件,能据此判断复分解反应能否发生。
3、知道碳酸根离子的鉴别方法。
教学重点:1、盐的化学性质实验的设计;
2、盐的化学性质的归纳;
3、生活与化学的联系。
教学难点:1、盐的化学性质的归纳;
2、对实验的分析归纳。
教学方法:实验探究法、归纳总结。
同步练习:
1.蒸馒头时,在发酵面团中加入某种物质,既能除去面团发酵产生的酸,又能使馒头松软,加入的这种物质是()
A.氢氧化钠
B.碳酸氢钠
C.氯化钠
D.氧化钙
2.欲除去氢氧化钠中的少量氢氧化钙,可以选用的试剂是()
A.氢氧化钾溶液
B.碳酸钠溶液
C.氯化钡溶液
D.稀盐酸
3.证明生石灰样品中含石灰石的最简便的方法是()
A.溶于水,看是否有不溶物
B.高温煅烧,看是否有CO2放出
C.滴加稀盐酸,看是否有气泡冒出
D.放在研钵中研磨,看是否有块状固体。
盐的性质知识与技能:1.了解盐的化学性质.2.会用金属活动性顺序来判断金属能不能跟盐溶液发生置换应。
过程与方法:1.通过实验培养学生的观察能力,思维能力,语言表达能力。
2.通过布置学生课前查找“警察破案可以根据指纹”的相关资料情感态度与价值观:培养学生学习化学的兴趣,使学生乐学,好学,充分调动学生学习的积极性。
教学重点:盐的化学性质;复分解反应的条件教学难点:复分解反应教学方法: 自学指导法、演示法、讲述法、归纳法教后反思:中国书法艺术说课教案今天我要说课的题目是中国书法艺术,下面我将从教材分析、教学方法、教学过程、课堂评价四个方面对这堂课进行设计。
一、教材分析:本节课讲的是中国书法艺术主要是为了提高学生对书法基础知识的掌握,让学生开始对书法的入门学习有一定了解。
书法作为中国特有的一门线条艺术,在书写中与笔、墨、纸、砚相得益彰,是中国人民勤劳智慧的结晶,是举世公认的艺术奇葩。
早在5000年以前的甲骨文就初露端倪,书法从文字产生到形成文字的书写体系,几经变革创造了多种体式的书写艺术。
1、教学目标:使学生了解书法的发展史概况和特点及书法的总体情况,通过分析代表作品,获得如何欣赏书法作品的知识,并能作简单的书法练习。
2、教学重点与难点:(一)教学重点了解中国书法的基础知识,掌握其基本特点,进行大量的书法练习。
(二)教学难点:如何感受、认识书法作品中的线条美、结构美、气韵美。
3、教具准备:粉笔,钢笔,书写纸等。
4、课时:一课时二、教学方法:要让学生在教学过程中有所收获,并达到一定的教学目标,在本节课的教学中,我将采用欣赏法、讲授法、练习法来设计本节课。
(1)欣赏法:通过幻灯片让学生欣赏大量优秀的书法作品,使学生对书法产生浓厚的兴趣。
(2)讲授法:讲解书法文字的发展简史,和形式特征,让学生对书法作进一步的了解和认识,通过对书法理论的了解,更深刻的认识书法,从而为以后的书法练习作重要铺垫!(3)练习法:为了使学生充分了解、认识书法名家名作的书法功底和技巧,请学生进行局部临摹练习。
盐的化学性质——初中化学第二册教案盐的化学性质——初中化学第二册教案精选2篇(一)教案题目:盐的化学性质教学目的:1. 理解盐的化学性质;2. 掌握盐的稳定性、水溶性和复原性的特点;3. 可以进展相关实验观察和记录。
教学内容:1. 盐的稳定性:介绍盐在常温下的稳定性特点,如氯化钠、硫酸铜等;2. 盐的水溶性:介绍盐在水中的溶解性,包括溶解度的影响因素和溶液的饱和度;3. 盐的复原性:介绍盐在适当条件下可以发生复原反响,并给出详细实例。
教学步骤:Step 1:引入新知识通过提问方式引导学生回忆上一课的内容,引导他们考虑盐的根本特点。
Step 2:学习盐的稳定性介绍盐的稳定性特点,结合实例讲解,如氯化钠、硫酸铜等。
Step 3:探究盐的水溶性让学生参与实验,观察不同盐在水中的溶解情况。
引导学生考虑溶解度的影响因素和溶液的饱和度。
Step 4:分组实验学生分组进展盐的复原性实验,观察不同盐在适当条件下是否可以发生复原反响。
让学生记录实验结果。
Step 5:总结与讨论指导学生总结盐的化学性质特点,并进展讨论,解答学生提出的问题。
Step 6:课堂作业布置相关作业,让学生稳固所学内容。
Step 7:课堂小结对本节课的重点知识进展小结,激发学生兴趣,进步他们对化学的学习积极性。
教学方法:1. 合作学习法:学生分组进展实验,进步合作意识和动手才能。
2. 提问法:课堂提问引导学生考虑,增加互动性。
教学资:1. 实验器材:测试管、盐样品、溶液。
2. PPT或黑板等教具。
评估方式:1. 实验记录:评价学生实验记录的准确性和完好性。
2. 课堂参与:评价学生在课堂上的积极性和学习态度。
3. 作业完成情况:评价学生对所学知识的掌握程度。
拓展延伸:学生可以进一步学习盐的电离、酸碱中和反响等内容,加深对盐的化学性质的认识。
盐的化学性质——初中化学第二册教案精选2篇(二)教学目的:1. 理解盐的定义和特点;2. 掌握盐的制法和用处;3. 理解酸和碱的中和反响。
第3课时盐的化学性质
李度一中陈海思
【灵师不挂怀,冒涉道转延。
——韩愈《送灵师》
◆教学目标】
1.知识与技能
(1)能根据复分解反应的条件判断酸、碱、盐之间的反应能否发生。
(2)归纳盐的相似化学性质。
(3)根据不同标准将物质分类。
2.过程与方法
(1)会对实验中出现的问题进行分析、归纳。
(2)会观察实验现象,并能通过讨论、归纳整理实验现象。
3.情感态度与价值观
(1)意识到化学与生产、生活的关系。
(2)进一步增强学好化学的信心,树立为民族振兴、为社会进步而学习的志向。
【教学重点】
1. 盐的相似化学性质。
2. 物质的分类。
【教学难点】
盐的化学性质。
【教具准备】
大理石(或石灰石)、稀盐酸、碳酸钠、碳酸氢钠、试管(若干)、澄清石灰水、带橡皮塞的导管、多媒体课件等。
【导入新课】
上一节课我们学习了生活中几种常见的盐及C03 2-(或HC03-)离子的检验,
这节课我们来继续学习盐的相关知识。
【活动与探究1】
请同学们按教材P75“探究”要求进行活动。
1. 归纳出常见酸、碱、盐的溶解性。
2. 按要求判断表中物质能否发生复分解反应。
【归纳总结】
常见酸、碱、盐的溶解性。
1. 溶于水的碱有五种:K0H、Na0H、NH3• H20、Ba( 0H) 2、Ca( 0H) 2。
2. 钾盐、钠盐、铵盐、硝酸盐都溶于水。
3.盐酸盐不溶于水的有AgCl。
4. 硫酸盐中不溶于水的有:BaS04;微溶于水的有:CaS04、Ag2S〇4。
5. 碳酸盐大多数不溶于水。
【提出问题】
上一单元我们学习酸碱的化学性质时,发现并归纳出了酸、碱的通性,那么盐是否也有相似的化学性质呢?
【交流讨论】
学生分组,讨论并交流盐有哪些化学性质。
【归纳总结】
师生互动,归纳盐的化学性质
1. 盐+金属→新盐+新金属
如:Fe + CuS04=Cu + FeS04 Cu + 2AgN03=2Ag+Cu(NO3)2
反应条件:①盐必须为可溶性盐;②“前换后”即金属活动性顺序中排在前面的金属把排在后面的金属从其盐溶液中置换出来(除K、Ca、Na外)。
2. 盐+酸→新盐+新酸条件:满足复分解反应条件即可。
3.盐+碱→新盐+新碱条件:①满足复分解条件,②反应物均必须可溶。
4.盐+盐→新盐+新盐条件:①满足复分解条件,②反应物均必须可溶。
【随堂巩固练习】
依据盐的化学性质及反应条件,判断下列反应能否发生,能的请完成化学方程式,并说明理由。
①Zn+CuC12 ——② Fe+AgC1——
③K+CuS04 ——④MgC12+Zn——
⑤BaC12+HN03——⑥BaC12+H2S04——
⑦AgN03+HC1——⑧K2C03+HC1——
⑨BaC12+K0H——⑩Mg(0H)2+CuC12——
【活动与探究】
请同学们分组按教材P76‘讨论”中的要求进行活动,然后做好归纳。
【交流讨论】
1. 根据物质的组成是否单一,可以把物质分为混合物和纯净物。
2. 在纯净物中,根据组成元素的异同,可以把它们分成单质和化合物。
3.在单质中,可以按性质的差异把它们分为金属单质和非金属单质。
4. 在化合物中,可以按组成的差异把它们分成酸、碱、盐和氧化物。
【归纳总结】
【课堂小结】
本节课我们纳出盐的化学性质及物质的分类,通过本节课的学习,同学们应学会利用复分解反应条件及酸、碱、盐间的反应规律,判断酸、、盐间的复分解反应能否发生,并能写出正确的化学反应方程式。
【布置作业】
完成本课时对应练习,并提醒学生预习下一节的内容。
第3课时物质的分类、盐的化学性质
一、盐的化学性质
1. 盐+金属=新盐+新金属(前置后,盐溶液)
Fe + CuS04 =Cu FeS04 (湿法金)
2. 盐+酸=新盐+新酸
CaC03 + 2HC1 =CaC12 +H20 + C02 ↑ (实验室制 C02) NaHC03 + HC1 =NaC1 + H20 + C02 ↑(检验 HC03-或 C032-) BaC12 +H2S04 =BaS04 ↓ +2HC1 (检验 S042-)
HC1 + AgN03 =AgC1↓ + HN03 (检验C1-)
3.盐+碱=新盐+新碱(两者都要可溶)
Na2C03 +Ca(0H)2 =CaC03↓ + 2Na0H(工业制烧碱)
CuS04 +2Na0H =Na2S04 + Cu( 0H)2↓(蓝色沉淀)
2Na0H + MgS04 =Na2S04 + Mg( 0H)2↓(白色沉淀)
4. 盐+盐=新盐+新盐(两者都要可溶)
AgN03 + NaC1 =AgC1 ↓ + NaN03 (检验 C1-)
BaC12 +Na2S04 =BaS04↓+2NaC1(检验 S042-)
二、物质的分类
此节课理论性比较强,涉及的知识在整个初中化学中比较重要,教师应充分利用讨论,培养学生观察、分析、归纳实验现象的能力和习惯。
同时通过师生交流,生生交流,充分开发学生的智力,挖掘学生的潜能,使学生形成爱化学,爱探究的良好情感态度。
【素材积累】
1、冬天是纯洁的。
冬天一来,世界变得雪白一片,白得毫无瑕疵,白雪松软软地铺摘大地上,好似为大地铺上了一层银色的地毯。
松树上压着厚厚的白雪,宛如慈爱的妈妈温柔地抱着自己的孩子。
白雪下的松枝还露出一点绿色,为这白茫茫的世界增添了一点不一样的色彩。
2、张家界的山真美啊!影影绰绰的群山像是一个睡意未醒的仙女,披着蝉翼般的薄纱,脉脉含情,凝眸不语,摘一座碧如翡翠的山上,还点缀着几朵淡紫、金黄、艳红、清兰的小花儿,把这山装扮得婀娜多姿。
这时,这山好似一位恬静羞涩的少女,随手扯过一片白云当纱巾,遮住了她那美丽的脸庞。