常用缓冲溶液的配制Word 文档 (2)
- 格式:doc
- 大小:51.00 KB
- 文档页数:3
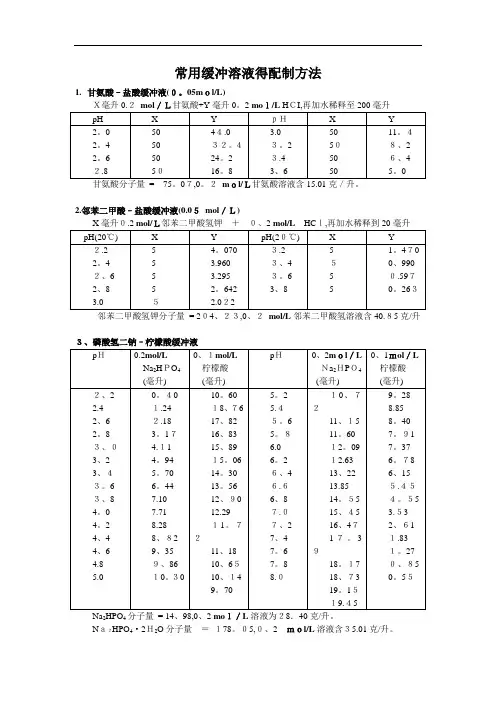
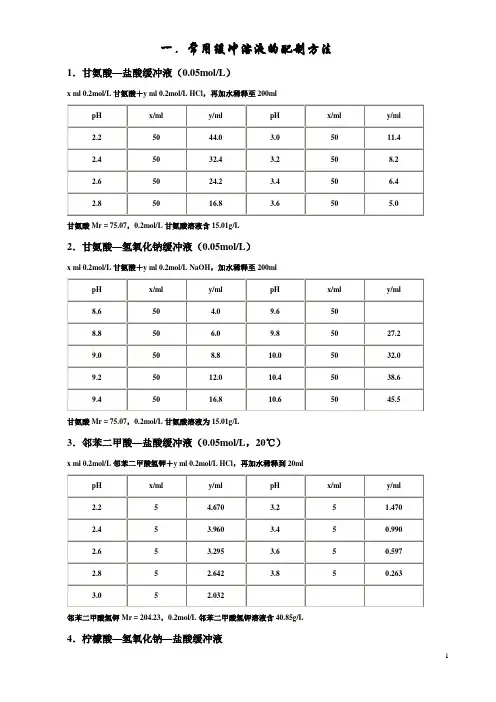
常用缓冲溶液得配制方法1.甘氨酸–盐酸缓冲液(0。
05mol/L)X毫升0.2mol/L甘氨酸+Y毫升0。
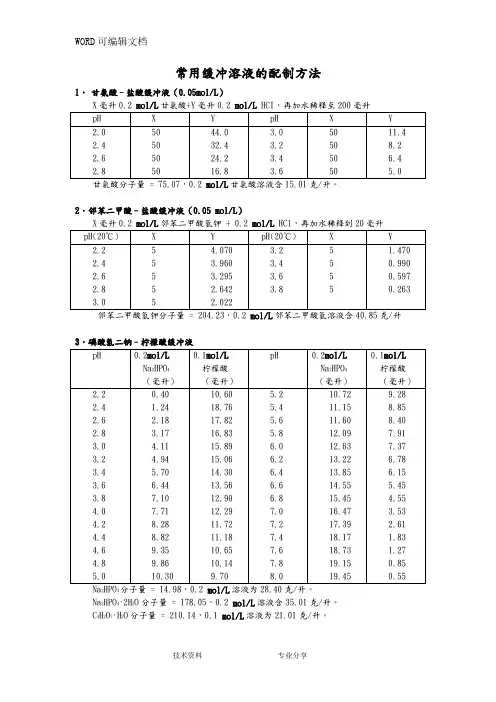
2 mol/L HCI,再加水稀释至200毫升2.邻苯二甲酸–盐酸缓冲液(0.05mol/L)邻苯二甲酸氢钾分子量= 204、23,0、2mol/L邻苯二甲酸氢溶液含40.85克/升3、磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量= 14、98,0、2 mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量=178。
05,0、2mol/L溶液含35.01克/升。
C4H 2O 7·H 2O 分子量 = 210。
14,0。
1 m ol/L 溶液为21.01克/升。
① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存、5.柠檬酸–柠檬酸钠缓冲液(0.1 mo l/L)柠檬酸C 6H 8O7·H 2O:分子量210。
14,0.1 mol /L溶液为21.01克/升。
柠檬酸钠Na 3 C 6H5O 7·2H2O:分子量294、12,0.1 mol/L 溶液为29。
41克/毫升、Na2Ac·3H2O分子量= 136、09,0、2 mol/L溶液为27.22克/升。
7、磷酸盐缓冲液242Na2HPO4·12H2O分子量= 358。
22,0.2 mol/L溶液为71.64克/升。
Na2HPO4·2H2O分子量=156。
03,0.2mol/L溶液为31.21克/升。
Na2HPO4·2H2O分子量= 178.05,1/15M溶液为11.876克/升。
KH2PO4分子量= 136.09,1/15M溶液为9.078克/升、8.磷酸二氢钾–氢氧化钠缓冲液(0。
05M)X毫升0.2MK2PO10.Tris–盐酸缓冲液(0.05M,25℃)50毫升0。
1M三羟甲基氨基甲烷(Tris)溶液与X毫升0.1N盐酸混匀后,加水稀释至100毫三羟甲基氨基甲烷(Tris)HOCH2CH2OHCHOCH2NH2分子量=121、14;0.1M溶液为12.114克/升、Tris溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
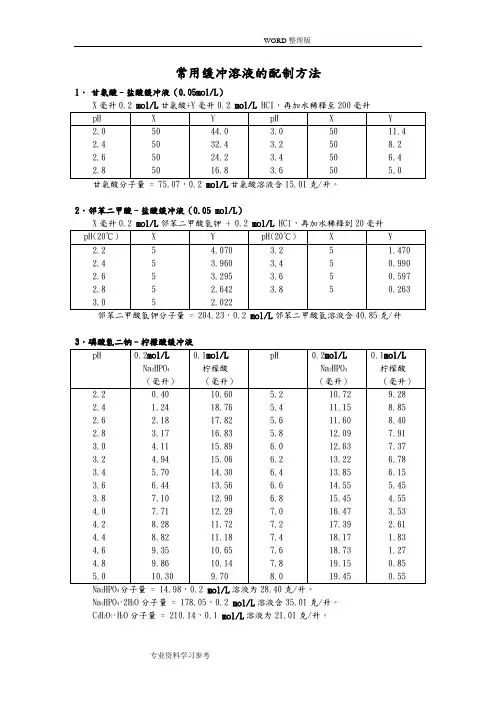
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾 + 0.2 mol/L HCl,再加水稀释到20毫升3.磷酸氢二钠–柠檬酸缓冲液24Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量 = 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L )柠檬酸C 6H 8O 7·H 2O :分子量210.14,0.1 mol/L 溶液为21.01克/升。
柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L ) 227.磷酸盐缓冲液Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液为85.61克/升。
Na2HPO 4·12H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L )242KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )X 毫升0.2M K 2PO 4 + Y 毫升0.2N NaOH 加水稀释至29毫升9.巴比妥钠-盐酸缓冲液(18℃)巴比妥钠盐分子量=206.18;0.04M溶液为8.25克/升10.Tris–盐酸缓冲液(0.05M,25℃)50毫升0.1M三羟甲基氨基甲烷(Tris)溶液与X毫升0.1N盐酸混匀后,加水稀释至100毫升。

常用缓冲溶液配制方法 Prepared on 24 November 2020常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(L)X毫升 mol/L甘氨酸+Y毫升 mol/L HCI,再加水稀释至200毫升甘氨酸分子量 = , mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液( mol/L)X毫升 mol/L邻苯二甲酸氢钾 + mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量 = , mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量 = , mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量 = , mol/L溶液含35.01克/升。
C4H2O7·H2O分子量 = , mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液( mol/L)柠檬酸C6H8O7·H2O:分子量, mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量, mol/L溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液( mol/L)Na2Ac·3H2O分子量 = , mol/L溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液()Na2HPO4·2H2O分子量 = , mol/L溶液为85.61克/升。
Na2HPO4·12H2O分子量 = , mol/L溶液为克/升。
NaH2PO4·2H2O分子量 = , mol/L溶液为克/升。
磷酸盐是化学研究中使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,所以用它们配制的缓冲液,pH 范围最宽:NaH2PO4: pKa1=,pKa2=;Na2HPO4:pKa1=,pKa2=配酸性缓冲液:用NaH2PO4,pH=1~4,配中性缓冲液:用混合的两种磷酸盐,pH=6~8,配碱性缓冲液:用Na2HPO4,pH=10~12。

常用缓冲溶液的配制方法1.乙醇-醋酸铵缓冲液(pH3.7)取5mol/L醋酸溶液15.0ml,加乙醇60ml和水20ml,用10mol/L氢氧化铵溶液调节pH值至3.7,用水稀释至1000ml,即得。
2.三羟甲基氨基甲烷缓冲液(pH8.0)取三羟甲基氨基甲烷12.14g,加水800ml,搅拌溶解,并稀释至1000ml,用6mol/L盐酸溶液调节pH值至8.0,即得。
3.三羟甲基氨基甲烷缓冲液(pH8.1)取氯化钙0.294g,加0.2mol/L三羟甲基氨基甲烷溶液40ml使溶解,用1mol/L盐酸溶液调节pH值至8.1,加水稀释至100ml,即得。
4.三羟甲基氨基甲烷缓冲液(pH9.0)取三羟甲基氨基甲烷6.06g,加盐酸赖氨酸3.65g、氯化钠5.8g、乙二胺四醋酸二钠0.37g,再加水溶解使成1000ml,调节pH值至9.0,即得。
5.乌洛托品缓冲液取乌洛托品75g,加水溶解后,加浓氨溶液4.2ml,再用水稀释至250ml,即得。
6.巴比妥缓冲液(pH7.4)取巴比妥钠4.42g,加水使溶解并稀释至400ml,用2mol/L盐酸溶液调节pH值至7.4,滤过,即得。
7.巴比妥缓冲液(pH8.6)取巴比妥5.52g与巴比妥钠30.9g,加水使溶解成2000ml,即得。
8.巴比妥-氯化钠缓冲液(pH7.8)取巴比妥钠5.05g,加氯化钠3.7g及水适量使溶解,另取明胶0.5g加水适量,加热溶解后并入上述溶液中。
然后用0.2mol/L盐酸溶液调节pH值至7.8,再用水稀释至500ml,即得。
9.甲酸钠缓冲液(pH3.3)取2mol/L甲酸溶液25ml,加酚酞指示液1滴,用2mol/L氢氧化钠溶液中和,再加入2mol/L甲酸溶液75ml,用水稀释至200ml,调节pH 值至3.25~3.30,即得。
10.邻苯二甲酸盐缓冲液(pH5.6)取邻苯二甲酸氢钾10g,加水900ml,搅拌使溶解,用氢氧化钠试液(必要时用稀盐酸)调节pH值至5.6,加水稀释至1000ml,混匀,即得。


常用缓冲溶液的配制方法简介缓冲溶液是一种能够稳定溶液中pH值的溶液,它通常由弱酸和其共轭碱(或弱碱和其共轭酸)组成。
在科学实验和生物学研究中,常常需要精确控制溶液的pH值,这就需要使用缓冲溶液。
本文将介绍几种常用的缓冲溶液及其配制方法,希望对实验科研工作者提供参考。
磷酸盐缓冲溶液磷酸盐缓冲溶液是一种常用的缓冲溶液,常被用于分子生物学和细胞生物学实验中。
它由磷酸盐酸(或碱)和其共轭碱(或酸)组成,可以在特定的pH范围内有效地稳定溶液的pH值。
配制方法磷酸盐缓冲溶液的配制方法如下:1.准备1M的磷酸盐酸(或碱)溶液,可以通过向蒸馏水中加入适量的磷酸(或磷酸盐)并搅拌溶解得到。
2.准备1M的磷酸盐共轭碱(或共轭酸)溶液,可以通过向蒸馏水中加入适量的磷酸(或磷酸盐)对应的碱(或酸)并搅拌溶解得到。
3.根据需要的缓冲溶液pH值,通过适当比例混合磷酸盐酸和磷酸盐共轭碱溶液,可以使用酸碱滴定法或pH计来完成溶液的调节。
需要注意的是,磷酸盐缓冲溶液在不同pH值下的配比不同,建议根据需要的pH值在事先制定好缓冲溶液的配比表。
Tris缓冲溶液Tris缓冲溶液是一种广泛应用于生化和分子生物学实验中的缓冲溶液。
它由Tris(Tris(hydroxymethyl)aminomethane)酸和其共轭碱(或酸)组成。
配制方法Tris缓冲溶液的配制方法如下:1.准备1M的Tris酸溶液,将适量的Tris酸加入蒸馏水中,并搅拌溶解得到。
2.准备1M的Tris共轭碱(或共轭酸)溶液,将适量的Tris共轭碱(或共轭酸)加入蒸馏水中,并搅拌溶解得到。
3.根据需要的缓冲溶液pH值,通过适当比例混合Tris酸和Tris共轭碱溶液,可以使用酸碱滴定法或pH计来完成溶液的调节。
需要注意的是,Tris缓冲溶液的pH值在不同温度下可能会有所偏差,因此在制备过程中可以参考相应的pH温度校正表。
PBS缓冲溶液PBS缓冲溶液是一种常用的生物学实验缓冲溶液,它是一种含磷酸盐的缓冲溶液。

常见缓冲液的配制附溶液配制方法:pH7.2 0.01mol/L PBSKH2PO40.38gNa2HPO4 1.02g(或Na2HPO4·12H2O2.58g) NaCl8.0g蒸馏水加至1000mLpH7.4 PBS/TNaCl8.0gKH2PO40.2gNa2HPO4·12H2O(或Na2HPO4·7H2O) 2.89g(或2.16g)KCl0.2g吐温200.5mL蒸馏水加至1000mLpH9.6碳酸盐缓冲液Na2CO3 1.59gNaHCO3 2.93g蒸馏水加至1000mL0.075mol/L氯化钾低渗液氯化钾0.559g,蒸馏水100ml甲醇冰醋酸(3:1)固定液甲醇3份冰醋(乙)酸1份姬姆萨染液Giemsa原液1ml1/15mol/L磷酸缓冲液(pH6.8或7.4)10ml2.3% 柠檬酸钠溶液柠檬酸钠(Na C H O ·2H O)2.3g蒸馏水100ml明胶显影液明胶粉0.2g三蒸水10ml甲酸0.1ml1% 醋酸冰醋(乙)酸1ml蒸馏水99mlH"o"33342-若丹明123染液H"o"33342(Hoechst 33342)0.25μg 若丹明123(Rhodamine 123)1.0μg PBS 1mlDPH贮备液DPH(1.6-Dipnenyl-1,3, 5hexatriene, 4.65mg)四氢呋喃10mlDPH工作液(2×10-6mol/L)DPH贮备液0.1mlPBS 100mlFDA贮备液二醋酸脂荧光素(Fluorescein diacetate,FDA) 5.0mg丙酮1mlFDA工作液FDA贮备液0.1mlPBS 100mlM-缓冲液(pH7.2)咪唑50mmol/L 3.404g氯化钾50mmol/L 3.7g氯化镁(MgCl ·6H O)0.5mol/L 101.65mgEGTA(乙二醇双(a-氨基乙基)醚四乙酸) 1mmol/L 380.35mg EDTA(乙二胺四乙酸) 0.1mmol/L 29.22mg疏基乙醇1mmol 0.07ml4mol/L甘油292ml蒸馏水加至1000ml1% TritonX-100液Triton X-100(聚乙二醇辛基苯基醚)1mlM-缓冲液99ml3% 戊二醛液戊二醛25% 3mlPBS 液(pH7.2)97ml0.2% 考马斯亮蓝R250染液考马斯亮蓝R250(Coomassie brilliant blue R250)0.2g 甲醇46.5ml冰醋(乙)酸7ml蒸馏水46.5ml生理盐水(0.85%氯化钠)氯化钠8.5g三蒸水1000ml0.25mol/L蔗糖水溶液(含0.003mol/L氯华钙)蔗糖85.5g无水氯华钙0.33g蒸馏水1000ml0.17mol/L氯化铵液氯化铵4.574g蒸馏水500ml0.17mol/L硝酸钠液硝酸钠7.224g 蒸馏水500ml0.12mol/L硫酸钠液硫酸钠(Na SO ·H O)19.333g蒸馏水500ml0.12mol/L草酸铵液草酸铵((NH )C o ·H O)8.527g蒸馏水500ml0.17mol/L醋酸铵液醋酸铵6.552g蒸馏水500ml0.32mol/L葡萄糖液葡萄糖28.83g蒸馏水500ml0.32mol/L甘油液甘油(C H (OH) ·1.26g/ml) 11.7ml蒸馏水500ml0.32mol/L乙醇液无水乙醇9.33ml蒸馏水500ml0.32mol/L丙醇液正丙醇(比重0.803)11.976ml蒸馏水500ml化学名:2-[4-(2-Hydroxyethyl)-1-piperazinyl]ethanesulfonic acid 中文名:羟乙基哌嗪乙硫磺酸分子式:C8H18N2O4SHEPES是一种非离子两性缓冲液,其在pH 7.2 - 7.4 范围内具有较好的缓冲能力。
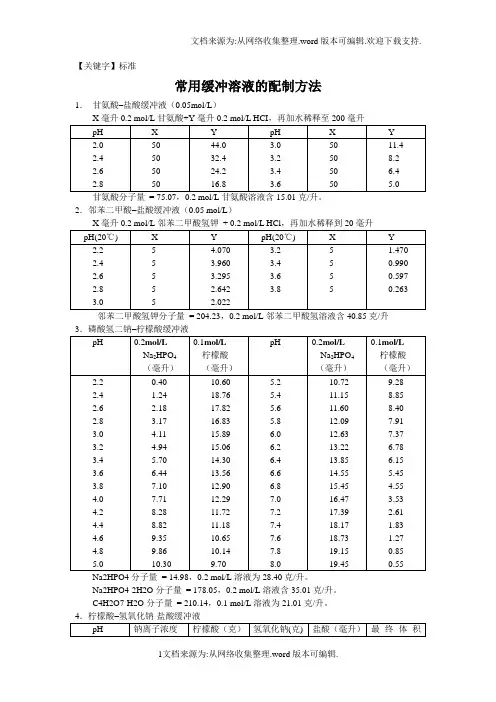
【关键字】标准常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)甘氨酸分子量= 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升Na2HPO4分子量= 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
Na2Ac·3H2O分子量= 136.09,0.2 mol/L溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液为85.61克/升。
Na2HPO4·12H2O分子量= 358.22,0.2 mol/L溶液为71.64克/升。
Na2HPO4·2H2O分子量= 156.03,0.2 mol/L溶液为31.21克/升。
Na2HPO4·2H2O分子量= 178.05,1/15M溶液为11.876克/升。
KH2PO4分子量= 136.09,1/15M溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M)巴比妥钠盐分子量=206.18;0.04M溶液为8.25克/升10.Tris–盐酸缓冲液(0.05M,25℃)50毫升0.1M三羟甲基氨基甲烷(Tris)溶液与X毫升0.1N盐酸混匀后,加水稀释至100CHOCH2 NH2分子量=121.14;0. 1M溶液为12.114克/升。
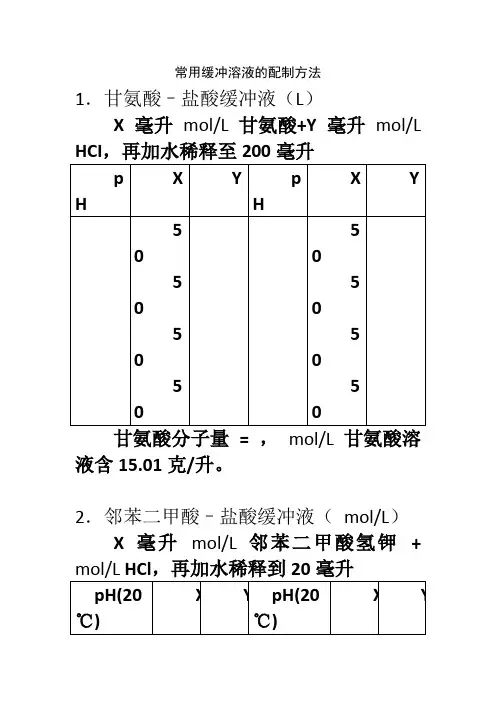
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(L)X毫升mol/L甘氨酸+Y毫升mol/L甘氨酸分子量= ,mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(mol/L)X毫升mol/L邻苯二甲酸氢钾+邻苯二甲酸氢钾分子量= ,mol/L 邻苯二甲酸氢溶液含40.85克/升Na2HPO4分子量= ,mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量= ,mol/L 溶液含35.01克/升。
C4H2O7·H2O分子量= ,mol/L溶液为21.01克/升。
①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
柠檬酸C 6H 8O 7·H 2O :分子量, mol/L 溶液为21.01克/升。
柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量, mol/L 溶液为29.41克/毫升。
Na2Ac·3H2O分子量= ,mol/L溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液()Na2HPO4·2H2O分子量= ,mol/L溶液为85.61克/升。
Na2HPO4·12H2O分子量= ,mol/L 溶液为克/升。
NaH2PO4·2H2O分子量= ,mol/L溶液为克/升。
磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,所以用它们配制的缓冲液,pH 范围最宽:NaH2PO4:pKa1=,pKa2=;Na2HPO4:pKa1=,pKa2=配酸性缓冲液:用NaH2PO4,pH=1~4,配中性缓冲液:用混合的两种磷酸盐,pH=6~8,配碱性缓冲液:用Na2HPO4,pH=10~12。
用钾盐比钠盐好,因为低温时钠盐难溶,钾盐易溶,但若配制SDS-聚丙烯酰胺凝胶电泳的缓冲液时,只能用磷酸钠而不能用磷酸钾,因为SDS(十二烷基硫酸钠)会与钾盐生成难溶的十二烷基硫酸钾。
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾 + 0.2 mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液24Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量 = 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L)柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
7.磷酸盐缓冲液Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液为85.61克/升。
Na 2HPO 4·12H 2O 分子量 = 358.14,0.2 mol/L 溶液为71.628克/升。
NaH 2PO 4·2H 2O 分子量 = 156.01,0.2 mol/L 溶液为31.202克/升。
磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,所以用它们配制的缓冲液,pH 范围最宽:NaH 2PO 4: pKa1=2.12,pKa2=7.21; Na 2HPO 4:pKa1=7.21,pKa2=12.32配酸性缓冲液:用NaH 2PO 4,pH =1~4,配中性缓冲液:用混合的两种磷酸盐,pH =6~8, 配碱性缓冲液:用Na 2HPO 4,pH =10~12。
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升甘氨酸分子量 = 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾 + 0.2 mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量 = 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4-2H2O分子量 = 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量 = 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L)柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L)Na2Ac·3H2O分子量 = 136.09,0.2 mol/L溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液为85.61克/升。
Na 2HPO 4·2H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
常见缓冲溶液配制方法1.醋酸/醋酸钠缓冲溶液:醋酸/醋酸钠缓冲溶液具有较宽的酸碱度范围,在生物化学以及分析化学实验中得到广泛应用。
其配制方法如下:(1)准备一定浓度的醋酸溶液,可以采用浓缩醋酸与适量的水混合而成。
(2)根据所需的缓冲溶液pH值,计算所需浓度的醋酸钠。
(3)将计算所需的醋酸钠溶解在适量的去离子水中,得到所需的缓冲溶液。
2.磷酸盐缓冲溶液:磷酸盐缓冲溶液在生物化学以及分子生物学实验中常用于维持pH值。
以下介绍两种常见的磷酸盐缓冲溶液的配制方法:(1)磷酸盐酸性缓冲液:-准备所需的酸性磷酸盐缓冲液,将一定量的二氢磷酸钠溶解在适量的去离子水中。
-根据所需的pH值,使用盐酸调节溶液的酸度,直至达到所需的pH 值。
(2)磷酸盐碱性缓冲液:-准备所需的碱性磷酸盐缓冲液,将一定量的氢磷酸二钠溶解在适量的去离子水中。
-根据所需的pH值,使用氢氧化钠调节溶液的碱性,直至达到所需的pH值。
3.碳酸盐缓冲溶液:碳酸盐缓冲溶液在一些生物化学实验中用于控制pH值。
以下介绍两种常见的碳酸盐缓冲溶液的配制方法:(1)酸性碳酸盐缓冲液:-准备所需的酸性碳酸盐缓冲液,将一定量的二氧化碳通过气体输注器向含有一定浓度的NaHCO3溶液中通入,直至溶液中的二氧化碳饱和。
(2)碱性碳酸盐缓冲液:-准备所需的碱性碳酸盐缓冲液,将一定量的Na2CO3溶解在适量的去离子水中。
4.三氯乙酸/氯化钾缓冲溶液:三氯乙酸/氯化钾缓冲溶液在DNA和RNA等生物大分子的提取和纯化过程中常用作酶及细胞的裂解缓冲液。
以下是常见的三氯乙酸/氯化钾缓冲溶液的配制方法:(1)将一定量的三氯乙酸和氯化钾溶解在适量的去离子水中,混合均匀。
(2)根据所需的缓冲溶液pH值,使用醋酸或氢氧化钾调节溶液的pH 值,直至达到所需的pH值。
5.甘氨酸缓冲溶液:甘氨酸缓冲溶液在生物化学实验中常用于维持pH值,并在一些药物的制剂和生物制品的稳定性中得到应用。
以下是甘氨酸缓冲溶液的配制方法:(1)准备一定浓度的甘氨酸溶液,将甘氨酸与适量的去离子水溶解。
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)24Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
液或浓盐酸调节,冰箱保存。
6872柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
7.磷酸盐缓冲液242Na 2HPO 4·12H 2O 分子量 = 358.14,0.2 mol/L 溶液为71.628克/升。
NaH 2PO 4·2H 2O 分子量 = 156.01,0.2 mol/L 溶液为31.202克/升。
磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,所以用它们配制的缓冲液,pH X 围最宽:NaH 2PO 4: pKa1=2.12,pKa2=7.21; Na 2HPO 4:pKa1=7.21,pKa2=12.32配酸性缓冲液:用NaH 2PO 4,pH =1~4,配中性缓冲液:用混合的两种磷酸盐,pH =6~8, 配碱性缓冲液:用Na 2HPO 4,pH =10~12。
用钾盐比钠盐好,因为低温时钠盐难溶,钾盐易溶,但若配制SDS-聚丙烯酰胺凝胶电泳的缓冲液时,只能用磷酸钠而不能用磷酸钾,因为SDS(十二烷基硫酸钠)会与钾盐生成难溶的十二烷基硫酸钾。
磷酸盐缓冲液的优点为:①容易配制成各种浓度的缓冲液;②适用的pH X 围宽;③pH 受温度的影响小;④缓冲液稀释后pH 变化小,如稀释10倍后pH 的变化小于0.1。
其缺点为:①易与常见的钙Ca2+离子、镁Mg2+离子以及重金属离子缔合生成沉淀;②会抑制某些生物化学过程,如对某些酶的催化作用会产生某种程度的抑制作用。
常见缓冲溶液配制方法乙醇一醋酸铵缓冲液(pH3.7):取5mol/L醋酸溶液15.0ml,加乙醇60ml和水20ml,用10mol/L氢氧化铵溶液调节pH值至3.7,用水稀释至1000ml。
三羟甲基氨基甲烷缓冲液(pH8.0):取三羟甲基氨基甲烷12.14g,加水800ml,搅拌溶解,并稀释至1000ml,用6mol/L盐酸溶液调节pH值至8.0。
三羟甲基氨基甲烷缓冲液(pH8.1):?取氯化钙0.294g,加0.2mol/L三羟甲基氨基甲烷溶液40ml使溶解,用1mol/L盐酸溶液调节pH值至&1,加水稀释至100ml。
三羟甲基氨基甲烷缓冲液(pH9.0):?取三羟甲基氨基甲烷 6.06g,加盐酸赖氨酸 3.65g,氯化钠5.8g,乙二胺四醋酸二钠0.37g,再加水溶解使成1000ml,调节pH值至9.0。
乌洛托品缓冲液:取乌洛托品75g,加水溶解后,加浓氨溶液4.2ml,再用水稀释至250ml。
巴比妥缓冲液(pH7.4):取巴比妥钠4.42g,加水使溶解并稀释至400ml,用2mol/L盐酸溶液调节pH值至7.4,滤过。
巴比妥缓冲液(pH8.6):取巴比妥5.52g与巴比妥钠30.9g,加水使溶解成2000ml。
巴比妥一氯化钠缓冲液(pH7.8):取巴比妥钠5.05g,加氯化钠3.7g及水适量使溶解,另取明胶0.5g加水适量,加热溶解后并入上述溶液中。
然后用0.2mol/L盐酸溶液调节pH值至7.8,再用水稀释至500ml。
甲酸钠缓冲液(pH3.3):取2mol/L甲酸溶液25ml,加酚酞指示液1滴,用2mol/L氢氧化钠溶液中和,再加入2mol/L甲酸溶液75ml,用水稀释至200ml,调节pH值至3.25〜3.30。
邻苯二甲酸盐缓冲液(pH5.6):?取邻苯二甲酸氢钾10g,加水900ml,搅拌使溶解,用氢氧化钠试液(必要时用稀盐酸)调节pH值至5.6,加水稀释至1000ml,混匀。
常用标准缓冲溶液在化学分析、仪器分析、生物化学等领域有广泛的应用。
它们通常用于标定传感器、校准仪器、测定物质特性等。
下面将详细介绍如何配制常用标准缓冲溶液。
一、磷酸盐标准缓冲溶液磷酸盐标准缓冲溶液通常用于pH测量。
具体配制方法如下:1. 称取约2克磷酸二氢钾,用纯水溶解。
2. 加入约700ml纯水。
3. 用氢氧化钠溶液调整溶液pH至7.0。
可以使用0.1N氢氧化钠溶液进行调pH。
4. 稀释至总容量为1000ml,这样就得到了磷酸盐标准缓冲溶液。
二、乙酸-乙酸钠缓冲液乙酸-乙酸钠缓冲液常用于PH计的校准。
其配制方法如下:1. 称取无水乙酸钠(28.85g)及乙酸(3mL,约27ml)溶于约500mL纯水中。
2. 用盐酸(1+1)溶液调整溶液pH至3.6~3.8。
3. 稀释至总容量约700mL。
三、纳氏试剂缓冲溶液纳氏试剂是一种常用的显色剂,常用于水质分析等工作中。
缓冲溶液的配制如下:1. 称取三乙醇胺9~15g,加少量纯水溶解,再加入氢氧化钠溶液至pH值约10,即得基本缓冲液。
2. 称取酒石酸钾钠20g及碘化钾2g溶于纯水,稀释至基本缓冲液总容量约50ml,然后慢慢加入碘化汞钾溶液(4%w/v)4~5滴,即得纳氏试剂缓冲溶液。
四、磺基水杨酸标准缓冲溶液磺基水杨酸标准缓冲溶液常用于电位滴定分析,其配制方法如下:1. 称取24克磺基水杨酸,加入约600毫升蒸馏水,完全溶解。
2. 用氢氧化钠溶液调整溶液pH至5.4,使其符合滴定分析要求。
可以使用0.1N氢氧化钠溶液进行调pH。
3. 稀释至总容量约1000ml,这样就得到了磺基水杨酸标准缓冲溶液。
需要注意的是,在配制标准缓冲溶液时,必须严格遵守实验室安全规范,包括正确处理化学药品、避免交叉污染、避免蒸发皿破裂等。
同时,也应注意保护实验环境的卫生和安全,如保持实验台整洁、避免有毒废料的排放等。
此外,对于不同类型和浓度的标准缓冲溶液,可能需要不同的配制步骤和注意事项。
常用缓冲溶液配置方法常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液〔0.05mol/L〕X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升甘氨酸分子量= 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液〔0.05 mol/L〕X邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升Na2HPO4分子量= 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4-2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4①使用时可以每升中参加1克克酚,假设最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
②5.柠檬酸–柠檬酸钠缓冲液〔0.1 mol/L〕柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液〔0.2 mol/L 〕Na 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液为85.61克/升。
Na2HPO 4·2H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
Na 2HPO 4·2H 2O 分子量 = 178.05,1/15M 溶液为11.876克/升。
11.硼酸-硼砂缓冲液(0.2M 硼酸根)
硼砂Na 2B 4O 7·10H 2O,分子量=381.43;0.05M 溶液(=0.2M 硼酸根)含19.07克/升。
硼酸H 2BO 3,分子量=61.84, 0.2M 溶液为12.37克/升。
硼砂 易失去结晶水,必须在带塞的瓶中保存。
12.甘氨酸–氢氧化钠缓冲液(0.05M )
X 毫升0.2M 甘氨酸
+Y 毫升0.2NnaOH 加水稀释至200毫升 甘氨酸分子量=75.07;0.2M 溶液含15.01克/升。
13.硼砂-氢氧化钠缓冲液(0.05M 硼酸根)
X 毫升0.05M 硼砂+Y 毫升0.2NNaOH 加水稀释至200毫升
硼砂Na 2B 4O 7·10H 2O,分子量=381.43;0.05M 溶液为19.07克/升。
14.碳酸钠-碳酸氢钠缓冲液(0.1M ) Ca 2+、Mg 2+存在时不得使用
Na 2CO 2
·10H 2O 分子量=286.2;0.1M 溶液为28.62克/升。
N 2HCO 3分子量=84.0;0.1M 溶液为8.40克/升。
15.“PBS ”缓冲液 10.Tris –盐酸缓冲液(0.05M ,25℃)
50毫升0.1M 三羟甲基氨基甲烷(Tris )溶液与X 毫升0.1N 盐酸混匀后,加水稀释至100毫升。
三羟甲基氨基甲烷(Tris)HOCH2 CH2OH HOCH2 NH2 C
分子量=121.14;
0.1M溶液为12.114克/升。
Tris溶液可从空气中吸收二氧化碳,使用。