电导法测定二级反应乙酸乙酯皂化反应的速率常数
- 格式:doc
- 大小:322.00 KB
- 文档页数:7

乙酸乙酯皂化反应速率常数的测定一、实验目的(1)通过电导法测定乙酸乙酯皂化反应速度常数。
(2)求反应的活化能。
(3)进一步理解二级反应的特点。
(4)掌握电导仪的使用方法。
二、实验原理乙酸乙酯的皂化反应是一个典型的二级反应:CH3COOC2H5+OH−→CH3COO−+C2H5OH设在时间t时生成物浓度为x,则该反应的动力学方程式为−dxdt=k(a−x)(b−x)〔2-41〕式中,a, b分别为乙酸乙酯和碱〔NaOH〕的起始浓度,k为反应速率常数,假设a=b,则〔2-41〕式变为−dxdt=k(a−x)2〔2-42〕积分〔2-42〕式,得k=1t ×xa(a−x)〔2-43〕由实验测得不同t时的x值,则可依式〔8-3〕计算出不同t时的k值。
假设果k值为常数,就可证明反应是二级的。
通常是作xa(a−x)对t图,假设所得的是直线,也可证明反应是二级反应,并可从直线的斜率求出k值。
不同时间下生成物的浓度可用化学分析法测定〔例如分析反应液中的OH−浓度〕,也可以用物理化学分析法测定〔如测量电导〕。
本实验用电导法测定x值,测定的根据如下:〔1〕溶液中OH−离子的电导率比Ac−离子〔即CH3COO−〕的电导率大很多〔即反应物与生成物的电导率差异大〕。
因此,随着反应的进行,OH−离子的浓度不断降低,溶液的电导率也就随着下降。
〔2〕在稀溶液中,每种强电解质的电导率κ与其浓度成正比,而且溶液的总电导率就等于组成溶液的电解质的电导率之和。
依据上述两点,对乙酸乙酯皂化反应来说,反应物与生成物只有NaOH和NaAc是强电解质,乙酸乙酯和乙醇不具有明显的导电性,它们的浓度变化不致影响电导率的数值。
假设果是在稀溶液下反应,则κ0=A1aκ∞=A2aκt=A1(a−x)+A2x式中:A1,A2是与温度、溶剂、电解质NaOH及NaAc的性质有关的比例常数;κ0,κ∞分别为反应开始和终了时溶液的总电导率〔注意这时只有一种电解质〕;κt为时间t时溶液的总电导率。

实验八十二 电导法测定乙酸乙酯皂化反应的速率常数一、实验目的(1)了解二级反应的特点,学会用图解法求取二级反应速率常数; (2)用电导法测定乙酸乙酯反应速率常数,了解反应活化能的测定方法; (3)掌握测量原理,并熟悉电导率仪的使用。
二、实验原理乙酸乙酯皂化反应是一个二级反应,其反应式为:CH 3COOC 2H 5 +Na + + OH - → CH 3COO - + Na + +C 2H 5OH在反应过程中,各物质的浓度随时间而改变。
某一时刻的OH -离子浓度可用标准酸进行滴定求得,也可以通过测量溶液的某些物理性质而求出。
用电导率仪测定溶液的电导率值κ随时间的变化关系,可以监测反应的进程,进而可求算反应的速率常数。
二级反应的速率与反应物的浓度有关。
为了处理方便起见,在设计实验时将反应物CH 3COOC 2H 5和NaOH 采用相同的浓度c 作为起始浓度。
当反应时间为t 时,反应所生成的CH3COO -和C 2H 5OH 的浓度为x ,那么CH 3COOC 2H 5和NaOH 的浓度则为(c -x )。
设逆反应可忽略,则反应物和生成物的浓度随时间的关系为:CH 3COOC 2H 5 + NaOH → CH 3COONa +C 2H 5OH t = 0: c c 0 0 t = t : c -x c -x x x t →∞: →0 →0 →c →c对于上述二级反应的速率方程可表示为:))((x c x c k dt dx--= (1) 积分得:()x c c xkt -=(2)显然,只要测出反应进程中t 时的x 值,再将c 代入上式,就可以算出反应速率常数k 值。
由于反应是在稀的水溶液中进行的,因此,可以假定CH 3COONa 全部电离。
溶液中参与导电的离子有Na +、OH -和CH 3COO -等,而Na +在反应前后浓度不变,OH -的迁移率比CH 3COO -的迁移率大得多。
随着反应时间的增加,OH -不断减少,而CH 3COO -不断增加,所以,体系的电导率值不断下降。

实验八-电导法测定乙酸乙酯皂化反应的速率常数实验四电导法测定乙酸乙酯皂化反应的速率常数一、目的要求1.用电导率仪测定乙酸乙酯皂化反应进程中的电导率2.学会用图解法求二级反应的速率常数,并计算该反应的活化能3.学会使用电导率仪和恒温水浴二、基本原理1 乙酸乙酯皂化是一个二级反应,其反应式为CH3COOC2H5+Na++OH-→CH3COO-+Na++C2H OH5在反应过程中,各物质的浓度随时间改变。
某一时刻的OH-离子浓度,可以用标准酸滴定,也可以通过测量溶液的某些物理性质而求出。
以电导率仪测定溶液的电导率值随时间的变化关系,可以监测反应的进程,进而可以求算反应的速率常数。
反二级反应的速率与应物的浓度有关。
方便起见,设计实验时应物的浓度均采用a 作为起始浓度。
当反应时间为t时,反应所生成的CH3COO-和C2H5OH的浓度为x,则CH3COOC2H5和NaOH的浓度为(a-x)。
设逆反应可以忽略,则有CH3COOC2H5CH3COOC2H5+NaOH→CH3COONa+C2H5OH t=0 c c 0 0t=t a-x a-x x xt→∞ →0 →0 →c →a二级反应的速率方程可表示为(1)积分得(2)起始浓度a为已知,因此只要由实验测得不同时间t时的x值,以对t作图,应得一直线,从直线的斜率m(=ak)便可求出k值。
由于反应是在稀水溶液中进行的,因此可以假定CH3COONa全部电离。
溶液中参与导电的离子有Na+,OH-和CH3COO-等,而Na+在反应前后浓度不变,OH-的迁移率比CH3COO-大得多。
随反应时间的增加,OH-不断减少,而CH3COO-不断增加,所以体系的电导值不断下降。
在一定范围内可以认为体系的电导值减少量和CH3COONa的浓度x的增加量成正比,即t=t时, x=β(κ0-κt) (3)t=∞时,a=β(κ0-κ∞) (4)式中κ0和κt分别为起始和t时的电导值,κ∞为反应终了时的电导值,β为比例常数。

电导法测定⼆级反应⼄酸⼄酯皂化反应的速率常数电导法测定⼆级反应——⼄酸⼄酯皂化反应的速率常数【摘要】本实验使⽤电导率仪,测量出反应中t 时刻的物质的浓度。
根据⼆级反应的速率与浓度的关系,求出⼄酸⼄酯皂化反应在⼀定温度下的速率常数。
学会⼆级反应的相关计算及图解法求解速率常数,了解电导率仪的使⽤。
【abstract 】This experiment use the electric conductivity rate machine ,to measure out thedegree of the reactive thing in the reaction system at each time t.According to the relation of the reaction rate and the thick degree of the second order reaction, beg out the rate constant of the C3COO2H5 and NaOH ‘s reaction at the certain temperatu re. Learn how to calculate the data of the second order reaction and learn about the calculation of the rate constant by using the graphing method. Master the skill of using the electric conductivity rate machine.【关键词】反应速率常数,⼆级反应,电导率,活化能【key word 】The reaction rate constant, second order reaction,electrict conductivity rate , ctivation energy,1. 实验⽬的1.1学习测定化学反应动⼒学参数的分析⽅法——电导法,了解反应活化能的测定⽅法 1.2了解⼆级反应的特点,学会⽤图解法求⼆级反应的速率常数。

电导法测定乙酸乙酯皂化反应的速率常数一、 实验目的1、了解电导法测定化学反应速度常数的方法。
2、理解二级反应的特点,学会用图解法求二级反应的速率常数及其活化能。
3、熟悉电导率仪的使用。
二、实验原理乙酸乙酯皂化反应为二级反应,其反应式如下,设在时间t 时生成物的浓度为x ,乙酸乙酯和氢氧化钠的起始浓度分别为a ,b 则反应物与生成物的浓度与时间的关系为:CH 3OOC 2H 5+NaOH→CH 3COONa+C 2H 5Ot =0 c c 0 0 t =t c -x c -x x x t →∞ →0 → 0 →c →c 则该反应的动力学方程式为式中k 为反应速率常数。
反应速度与两个反应物浓度都是一次方的关系,称为二级反应。
为了便于计算,设乙酸乙酯与氢氧化钠的反应起始浓度相等,a =b ,则上式变为:(15-1) 2()dxk a x dt=-积分式(15-1),且t =0时,x =0得:a kt x a 11+=- (15-2)或xa xta k -⋅=1 (15-3) 由式(15-2)、(15-3)可知,以x a -1 (或xa x-)对t 作图,均得一直线。
同样,亦可将测得不同t 时的x 值代入上式,得k 为常数。
据此则能证明反应为二级。
通常用的是作图法,并由直线的斜率计算反应速度常数k 。
如时间单位为分,浓度单位为摩尔/升,则k 的单位为升/摩尔·分。
不同时间下生成物的浓度可用化学分析法(如分析反应液中OH -的浓度),也可用物理法测定(如测量电导),本实验用电导法测定。
此方法的根据是: (1)反应物与生成物的电导率相差很大,在反应进行过程中,电导率大的OH -逐渐被电导率小的CH 3COO -所取代,溶液电导率有显著降低。
(2)在稀溶液中,可以近似认为每种强电解质的电导率与其浓度成正比,并且溶液的电导率就等于溶液中各电解质离子电导率之和。
乙酸乙酯和乙醇的导电性极小,反应时,它们浓度的改变认为不影响溶液的电导值,溶液的导电能力取决于溶液中能导电的Na +、OH -和 CH 3COO -的离子。
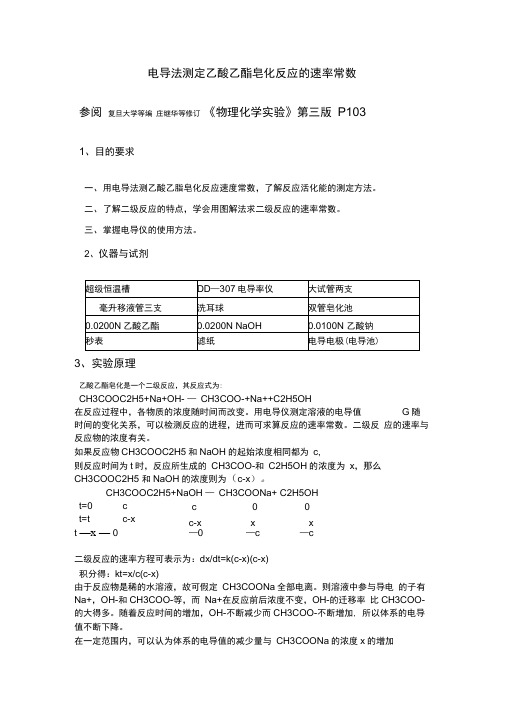
电导法测定乙酸乙酯皂化反应的速率常数参阅 复旦大学等编 庄继华等修订 《物理化学实验》第三版 P1031、目的要求一、 用电导法测乙酸乙脂皂化反应速度常数,了解反应活化能的测定方法。
二、 了解二级反应的特点,学会用图解法求二级反应的速率常数。
三、 掌握电导仪的使用方法。
2、仪器与试剂3、实验原理乙酸乙酯皂化是一个二级反应,其反应式为:CH3COOC2H5+Na+OH- — CH3COO-+Na++C2H5OH在反应过程中,各物质的浓度随时间而改变。
用电导仪测定溶液的电导值 G 随 时间的变化关系,可以检测反应的进程,进而可求算反应的速率常数。
二级反 应的速率与反应物的浓度有关。
如果反应物CH3COOC2H5和NaOH 的起始浓度相同都为 c,则反应时间为t 时,反应所生成的 CH3COO-和 C2H5OH 的浓度为 x ,那么 CH3COOC2H5 和NaOH 的浓度则为(c-x )。
CH3COOC2H5+NaOH — CH3COONa+ C2H5OHt=0 c t=t c-x t —x — 0二级反应的速率方程可表示为:dx/dt=k(c-x)(c-x)积分得:kt=x/c(c-x)由于反应物是稀的水溶液,故可假定 CH3COONa 全部电离。
则溶液中参与导电 的子有Na+,OH-和CH3COO-等,而 Na+在反应前后浓度不变,OH-的迁移率 比CH3COO-的大得多。
随着反应时间的增加,OH-不断减少而CH3COO-不断增加, 所以体系的电导值不断下降。
在一定范围内,可以认为体系的电导值的减少量与 CH3COONa 的浓度x 的增加c-x x x —0 —c —c c 0 0量成正比,即t=t 时,x=b(GO-Gt)t= x时,c=b(GO-G g)则kt=b(GO-Gt)/cb[(GO-G g)- (GO-Gt)]= (GO-Gt)/c (GO-G g)或ckt= (GO-Gt)/ (GO-G g)以(GO-Gt)/(3O-G g)对t作图应得一直线,由斜率即可求出反应速率常数k值.4、实验步骤1、熟悉仪器的使用方法。
电导法测定乙酸乙酯皂化反应的速率常数电导法测定乙酸乙酯皂化反应的速率常数一、实验目的1.了解二级反应的特点,学会用图解计算法求取二级反应的速率常数;2.用电导法测定乙酸乙酯皂化反应的速率常数,了解反应活化能的测定方法。
二、实验原理乙酸乙酯皂化是一个二级反应,其反应式为:在反应过程中,各物质的浓度随时间而变。
某一时刻的OH-离子浓度可用标准酸进行滴定求得,也可通过测定溶液的某些物理性质而得到。
用电导仪测定溶液的电导值G随时间的变化关系,可以监测反应进程,进而可求算反应的速率常数。
二级反应的速率与反应物的浓度有关。
若反应物CH3COOC2H5和NaOH的初始浓度相同(均设为c),设反应时间为t时,反应所产生的CH3COO-和C2H5OH的浓度为x,若逆反应可忽略,则反映物和产物的浓度时间的关系为:上述二级反应的速率方程可表示为:dx/dt=k(c-x)(c-x) (1)积分得:kt=x/c(c-x)(2)显然,只要测出反应进程中任意时刻t时的x值,再将已知浓度c代入上式,即可得到反应的速率常数k值。
因反应物是稀水溶液,故可假定全部电离。
则溶液中参与导电的离子有Na+、OH-和CH3COOH 等,Na+在反应前后浓度不变,OH-的迁移率比的大得多。
随着反应时间的增加,OH-不断减少,而CH3COO-不断增加,所以体系的电导值不断下降。
在一定范围内,可以认为体系电导值的减少量与CH3COONa的浓度x的增加量成正比,即:t=t时,x=β(G0-G t)(3)t=∞时,c=β(G0-G∞)(4)式中G0和G t分别是溶液起始和t时的电导值,,G∞为反应终了时的电导值,β是比例系数。
将(3)、(4)代入(2)得:kt=β(G0-G t)/cβ[(G0-G∞)- (G0-G t)]= (G0-G t)/c (G t-G∞) (5)或写成 (G0-G t)/ (G t-G∞) = ckt(6)从(6)式可知,只要测出G0、G∞和一组G t值,由(G0—G∞)/(G t—G∞)对t作图,应得一直线,从其斜率即可求得速率常数k值。
电导法测定乙酸乙酯皂化反应的速率常数指导老师:李国良【实验目的】①学习电导法测定乙酸乙酯皂化反应速率常数的原理和方法以及活化能的测定方法; ②了解二级反应的特点,学会用图解计算法求二级反应的速率常数; ③熟悉电导仪的使用。
【实验原理】(1)速率常数的测定乙酸乙酯皂化反应时典型的二级反应,其反应式为:CH 3COOC 2H 5+NaOH = CH 3OONa +C 2H 5OHt=0 C 0 C 0 0 0t=t Ct Ct C 0 - Ct C 0 -Ct t=∞ 0 0 C 0 C 0速率方程式 2kc dtdc=-,积分并整理得速率常数k 的表达式为: t0t0c c c c t 1k -⨯=假定此反应在稀溶液中进行,且CH 3COONa 全部电离。
则参加导电离子有Na +、OH -、CH 3COO -,而Na +反应前后不变,OH -的迁移率远远大于CH 3COO -,随着反应的进行, OH - 不断减小,CH 3COO -不断增加,所以体系的电导率不断下降,且体系电导率(κ)的下降和产物CH 3COO -的浓度成正比。
令0κ、t κ和∞κ分别为0、t 和∞时刻的电导率,则:t=t 时,C 0 –Ct=K (0κ-t κ) K 为比例常数 t →∞时,C 0= K (0κ-∞κ) 联立以上式子,整理得:∞+-⨯=κκκκtkc 1t00t 可见,即已知起始浓度C 0,在恒温条件下,测得0κ和t κ,并以t κ对tt0κκ-作图,可得一直线,则直线斜率0kc 1m = ,从而求得此温度下的反应速率常数k 。
(2)活化能的测定原理: )11(k k ln21a 12T T R E -=因此只要测出两个不同温度对应的速率常数,就可以算出反应的表观活化能。
【仪器与试剂】电导率仪1台铂黑电极1支大试管5支恒温槽1台移液管3支氢氧化钠溶液(1.985×10-2mol/L)乙酸乙酯溶液(1.985×10-2mol/L)【实验步骤】①调节恒温槽的温度在26.00℃;②在1-3号大试管中,依次倒入约20mL蒸馏水、35mL 1.985×10-2mol/L的氢氧化钠溶液和25mL1.985×10-2mol/L乙酸乙酯溶液,塞紧试管口,并置于恒温槽中恒温。
华南师大学实验报告电导法测定乙酸乙酯皂化反应的速率常数一'实验目的(1)学会用电导法測定乙酸乙酯皂化反应速率常数,掌握其原理及方法。
(2)掌握活化能的测定方法。
(2)了解二级反应的特点,学会用图解计算法求二级反应的速率常数。
(3)掌握电导率仪的使用方法。
二、实验原理2.1速率常数的测定乙酸乙酯皂化反应是典型的二级反应,其反应式为CHiCOOC/Hs + NaOH === CHCOONa + CzHsOH 其速率方程可表示为de■ dt=枕碱嗨①当反应物起始浓度相同即C怨=C 4 = Co时'则有CHaCOOC/Hs + NaOH === CHaCOONa + GHsOHt=0Cd Co00t=t Ct Ct Co- Ct Co- Ctt=oo00Cd Code则dt 碱酯y为反应任一时刻的浓度o积分并整理得速率常数k的表达式1 c o"c t t 二 _ x --t C 0C f ②在反应过程中,Ct 随时间变化而变化,不同反应的Ct 可以用各种方法测量, 本实验通过测定溶液电导率随时间的变化从而求出速率常数k 。
假定此反应在稀溶液中进行,且CH <COONa 全部电离。
则参加导电离子有Na*、 OH 、CHaCOO »而 曲反应前后不变,0H 的迁移率比CILCOO 大得多,随着反应的 进行,0H 不斷价绍,CH :<COO 不断增加,所以体系电导率不斷下降。
体系电导率 (K )的下降和产物CHaCOO 的浓度成正比。
另/O 、I 和兀3分别为0、t 和*时刻的电导率 ' 则 t=t 时♦ co - Ct = K( /co - /c«) K 为比例常数 tfOO 时,Cd = K( A ; o 一 兀8) 两式联立,整理得Ct = K( /C t - /C J 代入动力学方程②,并消去比例常数K 得进一步整理得可见,即已知起始浓度C (「在恒温条件下,测得Ko 和/C 「并以/C t 对 tm作图,可得一直线,则直线斜率为 加0 >从而求得此温度下的反应速率常数2. 2活化能的测定原理因此只要测定两个不同温度(T 】、T?)对应的速率常数ki 和kz ,根据式⑤可 算出反应的表观活化能E“。