管碟法测定抗生素效价中的影响因素分析及对策讲解
- 格式:doc
- 大小:27.50 KB
- 文档页数:4


管碟法测定抗生素效价中的影响因素分析及对策摘要:目的提高管碟法测定抗生素效价的准确性。
按操作步骤逐步,并提出合理的解决方案。
结果减少外界因素与人为因素给试验带来的误差。
结论可以提高测定结果的准确性。
管碟法是国内外常用的抗生素微生物检定法,利用管碟法测定抗生素效价,具有准确、直观、重复性好等优点,因而被广泛采用。
但是整个试验过程中结果的因素很多,任何一个环节操作不当或者忽略就会造成很大误差,导致整组试验失败。
根据实际操作中的积累经验,对管碟法中影响试验结果的因素进行如下分析及提出解决的方法。
1、实验器材的预备1.1实验器材的选择试验应该选择底面平整的玻璃双碟,避免底面的凹凸影响琼脂层的厚度。
可将双碟放置在水平台上,下垫一层白纸,加入3mL水,再滴加蓝墨水,根据蓝色是否深浅一致来判定双碟底面平整程度。
小钢管则应该选择加工精细的同一批产品,这样才能保证管壁厚薄与重量均匀一致,使得小钢管在培养基中下陷相同的深度,抗生素溶液扩散均匀有可比性。
假如小钢管两端不够平,就应予剔除,否则会使抗生素溶液漏出,破坏均匀扩散现象。
1.2实验器材的清洗抗生素试验中,玻璃双碟、小钢管往往会连续使用。
由于清洗方面的原因,它们还是轻易残留上次试验中的抗生素或者被清洗用的杀菌剂污染,以至于在下次试验中造成抑菌圈不正常的现象。
因此,在清洗时要尤为注重多用流水冲洗。
160℃干热灭菌2h后备用。
2、配制试验所需的样品、标准品、缓冲液与培养基2.1样品与标准品溶液的配制标准品与样品从冰箱取出后,使与室温平衡。
供试品应放于干燥器内至少30min方可称取。
称量最好为一次取样称量,动作迅速,不得反复称取,取样后立即将称量瓶瓶盖盖好,以免吸水。
标准品的称量最好用1/100,000克的分析天平,样品称量不得低于1/10,000克的分析天平。
天平中的干燥剂应保持经常注重更换。
称量结束后,加入超声波处理后的磷酸缓冲液,定容至刻度,过滤并稀释。
稀释时,都应采用容量瓶,每一步稀释取样量不得少于2mL。
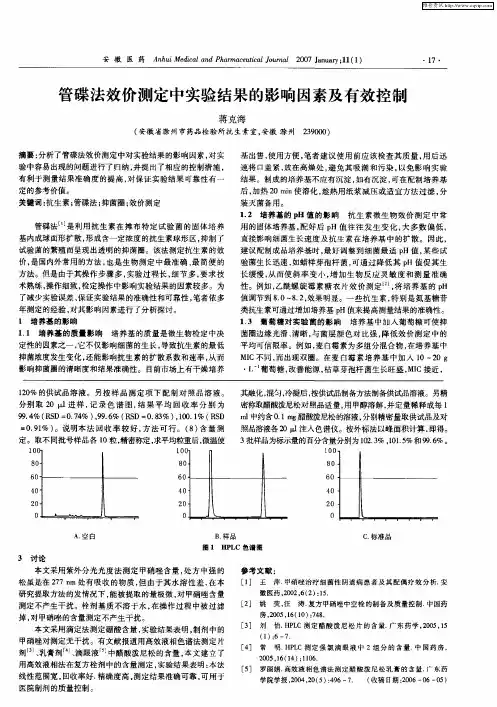

抗生素微生物检定法可分为:(1)稀释法;(2)比浊法;(3)琼脂扩散法(管碟法和打孔法)。
各国药典通常采用后两种方法测定抗生素的效价。
管碟法:利用抗生素在摊布特定试验菌的固体培养基内成球面形扩散,形成含一定浓度抗生素球形区,抑制了试验菌的繁殖而呈现出透明的抑菌圈。
此法系根据抗生素在一定浓度范围内,对数剂量与抑菌圈直径(面积)呈直线关系而设计,通过检测抗生素对微生物的抑制作用,比较标准品与供试品产生抑菌圈的大小,计算出供试品的效价。
原理:利用抗生素在固体培养基中的平面扩散作用,依据量反应平行线原理并采用交叉实验设计方法,在相同实验条件下通过比较标准品(已知效价)和供试品两者对所接种试验菌产生的抑菌圈(直径或面积)大小,来测定供试品效价的一种方法。
管碟法的操作步骤:1、预试验:确定最佳的试验条件:调整试验菌的浓度、使用量、抗生素终浓度、培养基等,使抑菌圈的大小符合规定:一剂量法中心点的抑菌圈直径应在16~17.5mm,二剂量法高剂量浓度标准品溶液所致的抑菌圈直径在18~22mm,三剂量法中间剂量浓度标准品溶液所致的抑菌圈直径在15~18mm。
2、试验准备:双碟、钢管、毛细滴管、吸管的清洗及灭菌;容量瓶、定量吸管的清洗;培养基、缓冲液的准备、半无菌间的紫外消毒等。
3、双碟的制备:每只双碟加底层培养基约20ml,待培养基凝固后,将双碟放入35~37℃培养箱中,待用。
4、供试品、标准品溶液的制备:估计供试品的效价,根据试验要求设计供试品、标准品溶液稀释步骤,平行制备供试品、标准品相关剂量的溶液。
5、菌层的制备:注意菌层培养基温度;根据预试验确定加入菌层培养基的菌液量,注意制备菌层的速度和平整度。
6、滴加抗生素溶液:注意标准品、供试品高、低剂量溶液滴加顺序,保证滴加速度和加量的均匀一致。
7、双碟的培养:根据培养温度的要求在培养箱中进行培养,培养箱中水平碟放的双碟数以不超过三层为宜。
8、抑菌圈的测量:抑菌圈测量仪的使用,每组试验双碟应在相同的测量参数下进行测量。

第9卷第3期延安大学学报(医学科学版)Vol.9No.3 2011年9月Journal of Yanan University(Med Sci)Sep.2011管碟法对抗生素药品效价的微生物检定王新霞1,宋雪玲2(1.延安大学附属医院;2.延安市药品检验所,陕西延安716000)摘要:目的减少实验过程中外界因素与人为因素给试验带来的误差,提高管碟法测定抗生素效价的准确性。
方法按药典操作步骤逐步分析,规范操作,并提出合理的解决方案。
结果得到清晰、圆整的抑菌圈。
结论可以提高测定结果的准确性。
关键词:抗生素效价;生物检定法—管碟法;抑菌圈中图分类号:R917文献标识码:A文章编号:1672-2639(2011)03-0058-01抗生素是医疗上广泛使用的药品[1]。
由于抗生素药品的医疗作用主要是它的抗菌效力,利用抗生素对细菌(霉菌)的杀死或抑制的程度,作为客观指标来衡量抗生素的效力。
根据此原理,设定了抗生素效价的生物检定法—管碟法。
1基本原理管碟法是利用抗生素在琼脂培养内的扩散作用,比较标准品与供试品两者对接种的试验菌产生抑菌圈的大小,以测定供试品效价的一种方法。
管碟法的特点是灵敏度高,能直接显示抗生素的抗菌效价,但操作步骤多,试验过程长。
影响试验结果的因素较多,需要从各个环节加以严格控制试验条件。
本文就对试验中各项影响因素的控制加以讨论。
2影响因素2.1抑菌圈圈正的控制在某些情况下,抑菌圈出现破裂,呈椭圆形,卵圆形等不正常形状,其原因[2]可能如下:(1)在滴加抗生素溶液至小管时,抗生素溶液从小管口或毛细滴管口溅出落在琼脂培养基表面上。
防止方法:毛细滴管内不得有气泡,毛细滴管口避免太细,毛细滴管离小管口距离不要太高,适当调节,使液滴下滴时不致溅出。
(2)小管两端面不够平,使抗生素溶液漏出,破坏了均匀扩散现象。
必须使用加工相同的小钢管。
如都用二端面平面的,或都使用二端面圆的。
(3)玻璃双碟、小钢管、钢管放置器被微量抗生素(或其他杀菌剂)污染,使抑菌圈破裂。

管碟法测定抗生素效价中的影响因素分析及对策(1)关键字:管碟法;抗生素;效价;抑菌圈摘要:目的提高管碟法测定抗生素效价的准确性。
方法按操作步骤逐步分析,并提出合理的解决方案。
结果减少外界因素与人为因素给试验带来的误差。
结论可以提高测定结果的准确性。
Abstract: OBJECTIVE To improve the veracity of antibiotics titer evaluation by cylinder-plate method. METHOD According to the process of test, analyze the test and offer a proper measure to avoid influencing factors. RESULTS Reduce the errors caused by environmental and artificial factors. CONCLUSION This can improve the veracity of test results.Key words: cylinder-plate method; antibiotics; titer; bacterial inhibition ring管碟法是国内外常用的抗生素微生物检定法[1],利用管碟法测定抗生素效价,具有准确、直观、重复性好等优点,因而被广泛采用。
但是整个试验过程中影响结果的因素很多,任何一个环节操作不当或者忽略就会造成很大误差,导致整组试验失败。
根据实际操作中的积累经验,对管碟法中影响试验结果的因素进行如下分析及提出解决的方法。
1. 实验器材的准备1.1 实验器材的选择试验应该选择底面平整的玻璃双碟,避免底面的凹凸影响琼脂层的厚度。
可将双碟放置在水平台上,下垫一层白纸,加入3mL水,再滴加蓝墨水,根据蓝色是否深浅一致来判断双碟底面平整程度。


管碟法抗生素效价测量实验抗生素的生物检定是以抗生素对微生物的抗菌效力作为效价的衡量标准,具有与应用原理相一致、用量少和灵敏度高等优点。
管碟法是琼脂扩散法中的一种,已被各国药典广泛采用,作为法定的抗生素生物检定方法。
当抗生素在菌层培养基中扩散时,会形成抗生素浓度由高到低的自然梯度,即扩散中心浓度高而边缘浓度低。
因此,当抗生素浓度达到或高于mic(最低抑制浓度)时,试验菌就被抑制而不能繁殖,从而呈现透明的抑菌圈。
根据扩散定律的推导,抗生素总量的对数值与抑菌圈直径的平方成线性关系。
实验简介在管碟法抗生素效价测量实验中需要注意的影响因素分析及对策如下:管碟法是国内外常用的抗生素微生物检定法[1],利用管碟法测定抗生素效价,具有准确、直观、重复性好等优点,因而被广泛采用。
但是整个试验过程中影响结果的因素很多,任何一个环节操作不当或者忽略就会造成很大误差,导致整组试验失败。
根据实际操作中的积累经验,对管碟法中影响试验结果的因素进行如下分析及提出解决的方法。
实验器材的准备1.1 实验器材的选择试验应该选择底面平整的玻璃双碟,避免底面的凹凸影响琼脂层的厚度。
可将双碟放置在水平台上,下垫一层白纸,加入3mL水,再滴加蓝墨水,根据蓝色是否深浅一致来判断双碟底面平整程度。
小钢管则应该选择加工精细的同一批产品,这样才能保证管壁厚薄与重量均匀一致,使得小钢管在培养基中下陷相同的深度,抗生素溶液扩散均匀有可比性。
如果小钢管两端不够平,就应予剔除,否则会使抗生素溶液漏出,破坏均匀扩散现象。
1.2 实验器材的清洗抗生素试验中,玻璃双碟、小钢管往往会连续使用。
由于清洗方面的原因,它们还是容易残留上次试验中的抗生素(庆大霉素、争光霉素、链霉素等)或者被清洗用的杀菌剂(如新洁而灭、洗洁精、去污粉等)污染,以至于在下次试验中造成抑菌圈不正常的现象。
因此,在清洗时要尤为注意多用流水冲洗。
160℃干热灭菌2h后备用。
配制试验所需的样品及药品2.1 样品与标准品溶液的配制标准品与样品从冰箱取出后,使与室温平衡。



管碟法测定抗生素效价中的影响因素分析及对策(1)关键字:管碟法;抗生素;效价;抑菌圈摘要:目的提高管碟法测定抗生素效价的准确性。
方法按操作步骤逐步分析,并提出合理的解决方案。
结果减少外界因素与人为因素给试验带来的误差。
结论可以提高测定结果的准确性。
Abstract: OBJECTIVE To improve the veracity of antibiotics titer evaluation by cylinder-plate method. METHOD According to the process of test, analyze the test and offer a proper measure to avoid influencing factors. RESULTS Reduce the errors caused by environmental and artificial factors. CONCLUSION This can improve the veracity of test results.Key words: cylinder-plate method; antibiotics; titer; bacterial inhibition ring管碟法是国内外常用的抗生素微生物检定法[1],利用管碟法测定抗生素效价,具有准确、直观、重复性好等优点,因而被广泛采用。
但是整个试验过程中影响结果的因素很多,任何一个环节操作不当或者忽略就会造成很大误差,导致整组试验失败。
根据实际操作中的积累经验,对管碟法中影响试验结果的因素进行如下分析及提出解决的方法。
1. 实验器材的准备1.1 实验器材的选择试验应该选择底面平整的玻璃双碟,避免底面的凹凸影响琼脂层的厚度。
可将双碟放置在水平台上,下垫一层白纸,加入3mL水,再滴加蓝墨水,根据蓝色是否深浅一致来判断双碟底面平整程度。
抗生素的生物效价测定法(管碟法)work Information Technology Company.2020YEAR抗生素的生物效价测定法测定抗生素效价的方法比较多,一般可以分为物理学方法、化学方法、生物学方法、和两种方法配合等四大类,可根据具体情况选择使用。
生物学方法以抗生素的杀菌力作为衡量效价的标准,其原理恰好和临床应用于的要求一致这是它的优点;又其灵敏度较高,需用检品的量较小,也是其它方法所不及的。
抗生素的生物效价测定法,常用的有稀释法、比浊法和扩散法(或称渗透法)。
稀释法这一方法是用培养基将检品抗生素稀释到各种浓度,并依次分装到一系列的容器内,再加入等量“试验菌种”菌种菌液,并放在37 ℃保温箱内培养一定时间,观察何种稀释度适能抑制细菌的生长,该稀释度即为测定终点(或以细菌生长所引起的PH改变及溶血现象等生化反应作为测定终点),再与同样处理的标准抗生素的终点作比较,即可求得检品的效价。
这种方法可以使用液体培养基,也可以使用固体培养基。
所用的材料及培养基都必须严格无菌,并要注意无菌操作。
由于测定终点是以有无细菌生长来判断的,因此所得结果公是一个范围。
比浊法原理及操作大致与稀释法相同。
比浊法也是将不同量的检品及标准品分别加入培养基中,观察其对“试验菌种”的效应——即细菌生长所引起的混浊。
这一方法和稀释法的区别有二:a.比浊法的稀释间隔的密度比较近,准确度高一些;b.比浊法不以细菌有无生长的区分为终点,而是将标准品浓度和细菌生长所引起的混浊度求得一定的比例,再由检品的细菌生长混浊度推算检品的效价。
这一方法易受杂质的影响,并且不适用于有色或混浊的检品。
扩散法使用固体培养基,在培养基凝固以前将“试验菌种”混合进去,在这样备妥的培养表面,可以用种种设计使检品液或含有抗生素的物质与有菌种的培养基接触。
经过培育后,由于抗生素向培养基中扩散,凡抑菌浓度所能达到之下细菌不能生长因而形成透明的抑菌范围,此种范围一般都呈圆形,称为“抑菌圈”。
管碟法测定抗生素效价结果的影响因素分析
黄镜娟
【期刊名称】《现代医药卫生》
【年(卷),期】2006(022)018
【摘要】管碟法是测定抗生素效价的方法之一,是国内外常用的方法,我国药典
微生物检定法也一直采用管碟法,该方法是生物测定中准确度、灵敏度较高的方法。
管碟法的基本原理.是以扩散为基础的量反应平行线法,由于该实验方法操作步骤多。
过程长,影响实验结果的因素较多,需要从各个环节加以严格控制,以确保实验结果的准确可靠,下面将管碟法的影响因素及控制方法分述如下:
【总页数】2页(P2853-2854)
【作者】黄镜娟
【作者单位】北海市人民医院,广西,北海,536000
【正文语种】中文
【中图分类】R9
【相关文献】
1.管碟法测定抗生素效价中的注意事项 [J], 萨丽塔娜提·居努司;玛尔江·木坎
2.管碟法测定抗生素效价中的影响因素 [J], 刘英
3.管碟法测定抗生素效价的影响因素及控制方法 [J], 陈家凤
4.管碟法测定抗生素效价中的影响因素分析及对策 [J], 唐靓;盛清;朱染枫
5.管碟法测定抗生素效价影响因素与控制方法的研究进展 [J], 任仲丽;张秀花;王静;李秀菊;刘博
因版权原因,仅展示原文概要,查看原文内容请购买。
实验2 管碟法测定土霉素生物效价一、目的要求1、了解管碟法测定抗生素生物效价的基本原理。
2、学会管碟法测定抗生素效价方法,并学习抗生素发酵过程一些重要生理生化指标分析。
二、基本原理衡量抗生素发酵液中抗菌物质的含量称效价。
抗生素效价测定可采用化学法或生物效价测定法。
抗生素生物检定法是利用抗生素对细菌(或真菌)的杀死或抑制的程度,作为客观指标来衡量维生素中有效成分的效力的一种方法。
此法检测灵敏性高,由微量抗生素即可检出(0.5u/ml)。
因此,微生物检定法被作测定抗生素效价的一种经典方法。
生物效价测定有稀释法、比浊法、扩散法三大类。
管碟法是扩散法的一种。
本实验采用管碟法测定抗生素的效价。
管碟法就是利用有一定体积的不锈钢制的小管(牛津杯),将抗生素溶液装满小杯,在含有敏感试验菌的琼脂培养基上进行扩散渗透,经过一定时间后,抗生素扩散到适当的范围,产生透明的抑菌圈。
抑菌圈的半径与抗生素在管中的总量(单位)、抗生素的扩散系数(cm2/h)、扩散时间(即抗生素溶液注入钢管至出现抑菌圈所需的时间)、培养基的厚度(mm)和最低抑菌浓度(u/ml)等因素有关。
抗生素总量的对数和抑菌圈直径的平方呈直线关系。
因此,抗生素效价可以由抑菌圈的大小来衡量。
将已知效价的土霉素标准液先制成标准曲线,比较已知效价标准液与未知效价的被检品溶液的抑菌圈的大小,就可算出样品中抗生素的效价。
三、实验材料1、培养基(供摊布平板用)蛋白胨6g 酵母膏6g 牛肉膏1.5g 葡萄糖1g 琼脂15—18g蒸馏水1000ml pH:6.8 1.05kg/cm?/SPAN> 121.3?/SPAN>C灭菌20分钟2、菌种:黄色八叠球菌(Sarcina flava)3、土霉素碱标准品4、仪器:玻璃试管、试管架、吸管(1ml,2ml,10ml)、吸耳球、离心管、容量瓶、烧杯、三角瓶(5 00ml)、量筒(250ml,500ml,1000ml)、玻璃棒、温度计、牛津杯、镊子、培养盘、恒温箱、台秤等管碟法测定抗生素效价一、目的和要求1、了解管碟法的原理。
管碟法测定抗生素效价中的影响因素分析及对策摘要:目的提高管碟法测定抗生素效价的准确性。
方法按操作步骤逐步分析,并提出合理的解决方案。
结果减少外界因素与人为因素给试验带来的误差。
结论可以提高测定结果的准确性。
Abstract: OBJECTIVE To improve the veracity of antibiotics titer evaluation by cylinder-plate method. METHOD According to the process of test, analyze the test and offer a proper measure to avoid influencing factors. RESULTS Reduce the errors caused by environmental and artificial factors. CONCLUSION This can improve the veracity of test results.Key words: cylinder-plate method; antibiotics; titer; bacterial inhibition ring管碟法是国内外常用的抗生素微生物检定法[1],利用管碟法测定抗生素效价,具有准确、直观、重复性好等优点,因而被广泛采用。
但是整个试验过程中影响结果的因素很多,任何一个环节操作不当或者忽略就会造成很大误差,导致整组试验失败。
根据实际操作中的积累经验,对管碟法中影响试验结果的因素进行如下分析及提出解决的方法。
1. 实验器材的准备1.1 实验器材的选择试验应该选择底面平整的玻璃双碟,避免底面的凹凸影响琼脂层的厚度。
可将双碟放置在水平台上,下垫一层白纸,加入3mL水,再滴加蓝墨水,根据蓝色是否深浅一致来判断双碟底面平整程度。
小钢管则应该选择加工精细的同一批产品,这样才能保证管壁厚薄与重量均匀一致,使得小钢管在培养基中下陷相同的深度,抗生素溶液扩散均匀有可比性。
如果小钢管两端不够平,就应予剔除,否则会使抗生素溶液漏出,破坏均匀扩散现象。
1.2 实验器材的清洗抗生素试验中,玻璃双碟、小钢管往往会连续使用。
由于清洗方面的原因,它们还是容易残留上次试验中的抗生素(庆大霉素、争光霉素、链霉素等)或者被清洗用的杀菌剂(如新洁而灭、洗洁精、去污粉等)污染,以至于在下次试验中造成抑菌圈不正常的现象。
因此,在清洗时要尤为注意多用流水冲洗。
160℃干热灭菌2h后备用。
2. 配制试验所需的样品、标准品、缓冲液与培养基2.1 样品与标准品溶液的配制标准品与样品从冰箱取出后,使与室温平衡。
供试品应放于干燥器内至少30min方可称取。
称量最好为一次取样称量,动作迅速,不得反复称取,取样后立即将称量瓶瓶盖盖好,以免吸水。
标准品的称量最好用1/100,000克的分析天平,样品称量不得低于1/10,000克的分析天平。
天平中的干燥剂应保持经常注意更换。
称量结束后,加入超声波处理后的磷酸缓冲液,定容至刻度,过滤并稀释。
稀释时,都应采用容量瓶,每一步稀释取样量不得少于2mL。
用刻度吸管吸取溶液前,要用待稀释液冲洗吸管2~3次,吸取溶液后,要用滤纸把刻度吸管外壁多余液体擦去,再从起始刻度开始放溶液。
把稀释后的抗生素溶液分装至干燥灭菌试管待用。
在称量抗生素样品过程中,操作者的工作服上有可能会沾染抗生素粉末,在配培养基、加底层培养基、加菌层培养基或滴加抗生素溶液时,会随衣袖的抖动落入培养基,造成破圈或者无抑菌圈。
所以配制抗生素溶液应单独使用一套工作服。
2.2 培养基与缓冲液的配制配制培养基与缓冲液时要按照文献的配比用量,配制后调节其pH值。
因为在pH值、盐浓度的影响下,即使琼脂培养基上的两个相邻的小管距离足够,还是可能会出现卵圆形抑菌圈。
例如四环素易受pH值影响,链霉素易受盐浓度影响[2]。
培养基可以购买厂家生产的产品,因为大批量产品中的成分配比较稳定,可比性较强。
116℃湿热灭菌20min后备用。
3. 加注培养基3.1 加注底层培养基无菌室工作台面可能因为使用时间已久,变得凹凸不平或者倾斜,会影响培养基菌层的厚度均匀性。
菌层越薄,形成的抑菌圈越大,会给试验造成很大的误差。
我们可以在桌面上放置一块足够大的玻璃平板,保证双碟放置区域的平整。
在双碟底部预先标记样品的高低浓度区域,在加注培养基底层的时候,有顺序地按照一致方向排列。
接下来加注培养基菌层的时候,仍然按照原来的位置与方向排列。
这样,即使桌面不够水平,还是能够保证培养基菌层是在水平的培养基底层上铺开,达到消除误差的目的。
试验中加注的培养基如果温度太低,就容易在内部结块,或者加注到双碟之后不能及时铺开,使得培养基表面为非水平面,会给试验带来误差。
加注60~80℃的培养基底层之后,不应立即给双碟加盖。
因为温度过高的培养基会形成大量的水蒸气,在双碟盖上凝集并滴落在已经凝固定的培养基底层上,会给培养基菌层的加注带来影响。
3.2 加注培养基菌层制备琼脂培养基菌层时,培养基温度过高或者受热时间太长都会导致试验菌死亡。
当菌种为非芽孢杆菌的时候,现象尤为明显,甚至会出现无菌生长。
因此,培养基应放在50℃水浴中保温。
当加入试验菌种混匀后,应尽快加注到底层培养基上。
在试验的时候,如果从大瓶内用刻度吸管吸取带菌培养基,吸管中培养基量少极易冷却,加在底层培养基上就不易均匀铺开,导致菌层厚度不均,影响到抑菌圈的直径。
因此可以事先把配制好的培养基分装在具塞试管内,每管5mL,湿热灭菌后放在50℃水浴锅内保温。
试验中,再分别加入菌液混匀,配制成带菌琼脂。
震荡混匀后继续保温5min使培养基温度回升,然后直接倒在底层培养基上,转动双碟使培养基均匀铺开。
4. 放置小钢管放置小钢管时,注意管与管之间不能太靠近,否则会引起相邻的两个抑菌圈之间的抗生素扩散区中的浓度增大,相互影响形成卵圆形或椭圆形抑菌圈。
管与双碟边缘同样也不能太靠近,因为液面浸润作用,边缘的琼脂培养基菌层为非平面,会影响抑菌圈的形状。
可在试验前在双碟的底上用尺测量,作好标记,试验中可以按照双碟底面标记放置小钢管,避免放置位置不恰当产生的问题。
小钢管放置时,要小心地从同一高度垂直放在菌层培养基上,不得下陷,不得倾斜,不能用悬空往下掉的方法。
放置之后,不能随意移动,要静置5min,使之在琼脂内稍下沉降稳定后,再开始滴加抗生素溶液。
5. 滴加抗生素溶液滴加抗生素要按照SH→TH→SL→T L(二剂量法)或者SH→TH→SM→TM→SL→TL (三剂量法)的顺序滴加[3]。
滴加之前,滴管至少要用被滴液体冲洗3次。
在滴加抗生素到小钢管的时候,由于毛细管内抗生素溶液往往会有气泡或者毛细管开口端有液体残留,继续滴加容易造成气泡膨胀破裂,使溶液溅落在琼脂培养基表面造成破圈。
因此一旦毛细管中出现气泡或者残留,就重新吸取抗生素溶液进行滴加,毛细管口应避免太细,滴加的时候离开小钢管口距离不要太高。
滴加中若有溅出,可用滤纸片轻轻吸去,不致造成破圈。
在滴加中还有可能出现抗生素溶液滴入小钢管后,没有与琼脂培养基菌层接触,有一段空气被压在溶液与培养基之间,这样是不会产生抑菌圈的。
此时可以小心的用滴管吸出小钢管内的抗生素溶液,弃去。
换滴管重新滴加。
抗生素溶液滴加后,液面应该与小钢管管口齐平,液面反光呈黑色。
(抗生素液体加入量不能按滴计算,即使同一滴管,每滴的量也有差异。
)如果抗生素溶液滴加过满,可以用无菌滤纸片小心吸去多余部分。
6. 双碟中菌株的培养滴加了抗生素溶液后的双碟忌震动,要轻拿轻放。
在搬运到培养箱的过程中,可以预先在培养箱中垫上报纸铺平,再把双碟连同垫于桌上的玻璃板小心运至培养箱,缓慢推入箱内。
双碟在37℃下培养约16h。
时间太短会造成抑菌圈模糊,太长则会使菌株对抗生素的敏感性下降,在抑菌圈边缘的菌继续生长,使得抑菌圈变小。
在培养过程中,如果温度不均匀(过于接近热源),会造成同一双碟上细菌生长速率不等,使抑菌圈变小或者不圆。
所以把双碟放入培养箱时,要与箱壁保持一定的距离,双碟叠放也不能超过3个。
培养中,箱门不得随意开启,以免影响温度。
应经常注意温度,防止意外过冷过热。
7. 抑菌圈测量7.1 试验结果中抑菌圈直径不应该过大或者过小,在试验之前,可以先做一个关于用不同浓度菌液配制的琼脂培养基菌层预试验,选择抑菌圈直径在18~22mm的菌液浓度为试验用浓度(菌液浓度约为106个/mL)。
批量试验中后期,菌液保存的时间过久,菌株就会逐渐衰亡,生长周期不一致,影响其对抗生素的敏感度,导致抑菌圈变大、模糊或者出现双圈。
如若菌株不纯,也会造成这样的结果。
因此,菌液在使用一段时间后,可以重新配制纯化或者减小原来菌液在使用中的稀释倍数。
7.2 用游标卡尺测量抑菌圈直径,可以在双碟底部垫一张黑纸,在灯光下测量。
不宜取去小钢管再测量,因为小钢管中残余的抗生素溶液会流出扩散,使抑菌圈变得模糊。
不能把双碟翻转过来测量抑菌圈直径,因为底面玻璃折射会影响抑菌圈测量的准确度。
记录测量结果后进行效价计算。
8.讨论试验中,往往会出现异常情况,使得试验结果与预期出现很大差异。
因此抗生素试验的每一步都需要仔细谨慎,严格按照操作规范,才可以得到准确的检测结果。
准确测定抗生素效价,对评价抗生素的治疗效果,指导临床应用都有着重要意义。