分子酶学名词解释简答
- 格式:docx
- 大小:34.44 KB
- 文档页数:9

一、名词解释1、基因:编码蛋白质或RNA等具有特定功能产物的遗传信息基本单位,是染色体或基因组的一段DNA序列(对以RNA作为遗传信息载体的RNA病毒而言则是RNA序列)。
2、基因组:是细胞或生物体中,一套完整的单倍体的遗传物质的总和。
泛指一种生物体具有的遗传信息的总和。
3、转座元件(transposable element):是指能够在DNA分子内部或DNA分子之间移动的DNA片段或基因。
4、转座(transposion):转座元件从基因组的一个部位直接转移到另一个部位的过程。
可引起基因组重排、基因突变、表型变化等。
5、假基因(Pseudogene):指与某些有功能的基因结构相似,但不能表达基因产物的基因。
又称为加工基因或非功能基因。
6、不对称转录Asymmetric transcription:DNA链是有极性的,RNA以不对称的方式与启动子结合,使得转录只能沿着一个方向进行。
对一个基因而言,互补链中只有一条链被转录成RNA.7、断裂基因(split gene):真核生物结构基因,由若干个编码区和非编码区互相间隔开但又连续镶嵌而成,去除非编码区再连接后,可翻译出由连续氨基酸组成的完整蛋白质,这些基因称为断裂基因。
8、外显子(exon):真核生物编码序列中出现在成熟RNA分子中的序列,所携带的遗传信息参与指定蛋白质的氨基酸排列。
9、内含子(intron):真核生物细胞编码序列中的间插序列。
这些序列被转录在前体RNA中,经过剪接被去除,最终不存在于成熟RNA分子中。
10、管家基因(housekeeping gene):某些基因在一个个体的几乎所有细胞中持续表达,通常被称为管家基因。
11、第二信使(second messenger):配体与受体结合后并不直接进入靶细胞内,但间接激活细胞内其他可扩散、并能调节信号转导蛋白活性的小分子或离子,如cAMP、ca2+等。
12、G蛋白循环:G蛋白偶联型受体的信号转导途径中的第一个信号传递分子是G蛋白,其活化过程称为G蛋白循环,存在有活性和无活性两种状态。

名词解释:3.DNA聚合酶(DNApolymerase):指以脱氧核苷三磷酸为底物,按5’→3’方向合成DNA的一类酶,反应条件:4种脱氧核苷三磷酸、Mg+、模板、引物。
DNA 聚合酶是多功能酶,除具有聚合作用外,还具有其它功能,不同DNA聚合酶所具有的功能不同。
4.解旋酶(helicase):是一类通过水解ATP提供能量,使DNA双螺旋两条链分开的酶,每解开一对碱基,水解2分子ATP。
5.拓扑异构酶(topoisomerase):是一类引起DNA拓扑异构反应的酶,分为两类:类型I的酶能使DNA的一条链发生断裂和再连接,反应无需供给能量,类型Ⅱ的酶能使DNA的两条链同时发生断裂和再连接,当它引入超螺旋时,需要由ATP 供给能量。
6.单链DNA结合蛋白(single-strandbindingprotein,SSB):是一类特异性和单链区DNA结合的蛋白质。
它的功能在于稳定DNA解开的单链,阻止复性和保护单链部分不被核酸酶降解。
7.DNA连接酶(DNAligase):是专门催化双链DNA中缺口共价连接的酶,不能催化两条游离的单链DNA链间形成磷酸二酯键。
反应需要能量。
10.前导链(1eadingstrand):在DNA复制过程中,以亲代链(3’→5’为模板时,子代链的合成(5’→3’)是连续的.这条能连续合成的链称前导链。
11.冈崎片段(Okazakifragment)、后随链(1aggingstrand):在DNA复制过程中,以亲代链(5’→3’)为模板时,子代链的合成不能以3’→5’方向进行,而是按5’→3’方向合成出许多小片段,因为是冈崎等人研究发现,因此称冈崎片段。
由许多冈崎片段连接而成的子代链称为后随链。
12.半不连续复制(Semidiscontinuousreplication):在DNA复制过程中,一条链的合成是连续的,另一条链的合成是不连续的,所以叫做半不连续复制。
14.修复(repair):除去DNA上的损伤,恢复DNA的正常结构和功能是生物机体的一种保护功能。


分子生物学名词解释分子生物学名词解释1. 基因(顺反子)(gene(cistron)):指能产生一条肽链的DNA 片段。
包括编码区和其上下游区域(引导区和尾部),以及在编码片段间(外显子)的割裂序列(内含子)。
2. DNA聚合酶(DNA polymerase):合成子代DNA链(在DNA模板的指导下)的酶。
任何独特的酶可在修复或复制(或两者都有)中发挥作用。
3. RNA聚合酶(RNA polymerase):使用DNA作为模板合成RNA的酶(正式应为DNA依赖性RNA聚合酶)。
4. 反转录酶(reverse transcriptase):以单链RNA为模板合成双链DNA的酶。
5. A deoxyribonuclease(DNAase)is an enzyme that attacks bonds in DNA. It may cut onlyone strand or both strand.DNA酶:攻击DNA之间化学键的酶。
(第二句自译:它可能仅仅切断单链或双链。
)6. RNA酶(ribonucleases(RNAase)):底物为RNA的酶,它可对双链或单链RNA特异性作用,它可为核酸内切酶或核酸外切酶。
7. 核酸外切酶(exonuclease):每次可从核酸链一头切割一个核苷酸的酶,可能特异性切割DNA或者RNA的5‘或者3’端。
8. 核酸内切酶(endonuclease):切割核酸链内的化学键。
可特异性地切割RNA或者单链或双链DNA。
9. A hotspot is a site in the genome at which the frequencyof mutation (or recombination)is very much increased, usually by at least an order of magnitude relative to neighboring sites.热点:突变或重组频率显著增加的位点。

一、名词解释1、广义分子生物学:在分子水平上研究生命本质的科学,其研究对象是生物大分子的结构和功能。
2、狭义分子生物学:即核酸(基因)的分子生物学,研究基因的结构和功能、复制、转录、翻译、表达调控、重组、修复等过程,以及其中涉及到与过程相关的蛋白质和酶的结构与功能3、基因:遗传信息的基本单位。
编码蛋白质或RNA等具有特定功能产物的遗传信息的基本单位,是染色体或基因组的一段DNA序列(对以RNA作为遗传信息载体的RNA病毒而言则是RNA序列)。
4、基因:基因是含有特定遗传信息的一段核苷酸序列,包含产生一条多肽链或功能RNA所必需的全部核苷酸序列。
5、功能基因组学:是依附于对DNA序列的了解,应用基因组学的知识和工具去了解影响发育和整个生物体的特定序列表达谱。
6、蛋白质组学:是以蛋白质组为研究对象,研究细胞内所有蛋白质及其动态变化规律的科学。
7、生物信息学:对DNA和蛋白质序列资料中各种类型信息进行识别、存储、分析、模拟和转输8、蛋白质组:指的是由一个基因组表达的全部蛋白质9、功能蛋白质组学:是指研究在特定时间、特定环境和实验条件下细胞内表达的全部蛋白质。
10、单细胞蛋白:也叫微生物蛋白,它是用许多工农业废料及石油废料人工培养的微生物菌体。
因而,单细胞蛋白不是一种纯蛋白质,而是由蛋白质、脂肪、碳水化合物、核酸及不是蛋白质的含氮化合物、维生素和无机化合物等混合物组成的细胞质团。
11、基因组:指生物体或细胞一套完整单倍体的遗传物质总和。
12、C值:指生物单倍体基因组的全部DNA的含量,单位以pg或Mb表示。
13、C值矛盾:C值和生物结构或组成的复杂性不一致的现象。
14、重叠基因:共有同一段DNA序列的两个或多个基因。
15、基因重叠:同一段核酸序列参与了不同基因编码的现象。
16、单拷贝序列:单拷贝顺序在单倍体基因组中只出现一次,因而复性速度很慢。
单拷贝顺序中储存了巨大的遗传信息,编码各种不同功能的蛋白质。


分子酶学复习重点1 剪接型核酶:定义:指RNA分子被磷酸二酯酶切割后,伴随着形成新的磷酸二酯键,即磷酸二酯键的转移反应或称转酯反应。
2 剪切型核酶: 这类核酶的作用是只剪不接,催化自身RNA或不同的RNA分子,切下特异行核苷酸序列。
3 探针酶:既保持高度的反应性,又能在DNA中任意选定的区域内进行切割的酶。
实质是核酸内切酶,由两部分组成,第一部分叫做切割系统,为核酸切割试剂或酶,第二部分叫做识别系统,可以识别核酸底物的特定核苷酸序列。
4 人工酶:人工合成的具有催化活性的蛋白质或多肽。
5 模拟酶:利用有机化学合成的一些比酶结构简单得多但具有催化功能的非蛋白质分子。
6 抗体酶:又称催化抗体,是一类具有催化能力的免疫球蛋白,即通过一系列化学与生物技术方法制备出的具有催化活性的抗体,它既具有相应的免疫活性,又能像酶那样催化化学反应。
7 克隆酶:基因工程将某种酶基因导入宿主细胞中大量表达其产物为克隆酶,即用基因工程技术生产的酶。
8 突变酶:用基因定位突变技术修饰天然酶基因,然后用基因工程技术生产该突变基因的酶,被称为突变酶。
9 酶活力(enzyme activity)也称为酶活性,是指酶催化一定化学反应的能力。
10 酶的比活力:单位质量样品中的酶活力;1mg蛋白质中所含的U数;1Kg蛋白质中所含的Kat数。
11 酶的转换数(K cat):当酶被底物饱和时每秒钟每个酶分子所转换底物分子数,又叫转换数(简称TN), Kcat可以用来衡量酶的催化效率,越大效率越高。
12 亲和标记:利用酶对S的特殊亲和力,将酶加以修饰标记,故称之为亲和标记。
13差别修饰法(差别标记):这种方法是非特异性试剂标记法的一个发展。
它利用竞争性抑制剂或底物预先占据活性中心,使非特异性试剂只修饰活性中心以外的基团,然后透析除去保护剂(即竞争性抑制剂或底物),再用同位素标记的非特异性试剂修饰活性中心的基团。
经氨基酸分析可知哪些基团位于活性中心。

分子生物学常见名词解释1、分子生物学:是一门从分子水平研究生命现象、生命本质、生命活动及其规律的科学。
2、医学分子生物学:是分子生物学的一个重要分支,又是一门新兴交叉学科。
它是从分子水平上研究人体在正常和疾病状态下的生命活动及其规律,从分子水平开展人类疾病的预防、诊断和治疗研究的一门科学。
3、酶工程:过去主要是通过生物化学方法从各种材料中提取、制备酶制剂。
现在主要应用基因工程技术制取酶制剂。
4、蛋白质工程:过去主要是采用化学方法对纯化的蛋白质进行结构改造,制备出有特定功能的蛋白质。
现在主要应用基因工程技术,从改造目的基因的结构入手,在受体细胞中表达不同结构的蛋白质。
5、微生物工程:又称发酵工程是利用微生物特定性状,使微生物产生有用物质或直接用于工业化生产的技术。
6、DNA的甲基化:DNA的一级结构中,有一些碱基可以通过加上一个甲基而被修饰,称为DNA的甲基化。
7、CG岛:在整个基因组中存在一些成簇、稳定的非甲基化CG,这类CG称为CG岛。
8 、信使RNA:从DNA分子转录的RNA分子中,有一类可作为蛋白质生物合成的模板,称为信使RNA。
9、顺反子:由结构基因转录生成的RNA序列亦称为顺反子。
10、帽子结构:5端第1个核苷酸是甲基化鸟嘌呤核苷酸,它以5端三磷酸酯键与第2个核苷酸的5端相连,而不是通常的3、5磷酸二酯键。
11 、核酶:在没有任何蛋白质(酶)存在的条件下,某些RNA分子也能催化其自身或其它RNA分子进行化学反应,即某些RNA具有酶样的催化活性,这类具有催化活力的RNA 被命名为核酶。
12、蛋白质的变性:蛋白质分子爱到物理化学因素(如加热、紫外线、高压、有机溶剂、酸、碱等)的影响时,可使维持空间结构的次级键断裂,性质改变,生物活性丧失,称为蛋白质的变性。
13、蛋白质的复性:导致蛋白质变性的因素除去后,某些蛋白质又可重新回复天然构象,表现出天然蛋白质的生物活性,称为蛋白质的复性。
14、基因:是核酸分子中贮存遗传信息的遗传单位,是指贮存有功能的蛋白质多肽链或RNA序列信息及表达这些信息所必需的全部核苷酸序列。

生化名解1、肽单元(peptide unit):参与肽键的6个原子Ca1、C、O、N、H、Ca2位于同一平面,Ca1和Ca2在平面上所处的位置为反式构型,此同一平面上的6个原子构成了肽单元,它是蛋白质分子构象的结构单元。
Ca是两个肽平面的连接点,两个肽平面可经Ca的单键进行旋转,N—Ca、Ca—C是单键,可自由旋转。
2、结构域(domain):分子量大的蛋白质三级结构常可分割成1个和数个球状或纤维状的区域,折叠得较为紧密,具有独立的生物学功能,大多数结构域含有序列上连续的100—200个氨基酸残基,若用限制性蛋白酶水解,含多个结构域的蛋白质常分成数个结构域,但各结构域的构象基本不变。
3、模体(motif):在许多蛋白质分子中,二个或三个具有二级结构的肽段,在空间上相互接近,形成一个特殊的空间构象。
一个模序总有其特征性的氨基酸序列,并发挥特殊功能,如锌指结构。
4、蛋白质变性(denaturation):在某些物理和化学因素作用下,其特定的空间构象被破坏,也即有序的空间结构变成无序的空间结构,从而导致其理化性质的改变和生物活性的丧失。
主要发生二硫键与非共价键的破坏,不涉及一级结构中氨基酸序列的改变,变性的蛋白质易沉淀,沉淀的蛋白质不一定变性。
5、蛋白质的等电点( isoelectric point, pI):当蛋白质溶液处于某一pH时,蛋白质解离成正、负离子的趋势相等,即成为兼性离子,蛋白质所带的正负电荷相等,净电荷为零,此时溶液的pH称为蛋白质的等电点。
6、酶(enzyme):酶是一类对其特异底物具有高效催化作用的蛋白质或核酸,通过降低反应的活化能催化反应进行。
酶的不同形式有单体酶,寡聚酶,多酶体系和多功能酶,酶的分子组成可分为单纯酶和结合酶。
酶不改变反应的平衡,只是通过降低活化能加快反应的速度。
(不考)7、酶的活性中心 (active center of enzymes):酶分子中与酶活性密切相关的基团在空间结构上彼此靠近,组成具有特定空间结构的区域,能与底物特异结合并将底物转化为产物。
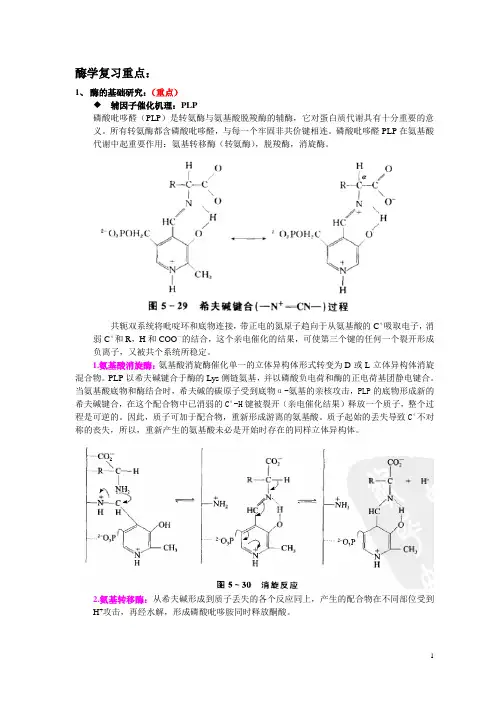
酶学复习重点:1、酶的基础研究:(重点)辅因子催化机理:PLP磷酸吡哆醛(PLP)是转氨酶与氨基酸脱羧酶的辅酶,它对蛋白质代谢具有十分重要的意义。
所有转氨酶都含磷酸吡哆醛,与每一个牢固非共价键相连。
磷酸吡哆醛PLP在氨基酸代谢中起重要作用:氨基转移酶(转氨酶),脱羧酶,消旋酶。
共轭双系统将吡啶环和底物连接,带正电的氮原子趋向于从氨基酸的Cα吸取电子,消弱Cα和R,H和COO—的结合,这个亲电催化的结果,可使第三个键的任何一个裂开形成负离子,又被共个系统所稳定。
1.氨基酸消旋酶:氨基酸消旋酶催化单一的立体异构体形式转变为D-或L-立体异构体消旋混合物。
PLP以希夫碱键合于酶的Lys侧链氨基,并以磷酸负电荷和酶的正电荷基团静电键合。
当氨基酸底物和酶结合时,希夫碱的碳原子受到底物α-氨基的亲核攻击,PLP的底物形成新的希夫碱键合,在这个配合物中已消弱的Cα-H键被裂开(亲电催化结果)释放一个质子,整个过程是可逆的。
因此,质子可加于配合物,重新形成游离的氨基酸。
质子起始的丢失导致Cα不对称的丧失,所以,重新产生的氨基酸未必是开始时存在的同样立体异构体。
2.氨基转移酶:从希夫碱形成到质子丢失的各个反应同上,产生的配合物在不同部位受到H+攻击,再经水解,形成磷酸吡哆胺同时释放酮酸。
从一个不同的酮酸对磷酸吡哆胺攻击开始,可发生逆向反映,形成不同于起始存在的氨基酸。
二步反应可表示为:L-Glu+E-PLP酮戊二酸+E-PMP Oxa+E-PMP L-Asp+E-PLP酶活性中心的鉴定方法(其中动力学分析法的具体细节掌握大概标题即可)酶是生物大分子物质,分子量至少10000以上,但只有少数一些氨基酸残基和催化活力有关,这些特异的氨基酸残基组成了酶的活性中心。
酶活性中心存在的实验证据:①从抑制剂的作用推测:DFP(二异丙基氟磷酸)与胰凝乳蛋白酶的Ser-195的羟基反应,不可逆抑制剂增加一倍,酶作用减少一倍。
②从酶与底物的作用证实:胰凝乳蛋白酶作用于对硝基苯酚乙酸酯,颜色深浅反应酶活性。

1.基因产生一条多肽链或功能RNA所必需的全部核苷酸序列。
2.基因组基因组是生物体内遗传信息的集合,是指某个特定物种细胞内全部DNA分子的总和。
3.顺反子由顺/反测验定义的遗传单位,与基因等同,都是代表一个蛋白质质的DNA 单位组成。
一个顺反子所包括的一段DNA与一个多肽链的合成相对应。
4.基因表达DNA分子在时序和环境的调节下有序地将其所承载的遗传信息通过转录和翻译系统转变成蛋白质分子(或者RNA分子),执行各种生理生化功能,完成生命的全过程。
5.ribozyme【已考试题】即核酶,由活细胞所分泌的具有像酶那样催化功能的RNA分子。
6.SD序列原核生物起始密码AUG上游7~12个核苷酸处的一段保守序列,能与16S rRNA 3′端反向互补,被认为在核糖体-mRNA的结合过程中起作用。
7.RFLP即限制性片断长度多态性。
指限制性酶切位点上的遗传差异。
这些差别引起相关限制性酶切割产生不同长度片段。
RELPs可用于遗传作图,将基因组与常见的遗传标记联系起来。
8.限制性内切酶限制性内切酶是一类能够识别双链DNA分子中的某种特定核苷酸序列,并在相关位置切割DNA双链结构的核酸内切酶。
9.内含子和外显子真核细胞DNA分子中能转录到mRNA前体分子中但会在翻译前被切除的非编码区序列称内含子。
而编码区称为外显子。
10.C值和C值反常现象C值指一种生物单倍体基因组DNA的总量,一般随生物进化而增加,但也存在某些低等生物的C值比高等生物大,即C值反常现象。
原因是真核生物基因组中含大量非编码序列。
11.卫星DNA在DNA链上串联重复多次的短片段碱基序列。
因能在密度梯度离心中区别与主DNA峰而单独成小峰而得名。
12.重叠基因一段能够携带多种不同蛋白质信息的DNA片段。
13.断裂基因【已考试题】在DNA分子的结构基因内既含有能转录翻译的片段,也含有不转录翻译的片段,这类基因称断裂基因。
14.复制子【已考试题】DNA分子上一个独立的复制单位,包括复制原点。
分子酶学的新理论与技术手段随着科学技术的不断发展,分子酶学在生物学、医学、农业等领域的应用越来越广泛。
本文将从分子酶学的概念入手,介绍当前分子酶学的新理论和技术手段。
一、分子酶学的概念分子酶学指的是研究酶分子结构、酶的功能、酶基因表达、酶催化机制以及与酶相关的代谢通路和信号传递的一门学科。
酶是许多生物过程中必不可少的催化剂,它们可以催化生物分子之间的化学反应,从而促进生物代谢、能量转换和信息传递等生命活动。
二、分子酶学的基本理论1. 结构与功能酶的结构与功能密不可分。
酶的结构是它的功能的基础,这是因为酶的结构决定了它的催化性质。
酶分子具有一定的空间结构,这种空间结构是由酶分子的氨基酸序列所决定的。
不同时期、不同物种的酶分子,其氨基酸序列可能会有所改变。
酶的活性中心可以招募底物参与反应,产生反应产物,这是酶功能的基础。
2. 酶功能的特异性酶分子的功能具有高度的特异性,这种特异性意味着同一种酶只能作用于特定的化学反应,而不能催化其他反应。
这种特异性是由酶分子的结构所决定的。
例如,葡萄糖氧化酶只能催化葡萄糖氧化的化学反应,而不能催化其他酮糖、芳香族化合物或脱氢酶这类共同存在的化学反应。
3. 酶的催化机理酶的催化机理是分子酶学的另一个重要研究方向。
酶的催化过程主要包括化学反应的热力学和动力学等方面。
酶催化反应速率常常比同类不带催化剂的反应速率快上几个数量级,这是由于酶催化方式与不带催化剂的反应机理不同所导致的。
三、分子酶学的新技术1. 用于检测酶活性的技术酶活性的检测是分子酶学中重要的一部分。
影响酶活性的因素非常多,包括酶的质量、浓度、温度、PH值等。
现有的酶活性检测技术主要包括银染法、放射性标记法、化学发光法、荧光标记法、色谱法等。
这些方法均可用于酶活性的定量、分离、鉴定及酶动力学研究。
2. 用于分离纯化酶的技术酶的纯化通常需要采用多种分离技术、柱层析技术和电泳技术等。
电泳分离技术包括直流电泳、聚丙烯酰胺凝胶电泳、二维电泳等。
分子酶学的研究与应用分子酶学是从分子水平研究酶的结构、功能、反应机理及其在生命体系中的角色的一门学科。
随着生物技术的发展和深入,分子酶学的研究不断深入,其在生物技术以及药物研究与开发中的应用也日益广泛。
本文将从分子酶学的基础知识、酶的结构与功能、分子酶学的研究方法与技术以及其应用四个方面进行阐述。
一、基础知识酶是一种催化生物化学反应的生物分子,可以加速化学反应的速率。
酶是由蛋白质或核酸组成的,具有高度的立体构象和选择性,可以在特定的条件下与底物结合成酶底物复合物,对其进行分子成键、分子断键、氧化还原和断裂等反应,并在反应后释放产物。
酶是生命体系中必不可少的分子,参与到细胞内的许多代谢过程,从而维持生命体系的正常运转。
分子酶学的研究就是探究酶的结构、功能、反应机理及其在生命体系中的角色,为药物研发和生物技术提供科学基础。
二、酶的结构与功能酶的结构是极其复杂的,其结构与功能密切相关。
酶分为原酶和活性酶两种形态。
原酶是指在特定条件下酶的非活性状态,具有酶分子结构的特性,但缺少酶产生特效催化反应的所需物质,通常是酶基团、受体或蛋白质等。
而活性酶是指在适宜条件下的具有催化活性的酶,其具有能够产生特效催化反应的基团。
酶具有高度的立体构象和选择性,可以与底物形成酶底物复合物,从而催化反应。
酶的催化反应主要包括分子成键、分子断键、氧化还原和断裂等四种类型,其中最常见的是分子成键与分子断键。
酶的活性受到许多因素的影响,如温度、pH 值、离子强度、离子种类、酶底物比例等。
三、分子酶学的研究方法与技术分子酶学的研究领域非常广泛。
酵素的研究方法与技术也在不断发展。
常见的酶研究方法包括晶体学、核磁共振、荧光共振能量转移、生物传感器等。
晶体学技术是一种用于研究蛋白质三维结构和酶的构象变化的方法,其在分子酶学研究中应用最为广泛。
核磁共振技术是一种分子结构的结构分析方法,在酶机理研究中具有重要的应用价值。
荧光共振能量转移是一种生物传感技术,通过分子之间的能量转移来检测酶的活性变化。
生物化学与分子生物学名词解释官方版第一章1.模体(motif):蛋白质分子中具有特定空间构象和特定功能的结构成分。
2.锌指结构(zinc finger):由蛋白质结构域围绕一个锌离子折叠形成的、保守的DNA结合蛋白模体。
3.纤连蛋白(fibronectin):一类细胞外粘连蛋白,可与其他细胞外基质组分、血纤维蛋白、整合蛋白家族的细胞表面受体结合,其功能是连接细胞与细胞外基质,参与损伤愈合。
4.结构域(domain):分子量较大的蛋白质常可折叠成多个结构较为紧密且稳定的区域,并各执行其功能,称为结构域。
5.亚基(subunit):组成具有四级结构的蛋白质的次级结构,每一条多肽链都有其完整的三级结构,称为亚基。
6.分子病(molecular disease):由于基因上DNA分子的缺陷,致使细胞内RNA及蛋白质合成出现异常,人体结构与功能随之发生变异的疾病。
7.蛋白质等电点(protein isoelectric point/pI):蛋白质静电荷为零时的溶液pH。
8.蛋白质变性(protein denaturation):多肽/蛋白质的特定空间构象的部分或完全,非折叠过程或形式。
9.电泳(electrophoresis):在电场作用下,带电溶液向正极或负极的移动。
经常用于蛋白质、核酸或其他带电颗粒混合物的分离。
10.层析(chromatography):利用物质分子在流动相与固定相之间分配比例不同,将不同物质分子的混合物分离的一种技术。
例如薄层层析、柱层析等。
第二章1.碱基堆积力(base stacking interaction):DNA分子的两条多聚核苷酸链在旋进过程中,相邻的两个碱基对平面会彼此重叠,由此产生的疏水作用力。
2.DNA变性(DNA denaturation):在某些理化因素(温度、pH、离子强度等)作用下,DNA双链的互补碱基之间的氢键断裂,使双螺旋结构松散,形成单链的构象,不涉及一级结构的改变。
分子酶学研究在日常生活中,我们经常听到“酶”的概念,但是它到底是什么呢?简单来说,酶就是在生物体内催化化学反应的一种蛋白质。
它能够加速化学反应并降低活化能,从而使得反应在低温、中性条件下快速进行。
酶的很多性质都与它的分子结构相关。
因此,分子酶学研究主要关注的就是酶的分子结构及其功能。
一、酶的分子结构酶的分子结构通常由两部分组成:蛋白质部分和辅助部分。
其中蛋白质部分是其活性中心,也就是催化反应的关键所在。
而辅助部分则是保护蛋白质部分不受到环境因素的影响,比如温度、PH值等。
通过分子酶学研究,我们可以了解到酶的分子结构对其功能和催化反应有着决定性的影响。
定量分析酶的构象变化和受体的结构变化对酶活性的影响,可以揭示酶的催化机制,从而帮助我们设计新的酶与底物之间的相互作用和反应。
二、酶的机理研究酶的机理研究是分子酶学研究的重要方向。
酶的催化反应过程,可以分为两个步骤:酶与底物的结合,以及催化反应的进行。
在底物结合的过程中,酶分子通过各种非共价相互作用,如氢键、离子键等,与底物结合成为酶底物复合物。
而在催化反应的过程中,酶会通过剪切、质子转移、脱水、氧化还原等化学变化,使底物转化为产物。
在酶的机理研究中,分子模拟技术是一个非常有用的工具。
通过分子动力学模拟,可以更加直观的观察到酶与底物之间的相互作用,发现可能存在的催化机理,为酶的催化反应提供理论依据。
三、酶的应用酶在许多生产过程中有着广泛的应用,特别是利用酵素催化的生物合成技术,成为了当前生物技术领域的重要手段。
比如,通过在酵素的作用下,将底物转化为高附加值的化学品、制备建筑材料和产生纤维素等。
通过分子酶学的研究,我们可以在原有的基础上,不断开发新的酶,运用更多的分子酶学研究方法和手段,深入理解酶活性的产生机制,从而大大提高酶活性,促进酶的应用。
结语分子酶学研究是一门综合性很强的学科,它涉及到化学、生物、物理等多个领域。
有了分子酶学的研究,我们可以更加深入地了解酶的构造和机理,发掘其潜在应用价值,促进生物技术的发展,同时也可以为人们的生活带来更多便利和舒适。
分子生物学重点名词解释1.Adapors pr:接头蛋白是指一些本身无酶活性,只是在信号通路中起连接,接头或停靠作用的细胞内蛋白质,它们能介导上游和下游信号转导蛋白间形成信号复合物。
2.Akt:蛋白激酶B(PKB)是PI-3K的间接靶酶。
PKB为与PKA和PKC家族成员具有同源性的丝/苏氨酸蛋白激酶,由因证实该酶是病毒癌基因v-akt产物而被称为Akt.3.allosteric effect) 别构效应一些特定的小分子化合物(如代谢终产物)与酶分子的调节亚基或部位结合时,可诱导和影响催化亚基或部位的空间结构改变,使催化活性增高或降低。
4.antisense RNA:反义RN A与细胞内DNA或RNA序列互补形成杂交体而阻断或减弱其转录或翻译过程的RNA片段。
5.AP-1:活化蛋白质一1,是广泛研究的癌基因产物之一,AP-1是Fos和Jun蛋白家族成员中一个二聚体。
这些蛋白质具有一个羟基到DNA结构域“亮氨酸拉链”二聚化界面,它能识别在许多基因调节区所发现的假回文序列。
6.apotosis:凋亡是机体细胞在正常生理或病理状态下发生的一种自发的程序化的死亡过程,其发生受到机体的严密调控。
7.arrestin阻遏蛋白:在转录水平上对基因表达产生负调节的蛋白质,抑制开放启动子复合物8.attenuator:衰减子trp操纵子前导序列中有一小段序列可形成转录终止子结构。
对操纵子的减弱有转录作用。
9.Calmodulin:钙调蛋白是细胞内重要的调节蛋白,由一条多肽链组成,有4个Ca2+结合位点,当胞浆Ca2+增高,Ca2+与CaM结合,其构象改变,而激活Ca2+---CaM激酶。
10.CASCADE:级联控制,每一个发育阶段均受到前一阶段的产物的调节,其产物又可充当转录因子调节下一阶段的反应的机制。
11.Caspsae:天冬氨酸特异性半胱氨酸蛋白酶,他们的活化与炎症因子合成及细胞凋亡有关。
12.CDK:细胞周期蛋白依赖性酶,高等真核细胞细胞周期的调节依赖于异二聚体蛋白激酶来完成,这些蛋白激酶是由调节亚单位和催化亚单位两部分组成。
分子酶学复习重点1 剪接型核酶:定义:指RNA分子被磷酸二酯酶切割后,伴随着形成新的磷酸二酯键,即磷酸二酯键的转移反应或称转酯反应。
2 剪切型核酶: 这类核酶的作用是只剪不接,催化自身RNA或不同的RNA分子,切下特异行核苷酸序列。
3 探针酶:既保持高度的反应性,又能在DNA中任意选定的区域内进行切割的酶。
实质是核酸内切酶,由两部分组成,第一部分叫做切割系统,为核酸切割试剂或酶,第二部分叫做识别系统,可以识别核酸底物的特定核苷酸序列。
4 人工酶:人工合成的具有催化活性的蛋白质或多肽。
5 模拟酶:利用有机化学合成的一些比酶结构简单得多但具有催化功能的非蛋白质分子。
6 抗体酶:又称催化抗体,是一类具有催化能力的免疫球蛋白,即通过一系列化学与生物技术方法制备出的具有催化活性的抗体,它既具有相应的免疫活性,又能像酶那样催化化学反应。
7 克隆酶:基因工程将某种酶基因导入宿主细胞中大量表达其产物为克隆酶,即用基因工程技术生产的酶。
8 突变酶:用基因定位突变技术修饰天然酶基因,然后用基因工程技术生产该突变基因的酶,被称为突变酶。
9 酶活力(enzyme activity)也称为酶活性,是指酶催化一定化学反应的能力。
10 酶的比活力:单位质量样品中的酶活力;1mg蛋白质中所含的U数;1Kg蛋白质中所含的Kat数。
11 酶的转换数(K cat):当酶被底物饱和时每秒钟每个酶分子所转换底物分子数,又叫转换数(简称TN), Kcat可以用来衡量酶的催化效率,越大效率越高。
12 亲和标记:利用酶对S的特殊亲和力,将酶加以修饰标记,故称之为亲和标记。
13差别修饰法(差别标记):这种方法是非特异性试剂标记法的一个发展。
它利用竞争性抑制剂或底物预先占据活性中心,使非特异性试剂只修饰活性中心以外的基团,然后透析除去保护剂(即竞争性抑制剂或底物),再用同位素标记的非特异性试剂修饰活性中心的基团。
经氨基酸分析可知哪些基团位于活性中心。
14 共价催化:酶与底物以共价键结合成共价中间物,并迅速转变成活化能大大降低的过渡态,从而大大提高底物反应速度。
15 K s型不可逆抑制剂:与底物结构相似,能与酶的底物结合部位结合,同时还带有一个活性基团,可以和附近的相应基团反应,形成共价键。
16 K cat型不可逆抑制剂(自杀性底物):该类抑制剂不但具有与天然底物相类似的结构,而且抑制剂本身也是酶的底物,因此也被称为自杀性底物(suicide substrate)。
17 竞争性抑制:抑制剂与底物竞争与酶的同一活性中心结合,从而干扰了酶与底物的结合,使酶的催化活性降低,这种作用就称为竞争性抑制作用。
18 非竞争性抑制:抑制剂既可以与游离酶结合,也可以与ES复合物结合,使酶的催化活性降低,称为非竞争性抑制。
19 反竞争性抑制:抑制剂不能与游离酶结合,但可与ES复合物结合并阻止产物生成,使酶的催化活性降低,称酶的反竞争性抑制。
20 混合型抑制:混合型抑制与非竞争性抑制基本相似,但是Ks≠Ks′, Ki≠Ki′。
21 乒乓机制:这类反应的特点是,酶同A的反应产物P是在酶同第二个底物B 反应前释放出来,作为这一过程的结果,酶转变为一种修饰酶形式F,然后再同底物B反应生成第二个产物Q,并再生为未修饰的酶形式E。
问答题1、ribozyme与传统酶有哪些相同和不同?阐述ribozyme的发现有哪些重大意义?有何应用前景?意义:①改变了人们长期对生物催化剂的化学本质的认识;②对生命系统起源的争论有重要启示;③Ribozymes作为RNA限制性内切酶成为分子生物学的工具酶;④Ribozymes作为抗病因子治疗疾病。
应用前景:①核酶在治疗遗传病,肿瘤和病毒性疾病上有巨大的潜力;2、简述CRISPR/Cas9技术的基本原理及在生物研究领域的应用进展。
基本原理:①从已知的序列中通过PAM进行定位寻找合适的靶位点并合成gDNA;②构建gDNA与Cas9重组质粒;③对重组质粒进行活性检测,敲除活性的计算;④挑选活性较高的敲除质粒导入培养的细胞或者生物体内进行基因组定位标记操作,crRNA合成后识别并结合到DNA互补链上,然后由Cas9对DNA靶点序列进行切割;利用测序、RFLP等方法检测基因组定点修饰结果。
应用进展:(1)CRISPR-Cas9系统可以作为一种位点特异性基因编辑平台;(2)利用CRISPR-Cas9系统在转录水平上对基因表达的调节;(3)利用CRISPR-Cas9系统对目标RNA序列进行操纵;(4)利用CRISPR-Cas9系统对基因组功能进行筛查;(5)CRISPR-Cas9系统作为DNA特定位点标签;(6)利用Cas9系统可实现对基因的诱导调控。
3、酶活力测定有哪些方法?说明酶活力测定过程中要注意的事项,以蛋白酶为例,设计酶活力测定的方法。
①按反应时间分类:连续监测法②按监测方法分类:(1)分光光度法;(2)旋光法;(3)荧光法;(4)电化学方法;(5)化学滴定法;(6)核素测定法;(7)量热法;(8)酶偶联测定法。
注意事项:①严格控制实验条件,最适温度、最适pH;②[E]〈〈[S];③做对照实验;④酶液不宜放置过久;⑤有些反应不一定在水溶液中进行。
实验设计:以菠萝蛋白酶为例①配制标准酪氨酸溶液,在多个试管中加入不同量酪氨酸溶液和其他溶剂,35℃温浴10min后测定吸光度,制备酪氨酸标准曲线;②酶反应:样品和对照分别取三支试管,加入酪蛋白溶液和其他试剂后与35℃温浴10min后,样品管加入菠萝蛋白酶液,对照管不加,继续温浴10min,然后加入三氯乙酸中止反应,对照管再加入等量蛋白酶液,静置后过滤。
③对滤液进行吸光度测定,按照公式计算酶活力单位数。
4、什么是酶的活性部位?有何特点?酶活性中心中常见氨基酸有哪些?概念:酶蛋白上只有少数氨基酸残基参与酶对底物的结合和催化,这些相关氨基酸残基在空间上比较靠近,形成一个与酶显示活性直接有关的区域(在酶分子表面上具有三维结构的特定区域),称为酶的活性中心,又称活性部位(active site)特点:(1)酶蛋白多肽链经过盘绕折叠形成特定的空间结构,使有关的AA形成微区,活性中心只占酶分子总体积的很小一部分,往往只占整个酶分子体积的1%-2%。
(2)酶的活性部位位于酶分子表面的一个裂隙(crevice)内。
裂隙内是一个相当疏水的环境,从而有利于同底物的结合。
活性中心一般为低介电区(非极性环境、或疏水区)。
(3)可以将酶的活性中心设想为一个口袋或是一条沟槽,形状与底物相近。
不同的酶的口袋适合不同的底物。
口袋中有相应的结合基团与底物上的某些基团结合,发生反应的底物上的键与催化基团靠近。
底物靠许多弱的键力与酶结合。
(4)酶的活性部位是一个三维实体,具有三维空间结构。
常见氨基酸:酶活性中心有7种氨基酸残基出现的频率最高Lys(赖氨酸)、Asp(天冬氨酸)、Glu(谷氨酸)、Cys(半胱氨酸)、His(组氨酸)、Tyr(酪氨酸)、Ser(丝氨酸)(兰天果拌猪肉丝)5、为什么酶具有极高的催化效率?①邻近定向效应:酶的作用就象把底物从溶液中取出来,使它们固定在酶分子表面的活性中心部位,它们的反应基团相互邻近,同时使反应基团的分子的轨道以正确方位相互交盖,使之易于发生反应。
②扭曲变形和构象变化的催化效应(变形与张力):酶的三维结构发生改变,酶从低活性→高活性S在酶的诱导下,敏感键扭曲、变形和去稳定作用→S的构象变得更像过渡状态。
③酸碱催化:酶活性部位上的某些基团可以作为良好的质子供体或受体对底物进行酸碱催化。
④金属离子催化(相当于酸催化):金属离子是多种酶的辅因子,可以稳定过渡态中间物,在氧化还原反应中传递电子,也可以进行亲电催化。
比酸催化能力强:(1)可带不止一个电荷;(2)络合作用;(3)可维持较高浓度⑤共价催化(亲核亲电催化):酶与底物以共价键结合成共价中间物,并迅速转变成活化能大大降低的过渡态,从而大大提高底物反应速度。
⑥微环境的影响:酶活性中心是低介电区域,在非极性环境中两个带电基团之间的静电作用比在极性环境中显著提高,从而有利于同底物的结合。
6、研究酶活性中心的方法有哪些?简述活性中心基团的鉴定标准。
①X射线衍射法;②化学修饰法:专一性氨基酸共价修饰法、差别修饰法、亲和标记法;③动力学分析;④定位诱变法;⑤切除法(酶化学资料有具体概念)活性中心基团的鉴定标准①酶的失活程度与修饰剂浓度成一定比例关系。
即修饰剂的浓度和酶活力丧失的速度常数成正比。
②S或可逆抑制剂有保护作用(活性中心)。
先加S或竞Ⅰ加共价修饰剂透析除去S或竞Ⅰ活性不丧失7、举例阐述差别修饰法研究酶活性中心的一般程序。
1过量S 或竞Ⅰ下加修饰剂2去除多余修饰剂及S或竞Ⅰ3加同位素标记的修饰试剂4原来被保护基团带有同位素标记胰蛋白酶的差示标记为例8、举例说明亲和标记法研究酶活性中心的优点。
①与S结构相似,可以比较专一地引入活性部位,接近S结合位点。
②具有活泼的化学基团(如卤素)可与活性中心的基团形成稳定的共价键。
③与活性中心的氨基酸残基亲和力大,而与活性中心以外的氨基酸残基亲和力小。
举例Ser-OH的专一性修饰剂——DIFP(二异丙基氟磷酸)对活性中心含有Ser的胰凝乳蛋白酶和胰蛋白酶都抑制,而亲和试剂则能分开,不同的亲和试剂能分别抑制这两种酶的活性。
9、K m有何意义和应用?(1) 活性中心被S占据一半时的[S](2)特征常数取决于酶的性质,与[E]无关, 但与T 和pH有关。
(3)Km值近似等于[ES]的解离常数,可表示酶与底物之间的亲和力:Km值大表示亲和程度小,酶的催化活性低; Km值小表示亲和程度大,酶的催化活性高。
(4) Km可以判断酶的专一性和天然底物,一种酶可有几种S,同一种酶有几种S 就有几个Km值,因此,从km可判断酶的专一性和天然底物。
Km最小的底物,通常就是该酶的最适底物,也就是天然底物。
(5) 已知Km,可根据[S]求v ; v求[S](6)了解酶的Km及S在细胞内浓度推知是否受[S]调节。
Km<[S]10倍以上,S饱和,v不受[S]调节;Km>[S],v受[S]调节。
(7)km还可以推断某一代谢物在体内可能的代谢途径。
(8)催化可逆反应的酶,测Km和[S]可大致推测酶催化正逆两向反应的效率。
(9)在连锁反应中根据Km找出限速步骤(10)用于鉴别原级同工酶,次级同工酶10、酶的抑制作用与失活作用有何区别?说明几种抑制类型的主要特点,举例说明研究酶的抑制剂有什么理论意义及实践意义。
失活作用:凡使酶蛋白变性而引起酶活力丧失的作用。
抑制作用:使酶活力下降,但并不引起酶蛋白变性的作用。
此作用使一部分酶的必需基团或辅助因子化学性质发生改变,而使酶活力丧失或降低的作用。
可逆抑制作用:抑制剂以非共价键与酶分子可逆性结合造成酶活力降低或丧失,且可采用透析、超滤等物理方法去除抑制剂而恢复酶活力,这种抑制作用是可逆抑制作用。