第五章pH值的标定与测量
- 格式:doc
- 大小:53.50 KB
- 文档页数:4

实验一 pH值的测定(直接电位法)一、实验目的1、了解用直接电位法测定溶液pH的原理和方法。
2、掌握酸度计的使用方法。
二、实验原理pH值是溶液中氢离子活度的负对数,是最常用的水质指标之一。
溶液的pH值通常是用酸度计进行测定的。
它是以玻璃电极为指示电极,饱和甘汞电极为参比电极,插入溶液中形成原电池,在25℃时,每单位pH相当于59.1mV电动势变化值。
即电动势每改变59.1mV,溶液的pH值相应改变一个单位,可在仪器上直接读出pH值。
温度差异在仪器上有补偿装置。
本实验采用复合电极代替玻璃电极和饱和甘汞电极使用。
在实际工作中,当用酸度计测定溶液的pH值时,经常用已知pH值的标准缓冲溶液来校正酸度计(也叫“定位”)。
校正时应选用与被测溶液的pH值接近的标准缓冲溶液,以减少在测量过程中可能由于液接电位、不对称电位以及温度等变化而引起的误差。
校正后的酸度计,可直接测量水或其他低酸碱度溶液的pH 值。
三、教学重点与难点教学重点:pH酸度计的使用;教学难点:pH酸度计的使用四、实验学时数和学时分配实验学时数:2学时学时分配:1、检查学生实验预习情况—5分钟;2、教师讲解本次实验内容—30分钟;3、学生开始独立实验—30分钟;4、学生讨论—30分钟;5、教师对本次实验情况进行点评,布置下次实验内容—25分钟。
五、实验准备仪器:pHS一3C型酸度计、pH复合电极。
试剂:(略)六、实验过程1、将仪器接通电源。
2、仪器选择开关置于pH档,开启电源,仪器预热。
3、仪器校正4、测量水样pH值5、实验完毕,清洗电极头,套好保护帽,放回电极盒中;仪器回零,关闭仪器开关。
七、注意事项1、电极取下帽后应注意,在塑料保护栅内的敏感玻璃泡不要与硬物接触,任何破损和擦毛都会使电极失效;2、测量完毕,不用时应将电极保护帽套上,帽内应有少量的补充液,以保持电极球泡的湿润;3、复合电极的引出端必须保持清洁和干燥,绝对防止输出两端短路,否则将导致测量结果失准或失效。


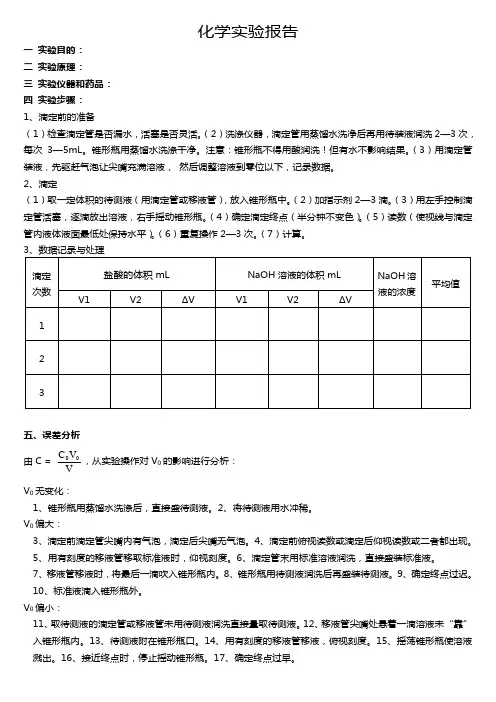
化学实验报告一 实验目的: 二 实验原理: 三 实验仪器和药品: 四 实验步骤: 1、滴定前的准备(1)检查滴定管是否漏水,活塞是否灵活。
(2)洗涤仪器,滴定管用蒸馏水洗净后再用待装液润洗2—3次,每次3—5mL 。
锥形瓶用蒸馏水洗涤干净。
注意:锥形瓶不得用酸润洗!但有水不影响结果。
(3)用滴定管装液,先驱赶气泡让尖嘴充满溶液, 然后调整溶液到零位以下,记录数据。
2、滴定(1)取一定体积的待测液(用滴定管或移液管),放入锥形瓶中。
(2)加指示剂2—3滴。
(3)用左手控制滴定管活塞,逐滴放出溶液,右手摇动锥形瓶。
(4)确定滴定终点(半分钟不变色)。
(5)读数(使视线与滴定管内液体液面最低处保持水平)。
(6)重复操作2—3次。
(7)计算。
五、误差分析 由C =VV C 00,从实验操作对V 0的影响进行分析: V 0无变化:1、锥形瓶用蒸馏水洗涤后,直接盛待测液。
2、将待测液用水冲稀。
V 0偏大:3、滴定前滴定管尖嘴内有气泡,滴定后尖嘴无气泡。
4、滴定前俯视读数或滴定后仰视读数或二者都出现。
5、用有刻度的移液管移取标准液时,仰视刻度。
6、滴定管末用标准溶液润洗,直接盛装标准液。
7、移液管移液时,将最后一滴吹入锥形瓶内。
8、锥形瓶用待测液润洗后再盛装待测液。
9、确定终点过迟。
10、标准液滴入锥形瓶外。
V 0偏小:11、取待测液的滴定管或移液管未用待测液润洗直接量取待测液。
12、移液管尖嘴处悬着一滴溶液未“靠”入锥形瓶内。
13、待测液附在锥形瓶口。
14、用有刻度的移液管移液,俯视刻度。
15、摇荡锥形瓶使溶液溅出。
16、接近终点时,停止摇动锥形瓶。
17、确定终点过早。

ph计的标定
以PH计的标定
PH计是一种用于测量溶液酸碱度的仪器,它的准确性对于实验结果的可靠性至关重要。
因此,正确的PH计标定是非常重要的。
PH计标定的目的是确定PH计的准确性和精度。
标定过程中,需要使用标准缓冲溶液,这些溶液的PH值已经被确定并且被广泛接受。
标定过程中,需要将PH计放入标准缓冲溶液中,然后根据PH 计的读数进行校准。
标定过程中,需要注意以下几点:
1. 选择合适的标准缓冲溶液。
标准缓冲溶液的选择应该与实验中使用的溶液的PH值相近。
2. 标定前,需要将PH计清洗干净。
使用去离子水或者酒精进行清洗,然后用纸巾擦干。
3. 标定过程中,需要将PH计完全浸入标准缓冲溶液中,并且等待一段时间,直到PH计的读数稳定。
4. 标定过程中,需要记录下PH计的读数和标准缓冲溶液的PH值。
如果PH计的读数与标准缓冲溶液的PH值相差较大,需要重新标定。
5. 标定完成后,需要将PH计清洗干净,并且存放在干燥的地方。
正确的PH计标定可以保证实验结果的准确性和可靠性。
如果PH 计没有正确标定,可能会导致实验结果的误差,甚至会影响实验的结论。
因此,标定过程中需要认真细致,确保PH计的准确性和精度。
PH计标定是实验中非常重要的一步,需要认真对待。
只有正确标定PH计,才能保证实验结果的准确性和可靠性。


pH计的校准与使用2005级化学一班()xx一、实验目的1、掌握用玻璃电极测量溶液pH值的基本原理;2、了解pH计的整个实验操作过程。
二、实验原理1、pH计的原理示意图2、pH计的原理玻璃电极使用前,必须在水中浸泡,使之生成一个三层结构,即中间的干玻璃层和两边的水化硅胶层。
当球状玻璃膜的内外玻璃表面与水溶液接触时,Na2SiO3晶体骨架中的Na+与水中的H+发生交换:G-Na++H+====G-H++Na+因为平衡常数很大,因此,玻璃膜内外表层中的Na+的位置几乎全部被H+所占据,从而形成所谓的“水化层”。
E(电池)=E(SCE)+E(液接)+E(膜)+E(Ag/AgCl)=K+E(膜)=K-0.059pH3、pH电极的使用原理该实验用复合电极(一根电极)测定PH值,其优点是使用方便,不受氧化性或还原性物质的影响,且平衡速度较快。
使用时,将电极加液口上所套的橡胶套和下端的橡皮套全取下,以保持电极内氯化钾溶液的液压差。
其校准方法均采用两点校准法,即选择两种标准缓冲液:一种是pH≈7标准缓冲液,第二种是pH≈9标准缓冲液或pH≈4标准缓冲液。
先用pH≈7标准缓冲液对电计进行定位,再根据待测溶液的酸碱性选择第二种标准缓冲液。
如果待测溶液呈酸性,则选用pH≈4标准缓冲液;如果待测溶液呈碱性,则选用pH≈9标准缓冲液。
若是手动调节的pH计,应在两种标准缓冲液之间反复操作几次,直至不需再调节其零点和定位(斜率)旋钮,pH计即可准确显示两种标准缓冲液pH值。
则校准过程结束。
此后,在测量过程中零点和定位旋钮就不应再动。
若是智能式pH计,则不需反复调节,因为其内部已贮存几种标准缓冲液的pH值可供选择、而且可以自动识别并自动校准。
但要注意标准缓冲液选择及其配制的准确性。
其次,在校准前应特别注意待测溶液的温度。
以便正确选择标准缓冲液,并调节电计面板上的温度补偿旋钮,使其与待测溶液的温度一致。
不同的温度下,标准缓冲溶液的pH值是不一样的。

1.仪器在连续使用时,每天要标定一次。
在测量电极插座处拔去Q9短路插头;在测量电极插座处插上复合电极;如不用复合电极,则在测量电极插座处插上电极转换器的插头;玻璃电极插头插入转换器插座处;参比电极接入参比电极接口处。
2.电源接通后,按“pH/mV”按钮,使仪器进入pH测量状态,预热30min。
按“温度”按纽,使显示为溶液湿度值(此时温度指示灯亮),然后按“确认”键,仪器确定溶液温度后回到pH测量状态。
3.把用纯化水清洗过的电极插入pH=6.86(25℃)的标准缓冲溶液中,待读数稳定后按“定位”键(此时pH指示灯慢闪烁,表明仪器在定位标定状态)使读数为该溶液当时温度下的pH值;然后按“确认”键,仪器进入测量状态,pH指示灯停止闪烁。
4.把用纯化水清洗过的电极插入pH=4.01(25℃)(或pH=9. 18(25℃))的标准缓冲溶液中,待读数稳定后按“斜率”键(此时pH指示灯闪烁,表明仪器在斜率标定状态)使读数为该溶液当时温度下的pH值,然后按“确认”键,仪器进入pH测量状态,p H指示灯停止闪烁,标定完成。
5.重复5~6直至不用再调节定位或斜率两调节旋钮仪器显示数值与标准缓冲溶液pH值之差≤±0.02为止。

第五章 酸碱滴定法一、内容提要本章讨论了水溶液中的酸碱滴定,它是以水溶液中的质子转移反应为基础的滴定分析法,其理论基础是酸碱平衡理论。
根据质子理论,凡能给出质子(H +)的物质是酸;凡能接受质子(H +)的物质是碱。
HA === A - + H +酸 碱 质子在溶剂水中酸碱的离解、盐水解、酸碱中和反应等都是通过水合质子实现质子转移过程,是由两个共轭酸碱对相互作用而达到平衡,该平衡反应总是由较强酸碱向生成较弱酸碱的方向进行。
在酸碱滴定法中,常借助酸碱指示剂来指示终点。
当酸碱滴定至化学计量点前后,其pH 值急剧变化,从而产生滴定突跃。
凡是变色点的pH 值处于滴定突跃范围内的指示剂均可用来指示终点。
由化学计量点与滴定终点不符合所引起的误差称为滴定误差,其大小由被滴定溶液中剩余酸(或碱)或多加碱(或酸)滴定剂的量决定。
一元酸碱滴定的可行性判据是C ·K a (b )≥10-8,多元酸碱的分步滴定及混合酸碱分别滴定的判据是C ×K (a )b ≥10-8和 >104。
本章重点是酸碱指示剂及强酸(强碱)的滴定,酸碱滴定可行性判据。
本章难点是酸碱滴定曲线。
二、 习题(一)判断题( )1.pH 值小于7的溶液一定是酸。
( )2.在酸碱滴定法中,为保证化学计量点附近相差0.1%,有0.2pH 单位的变化是指示剂法进行准确滴定的最低要求,因此,通常以C·K a ≥10-8作为判断弱酸能否被准确滴定的界限。
( )3.在酸碱滴定法中,用强碱滴定强酸时,滴定突跃范围越小,则滴定误差越小,准确度越高。
21b b K K()4.对于多元酸,应首先看相邻两级K a的比值是否大于104,如果大于104,则能够准确地分步滴定。
()5.酸碱指示剂为有机弱酸或弱碱,且其酸式和碱式结构具有不同的颜色。
()6.用已知浓度的NaOH标准溶液,滴定相同浓度的不同种弱酸时,若弱酸的K a 愈大,则滴定突跃范围愈大。

E+H PH标定步骤e,h,ph计标定(篇一)PH标定步骤1、用标定液标定。
准备好两种标定液,分别PH=6.86和PH=4 的标定液(化验室可以配制)2、将电极和变送器连接好,用蒸馏水清洗电极后,把电极浸入PH=6.86 的标定液中,然后按CAL键,按+或者-找到Calibration,按CAL 键,会出现,用+或者-将此值修改为6.86后,按CAL键2次,此时屏幕会闪烁一段时间,直到显示值稳定,然后会自动进入,然后把电极取出,用蒸馏水清洗后放置在PH=4的标定液中一段时间,然后按CAL键2次,此时屏幕会闪烁一段时间,直到显示值稳定后会出现变送器计算出的标定斜率,按CAL键,出现计算零点值,按CAL键出现,按CAL键,出现,按CAL键保存标定结果,返回到测量画面。
标定完成。
注意:如果标准液的PH值与变送器的显示值相差过大,会出现标定错误E32,此时标定无法进行。
如果会这样,请:变送器是否有报警?接线是否正确电极是否有损坏电极不可长时间在空气中暴露,长时间暴露会引起电极老化,不用时用饱和KCL或者一般水来浸泡,不要用蒸馏水浸泡。
E H-PH表的标定步骤e,h,ph计标定(篇二)ENDRESS+HAUSER标定步骤:1. 按CAL 键,屏幕显示CODE,用“+”键输入密码222. 屏幕显示CALIBRATE,.按CAL 屏幕显示温度,继续按CAL,屏幕下方显示BUFFER1,上方显示PH值,值后面是个C12,将电极放入6.86缓冲液中,将PH值修改到6.86。
3. 按E键,PH值后面变成C13,再按E键,屏幕闪10秒,稳定后标定完成4. 按E键(自动)屏幕下方显示BUFFER2,上面显示4.00 后面是C14,将电极放入4.00 的缓冲液中5. 按E键,变成C15,再按E键,屏幕闪10秒,稳定后标定完成。
6. 按E键,屏幕出现SLOPE(斜率)显示7. 按E键,屏幕出现ZERO(零点)显示8. 按E键,屏幕出现STATUS(状态OK)显示9. 按E键,屏幕出现STORE(保存YES),按E键保存,10. 结束。

PH作业指导书一、任务背景在当前全球化的背景下,人们对健康和生活质量的关注日益增加。
作为一种重要的健康评估指标,pH值对于环境、食品、饮用水等方面的监测具有重要意义。
为了提高pH值测量的准确性和可靠性,本指导书旨在为PH作业提供详细的操作步骤和相关要求。
二、任务目的本任务旨在指导PH作业的执行,确保操作规范、数据准确,并保证结果可靠。
通过本指导书,操作人员将能够正确使用pH仪器,进行标定和测量操作,以获得准确的pH值结果。
三、操作步骤1. 准备工作a. 确保所有操作人员已经接受相关培训,并具备操作pH仪器的基本知识。
b. 检查pH仪器的状态,确保仪器处于正常工作状态。
c. 根据实际需要选择合适的pH电极,并确保其清洁和完好无损。
2. pH仪器标定a. 将pH电极插入标定溶液中,确保电极完全浸入液体中。
b. 根据标定溶液的pH值,调节pH仪器的标定参数,使其与标定溶液的pH值一致。
c. 重复以上步骤,至少标定两个不同pH值的标定溶液,以确保准确性。
3. pH值测量a. 将pH电极插入待测液体中,确保电极完全浸入液体中。
b. 等待一定时间,直到pH值稳定,并记录测量值。
c. 如需多次测量,应在每次测量前将电极清洗干净,并用纯净水冲洗干净。
4. 数据处理a. 将测得的pH值记录下来,并进行必要的数据整理和分析。
b. 如有需要,可以将数据进行统计和图表展示,以便更好地理解和解释结果。
四、注意事项1. 操作人员应穿戴适当的个人防护装备,如实验手套和护目镜。
2. 在进行标定和测量操作前,应确保待测液体的温度稳定。
3. 避免将pH电极暴露在强酸、强碱等腐蚀性物质中,以免损坏电极。
4. 定期对pH电极进行清洁和校准,以确保其准确性和可靠性。
5. 在进行pH测量时,应避免气泡附着在电极上,以免影响测量结果。
五、总结通过本指导书的操作步骤和注意事项,操作人员将能够正确、准确地进行pH作业。
标定和测量的准确性将得到保证,从而提高了pH值测量的可靠性。
纯化水pH的测定
纯化水的pH的测定
1.配制标准缓冲液:取1000ml蒸馏水煮沸,将水中的二氧化碳排净,然后按照配制标准
配制pH=4.01、pH=6.85(都是30℃下)的缓冲液。
2.pH计的标定:先用温度计将标准缓冲液的温度测定出来开机显示在mv状态,按pH/mv
键进入pH的测定状态,按温度键调节温度至标液温度,按确认键。
用蒸馏水将电极冲洗干净后,插入到pH=6.85的标液中待读数稳定后调节定位键使显示的值与标液的值一致。
用蒸馏水将电极冲洗干净,调节温度同上,将电极插入到pH=4.01标液中调节斜率键使显示的值与标液一致。
3.pH值得测量:用被测溶液将电极冲洗干净,调节温度与被测液的温度相同,将电极插
入到被测液中,记录测量的数值。
4.实验结果:
第一批水:6.53、6.63、6.68、6.69、6.67 平均值为6.64
第二批水:6.65、6.65、6.64、6.61、6.63 平均值为6.636
标准pH值为4.2-7.6之间,纯化水的酸碱度合格。
E+H PH标定步骤e,h,ph计标定(篇一)PH标定步骤1、用标定液标定。
准备好两种标定液,分别PH=6.86和PH=4 的标定液(化验室可以配制)2、将电极和变送器连接好,用蒸馏水清洗电极后,把电极浸入PH=6.86 的标定液中,然后按CAL键,按+或者-找到Calibration,按CAL 键,会出现,用+或者-将此值修改为6.86后,按CAL键2次,此时屏幕会闪烁一段时间,直到显示值稳定,然后会自动进入,然后把电极取出,用蒸馏水清洗后放置在PH=4的标定液中一段时间,然后按CAL键2次,此时屏幕会闪烁一段时间,直到显示值稳定后会出现变送器计算出的标定斜率,按CAL键,出现计算零点值,按CAL键出现,按CAL键,出现,按CAL键保存标定结果,返回到测量画面。
标定完成。
注意:如果标准液的PH值与变送器的显示值相差过大,会出现标定错误E32,此时标定无法进行。
如果会这样,请:变送器是否有报警?接线是否正确电极是否有损坏电极不可长时间在空气中暴露,长时间暴露会引起电极老化,不用时用饱和KCL或者一般水来浸泡,不要用蒸馏水浸泡。
E H-PH表的标定步骤e,h,ph计标定(篇二)ENDRESS+HAUSER标定步骤:1. 按CAL 键,屏幕显示CODE,用“+”键输入密码222. 屏幕显示CALIBRATE,.按CAL 屏幕显示温度,继续按CAL,屏幕下方显示BUFFER1,上方显示PH值,值后面是个C12,将电极放入6.86缓冲液中,将PH值修改到6.86。
3. 按E键,PH值后面变成C13,再按E键,屏幕闪10秒,稳定后标定完成4. 按E键(自动)屏幕下方显示BUFFER2,上面显示4.00 后面是C14,将电极放入4.00 的缓冲液中5. 按E键,变成C15,再按E键,屏幕闪10秒,稳定后标定完成。
6. 按E键,屏幕出现SLOPE(斜率)显示7. 按E键,屏幕出现ZERO(零点)显示8. 按E键,屏幕出现STATUS(状态OK)显示9. 按E键,屏幕出现STORE(保存YES),按E键保存,10. 结束。
FHZDZHS0048 海水 pH 值的测定 pH 计法 F-HZ-DZ-HS-0048海水— pH 值的测定—pH 计法1 范围本方法适用于大洋和近岸海水pH 值的测定。
2 原理将玻璃-甘汞电极对插入水样中,组成电池,则水样的pH 与该电池的电动势(E )有如下线性关系。
见公式(1):pH s =A+FRT E X/6302.2 (1)当玻璃-甘汞电极对插入标准缓冲溶液时则得:A= pH s —FRT E s/6302.2 (2)在同一温度下,分别测定同一电极对在标准缓冲溶液和水样中的电动势,则水样的pH 值为:p H x = p H s +FRT E E sx /6302.2⋅ (3)式中:p H x —水样的pH 值; p H s —标准缓冲溶液的pH 值;E x —玻璃-甘汞电极对插入水样的电动势;E s —玻璃-甘汞电极对插入标准缓冲溶液中的电动势; R —气体常数;F —法拉第常数; T —绝对温度K 。
水的色度、浑浊度、胶体微粒、游离氯、氧化剂、还原剂以及较高的含盐量等干扰都较小,当pH 大于9.5时,大量的钠离子会引起很大误差,读数偏低。
3 试剂除非另作说明,所用试剂均为分析纯,水为去离子水或等效纯水。
3.1 饱和氯化钾溶液:称取40g 氯化钾(KCl),加100mL 水,充分搅拌后盛于试剂瓶中(此溶液应与氯化钾固体共存)。
3.2 氯化汞溶液,25g/L:称取2.5g氯化汞(HgCl2),溶于水并稀释至100mL,搅匀,盛于棕色试剂瓶中。
注意:氯化汞剧毒,小心操作。
3.3 标准缓冲溶液(均用pH标准缓冲物质配制)。
3.3.1 苯二甲酸氢钾标准缓冲溶液,C(KHC8H4O4)=0.05mol/L(25℃时,pHs=4.003)苯二甲酸氢钾的pH标准缓冲物质,有小塑料袋装和瓶装两种,配制方法如下:3.3.1.1 袋装配制法:根据袋中标准缓冲物质量,选择容量瓶的大小,并按袋上说明配制成所需的浓度,最后保存于聚乙烯瓶中。
PH计的分类人们依照生产与生活的需要,科学地研究生产了许多型号的计:按测量精度可分级、级、级或更高精度。
按仪器体积分有笔式(迷你型)、便携式、台式还有在线持续监控测量的在线式。
依照利用的要求笔式(迷你型)与便携式PH酸碱度计一样是检测人员带到现场检测利用。
选择PH酸碱度计的精度级别是依照用户测量所需的精度决定,而后依照用户方便利用而选择各式形状的PH计。
PH计原理与测量方式什么是PH?PH是拉丁文“Pondus hydrogenii”一词的缩写(Pondus=压强、压力hydrogenium=氢),用来量度物质中氢离子的活性。
这一活性直接关系到水溶液的酸性、中性和碱性。
水在化学上是中性的,但不是没有离子,即便化学纯水也有微量被离解:严格地讲,只有在与水分子水合作用以前,氢核不是以自由态存在。
H2O+ H2O=H3O+ + OHˉ显示操纵仪由于水合氢离子(H3O)的浓度是与氢离子(H)浓度等同看待,上式能够简化成下述经常使用的形式:H2O=H+ + OHˉ此处正的氢离子人们在化学中表示为“H+离子”或“氢核”。
水合氢核表示为“水合氢离子”。
负的氢氧根离子称为“氢氧化物离子”。
利用质量作用定律,关于纯水的离解能够找到一平稳常数加以表示:K = H3O+·OH- ——————H2O由于水只有极少量被离解,因此水的克分子浓度实际为一常数,而且有平稳常数K可求出水的离子积KW。
KW=K×H2O KW= H3O+·OH-=10-7·10-7=10-14mol/l(25℃)也确实是说关于一升纯水在25℃时存在10-7摩尔H3O+离子和10-7摩尔OHˉ离子。
在中性溶液中,氢离子H+和氢氧根离子OHˉ的浓度都是10-7mol/l。
如:假设有过量的氢离子H+,那么溶液呈酸性。
酸是能使水溶液中的氢离子H+游离的物质。
一样,若是氢离子H+并使OHˉ离子游离,那末溶液确实是碱性的。
第五章pH值的标定与测量
5.1两点标液自动标定
1、将p H电极与酸度计联接。
2、选择包括预期试样范围的pH4.00和pH6.86、pH6.86和p H9.18缓冲液。
3、按上下键改变温度,使显示温度与溶液的温度一致。
4、按“标定”键以开始标定过程。
使用“▲,▼”键选择标定范围,按“确定”键接受标定范围(p H7-4或
pH7-9),6.86pH信号灯亮。
用去离子水冲洗电极并将电极放入pH6.86缓冲液。
等待几分钟,待m V数稳定后,按“确定”键接受缓冲液数值。
5、4.00pH或9.18p H信号灯亮,将电极从pH6.86缓冲液中取出,用去离子水冲洗,并将电极放入
pH4.00或p H9.18的缓冲液(根据选定的标定范围确定)中。
等待几分钟,待m V数稳定后,按“确定”
键接受缓冲液数值。
标定结束后自动退回测量状态!
注意:哪个指示灯亮,就把pH电极放入该种溶液中。
如:6.86灯亮,pH电极就放入 6.86pH的标液中。
5.2一点标液自动标定
注意:单缓冲液自动标定只可使用p H6.86缓冲液进行。
1.将pH电极与p H计联接。
2.选择p H6.86缓冲液。
3.按上下键改变温度,使温度与溶液的温度一致。
4.按“标定”键以开始标定过程,使用“▲,▼”键选择标定方式。
当显示7时,按“确定”键接受选择,6.86pH
信号灯亮。
用去离子水冲洗电极并将电极放入pH6.86缓冲液。
等待几分钟,待m V数稳定后,按“确定”
键接受缓冲液数值。
标定结束后自动退回测量状态!
三种标液的理想mV数(25℃)为:
4.00pH——+177.5m V; 6.86p H——+8.3m V;9.18p H——-129.0m V
第六章其它测量方式
6.1 温度补偿
人工温度补偿
6.2 附加设置参数
1、按E O/S键,S et up指示灯将点亮。
2、零点值将同时显示在主屏幕上。
零点取决于在输入设置方式前的有效测量方式。
初始值为0.0
(一位小数)。
3、继续按E O/S键。
4、斜率值将同时显示在主屏幕上。
斜率取决于在输入设置方式前的有效测量方式。
初始值为59.16
(两位小数)
5、当查看了所有的参数之后,按p H/m V/℃键返回到测量方式。
6、按E O/S键循环显示斜率和零点。
第七章辅助操作代码
辅助操作代码用于通知用户界外数值或测试仪故障,下面列表归纳了辅助操作代码。
辅助操作代码E—21、E-20提醒用户注意在测量或标定过程中的潜在问题,可采取几个步骤来消除每种情况下的问题。
代码说明原因/建议
1.如果发生在电极不在溶液中的时侯代码将在电极重新浸入水溶液时消失。
仪表没有接p H电极。
2.试样可能越界,用缓
冲液检查系统。
3.用新缓冲液重新标定系统。
4.关于如何检查电极,请参考电极说明手册。
与缓冲液的平均标值比,测得的电极电压的误差>±0.5个单位。
1.核实缓冲液为p H4.00/ 6.86/9.18。
2.用新缓冲液重新标定。
3.关于如何清晰电极,请参考pH电极说明手册。
第八章故障排除指南
功能失灵可能的原因解决办法
检查测试仪是否连接。
检查正确的电源变换器是否牢固地插入。
遵循测试仪或电极手册中的故障检查步骤。
遵照说明手册检查电极的操作,确认电极正确地联接到测试仪上。
第九章仪器的模拟校验
当仪器在测量时出现问题,造成测量值不稳定或不正确时。
用户可以对二次表进行模拟测试,以便判断是电极还是二次表的问题。
p H值与m V数的校验
参数设置:先将仪表断电,按住“E O/S”键不放,再上电显示“P H2”(pHS-2C)或“25”(pHS-25)时,可使仪器的斜率和零点成理论值:S=59.16,E O=0;但断电后,又恢复成以前标定过的斜率和零点。
除非上电时仍按住“E O/S”键。
水质:普通水(P75)、温度:25.0℃。
注意:建议在模拟校验是把各个参数设置好后不要断电!当发现在模拟校验或检定仪表不正确时,查看E0 、S、水质(E0=0,S=59.16;水质:普通水P75)是否设置正确,否则无法检定!
1、测试输入mV数与pH值的对应关系:pH电极插孔接电位差计。
检测输入的mV数
与pH显示值是否符合表一的对应关系(误差:pHS-2C:<±0.02pH pHS-25:<±0.05pH)。
通
过上面的测
试,如果结果
符合上表,则
可以判断不
是二次表而
是电极的问题。
若有什么疑问需要帮助请与我们联系!
mV数的修正方法:输入7.00pH(即0.0mV),按“pH/m V/℃”键,显示mV值,记录下显示的m V数值,然后同时按住“E0/S”键和“确定”键进入调试菜单,显示HL1时,输入mV数偏差值,再按“确定”键存储。
再按“pH/m V/℃”键返回测量状态,若显示的m V数为0.0m V,则设置正确,否则重新进入调试菜单设置。
名称参数值
pH -2.00-18.00
分辨率0.01p H
准确度:pHS-2C:±0.02pH;pHS-25:±0.05 pH
m V±1999m V
分辨率0.1m V
准确度 ±1m V
手动温度0-99.9℃
分辨率0.1℃
输入阻抗≥1012Ω通讯接口RS232。