氧族元素通性
- 格式:doc
- 大小:1.11 MB
- 文档页数:8






氧族元素通性王振山氧族元素指周期系第ⅥA族元素,它包括氧(O)、硫(S)、硒(Se)、碲(Te)、钋(Po)五个元素。
除O之外的S,Se,Te,Po又称硫族元素。
其中氧是地壳中含量最多的元素,约占总质量的48.6%;硫在地壳中的含量只有0.052%,居元素丰度第16位,但在自然界的分布很广。
氧元素在地球上的丰度最高,达58%(以mol计),16O(993759%),17O(0.037%),18O(0.204%);14O,15O,19O为人工合成的同位素,t1/2为数十秒。
元素在地壳中的存在形式比较复杂,只有少数能以单质存在,例如,氧和硫在自然界大量以游离态单质状态存在,其余均为化合物。
化合物主要有氧化物和硫化物两大类。
地质学上称前者为亲石元素,后者为亲硫元素。
硒、碲则有稀有元素,单质为准金属,通常以硒化物,碲化物存在硫化矿床中;钋则是典型金属元素,是一种放身性元素,存在于含铀和钍的矿床中。
(S有四种同位素: 32, 33, 34, 35)氧族元素通性氧族元素(ⅥA族):O、S、Se、Te、Po,非金属、准金属、金属。
氧族元素的一些基本性质表性质氧硫硒碲价层电子构型2s22p43s23p44s24p45s25p4原子半径/pm 66 104 117 137M2-离子半径/pm 140 184 198 221熔点/℃-218.6 112.8 221 450沸点/℃-183.0 444.6 685 1009电负性χ 3.5 2.5 2.4 2.1第一电离能I1/kJ·mol-11314 999.6 940.9 869.3主要氧化值-2 -2,+2,+4,+6 -2,+2,+4,+6 -2,+2,+4,+6 从表可以看出,氧族元素的性质变化趋势与卤素相似。
氧族元素的金属性、原子半径、离子半径、熔点、沸点随原子序数增加而增大;电负性、电离能随原子序数增加而减小。
氧族元素原子的价层电子构型均为ns2np4,有获得2个电子达到稀有气体稳定结构的趋势。


氧族元素通性 王振山氧族元素指周期系第ⅥA 族元素,它包括氧(O )、硫(S )、硒(Se )、碲(Te )、钋(Po)五个元素。
除O 之外的S ,Se ,Te ,Po 又称硫族元素。
其中氧是地壳中含量最多的元素,约占总质量的48.6%;硫在地壳中的含量只有0.052%,居元素丰度第16位,但在自然界的分布很广。
氧元素在地球上的丰度最高,达58%(以mol 计),16O(993759%),17O(0.037%),18O(0.204%);14O ,15O ,19O 为人工合成的同位素,t 1/2为数十秒。
元素在地壳中的存在形式比较复杂,只有少数能以单质存在,例如,氧和硫在自然界大量以游离态单质状态存在,其余均为化合物。
化合物主要有氧化物和硫化物两大类。
地质学上称前者为亲石元素,后者为亲硫元素。
硒、碲则有稀有元素,单质为准金属,通常以硒化物,碲化物存在硫化矿床中;钋则是典型金属元素,是一种放身性元素,存在于含铀和钍的矿床中。
(S 有四种同位素: 32, 33, 34, 35)氧族元素通性氧族元素(ⅥA 族):O 、S 、Se 、Te 、Po ,非金属、准金属、金属。
氧族元素的一些基本性质表从表可以看出,氧族元素的性质变化趋势与卤素相似。
氧族元素的金属性、原子半径、离子半径、熔点、沸点随原子序数增加而增大;电负性、电离能随原子序数增加而减小。
氧族元素原子的价层电子构型均为ns 2np 4,有获得2个电子达到稀有气体稳定结构的趋势。
当氧族元素原子和其他元素化合时,如果电负性相差很大,则可以有电子的转移。
例如,氧可以和大多数金属元素形成二元离子化合物,硫、硒、碲只能和低价态的金属形成离子型的化合物。
当氧族元素和高价态的金属或非金属化合时,所生成的化合物主要为共价化合物。
氧和硫的性质相似,都活泼。
氧能与许多元素直接化合,生成氧化物,硫也能与氢、卤素及几乎所有的金属起作用,生成相应的卤化物和硫化物。
不仅氧和硫的单质的化学性质相似,它们的对应化合物的性质也有很多相似之处。
一、氧族元素1、原子结构和元素的性质 ⑴、原子结构*原子结构三要素:原子的电子层结构,原子半径,有效核电荷数。
⑵、元素的性质 ①、元素性质的递变②、硫分族(硫、硒、碲)*元素的金属性与非金属性的含义(孤立的原子在化学反应中的性能)。
例如,元素的非金属性强弱,是指元素的原子得电子能力的强弱。
*原子结构、元素在周期表中的位置、元素的性质,三者之间的关系。
③、氧族元素的非金属活泼性弱于卤素氧族元素的原子获得两个电子形成简单阴离子X 2-的倾向,比卤素原子形成X -的倾向要小得多。
例如,S 元素的非金属性[*氧元素的电负性(Pauling)=3.44,仅次于氟(3.98);氯(3.16),硫(2.58)。
] 2、成键特征:⑴、本族元素价电子层结构为:ns 2np 4nd 0如SF 6,均有获得2个电子的趋势,故常见氧化数为-2。
大多数金属氧化物是离子型的,含有O 2-离子,而S ,Se ,Te 形成的化合物离子性超过50%的为数则很少,因此在这些元素形成的化合物中,多为共价化合物。
⑵、氧的成键特点: ①、O原子a 、离子键O2-如:Na 2O(与电负性较小的元素),b 、共价键(与其电负性相近的元素),c 、OO <F S <Cl<原子电负性大、半径小,生成双键(CO 2),d 、O 原子可以与其它原子以三重键结合(CO ,NO), e 、可以作为配位原子形成配合物。
f 、O 原子可以把两个自旋相反的单电子归并,空出一个2P 轨道接受外来配位电子而成键;另外氧的孤电子对反馈到中心原子空的d 轨道形成d-p 反馈∏键(PO 43-,SO 42-) ②、O 2分子a 、O 22-,—O —O —过氧化物,Na 2O 2,K 2O 2)b 、O 2-(超氧化物,KO 2)c 、O 2+,生成二氧基阳离子化合物,2O 2+F 2+2AsF 5=2O 2+[AsF 6]-,O 2+Pt+3F 2=O 2+[PtF 6]-ee 思考:O 2+,O 2,O 2-,O 22-的分子轨道表示式及键级③、O 3分子 离子键O 3-,KO 3臭氧化钾。
⑶、单线态氧及性质:S=1:2S+1=3;S=0:S+1=1。
S 自旋量子数的合量通常所说的单线态氧就是指1△g(1O 2),单线态氧的生成可以通过光敏化法,微波放电法,化学方法。
敏化剂(基态)→敏化剂T 1(激发态),敏化剂T 1+3O 2 能量传递敏化剂+1O 2A(有机作用物) +1O 2→AO 2(产物)在化学方法中最常用的是H 2O 2-ClO -法:H 2O 2+ClO -→1O 2+H 2O+Cl - 单线态氧在有机体的代谢中会不断的生成与猝灭,并且在多种生理及病理生理过程中起作用。
(好坏两方面)⑷、与卤族元素相比:本族元素:价电子排布式n s 2n p 4,比ⅦA 元素相应的原子在p 轨道上少一个电子。
因此,本族元素的原子获得两个电子形成X 2-的倾向较卤素原子形成X -的倾向小得多,因为氧族元素的原子结合第二个电子是需要吸收能量的(E A2为正值)。
本族除O 之外,S ,Se ,Te 形成化合物时,还可有+2,+4,+6等氧化数,氧则仅与F 这种电负性最大的元素形成化合物时有+2氧化数(OF 2),其原因是O 的电负性大,且价电子层为n=2,只能容纳8个电子,要将电子拆单成键,使氧化数高于+2,就需将电子激发到较高能层,这就需要过高的能量,而硫族元素则电负性相对较小,又有价层d 轨道的利用,它们可以拆开成对电子而生成4个或6个价键。
〔S→Te :+2,+4,+6。
(S→Te 正氧化态化合物稳定性逐渐增加)〕成键特点:①、O 、S以-2价形式形成离子型化合物。
②、同过渡元素,非金属元素化合成共价化合物。
③、O有-2(H 2O )、-1(H 2O 2)、+2(OF 2) ⑷、形成共价单键的成键方式:电子构型四面体,分子角型;+2氧化数,如SCl 2、SF 2、TeCl 2、TeBr 2。
对共价型氧化物则为-2氧化数,如:H 2O 、Cl 2O 、H 2S 。
sp杂化态E nsnpnd 基态孤对电子通常占据赤道平面上的一个位置;电子构型三角双锥,分子构型畸变的四面体,形成+4氧化数,如TeF 4、TeCl 4、TeBr 4、TeI 4、SeF 4。
E nsnpnd激发态1杂化态1d电子构型八面体,分子构型亦为八面体,+6氧化数,如SF 6。
E nsnpnd激发态2 杂化态2sp 3d 2与卤素含氧酸一样,在S ,Se ,Te 的含氧酸及其盐中,中心原子采取SP 3杂化,形成d-pπ配键,但其中碲酸H 6TeO 6则与碘酸类似,中心原子也取sp 3d 2杂化,为正八面体结构。
3、重要性质递变规律〔r ,Ⅰ,Ⅹ:变化规律与ⅦA 相同;电子亲合势:A 12 A 1(-)A 2(+)〕 ⑴、原子共价半径,离子半径(-2,+6),单质的熔沸点从O-Te 递增,非极性分子色散力随分子量递增(S ,Se ,Te 为多原子分子)。
⑵、I 1、E A1、E A2、χ(电负性)从O-Te 递减,但O 的E A1与F 在卤素中类似,出现反常。
⑶、S→Te :+2,+4,+6。
(S→Te 正氧化态化合物稳定性逐渐增加)⑷、单质的键离解能书中指单键,O-O 键反常地小,与其r 特别小有关(因分子组成原子数不同,不作比较)。
⑸、单质的氧化性:φ:O 2/H 2O ,1.23;S/H 2S ,0.14;Se/H 2Se ,-0.99;Te/H 2Te ,-0.69; φ/V :O 2/OH -,0.401;S/S 2-,-0.476;Se/Se 2-,0.78;Te/Te 2-,-0.92。
可见从O 2-Te 呈降低趋势⑹、从O 2-Po ,非金属性──金属性 4、与卤族元素通性的比较⑴、同族从上──下,元素性质变化规律类似。
⑵、族间比较同周期氧族元素与卤素相比,电子层数不变,但从左──右有效核电数Z *e 增加,r 减小,得电子趋势增大,因此同周期的氧族元素的I 1,E A1均较卤族元素小,(单质)氧化力减弱,非金属性减弱。
从同族性质变化来看,虽然两族都是从上──下,非金属性减弱,但氧族的化性递变更明显:O 2为典型非金属,而Po 为金属。
⑶、在同族元素中,O 与F 具有类似性,即均是n=2,次外层(内层)只有2个电子,价层无d 轨道,半径特别小,故与本族其它元素相比,出现一些异常,如E A1反常,氧化力特别强,等等。
⑷、氧与硫的相似性小,而与卤素在性质上有颇多相似,如形成的金属化合物大多为离子型化合物等。
⑸、本族所有元素都存在不止一种的同素异形体,而卤素则无此特点。
二、单质⑴、氧与硫单质的结构氧与硫单质熔沸点相差很大,这是由于氧原子半径小而引起成键方式不同的缘故。
氧和硫原子的价层都有2个单电子,都可形成2个键,所以它们单质有两种键合方式:一种是两个原子之间以双键相连而形成双原子的小分子;另一种是多个原子之间以单键相连形成多原子的“大分子”。
氧单质是以小分子O 2,硫单质是以“大分子”S 8形式存在的,它们单质的分子结构分别为:O2分子结构式中表示由3个电子构成的π键,称为3电子π键。
简式表明O2分子中存在叁键,即一个σ键和两个3电子π键。
每个3电子π键中有1个未成对电子,2个π键则有2个未成对电子,并且自旋平行,致使O2表现出顺磁性。
⑵、同素异形体:①、氧单质:O2和O3;臭氧分子的构型为V型,如图所示:中心氧原子以2个sp2杂化轨道与另外两个氧原子形成σ键,第三个sp2杂化轨道被孤对电子所占有。
此外,中心氧原子的未参与杂化的p轨道上有一对孤对电子,两端的氧原子与其平行的p轨道上各有一个电子,它们之间形成垂直于分子平面的三中心四电子大π键,用∏43表示。
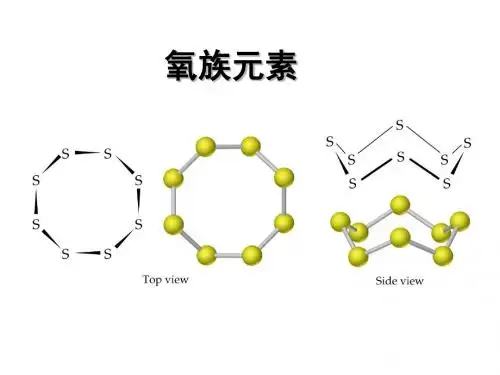
②、硫单质:单质硫有近50种同素异形体。
最常见的是斜方硫(菱形硫,又叫α-硫;确切地应称为“正交硫”—具有正交面心晶胞)和单斜硫(又叫β-硫)以及弹性硫等。
单斜硫和斜方硫的分子都是S8,它们只是晶体中分子排列不同而已。
室温下所有的晶体硫都是由S n环组成的,n可以从6到20。
室温下唯一稳定存在的形式是正交硫。
它们都易溶于CS2中,都是由S8分子组成的(在环状分子中,每个硫原子以SP3杂化轨道与另外两个硫原子形成共价单键相联结)。
对S6、S8、S12、S x等分子形成的晶体结构分析表明,分子中每个S 原子均与2个S原子成键,S-S键长206pm,∠SSS约为105°弹性硫为S8环断开后,相互聚合成长链的大分子,这些长链相互绞结,因而使其具有弹性。
③、硒单质:有三种红色单斜多晶态(无定形)物质(α、β、γ),是由Se8环组成,彼此的差别仅在分子间环的堆积不同,属于不良导体。