医学继续教育慢性肝病的营养支持疗法
- 格式:docx
- 大小:30.98 KB
- 文档页数:13

2019年ESPEN肝病营养指南解读(全文)2019年欧洲临床营养和代谢学会(the European Society for Clinical Nutrition and Metabolism,ESPEN)继1997年[1]、2006[2]年和2009年[3]之后,又一次更新了肝病临床营养指南。
十余年间大量基础和临床研究为指南更新提供了证据,需要通过专家团队进行汇总分析,最终转化为指导意见。
中华医学会2019年同时发布了《终末期肝病营养指南》,而2018年欧洲肝脏研究学会(European Association for the Study of the Liver,EASL)首次发布了《慢性肝病营养临床实践指南》,肝病患者营养管理得到空前的重视。
一、指南修订的历程和意义此次指南更新历时2年余,分为总论、急性肝衰竭(acute liver failure,ALF)、酒精性脂肪性肝病(alcoholic steatohepatitis,ASH)、非酒精性脂肪性肝病(non-alcoholic steatohepatitis,NASH)、肝硬化、移植与外科和营养相关肝损伤(nutrition associated liver injury,NALI)七个部分。
2016年11月24日在斯洛文尼亚首都卢布尔雅那召开第1次会议,形成106条推荐意见和声明,并对证据进行分级。
2017年经过数轮网络投票筛选,2018年对部分证据进行更新和补充,最终提出了85条推荐意见和17条声明。
该版指南把肠内和肠外营养综合起来进行意见推荐,不再单独阐述,提高了指南推荐意见的可操作性和便捷性。
此外,首次对NASH、肝硬化合并骨病、肝硬化合并肥胖、肝硬化合并肌少症和NALI等方面提出指导意见,而且对ALF、ASH、移植和外科等相关内容进行了更新和补充,更凸显了指南的延续性和整体性。
二、营养风险评估的实施指南推荐意见46和47首次建议成立包括医师、营养师、护士和药剂师在内的多学科团队共同实施营养管理,从而规范和提高营养管理质量,改善长期预后。

终末期肝病营养支持治疗作者:李华琳来源:《健康科学》2018年第14期摘要:终末期肝病患者几乎均存在不同程度的营养不良和代谢障碍,营养不良被认为是决定终末期肝病患者预后的一项非常重要且独立的影响因素,其严重程度直接关系到患者的短期生存率。
适当的营养支持治疗可以改善终末期肝病患者的预后,提高患者生活质量,延长生存期。
在进行营养支持时,应结合患者的具体情况与耐受能力,选择合适的营养物质与营养途径。
关键词:终末期肝病;营养不良;营养支持临床上常见的慢性肝衰竭(CLF)定义为在肝硬化基础上,肝功能进行性减退导致的凝血功能障碍、门静脉高压和肝性脑病等为主要表现的慢性肝功能失代偿终末期肝病通常累及广泛肝实质细胞,造成肝脏代谢功能不能满足机体的需要,最终导致肝功能衰竭。
1、终末期肝病营养代谢状况近年来,关于终末期肝病的治疗,在积极护肝的基础上,营养支持治疗日益受到重视。
临床上,终末期肝病患者几乎均存在不同程度的营养不良和代谢障碍。
有研究表明80%的肝硬化患者普遍存在营养不良。
也有国外学者报道,65%~90%住院肝硬化患者存在不同程度的营养不良,即使Child-Pugh分级为A级的患者,营养不良的发生率仍高达25%。
因此,营养不良被认为是决定终末期肝病患者预后的一项非常重要且独立的影响因素。
尽管营养不良不包括在分级及评分中,但它的存在应同其他常见并发症,如肝性脑病等一样引起临床医师的重视在最原始的分级中,营养状况评价是评判外科血管分流术后患者生存率的5个变量之一,并作为评估终末期肝病的预后标准之一,一直沿用至1973年,而在修改后的Child-Pugh分级中,营养状况才被凝血酶原时间替换。
说明营养状况在既往终末期肝病中的重要地位,而现在未引起足够的重视和关注。
因此,积极的营养支持治疗可以明显改善终末期肝病患者的预后,提高患者生活质量,延长其生存期。
2、终末期肝病营养支持的方式及营养摄入量目前对于终末期肝病患者主要的营养治疗方法已达成如下共识:(1)首先需对患者进行全面的营养状况评估,识别其代谢状态,设计个体化的营养支持治疗方案;(2)少食多餐(4~6餐/d,至少含1次富含碳水化合物的夜宵),尤其强调早餐和夜宵;(3)中、重度营养不良患者营养摄取以口服为主,并通过补充多种维生素如脂溶性维生素及微量元素如钙锌镁等,纠正患者的食欲障碍及提高患者的免疫力,必要时需要肠内营养如鼻饲或行肠外营养补充能量;(4)对于因肝性脑病有认知功能损害的患者,给予富含支链氨基酸的营养有助于提高患者的认知功能;(5)当有低钠血症(3、三大营养物质的支持治疗三大营养素对于机体正常功能的维持至关重要,关于终末期肝病患者蛋白质、碳水化合物及脂肪的补充方面,既往指南及相关文献已有详细介绍。




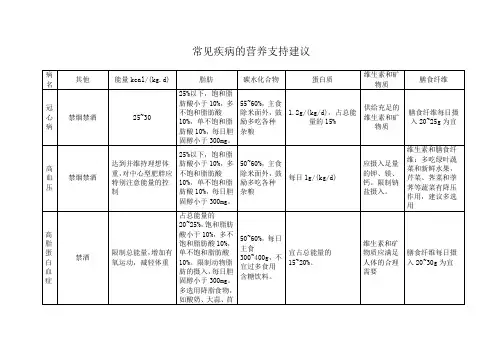



我说一下脂肪肝吧:脂肪肝本身不是一种疾病,而是多种因素或疾病所造成的一种病理现象,如营养过剩或肥胖、酗酒、、糖尿病、高脂血症、药物作用、营养障碍、脂肪摄入过多等,都可能导致脂肪肝。
脂肪肝是一种可逆性病变,只要应对得当,脂肪肝会得到良好的控制甚至会消失。
脂肪肝患者应注意控制热能摄入。
对正常体重者、从事轻度活动者或肝炎恢复期患者,按照每天30 kcal/kg 供能。
对于肥胖或超重者,每天供给20~25 kcal 热量有利于体重控制和肝功能恢复。
碳水化合物可刺激肝脏大量合成脂肪酸,是造成肥胖和脂肪肝的重要因素。
因此,相对于降低脂肪来说,控制碳水化合物的摄入,更有利于减轻体重和治疗脂肪肝,特别要禁食含糖量高的食物,适当补充蔬菜、低糖水果等。
脂肪肝患者应适当地提高蛋白质摄入量。
含充足蛋白质的膳食可以避免体内蛋白质流失,有利于肝细胞的修复与再生,并可纠正低蛋白血症和防止肝细胞进一步受损。
蛋白质有较高的食物特殊动力作用,可刺激新陈代谢。
适当提高饮食中蛋白含量,有利于减轻体重。
一般推荐蛋白质每天供给量为 1.5~1.8 g/kg 。
膳食中蛋、奶、肉类、豆类及其制品皆可提供充足蛋白质。
如果患者的肝功能异常,应以豆类及豆制品为主要蛋白来源,限制肉类食品的摄入。
脂肪肝患者应适量控制脂肪和胆固醇摄入。
脂肪摄入过量,热能难以控制,对减轻体重不利。
但脂肪中的必需脂肪酸参与磷脂的合成,能使脂肪从肝内运出,对预防脂肪肝有利。
因此给予适量脂肪,一般推荐每天40~50 g 左右。
植物油不含胆固醇,对治疗脂肪肝有益。
对一些高胆固醇食物,如动物的内脏、油脂和皮,以及鱼子、蛋黄等应严格限制。
最后,脂肪肝患者还应注意补充维生素、矿物质和膳食纤维,有利于代谢废物的排出和体重控制。
肝病患者的营养支持肝脏是人体最大的代谢器官,它广泛参与体内复杂的生化过程,包括碳水化合物、脂肪和蛋白质等的代谢、维生素的储存和激活、解毒和产生代谢废物等。
肝脏患病时将出现复杂的营养素代谢改变,尤其在终末期肝病(end stage liver disease, ESLD) 或肝功能衰竭的患者体内,肝脏功能严重受损极大地影响了机体物质和能量代谢,因而普遍导致较严重的营养不良。

慢性乙肝的病理与系统营养支持我国是一个“肝炎大国”,其中乙型肝炎患者达亿。
如果控制不好,慢性乙肝可演变成肝硬化和肝癌。
我国每年有10万余人死于原发性肝癌,因肝硬化而死亡的人则更多,严重威胁人们的健康。
但是,目前治疗乙型病毒性肝炎尚无特效药物,这是一个世界性的难题。
近几年来,医学研究表明:合理的营养治疗可以阻止乙肝病情向肝硬化和肝癌转变,对慢性乙型病毒性肝炎患者,营养支持治疗是控制肝炎的重要措施。
慢性肝炎营养支持治疗是一项技术含量很高的营养技术。
我综合所学到的有关知识,从以下四个方面介绍乙肝的病理及营养调理方法。
一、乙型病毒性肝炎发病机理乙型肝炎病毒简称HBV,其发病机理是:HBV感染肝细胞并在其中复制。
一般认为,HBV并不直接引起肝细胞病变,但HBV基因整合于宿主的肝细胞染色体中,可能产生远期后果。
乙型肝炎的肝细胞损伤主要通过机体一系列免疫应答所造成,其中以细胞免疫为主。
表达在肝细胞膜上的HBV核心抗原(HBcAg)和肝特异性脂蛋白是主要的靶抗原,致敏T淋巴细胞毒效应是肝细胞损伤的主要机制。
而抗体依赖的细胞毒作用及淋巴因子、单核因子等的综合效应也十分重要,尤其是慢性活动型肝炎的病理损伤机制中。
特异性抗体与循环中的相应抗原及变动颗粒结合成免疫复合物,并经吞噬细胞吞噬清除。
受染肝细胞被破坏以及HBV被保护性抗体(抗HB6,尤其是抗前S2)所清除可导致感染终止。
而慢性迁延型肝炎、慢性活动型肝炎是机体免疫功能(主要是清除功能)低下,病毒未得到彻底清除,肝细胞不断受到轻度损害所致。
慢性活动型肝炎的患者机体由于特异性免疫功能低下,不能充分清除循环中以及受染肝细胞内的不断,病毒持续在肝细胞内复制,使肝细胞不断受到免疫损伤。
且由于抑制性T细胞的数量或功能不足,以及肝细胞代谢失常所致肝内形成的免疫调节分子发生质与量改变,导致免疫调节功能紊乱,自身抗体产生增多,通过抗体依赖细胞毒效应或抗体介导,补体依赖的细胞溶解作用造成自身免疫性肝损伤,或大量抗原—抗体复合物的形成,导致肝细胞和其他器官更严重持久的损害。
肝脏疾病病人的营养支持费旭峰单位:上海第二医科大学附属瑞金医院临床营养科一、三大营养素对肝脏再生的影响严重肝衰竭病人的预后主要取决于机体残余肝细胞的再生能力。
已有不少研究报道强调营养物质代谢与肝脏再生之间的密切关联,说明机体的营养状况对肝脏修复可产生相当大的影响。
(一)糖类最初,糖类,主要是葡萄糖,被推荐作为肝细胞损伤、坏死和肝脏大部切除术后病人的主要能源。
然而,由于急性肝损、肝硬化、肝脏切除术后机体对葡萄糖的耐受性下降,所以将葡萄糖作为肝脏受损时机体的主要能量底物并不适宜。
不少学者通过动物实验证实葡萄糖对肝脏再生有抑制效应。
然而,Birkhahn等在输注葡萄糖同时给予氨基酸溶液或脂肪,未观察到在单独供应葡萄糖时产生的对肝脏再生的抑制效应,提示葡萄糖的抑制作用可通过同时提供其他营养底物加以削弱。
(二)脂肪脂肪是再生肝脏的优势能源,不应在饮食中加以限制。
有些肝病病人表现出对脂肪的严重消化不良和吸收不良,即脂肪泻,但若经静脉途径补充,机体可很好地耐受脂肪,且益于肝脏再生和修复。
(三)氨基酸再生肝脏对氨基酸的需求明显增加。
然而,单独给予标准配方的氨基酸溶液,而不同时输注葡萄糖溶液和/或脂肪乳剂,对肝脏再生也会产生抑制作用。
学术界就个别氨基酸在肝脏修复中的作用尚存不同意见。
有些氨基酸,如芳香族氨基酸(酪氨酸和苯丙氨酸),对肝脏再生的意义不大,也许并不必需。
而在肝脏修复期的最初几天内,机体对牛磺酸、苏氨酸和支链氨基酸的需求和利用增加;缬氨酸可增强肝脏再生,改善90%肝切除手术引起的肝衰竭大鼠的生存率;谷氨酰胺是核苷酸合成过程中的重要底物,所以对肝脏再生也会产生正面影响。
毫无疑问,充足的营养可以加速肝脏再生和机体恢复。
在临床实施时,应注意:①当必须输注葡萄糖溶液以纠正低血糖时,应同时给予脂肪乳剂和/或氨基酸溶液;②在大多数类型的肝脏损伤时均可选用肠外途径补充脂肪,仅对存在脂肪泻的病人方限制饮食中脂肪摄入量;③适当增加支链氨基酸供给量是合理的;④不能简单地将动物实验的结论直接应用于人体。
第五讲慢性肝病的营养支持疗法肝脏是人体最重要的代谢器官。
蛋白质、脂肪和碳水化合物的代谢,维生素的储存和激活等广泛而复杂的生化过程都在肝脏进行。
肝脏疾病时,可出现复杂的营养代谢改变和不同程度的蛋白质-能量营养不良。
而营养不良一直被认为是影响慢性肝病患者结局和治疗效果的重要因素。
一、营养不良与营养支持营养不良:指因能量、蛋白质或其他营养素缺乏或过量,对机体功能乃至临床结局造成不良影响的现象。
包括营养不足和营养过剩两个部分。
其中营养不足部分包括:蛋白质-能量营养不良和疾病相关营养不良。
其原因有摄入不足、吸收障碍、疾病应激消耗以及慢性疾病导致的营养素代谢障碍。
常用的有两个测量方法:(1)来源于体质量指数(BMI):BMI<18.5,且一般情况差的患者。
(2)来源于NRS-2002评分中的营养状态受损部分。
当评分达到3分,就属于有营养不足情况。
营养不良治疗的基本要求是满足90%液体目标需求、≥70%(70%~90%)能量目标需求、100%蛋白质目标需求及100%微量营养素目标需求。
营养不良治疗最高目标是调节异常代谢、改善免疫功能、控制疾病(如肿瘤)、提高生活质量、延长生存时间。
营养不良的规范治疗应该遵循五阶梯治疗原则(见图1):首先选择营养教育,然后依次向上晋级选择口服营养补充(oral nutritional supplements,ONS)、全肠内营养(total enteral nutrition,TEN)、部分肠外营养(partial parenteral nutrition,PPN)、全肠外营养(total parenteral nutrition,TPN)。
参照ESPEN指南建议,当下一阶梯不能满足60%目标能量需求3~5天时,应该选择上一阶梯。
图1营养不良患者营养干预五阶梯模式注:TPN,total parenteral nutrition,全肠外营养;TEN,total enteral nutrition,全肠内营养;PPN,partial parenteral nutrition,部分肠外营养;PEN,partial enteral nutrition,部分肠内营养;ONS,oral nutritional supplements ,口服营养补充;营养教育包括营养咨询、饮食指导与饮食调整。
肠内营养(enteral nutrition ,EN):是指经消化道给予较全面的营养素。
根据组成不同分为整蛋白型肠内营养、短肽型肠内营养、氨基酸型肠内营养。
根据给予途径的不同分为口服和管饲,其中口服又可分为部分经口营养补充(oral nutritional sup-plement ,简称ONS)或全量供给。
肠外营养(parenteral nutrition ,PN):又称“静脉营养”。
是经静脉为无法经胃肠道摄取或摄取营养物不能满足自身代谢需要的患者提供包括氨基酸、脂肪、碳水化合物、维生素及矿物质在内的营养素。
所有营养素完全经肠外获得的营养支持方式称为全肠外营养。
营养支持又称“营养支持疗法”,指经肠内或肠外途径为患者提供适宜的营养素的方法。
其涵义包括营养补充、营养支持和营养治疗三部分内容。
二、慢性肝病的临床分型:1.代偿期肝硬化2.失代偿期肝硬化3.肝衰竭:本文适用人群主要为慢加急性(亚急性)肝衰竭和慢性肝衰竭患者。
三、慢性肝病与营养不良(不足)的关系营养不良是慢性肝病患者的一个重要并发症。
综合文献报道,其发生率为65%~90%。
在住院的肝硬化患者中,81%存在蛋白质-能量营养不良。
Child-Pugh A级及B级肝硬化患者营养不良发生率为21%~40%,C级患者营养不良发生率为70%~90%。
48%~80.3%的肝硬化患者存在热量摄入不足。
等待进行肝移植的肝脏疾病患者营养不良发生率更高。
肝硬化的营养不良主要表现为骨骼肌质量减少及肌肉无力。
及时发现肝病患者具有的营养风险或已经有的营养不良(不足),并给予相应营养支持,有可能减少并发症的发生、降低病死率,从而改善临床结局。
对慢性肝病患者给予营养干预旨在改善蛋白质-能量营养不良状态。
有效的营养支持治疗对部分患者有可能改善肝功能。
四、慢性肝病营养支持的能量及营养素需求1.代偿期肝硬化:(1)能量:代偿期肝硬化患者每天能量摄入推荐量为25~40kcal/kg。
代偿期肝硬化患者的能量需求是基础代谢率的1.3倍。
(2)蛋白质:蛋白质的摄入量每天以1.2g/kg为宜。
对于酒精性肝硬化患者,每天蛋白质摄入量由1.0g/kg增加到1.8g/kg。
代偿期肝硬化患者如需要肠外营养,无需专门使用“肝病配方”的氨基酸制剂。
2.失代偿期肝硬化:(1)能量:失代偿期肝硬化患者每天能量摄入推荐量为35~40kcal/kg。
按照1.3倍基础代谢率提供能量。
有肝性脑病的肝硬化患者能量摄入为35~40kcal/kg;对于肥胖患者需适当减少能量摄入量,BMI30~40的患者建议能量摄入为25~35kcal/kg,BMI>40的患者建议能量摄入为20~25kcal /kg。
(2)蛋白质及氨基酸:对于严重营养不良的失代偿期肝硬化患者,每天蛋白质摄入量应为1.5g/kg。
对于酒精性肝硬化患者,蛋白质摄入量可增加到1.5~1.8g/kg。
肝性脑病I和Ⅱ级患者每日蛋白质摄入量为0.5g/kg。
在肝性脑病控制后,蛋白质的摄入量可适当增加,每2~3日增加10g;Ⅲ级和Ⅳ级肝性脑病患者每日蛋白质摄入量为0.5~1.2g/kg。
用于肝性脑病的纠正时,可静脉滴注支链氨基酸制剂。
关于氮源的摄入,对于反复出现肝性脑病或持续肝性脑病的患者,建议摄入富含植物蛋白质和乳清蛋白质的氮源,尽量避免动物蛋白质的摄入。
失代偿期肝硬化患者长期口服补充“肝病配方”的氨基酸制剂,有助于改善患者营养状态。
(3)脂肪:中/长链脂肪乳剂是肝功能不全患者比较理想的能源物质。
对于肝硬化患者,每天脂肪乳剂供给量应在1.0g/kg左右;失代偿期肝硬化患者,不宜超过1.0g/kg,输注速度为每小时0.11g/kg。
如发生胰岛素抵抗,给予葡萄糖的同时,每日应予脂肪0.8~1.2g/kg满足能量需求。
(4)维生素及微量元素:维生素、微量元素缺乏是肝病患者的共同特点。
对于需要营养支持的肝脏疾病患者,需补充维生素及微量元素。
对于不能经口摄入维生素和矿物元素的患者,可通过静脉途径补充水溶性及脂溶性维生素和微量元素注射液制剂。
锌和硒的补充能够改善肝硬化患者氨基酸的代谢,从而使肝性脑病得到改善。
3.慢加急性(亚急性)肝衰竭和慢性肝衰竭患者(1)能量:肝衰竭患者能量摄入为35~40kcal/kg。
急性期能量适量减少。
建议高碳水化合物、低脂、适量蛋白质饮食,预防和治疗低血糖对于肝衰竭患者十分重要,建议每日葡萄糖的供给量为2~3g/kg,同时监测血糖情况。
(2)蛋白质及氨基酸:建议适量蛋白质饮食。
合并肝性脑病者参考失代偿期肝硬化肝性脑病部分。
肝衰竭患者多有肠道消化和吸收功能障碍,可考虑使用预消化的蛋白质,如短肽型肠内营养制剂。
(3)脂肪:中/长链脂肪乳剂是肝功能不全患者比较理想的能源物质。
每天脂肪乳剂供给量不宜超过1.0g/kg,输注速度为每小时0.11g/kg。
(4)维生素及微量元素:参考失代偿期肝硬化部分。
五.慢性肝病营养支持的方式与时机1.营养支持方式的选择:遵循营养不良五阶梯治疗原则。
(1)第一阶梯:饮食+营养教育饮食+营养教育是所有营养不良患者(不能经口摄食的患者除外)首选的治疗方法,是一项经济、实用而且有效的措施,是所有营养不良治疗的基础。
轻度营养不良患者使用第一阶梯治疗即可能完全治愈。
判断营养不良类型通过膳食调查、实验室检查、人体成分分析等手段明确营养不良的类型,如能量缺乏型、蛋白质缺乏型、蛋白质-能量混合缺乏型,从而使营养治疗更加有针对性。
分析营养不良的原因,了解患者的家庭、社会、文化、宗教信仰、经济状况,了解疾病的病理生理、治疗情况及其对饮食和营养的影响,从而分析患者营养不良的原因,提供个体化饮食指导,在详细了解患者营养不良严重程度、类别及原因的基础上,提出针对性的、个体化的营养宣教、饮食指导及饮食调整建议,如调整饮食结构,增加饮食频次,优化食物加工制作,改善就餐环境等。
慢性肝病的膳食原则:高热量、高碳水化合物低脂高蛋白的饮食,食物多样化。
肝病清淡饮食是指膳食平衡、营养合理。
少油:烹调油25~30g/天。
少糖:添加糖<50g/天。
少盐:6~8g/天。
餐次:少量多餐,每日4~6餐,白天空腹不超过3~6h。
夜间加餐有助于避免低血糖。
烹调方式:以煮、蒸、汆为主,少用油煎、油炸的方式。
补充益生菌:食用含益生菌的酸奶。
适量补充微量元素、维生素。
(2)第二阶梯:饮食+ONSONS为“oral nutritional supplements”,并定义为:除了正常食物以外,补充性经口摄入特殊医学用途(配方)食品。
每天通过ONS提供的能量大于400~600kcal。
失代偿期肝硬化患者可选择“肝病配方(支链氨基酸型)”的全营养制剂,肝衰竭患者可选择短肽型全营养制剂。
ONS能增加营养不良或营养风险的患者的体重,减少瘦组织群和脂肪含量的丢失,改善机体的营养状态及肝性脑病。
(3)第三阶梯:TENTEN特指在完全没有进食条件下,所有的营养素完全由肠内营养制剂提供。
在饮食+ONS不能满足目标需要量或者一些完全不能饮食的条件下,如慢性肝病合并急性胰腺炎或合并肝性脑病昏迷时,TEN是理想选择。
肠内营养置管方式可选择鼻肠管或鼻胃管。
(4)第四阶梯:PEN+PPN在TEN不能满足目标需要量的条件下,应该选择PEN+PPN,或者说在肠内营养的基础上补充性增加肠外营养。
慢性肝病合并食道静脉曲张破裂出血恢复期时可选择PEN+PPN。
PEN与PPN两者提供的能量比例没有一个固定值,主要取决于肠内营养的耐受情况,肠内营养耐受越好,需要PPN提供的能量就越少,反之则越多。
(5)第五阶梯:TPN在肠道完全不能使用的情况下,TPN是维持患者生存的唯一营养来源。
肠外营养推荐以全合一(all-in-one,AIO)的方式输注,输注途径有外周静脉、经外周静脉穿刺置入中心静脉导管(peripherally inserted central catheter,PICC)及中心静脉导管(central venous catheter,CVC)。
CVC穿刺途径首选锁骨下静脉、次选颈内静脉或颈外静脉。
慢性肝病合并食道静脉曲张破裂出血时,可选择TPN。
一般情况下,我们应该遵循阶梯治疗原则,由下往上依次进行;但是阶梯与阶梯之间并非不可逾越,患者可能逾越上一阶梯直接进入上上阶梯,而且不同阶梯常常同时使用,如饮食+营养教育+ONS+PPN。
在临床营养工作实践中,我们应该根据患者的具体情况,进行个体化的营养治疗。