《本章整合》元素与物质世界
- 格式:pptx
- 大小:4.53 MB
- 文档页数:26

鲁科版高中化学必修1第二章元素与物质世界整章教案第一节元素与物质的分类一、新课标导航学习目标知识与技能:元素与物质的关系;胶体的性质。
过程与方法:探讨各类物质的通性及其相互反应关系,学会如何以元素为核心认识物质,从多角度依据不同标准对物质进行分类并体验分类的重要意义。
情感态度与价值观:体会分类的重要意义,依据不同的标准对物质进行分类;树立运用化学知识,使自己生活得更健康。
知识归纳本节重点:1.元素与物质的分类(1)元素是物质的基本组成成分,物质都是由元素组成的。
(2)同一种元素可以自身组成纯净物——单质(3)不同种元素相互之间按照一定的规律可以组成纯净物——化合物;相同的元素也可组成不同的化合物。
2.单质、酸、碱、盐、氧化物之间的关系(1)研究一类物质的性质(完成从单个物质向一类物质的过渡)。
(2)制备有关物质。
(3)鉴别物质。
(4)提纯物质。
3.几种常见的分散系(根据分散系中分散质粒度大小进行分类)胶体:分散质的粒度介于1~100nm之间的分散系叫胶体(也称为溶胶)。
4.胶体的性质(1)丁达尔现象:区别溶液和胶体。
(2)电泳:电泳现象说明胶体中的分散质微粒带有电荷。
(3)聚沉:本节难点:对胶体这一分散系的认识本节考点:(1)能够正确运用分类的思想。
(2)单质、氧化物、酸、碱、盐之间的反应关系(3)一类物质可能与哪些其它类物质发生化学反应。
(4)胶体的丁达尔现象、电泳、聚沉等特性(5)元素以游离态和化合态两种形态在物质中存在一、典型例题剖析基础题例1.试从多种角度对下列化学反应进行分类:(1)碳在氧气中燃烧(2)氢气在氯气中燃烧生成氯化氢(3)铁在纯氧中燃烧(4)铝箔在氧气中燃烧(5)锌与稀硫酸反应(6)氢氧化钠溶液与盐酸反应解析:根据你自己站的角度不同,可以有多种分类方法:①从化学反应基本类型分:(1)(2)(3)(4)属于化合反应,分为一类,(5)属于置换反应,分为一类,(6)属于复分解反应,分为一类;②从是否跟氧气发生反应分:(1)(3)(4)均为物质与氧气发生反应,分为一类,(2)(5)(6)无氧气参加,分为一类;③从是否是在溶液中反应分:(1)(2)(3)(4)不在溶液中反应,分为一类,(5)(6)为在溶液中发生的反应,分为一类;④可从有无金属参加反应、有无非金属参加反应分类,从是否属于氧化还原反应分类等。

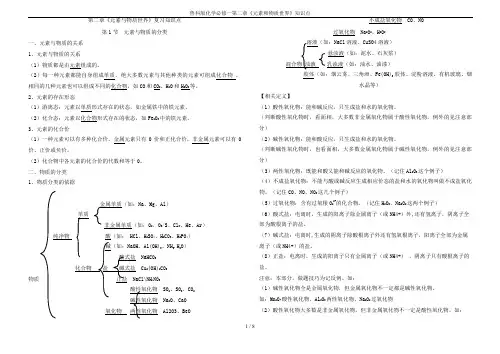
第二章 元素与物质世界 第1节 元素与物质的分类一、元素与物质及微粒间的关系:(1)宏观上物质是由元素组成的,微观上物质是由分子、原子或离子构成的。
(2)元素:具有相同核电荷数(或相同质子数)的一类原子的总称。
(3)元素与物质的关系:元素――→组成⎩⎨⎧组成的纯净物。
化合物:由不同种元素成的纯净物。
单质:由同一种元素组(4)元素在物质中的存在形态①游离态:元素以单质形式存在的状态。
②化合态:元素以化合物形式存在的状态。
(5)元素、物质及微粒间的关系如下图所示(6)有的元素只有一种单质,有的有两种或两种以上的单质(如O 元素有O 2、O 3等单质);几种元素组成化合物时,有的只能组成一种化合物(如钠元素和氯元素只能组成NaCl ),有的则能组成几种不同的化合物(如碳元素和氧元素可组成CO 和CO 2等)。
由于元素可以按照一定的规律以不同的种类和不同的方式进行组合, 因而110多种元素能够构成庞大繁杂的物质世界。
二、物质的分类: 1、分类方法: ①树状分类法②交叉分类法:1、根据物质类别研究物质性质 1)金属的通性①金属+非金属 → 无氧酸盐 (等点燃32e 22Cl F Cl Fe −−→−+)②金属+氧气 → 金属氧化物 (等或点燃O Na O Na O 222242Mg O Mg 2→+−−→−+)③较活泼金属+酸 → 盐+氢气 (Zn+2HCl →ZnCl 2+H 2或Fe+H 2SO 4→FeSO 4+H 2) ④较活泼金属+较不活泼的金属的盐溶液 → 较不活泼金属+较活泼金属的盐溶液 (Fe+CuSO 4→Cu+FeSO 4 )2)氧化物的通性酸性氧化物(能和碱反应生成盐和水的氧化物,如CaO 、Na 2O 等多数金属氧化物) ①酸性氧化物+水 →含氧酸 (CO 2+H 2O →H 2CO 3或SO 2+H 2O →H 2SO 3) ②酸性氧化物+碱 → 盐+水 (CO 2+2NaOH →Na 2CO 3+H 2O )③酸性氧化物+碱性氧化物 → 盐(Na 2O+SO 2→Na 2SO 3或CaO+SiO 2→CaSiO 3) 碱性氧化物(能和酸反应生成盐和水的氧化物,如CO 2、SO 2等多数非金属氧化物) ①碱性氧化物+水 → 碱 (如Na 2O+H 2O →2NaOH)②碱性氧化物+酸 →盐+水 ( CaO+2HCl →CaCl 2+H 2O 或Fe 2O 3+H 2SO 4→Fe 2(SO 4)3+H 2O )③碱性氧化物+酸性氧化物 →盐 (CaO+SO 2→CaCO 3或CaO+CO 2→CaCO 3等) 注:(1)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn 2O 7为酸性氧化物、Al 2O 3为两性氧化物、Na 2O 2为过氧化物)。

第二章元素与物质世界的知识概要
第一节元素与物质的分类
§1、元素与物质的关系
元素:是含有相同核电荷数或质子数一类原子的总称。
元素是物质的基本组成成分,物质都是由元素组成的。
元素在物质中一般以两种形态存在:一种是游离态(单质),另一种是化合态(化合物)。
第二节电解质
一、电解质
用化学式表示,其余的则用离子符号表示。
三删;删除不参加反应的离子。
2Na+ + 2OH- + 2H+ == 2Na+ + SO2O
OH- + H+ == H2O
四查;检查是否符合质量守恒与电荷守恒定律。
注意:在书写离子方程式时,难溶物质、难电离物质(弱电解质)、挥发性的物质(气体)书写
化学式表示。
第三节氧化剂和还原剂
§1、氧化还原反应
我们根据化学反应中元素是否有化合价的变化,将反应分所化还原反应和非氧化还原反应。
氧化反应和还原反应是两个相反应的过程,它们统一于一个氧化还原反应中,是一个整体。
△
2KMnO4 + 16HCl (浓)== 2MnCl2 + 2KCl + 5Cl2 + 8H2O MnO2 + 4HCl(浓) == MnCl2 + Cl2 + 2H2O 因KMnO4与浓盐酸反应比MnO2与浓盐酸反应条件较为溶易,固其氧化性是:KMnO4>MnO2§3、铁及其化合物的氧化性和还原性:
单质铁的物理性质:铁,元素符号为Fe,有银白色金属光泽的金属单质、质硬、密硬较大、有良好的导电、导热能力和良好的延展性。
2+3+
含Fe的溶液一般为黄色,含Fe的溶液一般为浅绿色。
既有氧化性
又有还原性。

第二章《元素与物质世界》复习知识点第1节元素与物质的分类一、元素与物质的关系1、元素与物质的关系(1)物质都是由元素组成的。
(2)每一种元素都能自身组成单质,绝大多数元素与其他种类的元素可组成化合物,相同的几种元素也可以组成不同的化合物,如CO和CO2、H2O和H2O2等。
2、元素的存在形态(1)游离态:元素以单质形式存在的状态,如金属铁中的铁元素。
(2)化合态:元素以化合物形式存在的状态,如Fe2O3中的铁元素。
3、元素的化合价(1)一种元素可以有多种化合价,金属元素只有0价和正化合价,非金属元素可以有0价、正价或负价。
(2)化合物中各元素的化合价的代数和等于0。
二、物质的分类1、物质分类的依据Al)3/S、Cl2、He、Ar)H2CO3、H3PO4)3、NH3.H2O)2CO3物质32、SO3、CO22O、CaO、BeO不成盐氧化物 CO、NO过氧化物 Na2O2、H2O2NaCl溶液、CuSO4溶液)悬浊液(如:泥水、石灰浆)乳浊液(如:油水、油漆)胶体(如:烟云雾、三角洲、Fe(OH)3胶体、淀粉溶液、有机玻璃、烟水晶等)【相关定义】(1)酸性氧化物:能和碱反应,只生成盐和水的氧化物。
(判断酸性氧化物时,看面相,大多数非金属氧化物属于酸性氧化物,例外的见注意部分)(2)碱性氧化物:能和酸反应,只生成盐和水的氧化物。
(判断碱性氧化物时,也看面相,大多数金属氧化物属于碱性氧化物,例外的见注意部分)(3)两性氧化物:既能和酸又能和碱反应的氧化物。
(记住Al2O3这个例子)(4)不成盐氧化物:不能与酸或碱反应生成相应价态的盐和水的氧化物叫做不成盐氧化物。
(记住CO、NO、NO2这几个例子)(5)过氧化物:含有过氧根O22-的化合物。
(记住H2O2、Na2O2这两个例子)(6)酸式盐:电离时,生成的阳离子除金属离子(或NH4+)外,还有氢离子,阴离子全部为酸根离子的盐。
(7)碱式盐:电离时,生成的阴离子除酸根离子外还有氢氧根离子,阳离子全部为金属离子(或NH4+)的盐。



2018版高中化学第2章元素与物质世界第1节元素与物质的分类(第2课时)一种重要的混合物——胶体教师用书鲁科版必修1编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2018版高中化学第2章元素与物质世界第1节元素与物质的分类(第2课时)一种重要的混合物——胶体教师用书鲁科版必修1)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2018版高中化学第2章元素与物质世界第1节元素与物质的分类(第2课时)一种重要的混合物——胶体教师用书鲁科版必修1的全部内容。
第2课时一种重要的混合物——胶体1.了解分散系的含义及其种类,知道胶体是一种常见的分散系。
2.了解胶体的丁达尔现象、聚沉等性质,了解胶体的性质在生活中的简单应用.重点分散系及其分类[基础·初探][探究·升华][思考探究]胶体一定呈液态吗?【提示】不一定。
如云、烟、雾都是气态胶体。
[认知升华]三种分散系的区别分散系溶液胶体浊液分散质粒子单个小分子或离子高分子或多分子集合体巨大数目的分子集合体分散质粒子直径小于1 nm1~100 nm大于100nm 性外观均一、透明多数均一、不均一、不1.溶液、胶体和浊液这三种分散系的本质区别是( )A.是否有丁达尔现象B.是否能通过滤纸C.分散质粒子的大小D.是否均一、透明、稳定【解析】溶液、胶体、浊液三种分散系是依据分散质粒子直径大小进行分类。
【答案】C2.下列关于各分散系的说法中,正确的是 ( )A.溶液、胶体、悬浊液的外观没有区别B.分散质微粒直径大小:悬浊液〉溶液〉胶体C.胶体一定是液体D.不管分散剂的状态如何,只要分散质粒子的直径在1~100 nm 之间,该分散系就是胶体【解析】溶液、胶体一般透明,而悬浊液不透明;分散质微粒直径由大到小依次是:悬浊液、胶体、溶液;胶体可能是液体、气体或固体;分散质粒子的直径在1~100 nm 之间的分散系就是胶体。

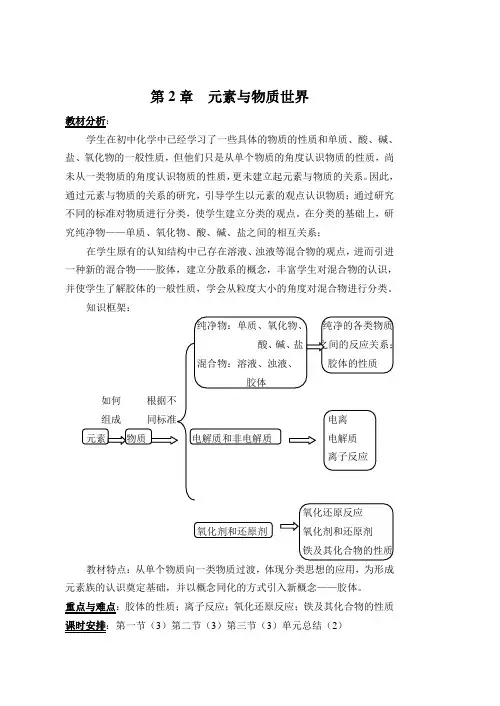
第2章元素与物质世界教材分析:学生在初中化学中已经学习了一些具体的物质的性质和单质、酸、碱、盐、氧化物的一般性质,但他们只是从单个物质的角度认识物质的性质,尚未从一类物质的角度认识物质的性质,更未建立起元素与物质的关系。
因此,通过元素与物质的关系的研究,引导学生以元素的观点认识物质;通过研究不同的标准对物质进行分类,使学生建立分类的观点。
在分类的基础上,研究纯净物——单质、氧化物、酸、碱、盐之间的相互关系;在学生原有的认知结构中已存在溶液、浊液等混合物的观点,进而引进一种新的混合物——胶体,建立分散系的概念,丰富学生对混合物的认识,并使学生了解胶体的一般性质,学会从粒度大小的角度对混合物进行分类。
知识框架:教材特点:从单个物质向一类物质过渡,体现分类思想的应用,为形成元素族的认识奠定基础,并以概念同化的方式引入新概念——胶体。
重点与难点:胶体的性质;离子反应;氧化还原反应;铁及其化合物的性质课时安排:第一节(3)第二节(3)第三节(3)单元总结(2)第一节元素与物质世界教学目标:1.知识与技能:初步认识常见的元素及其化合物,知道元素的两种存在形态——游离态和化合态;建立物质的类别观,认识元素与物质的关系,了解110多种元素能组成上千万种物质的原因;了解单质、氧化物、酸、碱、盐的通性及相互反应的关系;知道胶体的概念,了解胶体的特性,了解胶体性质的简单应用。
2.过程与方法:学习物质分类的方法;体验并了解研究一类物质与其他类物质之间反应关系的过程与方法。
3.情感态度与价值观:正确认识科学、技术与社会的相互作用,能运用所学的知识解释生产、生活中的化学现象,解决与化学有关的一些实际问题,关注与化学有关的社会热点问题。
重点与难点:重点:元素与物质的关系;胶体的性质。
学会以元素为核心认识物质;能多角度、依据不同标准对物质进行分类,体验分类的重要意义。
难点:胶体课时安排:3课时第一课时教学目标:知识与技能:了解元素与物质家族的关系;知道元素存在的两种形态;能从物质的组成和性质的角度对物质进行分类;了解对物质进行分类的不同标准。

第二章元素与物质世界章末知识整合知识网络构建热点专题聚焦专题一离子共存问题有关溶液中离子能否共存问题是中学化学中的常见问题。
从历年高考中有关离子共存问题的难度上分析,这类问题都属于中等难度偏易题,但这类题的区分度都比较高。
也就是说,题不难,但考生在这类题上得分差异较大。
造成这种状况的原因,主要是考生在元素及其化合物知识的学习中,没有将众多的元素及其化合物知识统摄整理,使之网络化并进行有序的存储,因而在提取、再现、辨认时,或出现错误,或发生障碍,或不完整。
也有知识掌握不完整,物质间相互反应的规律不清晰,在解决问题时缺乏信心等因素。
1.发生复分解反应,离子不能大量共存。
(1)有气体产生。
如CO2-3、HCO-3、S2-、HS-、SO2-3、HSO-3等易挥发的弱酸的酸根与H+不能大量共存,主要是由于发生CO2-3+2H+===CO2↑+H2O、HS-+H+===H2S↑等。
(2)有沉淀生成。
如Ba2+、Ca2+、Mg2+等不能与SO2-4、CO2-3等大量共存,主要是由于Ba2++CO2-3===BaCO3↓,Ca 2++SO2-4===CaSO4↓(微溶);Mg2+、Al3+、Cu2+、Fe2+、Fe3+等不能与OH-大量共存是因为Cu2++2OH-===Cu(OH)2↓,Fe3++3OH+===Fe(OH)3↓等;SiO2-3、[Al(OH)4]-等不能与H+大量共存是因为SiO2-3+2H +===H2SiO3↓,[Al(OH)4]-+H+===Al(OH)3↓+H2O。
(3)有难电离物质(或弱电解质)生成。
如OH-、ClO-、CH3COO-等与H+不能大量共存,主要是由于OH-+H+===H2O,CH3COO-+H+===CH3COOH等;一些酸式弱酸根及NH+4不能与OH-大量共存是因为HCO-3+OH-===CO2-3+H2O,NH+4+OH-===NH3·H2O等。
(4)一些容易发生水解的离子,在溶液中的存在是有条件的。
《元素与物质世界》教案《元素与物质世界》教案作为一名辛苦耕耘的教育工,常常要依据教学需要编写教案,教案是实施教学的主要依据,有着至关重要的作用。
那么应当如何写教案呢?以下是我细心整理的《元素与物质世界》教案,欢迎大家共享。
《元素与物质世界》教案1【复习目标】1.了解物质简洁分类法的意义2.理解胶体与其他分散系的区分3.了解电解质、非电解质的概念,把握酸、碱、盐电离方程式的书写4.把握常见离子方程式的书写及离子反应发生的条件5.理解氧化还原反应、氧化剂、还原剂的概念,能推断电子转移的方向和数目6.把握铁及其化合物的氧化性和还原性【重点、难点】离子反应和氧化还原反应1.物质都是由XX组成的,单质是XX,化合物是XX。
元素在物质中以两种形态存在,即XX和XX。
2.物质可分为XX和XX。
混合物可分为XX,XX和XX。
依据元素的组成和性质,纯净物通常可以分为XX,XX,XX。
依据在溶液中或熔化状态下能够导电,化合物可分为XX,XX。
依据在氧化还原反应中的表现,可将反应物分为XX和XX。
XX是碱性氧化物,金属氧化物不都是碱性氧化物,例如Na2O2、MnO2是金属氧化物,但不是碱性氧化物。
XX是酸性氧化物,非金属氧化物不都是酸性氧化物,例如CO、NO、NO2是非金属氧化物,但不是酸性氧化物。
3.XX之间的反应通常是复分解反应。
4.光束照射胶体时,这种现象叫做丁达尔效应。
借助此现象可以用来区分胶体和溶液。
在外加电场作用下,胶体微粒在分散剂里作定向运动的现象,叫做XX。
它说明胶体的微粒带有XX。
能使胶体聚沉的三种方法XX、XX、XX。
5.利用XX分别胶体中能够的杂质分子或离子,提纯,精制胶体的操作称为XX。
只有浊液中的微粒不能通过滤纸,只有溶液中的微粒能通过半透膜。
(滤纸的孔隙比半透膜大)。
其他和胶体有关的现象:土壤,水泥,三角洲,有机玻璃,墨水6.制备氢氧化铁胶体的方法、反应方程式。
7.电离是XX。
电解质是XX。