高一化学乙酸和羧酸
- 格式:pdf
- 大小:329.63 KB
- 文档页数:11


高一化学必修三羧酸知识点羧酸是有机化合物中十分重要的一类物质,它在生物学、医药学、化工等领域都扮演着重要角色。
羧酸可用于制药、生物催化、有机合成等领域,因此,对于高中化学学生来说,了解羧酸的性质、结构和反应十分重要。
一、羧酸的基本结构羧酸分子由一个羧基(-COOH)和一个碳链组成。
羧基是由一个碳原子与一个氧原子和一个氢原子连接而成的。
羧酸的碳链可以是直链、支链或环状结构,其中直链和支链结构的羧酸是最常见的。
二、羧酸的命名和表示方法羧酸的命名通常以其碳链的命名为基础,然后在末端加上“酸”字。
例如,乙酸就是由两个碳原子组成的羧酸分子。
除了常见的化学式表示外,羧酸还可以用分子式、结构式和简图表示。
三、羧酸的性质1. 酸性:羧酸具有较强的酸性。
它们可以与碱反应生成相应的盐和水。
例如,乙酸与氢氧化钠反应生成乙酸钠和水。
2. 气味:羧酸在溶液中具有特殊的气味,例如,乙酸的气味呛鼻且具有辛辣的性质。
3. 溶解性:羧酸在水中具有一定的溶解性。
溶解度与羧酸的碳链长度有关,碳链越短,溶解度越高。
4. 沸点和熔点:羧酸的沸点和熔点与其分子大小、分子间相互作用力有关。
一般来说,分子量较大的羧酸沸点和熔点较高。
四、羧酸的常见反应1. 氧化反应:羧酸可以在适当条件下发生氧化反应,生成相应的醛、酮或羧酸。
例如,乙酸可以被氧气氧化生成乙醛。
2. 脱羧反应:羧酸可以在加热条件下发生脱羧反应,生成相应的酸酐和水。
例如,乙酸可以加热生成醋酸酐和水。
3. 还原反应:羧酸可以通过还原剂还原为相应的醛、酮或烃。
还原反应的条件取决于具体的羧酸和还原剂。
例如,乙酸可以被还原为乙醛。
五、羧酸的应用领域1. 制药:许多药物都是羧酸衍生物,包括乙酸钠、阿司匹林等。
羧酸可以增加药物的水溶性和生物利用度。
2. 化学工业:羧酸可用于合成香料、润滑剂、染料和橡胶等化工产品。
3. 生物学:在生物学中,羧酸是脂肪酸和氨基酸的重要成分,参与体内能量代谢和脂质合成等生物过程。


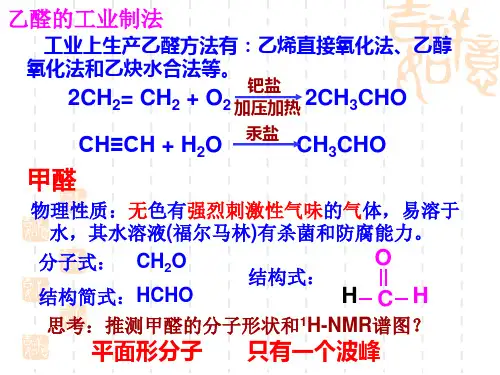


乙酸羧酸物理性质。
一、乙酸1·分子结构2·物理性质:无色有强烈刺激性气味的液体、易凝结成冰一样的晶体、易溶于水和乙醇—COOH叫羧基,乙酸是由甲基和羧基组成。
羧基是由羰基和羟基组成,这两个基团相互影响,结果不再是两个单独的官能团,而成为一个整体。
羧基是乙酸的官能团。
(1)弱酸性:(2) 酯化反应——取代反应注:①浓硫酸的作用:催化剂、吸水剂。
②反应过程:酸脱羟基、醇脱氢。
③饱和碳酸钠溶液作用:中和乙酸,溶解乙醇,便于闻乙酸乙酯的气味;降低乙酸乙酯的溶解度,便于分层析出。
④导气管不能伸入碳酸钠溶液中,防止加热不匀,液体倒吸。
二、酯1·定义:羧酸和醇反应,脱水后生成的一类物质叫酯2·通式:RCOOR/3·物理性质:低级酯有芳香气味、密度比水小、难溶于水。
4·水解反应:强调断键位置和反应条件。
RCOOR/ + NaOH→RCOONa + R/OH加碱为什么水解程度大?——中和酸,平衡右移。
像乙酸一样,分子由烃基和羧基相连构成的有机物还很多,统称为羧酸,看课本P176 二、羧酸,了解羧酸的分类、性质和用途。
三、羧酸1·定义2·按羧基数目分:一元酸(如乙酸)、二元酸(如乙二酸又叫草酸HOOC-COOH)和多元酸分 按烃基类别分:脂肪酸(如乙酸)、芳香酸(苯甲酸C 6H 5OH) 按含C 多少分: 低级脂肪酸(如丙酸)、类 高级脂肪酸(如硬脂酸C 17H 35COOH 、软脂酸C 15H 31COOH 、油酸C 17H 33COOH )3·饱和一元酸:烷基+一个羧基(1)通式:C n H 2n+1COOH 或C n H 2n O 2、R —COOH (2) 性质:弱酸性、能发生酯化反应。
3.例题精讲例1.有机物(1)CH 2OH (CHOH )4CHO (2)CH 3CH 2CH 2OH (3)CH 2=CH —CH 2OH (4)CH 2=CH —COOCH 3(5)CH 2=CH —COOH 中,既能发生加成、酯化反应,又能发生氧化反应的是 ( )A .(3)(5)B .(1)(3)(5)C .(2)(4)D .(1)(3)例2.一种含碳、氢、氧三种元素的有机化合物。




第六节乙酸羧酸一、乙酸1、分子结构分子式C2H4O2, 结构简式:CO O H3CHO HOC3CH或2、物理性质无色、强烈刺激性气味的液体,熔点为16.6℃,低于16.6℃凝结成冰状晶体,故无水乙酸又称冰醋酸。
能与水和乙醇任意比互溶。
3、化学性质由于羰基对羟基影响,使羟基活性增强。
(1)酸性:乙酸在水溶液里部分电离-++C O O3C HHC O O H3C H具有无机酸通性:①与指示剂反应,如使紫色石蕊试液变红色。
②与金属活动顺序表中排了H前金属反应生成乙酸盐和H2③与碱性氧化物反应生成盐和水④与碱反应生成盐和水⑤与某些弱酸盐或不稳定酸盐反应注意:CH3CH2OH、H、CH3COOH 酸性比较:乙醇:中性,能与活泼金属反应,不与盐和碱反应。
苯酚:弱酸性,不能使指示剂变色,能与强碱反应,不与NaHCO3反应(更不会产生CO2)。
乙酸:弱酸性,能使指示剂变色,能与NaOH反应,能与碳酸盐反应产生CO2。
故酸性:乙酸﹥碳酸﹥苯酚﹥乙醇(2)酯化反应:酸与醇作用生成酯和水的反应O2H5H2CO18OC3CH4SO2H5H2CO18HO HOC3CH+∆+浓注意:a)经同位素氧-18测定,乙酸与乙醇作用生成乙酸乙酯的反应原理是:乙酸脱去羧基上的羟基,乙醇脱去羟基上的氢原子。
b)反应中浓硫酸起催化、吸水作用。
c)吸收装置(如右图)中导管口不与液面接触是防止试管中液体倒吸入反应容器中。
d)试管中用饱和Na2CO3溶液收集乙酸乙酯,目的是中和蒸气中的乙酸,溶解乙醇,降低乙酸乙酯的溶解度。
e)酯与混合液分离:用分液漏斗分液,取上层油状液体得酯。
4、乙酸的制法(1)发酵法乙酸氧化乙醛发酵氧化乙醇酶发酵糖类淀粉−−−→−()((2)乙烯氧化法C O O H3CH 22O CHO 3CH 2CHO 3CH 22O 2CH 2CH 2−−−→−+−−−→−+=催化剂催化剂此法原料来源丰富,生产工艺流程简单 (3)烷烃直接氧化法—丁烷氧化法O 2H 2C O O H3CH 2O 53CH 2CH 2CH 3CH 2++5、乙酸的用途生产醋酸纤维 、合成维纶纤维 、作溶剂、制香料、染料、医药、农药等。
乙酸 羧酸 一、乙酸 羧酸1、 定义:分子中烃基(或氢原子)跟羧基()相连的化合物属于羧酸。
2、 物理性质:无色液体,易溶于水,随着碳原子数增多,水溶性降低。
具有弱酸性,随着碳原子数增多,酸性降低。
3、 饱和一元酸的通式_________________________ 二、乙酸(冰醋酸即无水乙酸) 1、 分子结构:分子式为___________,结构式为_______________,结构简式为_________________,俗称_______2、乙酸的化学性质 (1)酸性乙酸水溶液中存在以下电离方程式:CH 3COOH CH 3COO -+H +,故乙酸为弱酸,能体现酸的性质。
乙酸能与Na 、NaOH 、NaHCO 3、Na 2CO 3反应,酸性大于碳酸。
酸性比较:在某有机物A 的分子中,其结构简式如右图。
写出: A 跟NaOH 溶液反应的化学方程式是A 跟NaHCO 3溶液反应的化学方程式是A 在一定条件下跟Na 反应的化学方程式是:(2)酯化反应在一支试管中加入3 mL 乙醇,然后边摇动试管边慢慢加入2 mL 浓硫酸和2 mL 冰醋酸。
按图连接好装置用酒精灯小心均匀地加热试管3~5 min ,产生的蒸气经导管通到饱和的碳酸钠溶液的液面上。
可以看到碳酸钠饱和溶液的液面上有透明的油状液体产生,并可闻到香味。
生成乙酸乙酯的反应A 、这种有香味的无色透明油状液体就是乙酸乙酯,反应的化学方程式可以表示如下:+CH 3CH 2OH浓硫酸+H 2OCH 3COOH CH 3COOCH 2CH3反应类型:酯化反应(取代反应),反应规律:_______________________________酸和醇起作用,生成酯和水的反应叫做酯化反应,这里的酸是指像乙酸之类的有机酸和像硝酸之类的无机含氧酸。
如果用含氧的同位素188O 的乙醇与乙酸作用,请写出化学方程式:B 、乙酸乙酯是酯类化合物的一种,乙酸乙酯的密度约为0.9 g·cm -3,沸点77 ℃,易溶于乙醇等,微溶于水。
高一化学必修二官能团知识点官能团是有机化合物分子中具有一定反应性和特殊性质的特定结构基团。
它们在有机化学中起着至关重要的作用。
本文将介绍高一化学必修二中所要了解和掌握的官能团知识点。
一、醇官能团醇是一类含有羟基(-OH)的化合物,可以用通式R-OH表示。
常见的醇有甲醇、乙醇等。
醇官能团在有机合成和化学反应中具有重要的作用,如醇的氧化反应、脱水反应等。
二、酮和醛官能团酮和醛是含有羰基(C=O)的化合物。
区别在于酮的羰基碳原子两侧连接有两个烃基,而醛只有一个烃基。
酮和醛官能团参与了许多常见的有机反应,如酮和醛的还原反应、酮和醛的氧化反应等。
三、羧酸官能团羧酸是一类含有羧基(-COOH)的化合物,通式为R-COOH。
羧酸官能团具有酸性和氢键性质,可以发生酯化反应、酰化反应等。
乙酸和丙酸是常见的羧酸。
四、酯官能团酯是一类含有酯基(-COO-)的化合物,可用通式R1-COO-R2表示。
酯官能团常见于天然香料、脂肪和乳胶等化合物中。
酯是羧酸和醇反应生成的产物,可以通过酯水解反应还原为羧酸和醇。
五、酸醛官能团酸醛是一类含有酸醛基(-CHO)的化合物,通式为R-CHO。
常见的酸醛有甲醛、乙醛等。
酸醛官能团参与了许多常见的有机反应,如酸醛的氧化反应、酸醛的加成反应等。
六、胺官能团胺是一类含有氨基(-NH2)的化合物,可用通式R-NH2表示。
胺官能团在许多生物活性物质、医药和染料化合物中都有应用,如酰胺、吡啶等。
胺与酸反应可以生成盐类,与醛或酮反应可以生成胺酮。
七、卤代烃官能团卤代烃是一类含有卤素(F、Cl、Br、I)的碳氢化合物。
卤代烃官能团在有机合成和化学反应中具有重要的作用,如亲核取代反应、副反应等。
以上是高一化学必修二中的官能团知识点。
理解和掌握这些官能团的性质和反应特点,对于理解和预测有机化合物的性质和反应机理都至关重要。
希望通过本文的介绍,能够对官能团有更深入的了解,并能够在学习和应用中运用自如。
高中化学如何解决羧酸的有机反应问题在高中化学学习中,羧酸的有机反应是一个重要的内容。
羧酸是一类含有羧基(-COOH)的有机化合物,其反应性较强,可以参与多种有机反应。
解决羧酸的有机反应问题,需要掌握一些基本的知识和技巧。
首先,我们需要了解羧酸的结构和性质。
羧酸分子由一个羧基和一个碳基团组成,羧基是一个碳氧双键和一个氧氢单键组成的官能团。
羧酸具有酸性,可以与碱反应生成盐和水,同时还可以发生酯化、酰化、脱羧等反应。
一种常见的羧酸有机反应是酯化反应。
酯化反应是指羧酸与醇反应生成酯的过程。
例如,乙酸(CH3COOH)与乙醇(C2H5OH)反应可以生成乙酸乙酯(CH3COOC2H5)。
在这个反应中,乙酸中的羧基与乙醇中的羟基发生酯化反应,生成酯和水。
解决这类问题的关键是要理解酯化反应的机理和反应条件。
另一种常见的羧酸有机反应是酰化反应。
酰化反应是指羧酸与醇反应生成酰基化合物的过程。
例如,乙酸(CH3COOH)与氯化亚砜(SOCl2)反应可以生成乙酰氯(CH3COCl)。
在这个反应中,乙酸中的羧基与氯化亚砜中的氯发生酰化反应,生成酰基化合物和氯化氢。
解决这类问题的关键是要熟悉酰化反应的机理和反应条件。
除了酯化和酰化反应,羧酸还可以发生脱羧反应。
脱羧反应是指羧酸分子中的羧基脱离,生成相应的酸酐。
例如,乙酸(CH3COOH)可以脱羧生成乙酸酐(CH3COOCOCH3)。
在这个反应中,乙酸中的羧基通过失去一个水分子,生成酸酐。
解决这类问题的关键是要理解脱羧反应的机理和反应条件。
在解决羧酸的有机反应问题时,我们需要注意以下几点:首先,要掌握羧酸的结构和性质,了解其反应性和反应类型。
这样可以根据具体的反应条件和反应物,判断出所需要的反应类型。
其次,要熟悉不同有机反应的机理和反应条件。
不同的反应类型有不同的反应机理和反应条件,只有掌握了这些知识,才能正确地解决问题。
最后,要通过大量的练习,加深对羧酸有机反应的理解和应用。