无机化学第五章
- 格式:doc
- 大小:42.50 KB
- 文档页数:2
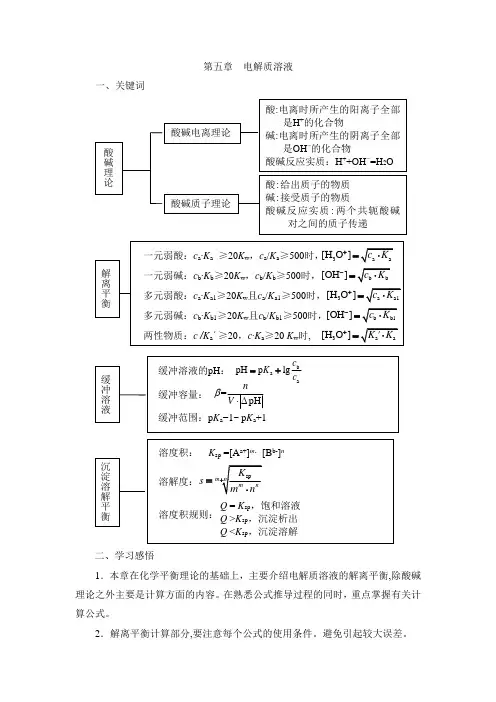
第五章电解质溶液一、关键词二、学习感悟1.本章在化学平衡理论的基础上,主要介绍电解质溶液的解离平衡,除酸碱理论之外主要是计算方面的内容。
在熟悉公式推导过程的同时,重点掌握有关计算公式。
2.解离平衡计算部分,要注意每个公式的使用条件。
避免引起较大误差。
3.本章的重点是弱电解质溶液和缓冲溶液的pH计算及难溶电解质溶度积规则的应用。
三、难点辅导1. 为什么任何物质的水溶液中都含有H3O+和OH−,而且在常温时,[H3O+]∙[OH−]=K w=1.0×10−14?无论是酸性还是碱性的物质,一旦与水形成溶液后,由于水发生的质子自递平衡中,会产生H3O+和OH−,所以任何物质的水溶液都含有H3O+和OH−。
在水溶液中,按照酸碱质子理论,酸会给出质子,碱会接受质子,这样必定会引起水的解离平衡发生移动,但水的解离平衡常数不会因平衡的移动发生改变,其解离平衡常数只与温度有关,在常温时,[H3O+]∙[OH−]=K w=1.0×10−14。
对酸性溶液来说,H3O+主要来自酸性物质(水的极少量解离可忽略),OH−则来自水的少量解离;对碱性溶液来说,OH−主要来自碱性物质(水的极少量解离可忽略),H3O+则来自水的少量解离。
2. 酸碱的强弱由哪些因素决定?酸碱的强弱首先取决于酸碱本身给出和接受质子的能力,其次取决于溶剂接受和给出质子的能力。
同一种物质在不同溶剂中的酸碱性不同,如HCl 在水中是强酸,在冰醋酸中是弱酸,这是因为水接受质子的能力比冰醋酸强;NH3在水中是弱碱,在冰醋酸中是强碱,冰醋酸给予质子的能力比水强的缘故。
所以在比较不同酸碱的强弱时,应在同一溶剂中进行,一般以水为溶剂比较其酸碱性的强弱,即比较在水溶液中的离解平衡常数K a或K b。
3. 缓冲溶液通常由一对共轭酸碱组成,那么HCl-NaCl这对共轭酸碱可组成缓冲溶液吗?为什么?缓冲溶液是由共轭酸碱对组成,其中共轭酸是抗碱成分,共轭碱是抗酸成分。



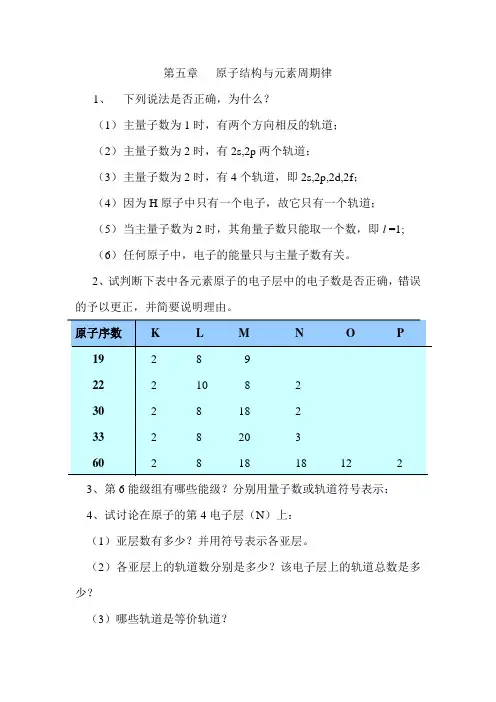
第五章原子结构与元素周期律1、下列说法是否正确,为什么?(1)主量子数为1时,有两个方向相反的轨道;(2)主量子数为2时,有2s,2p两个轨道;(3)主量子数为2时,有4个轨道,即2s,2p,2d,2f;(4)因为H原子中只有一个电子,故它只有一个轨道;(5)当主量子数为2时,其角量子数只能取一个数,即l =1;(6)任何原子中,电子的能量只与主量子数有关。
2、试判断下表中各元素原子的电子层中的电子数是否正确,错误的予以更正,并简要说明理由。
3、第6能级组有哪些能级?分别用量子数或轨道符号表示:4、试讨论在原子的第4电子层(N)上:(1)亚层数有多少?并用符号表示各亚层。
(2)各亚层上的轨道数分别是多少?该电子层上的轨道总数是多少?(3)哪些轨道是等价轨道?5、写出与下列量子数相应的各类轨道符号,并写出其在近似能级图中的前后能级所对应的符号:(1)n=2, l=1(2) n=3, l =2(3) n=4, l =0(4) n=4, l =36、在下列各项中,填入合适的量子数:(1)n=?, l=2, m=0, m s=±1/2(2)n=2, l=?, m=-1, m s=±1/2(3)n=4, l=?, m=+2, m s=±1/2(4)n=3, l=0, m=?, m s=±1/27、指出下列假设的电子运动状态(依次为n,l,m, m s),哪几种不可能存在?为什么?(1)3,2,+2,+1/2 (2)2, 2, -2, +1/2(3)2, 0, +1, -1/2 (4) 2, -1, 0, +1/2(5) 4, 3, -1, 18、原子吸收能量由基态变成激发态时,通常是最外层电子向更高的能级跃迁。
试指出下列原子的电子排布中,哪些属于基态或激发态,哪些是错误的。
(1)1s2 2s2 2p1(2)1s2 2s2 2p62d1(3) 1s22s22p43s1(4) 1s2 2s4 2p29、写出原子序数为45,52,79各元素的原子核外电子排布式及其价层电子构型。






第五章沉淀反应Chapter 5The Precipitation Reactions中学的化学知识中,常常用沉淀反应来鉴别一些金属离子或酸根离子,这就涉及到一些难溶电解质的沉淀和溶解问题。
在含有固体的难溶电解质的饱和溶液中,存在着固体难溶电解质与溶液中相应各离子间的多相平衡。
§5-1溶度积Solubility Product一、沉淀和溶解平衡(The Equilibrium of Precipitation and Dissolution )1.在一定温度和一定量水中,AgCl(s)Ag +(aq)+Cl -(aq)当v 沉淀=v 溶解时,沉淀和溶解达到平衡,称为异相平衡(heterogeneous equilibrium ).2.平衡表达式:[Ag ][Cl ][AgCl]K +-=∴[Ag +][Cl -]=K ·[AgCl],把K ·[AgCl]记作K sp ,K sp 称为溶度积常数。
3.通式:A Bn m (s)A aq B aq ()()m n n m +-+,sp[A ][B ]m n n m K +-=⋅4.注意点:(1)K sp 与温度有关,但影响不大。
在实际中,常用25℃时的K sp ;(2)在上述表达式中,浓度必须用体积物质的量浓度;(3)在K sp 表达式中,应该用离子活度代替离子浓度。
但由于在难溶电解质的溶液中,离子浓度很小,离子的活度系数γ=1,所以可以用离子浓度代替离子活度。
二、溶度积与溶解度的关系(The Relationship of Solubility Product and Solubility )1.溶解度s o (mol·dm -3)与K sp 的换算(1)由于两者都表示某一物质成为饱和溶液时所含溶质的量相同,即都是表示物质的溶解能力,故它们之间可换算。
(2)换算关键:由于难溶电解质的溶解度很小,所以虽然是饱和溶液,但此饱和溶液很稀,则1ρρ==溶液水,所以,也可以把摩尔溶解度换算成g /100H 2O 。
第五章
(一)是非题
1. CuCO 3的溶度积K sp =1.4×10-10,这表明在所有含有CuCO 3的溶液中,c (Cu 2+)=c (CO 32-) 而且c (Cu 2+)•c (CO 32-)=1.4×10-10 ( )
2.溶度积的大小决定于物质的本性和温度,与浓度无关。
( )
3.因为Ag 2CrO 4的溶度积(K SP =2.0×10-12)小于AgCl 的溶度积(K SP =1.6×10-10),所以,Ag 2CrO 4必定比AgCl 更难溶于水。
( )
4. AgCl 在1 mol .L -1NaCl 溶液中,由于盐效应的影响,使其溶解度比在水中要略大一些。
( )
5. 难溶物质的离子积达到(等于)其溶度积并有沉淀产生时,该溶液为其饱和溶液。
( )
(二)选择题
1.在配制FeCl 3溶液时,为防止溶液产生沉淀,应采取的措施是 ( )
A. 加碱
B. 加酸
C. 多加水
D. 加热
2. AgCl 固体在下列哪一种溶液中的溶解度最大? ( )
A. 1mol·L -1氨水溶液 B . 1mol·L -1氯化钠溶液
C. 纯水
D. 1mol·L -1硝酸银溶液
3.Ag 2SO 4饱和溶液浓度为2.5×10-2mol .L -1,则其K sp 为 ( )
A. 6.25×10-5
B. 6.25×10-7
C. 1.25×10-3
D. 3.0×10-3
4.CaF 2的饱和溶液浓度为2×10-4mol .L -1,它的溶度积常数是 ( )
A. 4×10-8
B. 8×10-12
C. 3.2×10-11
D. 8×10-10
5.已知K sp (Ag 2CrO 4) = 1.1×10-12
,在0.10mol .L -1Ag +溶液中,要产生Ag 2CrO 4沉淀,CrO 42-的浓度至
少应大于( )
A. 1.1×10-10 mol .L -1
B. 2.25×10-11 mol .L -1
C. 0.10mol .L -1
D. .1 10-11 mol .L -1
6.欲使CaCO 3在水溶液中溶解度增大,可以采用的方法是 ( )
A. 加入1.0 mol .L -1 Na 2CO 3
B. 加入2.0 mol .L -1NaOH
C. 加入0.10 mol .L -1EDTA
D. 降低溶液的pH 值
7.设AgCl 在水中,在0.01mol .L -1CaCl 2中,在0.01mol .L -1NaCl 中以及在0.05mol .L -1AgNO 3中的溶解度分别为S 0,S 1,S 2和S 3,这些量之间的正确关系是 ( )
A. S 0>S 1>S 2>S 3
B. S 0>S 2>S 1>S 3
C. S 0>S 1=S 2>S 3
D. S 0>S 2>S 3>S 1
8.已知某难溶盐AB 2的溶解度为S (单位为mol .L -1),其浓度积K sp 为( )
A. S 3
B. S 2
C. 4S 3
D. S 3/4
9.已知K sp (AgCl)= 1.8 × 10-10,K sp (Ag 2CrO 4)= 1.1 × 10-12 ,K sp (AgI)= 8.3 × 10-17,在含以上沉淀的溶液中滴加氨水,三种沉淀中,何者最易溶解 ( )
A. Ag 2C r O 4
B. AgCl
C. AgI
D.无法判断
10.在下列浓度相同的溶液中,Agl 具有最大溶解度的是 ( )
A.NaCl
B. AgNO 3
C.NH 3.H 2O
D.KCN
11.已 知K sp (AgCl) = 1.6 ⨯ 10-10 ,K sp (Ag 2CrO 4) = 1.1 ⨯ 10-12 ,K sp (Ag 3AsO 4) = 1.0 ⨯ 10-22 ,K sp { Mg(OH)2} = 5.6 ⨯ 10-12 。
若不考虑水解等副反应,则在水中溶解度最小的为:( )
A. AgCl
B. Ag 2CrO 4
C. Ag 3AsO 4
D. Mg(OH)2
12.为了防止热带鱼池中水藻的生长,需使水中保持0.75mg .L -1的Cu 2+ ,为避免在每次换池水时溶液浓度的改变,可把一块适当的铜盐放在池底,它的饱和溶液提供了适当的Cu 2+浓度。
假如使用的是蒸馏水,哪一种盐提供的饱和溶液最接近所要求的Cu 2+浓度?(已知K sp (CuS) = 6.3×10-36, K sp {Cu(OH)2} = 2.2×10-20, K sp (CuCO 3) = 1.4×10-10) ( )
A.CuSO 4
B.CuS
C.Cu(OH)2
D.CuCO 3
E.Cu(NO 3)2
13.在沉淀反应中,加入易溶电解质会使沉淀的溶解度增加,该现象称为 ( )
A. 同离子效应
B. 盐效应
C. 酸效应
D. 络合效应
(三)填空题
1.已知 K sp (CaCO 3)=4.96×10-9,K sp (CaSO 4)=7.10×10-5,反应CaSO 4+CO 32-==CaCO 3+SO 42-的平衡常数是____________________。
2.比较Mg(OH)2在下述四种液体中的溶解度大小(A )纯H 2O (B )0.1mol .L -1 氨水 (C)0.1mol .L -1NH 4Cl
(D) 0.1mol .L -1HCl________________________。
3.某溶液中含有 CaF 2 (s)(K sp = 1.5 ⨯ 10-10)和 CaCO 3 (s)(K sp = 5.0 ⨯ 10 -9 ),若 c (F -)= 2.0 ⨯ 10-4mol .L -1 , 则 c (CO 32-) 为 ____________。
4.Ag 2SO 4饱和水溶液中,溶解浓度为2.5 × 10-2mol · L -1,其溶度积K sp 为__________。
Ag 2SO 4在0.5mol · L -1的AgNO 3溶液中溶解度应为________ mol .L -1。
将Ag 2SO 4溶于0.625 mol .L -1的硫酸中,溶解度应为________ mol .L -1。
5.CaF 2溶解度为2×10-4mol .L -1,它的溶度积K sp 为_____________________。
6.要 将 Mg(OH)2 与 Fe (OH)3 沉 淀 分 离, 可 加 入______________ 试 剂 。
7.Ag 2S 可 溶 于 HNO 3 , 主 要 原 因 是__________________________
_________________________________ ____ , 反 应 式 为
________________________________________________。
8.佛尔哈德法中的直接法是在含有Ag +的酸性溶液中,以________作指示剂,用________作滴定剂的分析方法。
9.用莫尔法测Cl -时的适宜pH 范围是________,滴定剂是________,指示剂是________。
10.卤化银对卤化物和几种吸附指示剂的吸附的次序为, I ->SCN ->Br ->曙红>Cl ->荧光黄。
因此,滴定C1-时应选________。
11.用佛尔哈德法测C1-时,若不采用加硝基苯等方法,分析结果将________;。