紫杉醇生产工艺
- 格式:ppt
- 大小:588.00 KB
- 文档页数:36

紫杉醇工厂化生产流程1.紫杉醇是一种重要的抗癌药物。
Paclitaxel is an important anti-cancer drug.2.它可以从紫杉树的树皮中提取得到。
It can be extracted from the bark of the Pacific yew tree.3.为了实现工厂化生产,首先需要收集大量的紫杉树皮。
To achieve industrial production, a large amount ofPacific yew bark needs to be collected first.4.收集的树皮会被送往生产基地进行初步处理。
The collected bark will be sent to the production basefor initial processing.5.首先,树皮会被剥离并清洗干净。
First, the bark will be stripped and cleaned.6.接下来,经过干燥处理,去除多余水分。
Next, after drying, excess moisture will be removed.7.处理后的树皮会被切碎或研磨成粉末。
The processed bark will be chopped or ground into powder.8.粉末会被放入提取设备中进行浸提过程。
The powder will be placed in an extraction device for the extraction process.9.通过溶剂提取,紫杉醇会被从树皮中提取出来。
Through solvent extraction, paclitaxel will be extracted from the bark.10.提取后的液体会被加热蒸发,得到纯净的紫杉醇溶液。
The extracted liquid will be heated and evaporated to obtain a pure solution of paclitaxel.11.紫杉醇溶液会通过过滤和结晶得到固态的紫杉醇结晶体。

1、紫杉醇的提取——溶剂萃取法溶剂萃取法常用于紫杉醇的粗提阶段。
紫杉醇的粗提阶段又可分为初级萃取和次级萃取。
在这两级萃取过程中,溶剂的选择对于精提产物的质量和过程经济性具有重要影响。
初级萃取和次级萃取一般采用的溶剂系统不同。
各个时期的研究者对这两个过程的溶剂系统的研究结果已有详细的总结。
最近、日本学者对紫杉醇提取的溶剂种类进行了详细的研究,结果表明:在乙酸乙酯、乙醚、乙腈、丙酮、甲醇、已烷、异丙醇、乙酸乙酯-甲醇、乙酸乙酯-二氯甲烷、乙酸乙酯-丙酮、乙酸乙酯-乙醚等溶剂中,以乙酸乙酯-丙酮(1:1)混和溶剂提取的效果最好,所得浸膏仅为植物干重的7.70%,紫杉醇的含量高达浸膏的0.084%,而用甲醇提取所得浸膏为植物干重的20.98%,紫杉醇的含量为浸膏的0.027%,尚需要多次抽提才能得到紫杉醇含量较高的浸膏。
现在看来利用乙酸乙酯-丙酮(1:1)一次便可以使紫杉醇提取量高于以往常用溶剂所能得到的量,这就为后序的分离纯化工作带来很大的方便,由于乙酸乙酯-丙酮(1:1)的价格与甲醇的价格相当,且可回收再利用,因此,这一提取方法的经济性较为合理。
在初级萃取过程中引入超声技术,可大大缩短初级萃取过程的时间。
例如Xu采用甲醇-二氯甲烷(95.5)作初级溶剂,所需萃取时间约为35-60min。
在溶剂系统不变的情况下,将原料与溶剂的混和物进行超声振荡,萃取达到平衡的时间缩短到仅5min,与此对比,Hoke 等人采用纯甲醇作为初级溶剂,无超声振荡,所需时间长达16-48h。
超声技术的引入,除可大大缩短萃取平衡时间外,还可以使初级萃取在低温下进行,从而避免了紫杉醇在高温下转化为其它物质而造成收率降低。
2、紫杉醇的提取——色谱法早期的色谱纯化紫杉醇工艺是采用多根硅胶层析柱串联的一种操作,因为硅胶对紫杉醇的不可逆吸附造成的损失很大,使得紫杉醇的收率很低,仅为0.004%左右。
近年来,随着色谱技术的进步,不断有新的色谱技术被引入到紫杉醇的分离提取过程中来。

紫杉醇(paclitaxel,商品名Taxol)是当今一种重要的抗癌新药。
早在1971年,Wani等就从红豆杉树皮中发现并分离出了这种物质。
由于它特异的临床抗癌疗效,1992年被美国FAD批准为治疗晚期乳腺癌的特效药而上市。
然而,在实际药物生产中,紫杉醇的大规模制备仍存在许多问题。
首先,紫杉醇来源匮乏,其主要存在于红豆杉树皮和针叶中,其次,紫杉醇在植物中含量极低,大约为0.010%~0.013%,而紫杉醇与其它紫杉烷化合物在化学结构和极性等方面又极为相似,要将它们完全分离困难很大。
关于紫杉醇提取分离方法,已有过不少的研究。
其中以液-液萃取应用最为广泛,在文献报道的每一种工艺中,几乎都采用过它。
Willey等和Mattina等在测定样品中紫杉醇浓度时,选择了固相萃取作为HPLC分析的预处理。
以分子间吸附为机理的硅胶柱层析,是制备紫杉醇最常用的方法之一。
1984年,Senilh等曾采用氧化铝柱层析处理红豆杉浸膏,但所报道的分离效果不是太理想。
1995年,Matysik等曾用制备薄层层析来少量获取紫杉醇。
本研究的目的,在于寻找一条切实可行的工艺路线,最大程度地提高紫杉醇的回收率,以充分利用有限的红豆杉资源;采用一些高效、经济的提取分离方法,减少过程步骤,快速、简捷地提取出紫杉醇。
1 材料方法1.1 材料红豆杉树皮提取浸膏,云南张峰植物加工厂;紫杉醇对照品,纯度大于95%,Sigma;固相萃取柱(C18填料,10ml),大连化学物理研究所;GF254硅胶和粗孔硅胶(100~140目),青岛海洋化工厂;层析氧化铝(200~300目),上海新诚精细化学品有限公司。
DU-7紫外/可见分光光度计及FL-750HPLC仪,Beckman公司;XZ-6A旋转蒸发器,北京科龙仪器公司;常压层析系统,Pharmacia公司。
1.2 方法1.2.1 液-液萃取称取红豆杉树皮浸膏于锥形瓶中,加CH2Cl2(浸膏CH2Cl2的重量比为1:50),充分溶解,再加入与CH2Cl2等量的水,充分混合后静置分层,分液回收有机相,弃水相。


微生物发酵生产紫杉醇产品介绍及社会价值:紫杉醇是一种二萜类衍生物,是当前公认的广谱、活性强的抗癌药物之一⋯。
紫杉醇最早是wanj等于1971年从短枝红豆杉(7Ikusbreviifolia)树皮中分离得到的。
随后,schiff等证实紫杉醇具有独特的抗癌机制。
随着紫杉醇的临床应用,对其研究也逐渐深入,其主要抗癌机制为抑制肿瘤细胞的微管(Microtllbules)合成,以阻断细胞分裂,致使肿瘤体积逐渐缩小;紫杉醇还可诱导细胞凋亡,另外还有类似脂多糖(IPS)的作用,可调节机体的免疫功能。
目前国际市场上的紫杉醇仍依靠从红豆杉树皮提取及半合成,迄今为止尚未见有第三种形式形成大规模工业化生产的报道。
紫杉醇的工业生产受到了原料和技术两方面的制约,短期内难以突破。
为了解决红豆杉资源短缺与紫杉醇需求量的日益增加的矛盾,人们对生产紫杉醇进行了多方面的研究,包括化学全合成、红豆杉细胞培养及微生物发酵。
微生物发酵法生产紫杉醇因具有明显优势,其研究和开发越来越受到国内外研究学者的广泛关注。
这里提出一种运用基因工程,代谢工程,发酵工程结合的方法生产紫杉醇,该法首先将杉醇纯合成基因克隆至大肠杆菌,让其高产紫杉二烯,再把它流加至高产紫杉醇酵母的发酵罐中,运用代谢工程手段生产紫杉醇。
创新点:运用克隆方法,将合成紫杉二烯的代谢过程酶的结构基因,以及调控系列克隆至大肠杆菌,让其表达,此过程刚被Parayil Kumaran Ajikumar及其同事实现,而运用代谢工程手段让高产紫杉醇酵母利用紫杉二烯这个前体高产紫杉醇,这是没尝试但可行的。
国内外研究:1、分离菌种:最早stierle和strobel等在短叶红豆杉的枝条上分离到一种内生真菌,能够产生紫杉醇,定名为安德列亚霉。
此后,各国学者纷纷开展产紫杉醇内生真菌的分离工作,陆续从西藏红豆杉、云南红豆杉、东北红豆杉、欧洲红豆杉、中国红豆杉中分离到产紫杉醇的内生真菌,其宿主植物几乎涉及红豆杉属的各个种。

紫杉醇原料及其注射液有关物质检查中需注意的问题紫杉醇原料及其注射液均为已有国家标准品种(标准编号分别为:WS1-(X-025)-2001Z和WS1-(X-026)-2001Z),美国药典28版亦有收载。
目前国内有多家厂家申请仿制本品,在审评中我们发现存在一些问题,提出来与大家共同商榷。
紫杉醇最早是从红豆杉的树皮中提取的,现在主要的生产工艺为从植物中提取后,用硅胶柱分离纯化,或半合成制成。
因为系从天然植物中提取,紫杉醇的杂质较为复杂,USP中有关物质检查方法有二种,方法一用于从植物中提取分离产品,方法二用于半合成产品的检测。
二个方法所用流动相一致,均为乙腈和水,只是梯度洗脱的初始溶剂强度和梯度变化速率不同,但方法一所用的色谱柱填料为L43,方法二为C18柱,其中方法二与国家标准品种(WS1-(X-025)-2001Z)较接近。
从上述列表可以看出美国药典和国家标准均采用梯度洗脱法测定有关物质,究其原因,本品的杂质的分配系数相差较大,用等度洗脱,如洗脱强度不足,则7-表紫杉醇类杂质可能无法出峰。
如洗脱强度过大,则易引起杂质峰与紫杉醇峰的重叠。
目前部分研制单位将有关物质检查改为用乙腈-水(40:60)等度洗脱,但未提供详细的方法学研究,只提供了酸、碱、氧化、光照、热破坏后分离情况。
虽然等度洗脱可以避免基线的波动,但未证明等度洗脱条件对杂质的检测能力。
从美国药典提供的相对保留时间分析,采用梯度洗脱,通过加大有机相的比例,洗脱难度较大的杂质7-表紫杉醇得以洗脱,相对保留时间为1.4,如采用等度洗脱,则可能导致该杂质无法洗脱或虽能出峰,但峰形变得平坦,影响检测灵敏度。
因此,如提出方法的修改,需要将变更后方法同国家标准中的方法进行比较,考证变更后方法是否能有效洗脱和检测可能的有关物质,并对两种方法的检测结果进行对比。
在进行充分的方法学对比的基础上,分析修订方法是否可行。
如修订后方法无明显优势,不推荐修订国家标准中所收载的业已经验证的方法。

紫杉醇的提取工艺研究紫杉醇提取纯化方法的研究进展紫杉醇是最早从红豆杉属植物中分离出来的三环二菇类化合物,是继阿霉素和顺铂之后最热点的抗癌新药。
紫杉醇具有复杂的化学结构,分子由3个主环构成二菇核,分子中有11个手性中心和多个取代基团,母环部分是一个复杂的四环体系,有许多功能基团和立体化学特征。
分子式C47H51NO14,分子量853.92。
同位素示踪表明, 紫杉醇只结合到聚合的微管上, 不与未聚合的微管蛋白二聚体反应。
细胞接触紫杉醇后会在细胞内积累大量的微管,这些微管的积累干扰了细胞的各种功能,特别是使细胞分裂停止于有丝分裂期,阻断了细胞的正常分裂。
通过Ⅱ-Ⅲ临床研究,紫杉醇主要适用于卵巢癌和乳腺癌,对肺癌、大肠癌、黑色素瘤、头颈部癌、淋巴瘤、脑瘤也都有一定疗效。
紫杉醇属于有丝分裂抑制剂,它的独特机制在于可以诱导和促进微管蛋白聚合,促进微管装配及阻止微管的生理解聚,由此抑制癌细胞纺锤体的形成,阻止有丝分裂的完成,使其停留在G2期和M期直至死亡,从而起到抗癌的作用。
迄今为止紫杉醇是唯一促进微管聚合的新型抗癌药。
这一新的发现引起了各国医药界的极大兴趣。
现在已有包括我国在内的十多个国家批准了紫杉醇类药物的正式生产。
目前有关紫杉醇研究的几个主要问题是:紫杉醇的提取;紫杉醇的人工合成;紫杉醇的临床应用(水不溶性问题的解决);紫杉醇的构效关系;紫杉醇的抗癌机理。
紫杉醇的抗癌机理1971年,Wani等报道了紫杉醇在一些实验体系中具有抗癌活性。
1978年,Schiff等发现紫杉醇在极低的浓度下(0.25μM)可以完全抑制Hela细胞的分裂,而且在对细胞4小时的培养过程中,对DNA、RNA和蛋白质的合成没有明显影响。
Hela细胞在与紫杉醇共同温育20小时后被阻断在G2后期和M期。
1979年Schiff等用浊度法进行了研究,发现紫杉醇能缩短微管在体外的聚合时间,使平衡向微管聚合方向移动,从而减小微管聚合临界浓度。
在有GTP时,紫杉醇可以和PC-tubulin结合,计量比为1:1。


微生物发酵生产紫杉醇产品介绍及社会价值:紫杉醇是一种二萜 类衍生物,是当前公认的广谱、活性强的 抗癌药物之一 ?。
紫杉醇最早是wanj 等于1971 年从短枝红豆杉(7lkusbreviifolia) 树皮中分离得到的。
随后, schiff 等证实 紫杉醇具有独特的抗癌机制。
随着紫杉醇 的临床应用,对其研究也逐渐深入,其主 要抗癌机制为抑制肿瘤细胞的微管 (Microtllbules) 合成,以 阻断细胞分裂,致使肿瘤体积逐渐缩小;的作用,可调节机体的免疫功能。
目前国际市场上的紫杉醇仍依靠从红豆杉树皮提取及半合 成,迄今为止尚未见有第三种形式形成大规模工业化生产的报道。
紫杉醇的工业生产受到了 原料和技术两方面的制约, 短期内难以突破。
为了解决红豆杉资源短缺与紫杉醇需求量的日 益增加的矛盾,人们对生产紫杉醇进行了多方面的研究,包括化学全合成、红豆杉细胞培养 及微生物发酵。
微生物发酵法生产紫杉醇因具有明显优势,其研究和开发越来越受到国内外 研究学者的广泛关注。
这里提出一种运用基因工程,代谢工程,发酵工程结合的方法生产紫杉醇, 该法首先将杉醇 纯合成基因克隆至大肠杆菌,让其高产紫杉二烯,再把它流加至高产紫杉醇酵母的发酵罐中, 运用代谢工程手段生产紫杉醇。
创新点:运用克隆方法,将合成紫杉二烯的代谢过程酶的结构基因,以及调控系列克隆至大 肠杆菌,让其表达,此过程刚被 Parayil Kumaran Ajikumar 及其同事实现,而运用代谢工程手 段让高产紫杉醇酵母利用紫杉二烯这个前体高产紫杉醇,这是没尝试但可行的。
国内外研究:1、 分离菌种:最早stierle 和strobel 等在短叶红豆杉的枝条上分离到一种内生真菌,能够产生紫杉醇,定名为安德列亚霉。
此后, 各国学者纷纷开展产紫杉醇内生真菌的分离工作, 陆续 从西藏红豆杉、云南红豆杉、东北红豆杉、欧洲红豆杉、 中国红豆杉中分离到产紫杉醇的内 生真菌,其宿主植物几乎涉及红豆杉属的各个种。
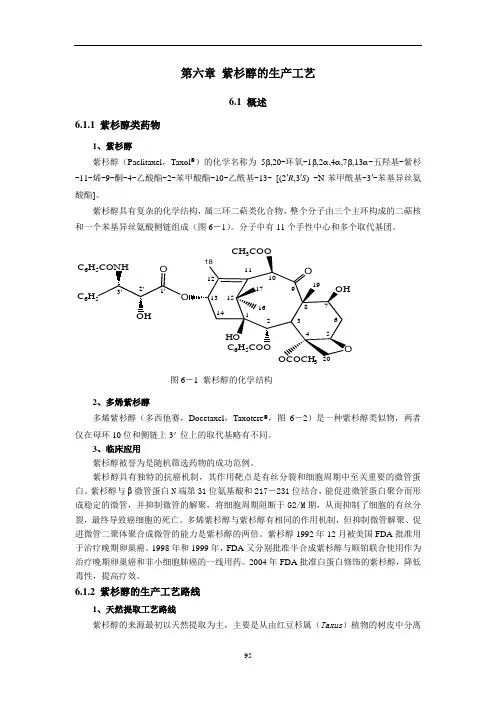
第六章紫杉醇的生产工艺6.1 概述6.1.1 紫杉醇类药物1、紫杉醇紫杉醇(Paclitaxel,Taxol®)的化学名称为5β,20-环氧-1β,2α,4α,7β,13α-五羟基-紫杉-11-烯-9-酮-4-乙酸酯-2-苯甲酸酯-10-乙酰基-13-[(2′R,3′S) -N-苯甲酰基-3′-苯基异丝氨酸酯]。
紫杉醇具有复杂的化学结构,属三环二萜类化合物,整个分子由三个主环构成的二萜核和一个苯基异丝氨酸侧链组成(图6-1)。
分子中有11个手性中心和多个取代基团。
图6-1 紫杉醇的化学结构2、多烯紫杉醇多烯紫杉醇(多西他赛,Docetaxel,Taxotere®,图6-2)是一种紫杉醇类似物,两者仅在母环10位和侧链上3'位上的取代基略有不同。
3、临床应用紫杉醇被誉为是随机筛选药物的成功范例。
紫杉醇具有独特的抗癌机制,其作用靶点是有丝分裂和细胞周期中至关重要的微管蛋白。
紫杉醇与β微管蛋白N端第31位氨基酸和217-231位结合,能促进微管蛋白聚合而形成稳定的微管,并抑制微管的解聚,将细胞周期阻断于G2/M期,从而抑制了细胞的有丝分裂,最终导致癌细胞的死亡。
多烯紫杉醇与紫杉醇有相同的作用机制,但抑制微管解聚、促进微管二聚体聚合成微管的能力是紫杉醇的两倍。
紫杉醇1992年12月被美国FDA批准用于治疗晚期卵巢癌。
1998年和1999年,FDA又分别批准半合成紫杉醇与顺铂联合使用作为治疗晚期卵巢癌和非小细胞肺癌的一线用药。
2004年FDA批准白蛋白修饰的紫杉醇,降低毒性,提高疗效。
6.1.2 紫杉醇的生产工艺路线1、天然提取工艺路线紫杉醇的来源最初以天然提取为主,主要是从由红豆杉属(Taxus)植物的树皮中分离得到。
2、生物合成工艺目前,已有前体饲喂、添加诱导子、两相培养等技术在红豆杉细胞培养中相继使用。
在进一步研究紫杉醇的生物合成途径与调控、规模反应器放大规律的基础上,提高生产率,增加经济可行性,使得细胞培养过程被认为是相当有潜力的路线。

微生物发酵生产紫杉醇产品介绍及社会价值:紫杉醇是一种二萜类衍生物,是当前公认的广谱、活性强的抗癌药物之一⋯。
紫杉醇最早是wanj等于1971年从短枝红豆杉(7Ikusbreviifolia)树皮中分离得到的。
随后,schiff等证实紫杉醇具有独特的抗癌机制。
随着紫杉醇的临床应用,对其研究也逐渐深入,其主要抗癌机制为抑制肿瘤细胞的微管(Microtllbules)合成,以阻断细胞分裂,致使肿瘤体积逐渐缩小;紫杉醇还可诱导细胞凋亡,另外还有类似脂多糖(IPS)的作用,可调节机体的免疫功能。
目前国际市场上的紫杉醇仍依靠从红豆杉树皮提取及半合成,迄今为止尚未见有第三种形式形成大规模工业化生产的报道。
紫杉醇的工业生产受到了原料和技术两方面的制约,短期内难以突破。
为了解决红豆杉资源短缺与紫杉醇需求量的日益增加的矛盾,人们对生产紫杉醇进行了多方面的研究,包括化学全合成、红豆杉细胞培养及微生物发酵。
微生物发酵法生产紫杉醇因具有明显优势,其研究和开发越来越受到国内外研究学者的广泛关注。
这里提出一种运用基因工程,代谢工程,发酵工程结合的方法生产紫杉醇,该法首先将杉醇纯合成基因克隆至大肠杆菌,让其高产紫杉二烯,再把它流加至高产紫杉醇酵母的发酵罐中,运用代谢工程手段生产紫杉醇。
创新点:运用克隆方法,将合成紫杉二烯的代谢过程酶的结构基因,以及调控系列克隆至大肠杆菌,让其表达,此过程刚被Parayil Kumaran Ajikumar及其同事实现,而运用代谢工程手段让高产紫杉醇酵母利用紫杉二烯这个前体高产紫杉醇,这是没尝试但可行的。
国内外研究:1、分离菌种:最早stierle和strobel等在短叶红豆杉的枝条上分离到一种内生真菌,能够产生紫杉醇,定名为安德列亚霉。
此后,各国学者纷纷开展产紫杉醇内生真菌的分离工作,陆续从西藏红豆杉、云南红豆杉、东北红豆杉、欧洲红豆杉、中国红豆杉中分离到产紫杉醇的内生真菌,其宿主植物几乎涉及红豆杉属的各个种。
第二十卷第六册2010年12月口腔护理用品工业ORAL CARE I N DUSTRY41紫杉醇生产工艺精选李 全(昆明牙膏有限责任公司650221)摘 要:以云南红豆杉枝叶为原料,通过三次柱层析、二次重结晶,利用目前国际上先进的加压柱层析设备,确定精确的工艺参数和条件,提取含量超过99%的紫杉醇。
关键词:红豆杉 紫杉醇 生产工艺1 紫杉醇产品介绍1 1 产品相关知识产品名称:红豆素I(紫杉醇)。
英文名:Paclitaxel 。
产品化学名:{2a R -[2a ,4 ,4a ,6 ,9 ( *, S*),11 ,12 ,12a ,12b ]}-(9C I), -苯甲酰胺)- -羟基-6,12b-双(乙酰氧基)-2 ,3,4,4 ,5,6,9,10,11,12,12 ,12b-十二氢-4,11-二羟基-4 ,8,13,13-四甲基-5-氧代-7,11-甲撑-1H -环+(3,4)苯(1,2b)氧桥-9-脂基苯丙酮酸。
分子式:C 47H 51NO 14。
分子量:853.9。
化学结构式:其他名称:Taxol 或Taxol A 。
美国化学文摘号:[33069-62-4]。
化学分类:二萜类紫杉烷。
性状:外观近白色粉末。
熔点:208~210 。
比旋度:[ ]020:-49 ~-54 。
紫外最大吸收波长:227nm 。
鉴别:红外吸收光谱、紫外吸收光谱、核磁共振波谱、质谱。
溶解度:可溶于氯仿、乙醇、甲醇及丙酮,不溶于水。
吸湿性:紫杉醇具有一定的吸湿性,在室温空气中能够快速吸湿至饱和,所吸湿水分在5~45 ,真空度:-0.08~-0.06MPa 下可干燥除去。
产品纯度:紫杉醇含量!99%。
1.2 产品使用范围及用途紫杉醇对药物难治性卵巢癌和转移性乳腺癌、非小细胞癌有显著疗效,对B16黑色素瘤、S180肉瘤及P338、L1210、II L60、P1534白血病也有较好治疗作用,对头颈部癌、食道癌也有一定疗效。
此外,红豆杉植物中含有的二萜类紫杉烷化合物,如三尖杉磷碱、巴卡亭III 、10-去乙酰巴卡亭III 、1-羟基巴卡亭I 和10-去乙酰-7-差向紫杉醇等,具有通经、利尿、抗癌症功能,主治肾炎、小便不利、糖尿病。
紫杉醇半合成
紫杉醇半合成是一种化学过程,通过该过程,可以从天然来源的植物中提取紫杉醇,然后将其转化为具有更高活性的形式。
这个过程需要使用一系列的化学反应和分离技术,以确保最终产品的纯度和质量。
紫杉醇是一种具有抗癌活性的天然产物,它被广泛用于治疗乳腺癌、肺癌、卵巢癌等多种癌症。
然而,天然来源的紫杉醇含量较低,因此需要进行半合成以提高其产量和纯度。
半合成紫杉醇的过程通常包括以下步骤:
1. 从植物中提取紫杉醇:这通常需要使用溶剂或其他提取方法来从植物中分离出紫杉醇。
2. 转化反应:将提取的紫杉醇进行一系列的化学反应,以将其转化为具有更高活性的形式。
3. 分离和纯化:通过一系列的分离和纯化技术,如结晶、过滤、蒸馏等,以获得高纯度的半合成紫杉醇。
半合成紫杉醇具有更高的抗癌活性和更低的副作用,因此被广泛应用于临床治疗。
然而,这个过程需要高度专业化的技术和设备,以确保最终产品的质量和安全性。