保健食品安全性毒理学评价程序
- 格式:ppt
- 大小:2.95 MB
- 文档页数:56





保健食品功能学评价程序和检验方法(1996年7月18日卫监发[1996]38号发布,自发布之日起实行1.主题内容和适用范围本程序和检验方法规定了评价食品保健作用的统一程序和检验方法。
本程序和检验方法适用于评价食品的免疫调节、延缓衰老、改善记忆、促进生长发育、抗疲劳、减肥、耐缺氧、抗辐射、抗突变、抑制肿瘤、调节血脂、改善性功能等作用。
本程序和检验方法规定了评价食品保健作用的人体试食试验规程。
2.进行食品保健作用评价的基本要求2.1对受试物的要求2.1.1提供受试物的物理、化学性质(包括化学结构、纯度、稳定性等)等有关资料。
2.1.2受试物必须是规格化的产品,即符合既定的生产工艺、配方及质量标准。
2.1.3提供受试物安全性毒理学评价的资料,受试物必须是已经过食品安全性毒理学评价确认为安全的物质。
2.2对实验动物的要求2.2.1根据各种试验的具体要求,合理选择实验动物。
常用大鼠和小鼠,品系不限,推荐使用近交系动物。
2.2.2 动物的性别不限,可根据试验需要进行选择。
动物的数量的要求为小鼠每组至少10只(单一性别),大鼠每组至少8只(单一性别)。
动物的年龄可根据具体试验需要而定。
2.2.3 动物应达到二级实验动物的要求。
2.3 给受试物的剂量及时间2.3.1 各种试验至少应设3个剂量组,1个对照组,必要时可设阳性对照组。
剂量选择应合理,尽可能找出最低有效剂量。
在3个剂量组中,其中一个剂量应相当于人推荐摄入量的5-10倍左右。
2.3.2 给受试物的时间应根据具体试验而定,原则上至少1个月。
3.试验项目、试验原则及结果判定3.1 免疫调节作用3.1.1 试验项目3.1.1.1.1 脏器/体重比值胸腺/体重比值脾脏/体重比值3.1.1.1.2 细胞免疫功能测定小鼠脾淋巴细胞转化实验迟发型变态反应3.1.1.1.3 体液免疫功能测定抗体生成细胞检测血清溶血素测定3.1.1.1.4 单核-巨噬细胞功能测定小鼠碳廓清试验小鼠腹腔巨噬细胞吞噬鸡红细胞试验3.1.1.1.5 N细胞活性测定3.1.1.2 人体试食试验3.1.1.2.1 细胞免疫功能测定外周血淋巴细胞转化试验3.1.1.2.2 体液免疫功能试验单向免疫扩散法测定IgG、IgA、IgM3.1.1.2.3 非特异性免疫功能测定吞噬与杀菌试验3.1.1.2.4 N细胞活性测定3.1.2 试验原则要求选择一组能够全面反映免疫系统各方面功能的试验,其中细胞免疫、体液免疫、单核-巨噬细胞功能三个方面至少各选择1种试验,在确保安全的前提下尽可能进行人体试食试验。
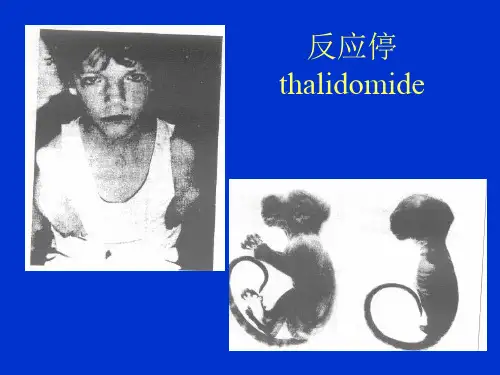

食品安全性毒理学评价程序(试行)正文:---------------------------------------------------------------------------------------------------------------------------------------------------- 食品安全性毒理学评价程序(试行)(1985年12月1日卫生部)前言为了保障广大消费者的健康,对于直接和间接用于食品的化学物质进行安全性评价是一项极为重要的任务。
根据目前我国的具体情况,制定一个统一的食品安全性毒理学评价程序,将有利于推动此项工作的开展,也便于将彼此的结果进行比较,随着科学技术和事业的发展此程序将不断得到修改完善。
目的为我国食品安全性毒理学评价工作提供一个统一的评价程序和各项实验方法,为制定食品添加剂的使用限量标准和食品中污染物及其他有害物质的允许含量标准,并为评价新食物资源,新的食品加工、生产和保藏方法,提供毒理学依据,特制定本程序。
适用范围一、用于食品生产、加工和保藏的化学和生物物质,如食品添加剂,食品加工用微生物等。
二、食品生产、加工、运输、销售和保藏等过程中产生和污染的有害物质,如农药残留、重金属、生物毒素、包装材料溶出物、放射性物质和洗涤消毒剂(用于食品容器和食品用工具)等。
三、新食物资源及其成份。
四、食品中其他有害物质。
总则在评价一种物质的安全性时,应全面考虑以下几方面的因素,以进行综合评价:一、化学结构:可以根据化学结构预测其毒性。
二、理化性质和纯度:试验样品必须符合既定的生产工艺、配方和理化性质。
其纯度应与实际应用的相同。
需要鉴别其毒性作用系该物质本身的作用还是杂质的作用,或进行其它特殊试验时可用纯品。
必要时应考虑杂质的毒性。
如农药,一般用原药,但对我国创制的新农药,则应同时用纯品和原药进行试验。
三、人的可能摄入量:除一般人群的摄入量外,还应考虑特殊和敏感人群(如儿童、孕妇及高摄入量人群)。

中华人民共和国国家标准食品安全性毒理学评价程序1 主题内容与适用范围本标准规定了食品安全性毒理学评价的程序.本标准适用于评价食品生产、加工、保藏、运输和销售过程中使用的化学和生物物质以及在这些过程中产生和污染的有害物质,食物新资源及其成分和新资源食品。
也适用于食品中其他有害物质。
2 受试物的要求 2.1 提供受试物(必要时包括杂质)的物理、化学性质(包括化学结构、纯度、稳定性等)。
2.2 受试物必须是符合既定的生产工艺和配方的规格化产品,其纯度应与实际应用的相同,在需要检测高纯度受试物及其可能存在的杂质的毒性或进行特殊试验时可选用纯品,或以纯品及杂质分别进行毒性检验。
3 食品安全性毒理学评价试验的四个阶段和内容及选用原则3.1 毒理试验的四个阶段和内容3。
1.1 第一阶段:急性毒性试验.经口急性毒性:LD50,联合急性毒性.3。
1.2 第二阶段:遗传毒性试验,传统致畸试验,短期喂养试验.遗传毒性试验的组合必须考虑原核细胞和真核细胞、生殖细胞与体细胞、体内和体外试验相结合的原则.3.1.2。
1 细菌致突变试验:鼠伤寒沙门氏菌/哺乳动物微粒体酶试验(Ames试验)为首选项目,必要时可另选和加选其他试验。
3。
1.2.2 小鼠骨髓微核率测定或骨髓细胞染色体畸变分析。
3.1。
2.3 小鼠精子畸形分析和睾丸染色体畸变分析。
3。
1.2.4 其他备选遗传毒性试验:V79/HGPRT基因突变试验、显性致死试验果蝇伴性隐性致死试验,程序外DNA修复合成(UDS)试验。
3。
1.2.5 传统致畸试验3.1.2.6 短期喂养试验:30d喂养试验。
如受试物需进行第三、四阶段毒性试验者,可不进行本试验.3。
1.3 第三阶段:亚慢性毒性试验——90d喂养试验、繁殖试验、代谢试验.3.1。
4 第四阶段:慢性毒性实验(包括致癌试验)。
3。
2 对不同受试物选择毒性试验的原则3.2.1 凡属我国创新的物质一般要求进行四个阶段的试验。


中华人民共和国国家标准食品安全性毒理学评价程序1 主题内容与适用范围本标准规定了食品安全性毒理学评价的程序。
本标准适用于评价食品生产、加工、保藏、运输和销售过程中使用的化学和生物物质以及在这些过程中产生和污染的有害物质,食物新资源及其成分和新资源食品。
也适用于食品中其他有害物质。
2 受试物的要求 2.1 提供受试物(必要时包括杂质)的物理、化学性质(包括化学结构、纯度、稳定性等)。
2.2 受试物必须是符合既定的生产工艺和配方的规格化产品,其纯度应与实际应用的相同,在需要检测高纯度受试物及其可能存在的杂质的毒性或进行特殊试验时可选用纯品,或以纯品及杂质分别进行毒性检验。
3 食品安全性毒理学评价试验的四个阶段和内容及选用原则3.1 毒理试验的四个阶段和内容3.1.1 第一阶段:急性毒性试验。
经口急性毒性:LD50,联合急性毒性。
3.1.2 第二阶段:遗传毒性试验,传统致畸试验,短期喂养试验。
遗传毒性试验的组合必须考虑原核细胞和真核细胞、生殖细胞与体细胞、体内和体外试验相结合的原则。
3.1.2.1 细菌致突变试验:鼠伤寒沙门氏菌/哺乳动物微粒体酶试验(Ames试验)为首选项目,必要时可另选和加选其他试验。
3.1.2.2 小鼠骨髓微核率测定或骨髓细胞染色体畸变分析。
3.1.2.3 小鼠精子畸形分析和睾丸染色体畸变分析。
3.1.2.4 其他备选遗传毒性试验:V79/HGPRT基因突变试验、显性致死试验果蝇伴性隐性致死试验,程序外DNA修复合成(UDS)试验。
3.1.2.5 传统致畸试验3.1.2.6 短期喂养试验:30d喂养试验。
如受试物需进行第三、四阶段毒性试验者,可不进行本试验。
3.1.3 第三阶段:亚慢性毒性试验——90d喂养试验、繁殖试验、代谢试验。
3.1.4 第四阶段:慢性毒性实验(包括致癌试验)。
3.2 对不同受试物选择毒性试验的原则3.2.1 凡属我国创新的物质一般要求进行四个阶段的试验。

保健食品功能学评价程序和检验方法1主题内容和适用范围本程序和检验方法规定了评价食品保健作用的统一程序和检验方法。
本程序和检验方法适用于评价食品的免疫调节、延缓衰老、改善记忆、促进生长发育、抗疲劳、减肥、耐缺氧、抗辐射、抗突变、抑制肿瘤、调节血脂、改善性功能等作用。
本程序和检验方法规定了评价食品保健作用的人体试食试验规程。
2进行食品保健作用评价的基本要求2.1对受试物的要求2.1.1提供受试物的物理、化学性质(包括化学结构、纯度、稳定性等)等有关资料。
2.1.2受试物必须是规格化的产品,即符合既定的生产工艺、配方及质量标准。
2.1.3提供受试物安全性毒理学评价的资料,受试物必须是已经过食品安全性毒理学评价确认为安全的物质。
2.2对实验动物的要求2.2.1根据各种试验的具体要求,合理选择实验动物。
常用大鼠和小鼠,品系不限,推荐使用近交系动物。
2.2.2动物的性别不限,可根据试验要进行选择。
动物的数量的要求为小鼠每组至少10只(单一性别),大鼠每组至少8只(单一性别)。
动物的年龄可根据具体试验要而定。
2.2.3动物应达到二级实验动物的要求。
2.3给受试物的剂量及时间2.3.1各种试验至少应设3个剂量组,1个对照组,必要时可设阳性对照组。
剂量选择应合理,尽可能找出最低有效剂量。
在3个剂量组中,其中一个剂量应相当于人推荐摄入量的5-10倍左右。
2.3.2给受试物的时间应根据具体试验而定,原则上至少1个月。
3试验项目、试验原则及结果判定3.1免疫调节作用3.1.1.1.1脏器/体重比值胸腺/体重比值脾脏/体重比值3.1.1.1.2细胞免疫功能测定小鼠脾淋巴细胞转化实验迟发型变态反应3.1.1.1.3体液免疫功能测定抗体生成细胞检测血清溶血素测定3.1.1.1.4单核-巨噬细胞功能测定小鼠碳廓清试验小鼠腹腔巨噬细胞吞噬鸡红细胞试验3.1.1.1.5NK细胞活性测定3.1.1.2人体试食试验3.1.1.2.1细胞免疫功能测定外周血淋巴细胞转化试验3.1.1.2.2体液免疫功能试验单向免疫扩散法测定IgG、IgA、IgM 3.1.1.2.3非特异性免疫功能测定吞噬与杀菌试验3.1.1.2.4NK细胞活性测定要求选择一组能够全面反映免疫系统各方面功能的试验,其中细胞免疫、体液免疫入单核-巨噬细胞功能三个方面至少各选择1种试验,在确保安全的前提下尽可能进行人体试食试验。
保健食品功能学评价程序和检验方法保健食品功能学评价程序和检验方法1 主题内容和适用范围本程序和检验方法规定了评价食品保健作用的统一程序和检验方法。
本程序和检验方法适用于评价食品的免疫调节、延缓衰老、改善记忆、促进生长发育、抗疲劳、减肥、耐缺氧、抗辐射、抗突变、抑制肿瘤、调节血脂、改善性功能等作用。
本程序和检验方法规定了评价食品保健作用的人体试食试验规程。
2 进行食品保健作用评价的基本要求2.1 对受试物的要求2.1.1 提供受试物的物理、化学性质(包括化学结构、纯度、稳定性等)等有关资料。
2.1.2 受试物必须是规格化的产品,即符合既定的生产工艺、配方及质量标准。
2.1.3 提供受试物安全性毒理学评价的资料,受试物必须是已经过食品安全性毒理学评价确认为安全的物质。
2.2 对实验动物的要求2.2.1 根据各种试验的具体要求,合理选择实验动物。
常用大鼠和小鼠,品系不限,推荐使用近交系动物。
2.2.2 动物的性别不限,可根据试验需要进行选择。
动物的数量的要求为小鼠每组至少10只(单一性别),大鼠每组至少8只(单一性别)。
动物的年龄可根据具体试验需要而定。
2.2.3 动物应达到二级实验动物的要求。
2.3 给受试物的剂量及时间2.3.1 各种试验至少应设3个剂量组,1个对照组,必要时可设阳性对照组。
剂量选择应合理,尽可能找出最低有效剂量。
在3个剂量组中,其中一个剂量应相当于人推荐摄入量的5-10倍左右。
2.3.2 给受试物的时间应根据具体试验而定,原则上至少1个月。
3 试验项目、试验原则及结果判定3.1 免疫调节作用3.1.1 试验项目3.1.1.1.1 脏器/体重比值胸腺/体重比值脾脏/体重比值3.1.1.1.2 细胞免疫功能测定小鼠脾淋巴细胞转化实验迟发型变态反应3.1.1.1.3 体液免疫功能测定抗体生成细胞检测血清溶血素测定3.1.1.1.4 单核-巨噬细胞功能测定小鼠碳廓清试验小鼠腹腔巨噬细胞吞噬鸡红细胞试验3.1.1.1.5 NK细胞活性测定3.1.1.2 人体试食试验3.1.1.2.1 细胞免疫功能测定外周血淋巴细胞转化试验3.1.1.2.2 体液免疫功能试验单向免疫扩散法测定IgG、IgA、IgM3.1.1.2.3 非特异性免疫功能测定吞噬与杀菌试验3.1.1.2.4 NK细胞活性测定3.1.2 试验原则要求选择一组能够全面反映免疫系统各方面功能的试验,其中细胞免疫、体液免疫入单核-巨噬细胞功能三个方面至少各选择1种试验,在确保安全的前提下尽可能进行人体试食试验。