高中化学 专题1 第2单元 第1课时 原电池的工作原理作业苏教版选修4
- 格式:doc
- 大小:51.50 KB
- 文档页数:4
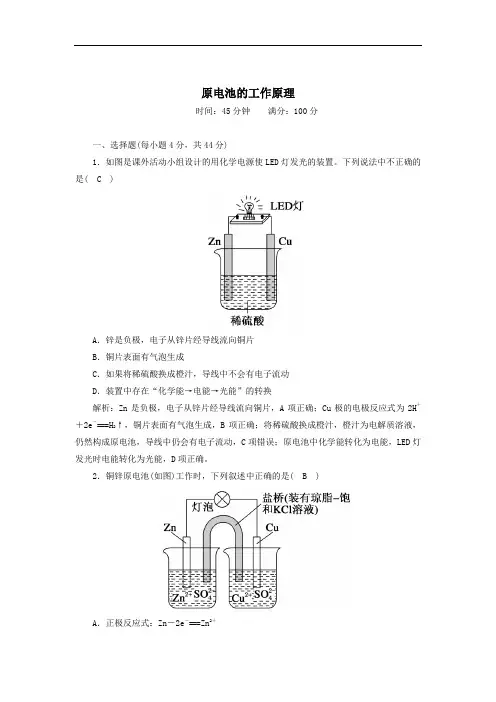
原电池的工作原理时间:45分钟满分:100分一、选择题(每小题4分,共44分)1.如图是课外活动小组设计的用化学电源使LED灯发光的装置。
下列说法中不正确的是( C )A.锌是负极,电子从锌片经导线流向铜片B.铜片表面有气泡生成C.如果将稀硫酸换成橙汁,导线中不会有电子流动D.装置中存在“化学能→电能→光能”的转换解析:Zn是负极,电子从锌片经导线流向铜片,A项正确;Cu极的电极反应式为2H++2e-===H2↑,铜片表面有气泡生成,B项正确;将稀硫酸换成橙汁,橙汁为电解质溶液,仍然构成原电池,导线中仍会有电子流动,C项错误;原电池中化学能转化为电能,LED灯发光时电能转化为光能,D项正确。
2.铜锌原电池(如图)工作时,下列叙述中正确的是( B )A.正极反应式:Zn-2e-===Zn2+B.电池总反应式:Zn+Cu2+===Zn2++CuC.在外电路中,电子从正极流向负极D.盐桥中的K+移向ZnSO4溶液解析:锌比铜活泼,锌作负极,铜作正极,正极反应式应为Cu2++2e-===Cu,故A错误;负极反应式为Zn-2e-===Zn2+,正、负两极反应式相加,得到总反应式:Zn+Cu2+===Zn2++Cu,故B正确;根据原电池工作原理,电子从负极经外电路流向正极,故C错误;根据原电池的工作原理,阳离子移向正极,即盐桥中的K+移向CuSO4溶液,故D错误。
3.图甲和图乙是双液原电池装置。
由图可判断下列说法中错误的是( B )A.图甲电池反应的离子方程式为Cd(s)+Co2+(aq)===Co(s)+Cd2+(aq)B.反应2Ag(s)+Cd2+(aq)===Cd(s)+2Ag+(aq)能够发生C.盐挢的作用是形成闭合回路,并使两边溶液保持电中性D.当图乙中有1 mol电子通过外电路时,正极有108 g Ag析出解析:根据图甲可知,原电池中Cd为负极,Cd失电子,Co2+得电子,所以其电池反应的离子方程式为Cd(s)+Co2+(aq)===Co(s)+Cd2+(aq),金属活动性:Cd>Co,故A正确;根据图乙可知,原电池中Co为负极,Co失电子,Ag+得电子,所以Co(s)+2Ag+(aq)===2Ag(s)+Co2+(aq),金属活动性:Co>Ag,则金属活动性:Cd>Co>Ag,因此反应2Ag(s)+Cd2+(aq)===Cd(s)+2Ag+(aq)不能发生,故B错误;原电池放电时,盐桥中的阴、阳离子定向移动而构成闭合回路,并使两个烧杯中的溶液保持电中性,故C正确;根据Co(s)+2Ag+(aq)===2Ag(s)+Co2+(aq)知,当有1 mol电子通过外电路时,正极有108 g Ag析出,故D 正确。

1.2.1 原电池的工作原理化学电源同步精练苏教版选修4 1.下列叙述正确的是( )①原电池是把化学能转化为电能的一种装置②原电池的正极发生氧化反应,负极发生还原反应③不能自发进行的氧化还原反应,通过原电池的装置均可实现④碳棒不能用来作原电池的正极⑤反应Cu+2Ag+===2Ag+Cu2+,能以原电池的形式来实现A.①⑤ B.①④⑤C.②③④ D.②⑤解析:②原电池负极发生氧化反应,正极发生还原反应;③原电池的反应必须是自发进行的氧化还原反应;④碳棒是导体,可作原电池的正极。
答案:A2.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。
若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c上产生大量气泡,b、d相连时,b 上产生大量气泡,则四种金属的活动性顺序由强到弱的是( )A.a>b>c>d B.a>c>d>bC.c>a>b>d D.b>d>c>a解析:解题时先依据相关条件准确判断正、负极,再根据原电池原理,负极金属的活动性比正极金属的活动性强进行判断。
电子流动方向是由负极流向正极,电流方向与电子流动方向相反,有气泡产生的应为正极,因此可作出如下判断:活动性:①a>b;②c>d;③a>c;④d>b,综合得结论,金属活动性:a>c>d>b。
答案:B3.在图中的8个装置中,能够发生原电池反应的是( )A.①②③⑤⑧ B.③④⑥⑦C.④⑤⑥⑦ D.③⑤⑦解析:构成原电池要有四个基本条件:a.电解质溶液;b.两个电极,其中一个相对较活泼,另一个相对较不活泼,两个电极直接或间接地连接在一起,并插入电解质溶液中;c.能自发地发生氧化还原反应;d.形成闭合回路。
其中,①⑧不满足d条件,②不满足b条件,④不满足a条件,⑥Zn、Cu电极调换位置才能构成原电池。
答案:D4.铜锌原电池(如图)工作时,下列叙述正确的是( )A.正极反应为:Zn-2e-===Zn2+B.电池反应为:Zn+Cu2+===Zn2++CuC.在外电路中,电子从负极流向正极D.盐桥中的K+移向ZnSO4溶液解析:由图示可知该装置为原电池,Zn极(负极)反应为:Zn-2e-===Zn2+;Cu极(正极)反应为:Cu2++2e-===Cu,故电池总反应为:Zn+Cu2+===Cu+Zn2+,故A项错、B项正确;在外电路中,电子由负极流向正极,故C项正确;在盐桥中阳离子移向正极,故D项错。

专题一第二单元第1课时原电池的工作原理基础演练1.下列叙述正确的是( )①原电池是把化学能转化成电能的一种装置②原电池的正极发生氧化反应,负极发生还原反应③不能自发进行的氧化还原反应,通过原电池的装置均可实现④碳棒不能用来作原电池的正极⑤反应Cu+2Ag+===2Ag+Cu2+能以原电池的形式来实现A.①⑤B.①④⑤C.②③④D.②⑤【答案】A【解析】②原电池负极发生氧化反应;③不能实现;④碳棒可以作原电池的正极。
2.某原电池的总反应的离子方程式为:Zn+Cu2+===Zn2++Cu,则该原电池的正确组成可以是下列的( )A BC D【答案】A【解析】由电池反应可知,该原电池的负极为锌,电解质溶液为含Cu2+的溶液,结合原电池的构成条件,A项符合题意。
3.将甲、乙两种金属的性质相比较,已知①甲跟水反应比乙跟水反应剧烈;②甲单质能从乙的盐溶液中置换出乙单质;③甲的最高价氧化物对应水化物的碱性比乙的最高价氧化物对应水化物的碱性强;④与某金属反应时甲原子得电子数目比乙的多;⑤以甲、乙两金属为电极构成原电池,甲作负极。
一定能说明甲的金属性比乙强的是( ) A.①②③B.③⑤C.①②③⑤D.①②③④⑤【答案】A【解析】金属性即金属的还原性,金属的还原性越强,则金属在反应时越易失去电子。
而④中的表述指的是甲原子的氧化性,则甲原子不属于金属原子,不符合要求。
⑤中两种金属作电极,一般是较活泼的金属作负极,但也要具体问题具体分析,如Mg比Al活泼,但Mg、Al、NaOH溶液组成原电池时,Al作负极。
综合应用4.A、B、C、D四种金属按下表中的装置图进行实验。
(1)装置甲中负极的电极反应是________________________________________________________________________。
(2)装置乙中正极的电极反应是________________________________________________________________________。

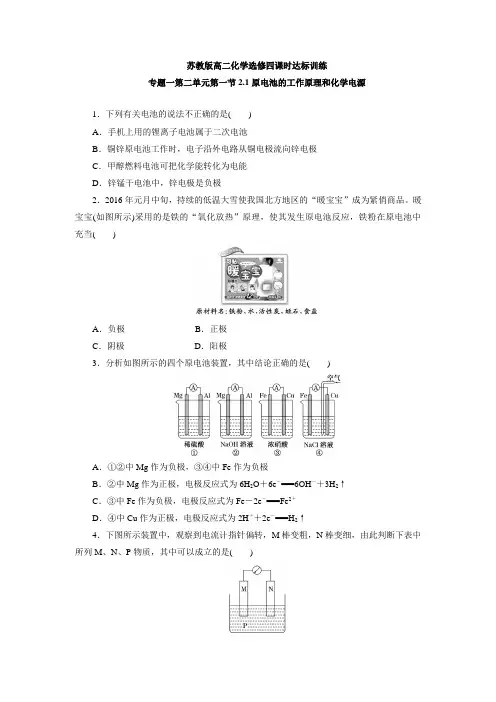
苏教版高二化学选修四课时达标训练专题一第二单元第一节2.1原电池的工作原理和化学电源1.下列有关电池的说法不正确的是()A.手机上用的锂离子电池属于二次电池B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极C.甲醇燃料电池可把化学能转化为电能D.锌锰干电池中,锌电极是负极2.2016年元月中旬,持续的低温大雪使我国北方地区的“暖宝宝”成为紧俏商品。
暖宝宝(如图所示)采用的是铁的“氧化放热”原理,使其发生原电池反应,铁粉在原电池中充当()A.负极B.正极C.阴极D.阳极3.分析如图所示的四个原电池装置,其中结论正确的是()A.①②中Mg作为负极,③④中Fe作为负极B.②中Mg作为正极,电极反应式为6H2O+6e-===6OH-+3H2↑C.③中Fe作为负极,电极反应式为Fe-2e-===Fe2+D.④中Cu作为正极,电极反应式为2H++2e-===H2↑4.下图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是()选项M N PA 锌铜稀硫酸溶液B 铜铁稀盐酸C 银锌硝酸银溶液D 锌铁硝酸铁溶液5.下图甲和乙是双液原电池装置,由图可判断下列说法错误的是()A.甲图电池反应的离子方程式为:Cd(s)+Co2+(aq)===Co(s)+Cd2+(aq)B.2Ag(s)+Cd2+(aq)===Cd(s)+2Ag+(aq)反应能够发生C.盐桥的作用是形成闭合回路,并使两边溶液保持电中性D.乙图当有1 mol电子通过外电路时,正极有108 g Ag析出6.锂电池反应原理如下:FePO4+Li LiFePO4,内部为能够导电的固体电解质。
下列有关该电池说法正确的是()A.可加入硫酸以提高电解质的导电性B.放电时电池内部Li+向负极移动C.放电时,Li发生还原反应D.放电时电池正极反应为:FePO4+e-+Li+===LiFePO47.A、B、C、D四种金属按下表中的装置图进行实验。


第二单元化学能与电能的转化第1课时原电池及化学电源『问题探究1』与图1中原电池的装置相比较,图2装置有什么特点?图1 图2图2中双液原电池具有的特点是:(1)具有盐桥。
取下盐桥,无法形成闭合回路,反应不能进行,可控制原电池反应的进行。
(2)两个半电池完全隔开,Cu2+无法移向锌片,可以获得单纯的电极反应,有利于最大程度地将化学能转化为电能。
「特别提醒」盐桥盐桥中通常装有含琼胶的KCl饱和溶液。
当其存在时,随着反应的进行,Zn棒中的Zn原子失去电子成为Zn2+进入溶液中,使ZnSO4溶液中Zn2+过多,带正电荷。
Cu2+获得电子沉积为Cu,溶液中Cu2+过少,SO2-4过多,溶液带负电荷。
当溶液不能保持电中性时,将阻止放电作用的继续进行。
盐桥的存在就避免了这种情况的发生,其中Cl-向ZnSO4溶液迁移,K+向CuSO4溶液迁移,分别中和过剩的电荷,使溶液保持电中性,反应可以继续进行。
『问题探究2』如何设计电池?利用反应Fe3++Zn===Fe2++Zn2+设计一个带盐桥的原电池,并画出实验装置图,并指出正极为________,电极反应式为______________。
负极为________,电极反应式为______________________。
此装置中盐桥的作用为___________________________________________。
根据反应Zn+2Fe3+===Zn2++2Fe2+知该反应中的氧化反应为Zn-2e-===Zn2+,故应采用Zn片作负极,还原反应为2Fe3++2e-===2Fe2+,故应选择比Zn不活泼的金属或非金属石墨等作正极,根据应选择与电极材料相同的阳离子的电解质溶液作电解液,故负极区应选含Zn2+的盐溶液如ZnSO4溶液,正极区选含Fe3+的溶液作电解液如FeCl3、Fe2(SO4)3溶液等。
正极Pt 2Fe3++2e-===2Fe2+负极Zn Zn-2e-===Zn2+盐桥的作用使两个半电池连成一个通路;使两溶液保持电中性。

第二单元化学能与电能的转化第1课时原电池的工作原理目标与素养:1.以铜锌原电池为例,理解原电池的工作原理。
(宏观辨识与微观探析)2。
学会判断原电池的正、负极,掌握原电池反应方程式和电极反应式的书写。
(宏观辨识与微观探析)3.掌握原电池原理的基本应用。
(科学态度与社会责任)一、原电池的工作原理1.原电池(1)概念:将化学能转化为电能的装置。
(2)构成条件①两个活泼性不同的电极(材料可以是金属或导电的非金属).②电解质溶液。
③形成闭合回路(或两极直接接触)。
④能自发地发生氧化还原反应.2.铜锌原电池的工作原理(1)用温度计测量锌粉与CuSO4溶液反应的温度变化,说明该反应为放热反应,该反应在物质变化的同时,实现化学能转化为热能.(2)铜锌原电池的工作原理装置电极Zn Cu反应现象逐渐溶解铜片上有红色(1)成分:含有KCl饱和溶液的琼脂.(2)离子移动方向:Cl-移向ZnSO4溶液(负极区),K+移向CuSO4溶液(正极区)。
(3)作用:①使两个半电池形成通路,并保持两溶液的电中性。
②避免电极与电解质溶液反应,有利于最大程度地将化学能转化为电能。
二、原电池的设计请根据离子反应Fe+Cu2+===Fe2++Cu设计一个原电池(1)将氧化还原反应拆成氧化反应和还原反应两个半反应,分别作原电池的负极和正极的电极反应式。
负极:Fe-2e-===Fe2+;正极:Cu2++2e-===Cu。
(2)确定电极材料如发生氧化反应的物质为金属单质,可用该金属直接作负极;如为气体(如H2)或溶液中的还原性离子,可用惰性电极(如Pt、碳棒)作正极.发生还原反应的电极材料一般不如负极材料活泼。
本例中可用铁作负极,用铜作正极。
(3)确定电解质溶液①负极区用FeCl2溶液作电解液;②正极区用CuCl2溶液作电解液;③如果原电池中没有盐桥,可用CuCl2溶液作电解液。
(4)构成闭合回路:将电极用导线连接,使之构成闭合回路。
(5)画出装置图1.判断正误(正确的打“√”,错误的打“×”)。

Cu ×2019-2020年高中化学 1.2.1《原电池的工作原理》教案苏教版选修4【知识与技能目标】了解原电池的工作原理,能写出其电极反应和电池反应方程式。
【过程与方法目标】通过进行化学能转化为电能的探究活动,体验原电池的工作原理,熟练书写电极反应和电池反应方程式。
【情感态度与价值观目标】通过化学能与电能相互转化关系的学习,使学生从能量的角度比较深刻地了解化学科学对人类的贡献,体会能量守恒的意义。
学会利用能源与创造新能源的思路和方法,提高环保意识和节能意识。
【教学重点】了解原电池的工作原理,能够写出电极反应式和电池反应方程式。
【教学难点】原电池的工作原理,从电子转移角度理解化学能向电能转化的本质。
【教学过程】【引入】电能是现代社会中应用最广泛,使用最方便、污染最小的一种二次能源,又称电力。
例如,日常生活中使用的手提电脑、手机、相机、摄像机……这一切都依赖于电池的应用。
那么,电池是怎样把化学能转变为电能的呢?我们这节课来一起复习一下有关原电池的相关内容。
【板书】原电池的工作原理一、原电池实验探究讲:铜片、锌片、硫酸都是同学们很熟悉的物质,利用这三种物质我们再现了1799年意大利物理学家——伏打留给我们的历史闪光点!【实验探究】(铜锌原电池)实验步骤现象1. 锌片插入稀硫酸2. 铜片插入稀硫酸3. 锌片和铜片上端连接在一起插入稀硫酸【问题探究】1. 锌片和铜片分别插入稀硫酸中有什么现象发生?2. 锌片和铜片用导线连接后插入稀硫酸中,现象又怎样?为什么?3. 锌片的质量有无变化?溶液中c (H+)如何变化?4. 锌片和铜片上变化的反应式怎样书写?5. 电子流动的方向如何?讲:我们发现检流计指针偏转,说明产生了电流,这样的装置架起了化学能转化为电能的桥梁,这就是生活中提供电能的所有电池的开山鼻祖——原电池。
【板书】(1)原电池概念:学能转化为电能的装置叫做原电池。
问:在原电池装置中只能发生怎样的化学变化?学生:Zn+2H+=Zn2++H2↑讲:为什么会产生电流呢?答:其实锌和稀硫酸反应是氧化还原反应,有电子的转移,但氧化剂和还原剂热运动相遇发生有效碰撞电子转移时,由于分子热运动无一定的方向,因此电子转移不会形成电流,而通常以热能的形式表现出来,激烈的时候还伴随有光、声等其他的形式的能量。
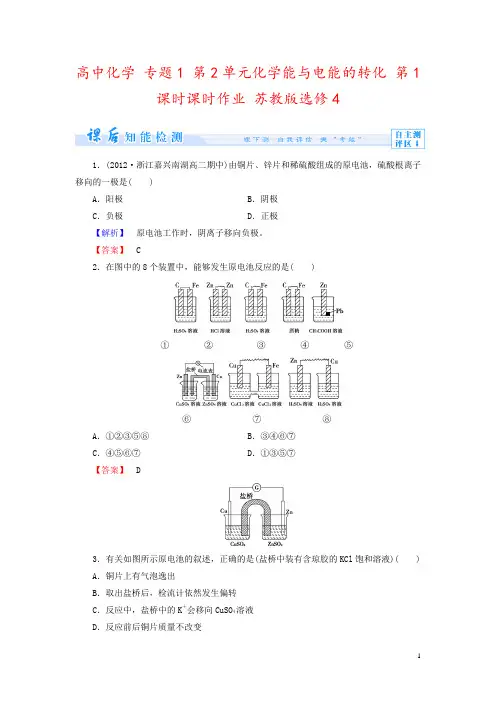
高中化学专题1 第2单元化学能与电能的转化第1课时课时作业苏教版选修41.(2012·浙江嘉兴南湖高二期中)由铜片、锌片和稀硫酸组成的原电池,硫酸根离子移向的一极是( )A.阳极B.阴极C.负极D.正极【解析】原电池工作时,阴离子移向负极。
【答案】 C2.在图中的8个装置中,能够发生原电池反应的是( )①②③④⑤⑥⑦⑧A.①②③⑤⑧B.③④⑥⑦C.④⑤⑥⑦D.①③⑤⑦【答案】 D3.有关如图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)( ) A.铜片上有气泡逸出B.取出盐桥后,检流计依然发生偏转C.反应中,盐桥中的K+会移向CuSO4溶液D.反应前后铜片质量不改变【解析】由题图可得知,Cu为正极,电极反应为:Cu2++2e-===Cu,Zn为负极,电极反应为:Zn-2e-===Zn2+,则铜片上应有固体析出,反应后铜片质量增加,所以A、D均错误;取出盐桥后,原电池成为断路,因此检流计不会再发生偏转,B错误;左池中由于铜离子的反应,正电荷减少,为保持电中性,盐桥中的K+会移向CuSO4溶液,C正确。
【答案】 C4.如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )A.外电路的电流方向为:X→外电路→YB.若两电极分别为Zn和石墨棒,则X为石墨棒,Y为ZnC.若两电极都是金属,则它们的活泼性为X>YD.X极上发生的是还原反应,Y极上发生的是氧化反应【解析】由图可知,电子的流动方向是X→外电路→Y,则电流的方向就为Y→外电路→X;X为原电池的负极,Y为正极,X的活动性比Y的强;X极应发生氧化反应,Y极应发生还原反应。
所以,A、B、D错误,C正确。
【答案】 C5.如图所示装置中,可观察到检流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )M N PA 锌铜稀硫酸溶液B 铜锌稀盐酸C 银锌硝酸银溶液D 锌铁硝酸铁溶液【解析】N棒变细,说明N为较活泼金属做负极,M棒变粗,说明M为正极,电解质溶液中的阳离子得电子析出金属。

第二单元化学能与电能的转化1-2 课时1 原电池的工作原理知能定位1.了解原电池的工作原理及构成条件。
2.能正确判断原电池的正、负极。
3.能写出原电池电极反应式和电池反应方程式。
4.能根据氧化还原反应设计原电池。
情景切入原电池可将化学能转化为电能,如何来实现呢?自主研习一、原电池的工作原理1.原电池定义将化学能转化为电能的装置。
2.原电池的构成条件(1)活泼性不同的电极材料。
(2)电解质溶液。
(3)形成闭合回路。
(4)能自发地发生氧化还原反应。
3.原电池的工作原理外电路中电子由负极流向正极;内电路(电解质溶液)中阴离子移向负极,阳离子移向正极;电子发生定向移动从而形成电流,实现了化学能向电能的转化。
总反应式注意以下几方面。
1.外电路−-e正极负极(还原性较强的物质)−→导线2.内电路将两极浸入电解质溶液中,使正、负离子作定向移动。
3.闭合电路规律方法:原电池的设计思路一般是先依据反应式中的氧化剂和还原剂来确定正、负极材料,然后再看电解质溶液是否符合题意,只有自发进行的氧化还原反应才可以设计成原电池,其中发生氧化反应的物质作负极,发生还原反应的物质作正极。
一般选用酸、碱或能参与负极反应的氧化性物质作电解质溶液。
课堂师生互动知识点1原电池电极反应式的书写原电池反应所依托的化学反应原理是氧化还原反应,正极发生还原反应,负极发生氧化反应,据此书写电极反应的方法如下:(1)确定原电池的正、负极,以及两极上发生反应的负极:失去电子被氧化,发生氧化反应;正极:得到电子被还原,发生还原反应。
(2)书写电极反应式时,注意电解质溶液是否参加反应。
电极反应也遵守质量守恒、电荷守恒及正、负两极得失电子数守恒的规律。
(3)将两极的电极反应式相加可得原电池的总反应式,反过来,也可以将总反应式与其中一个电极反应相减得另一个电极反应式。
考例1分析下图所示的四个原电池装置,结论正确的是()A.(1)(2)中Mg作负极,(3)(4)中Fe作负极B.(2)中Mg作正极,电极反应式为:6H2O+6e-===6OH-+3H2↑C.(3)中Fe作电池负极D.(4)中Cu作正极,电极反应式为:2H++2e-===H2↑解析:本题考查原电池的正、负极的判断及电极反应式的书写,电解质溶液不同,导致两极发生改变。
第二单元化学能与电能的转化第1课时原电池的工作原理[目标要求] 1.理解原电池的工作原理,能够写出电极反应式和电池反应方程式。
2.了解半反应、盐桥、内电路、外电路等概念。
3.会判断原电池的正、负极,能够利用氧化还原反应设计简单的原电池。
一、原电池1.原电池定义:将化学能转变为电能的装置。
2.实质:将氧化还原反应的电子转移变成电子的定向移动。
即将化学能转化成电能。
3.简单原电池的构成条件:①活泼性不同的两个电极,②电解质溶液,③形成闭合回路,④能自发进行的氧化还原反应。
二、原电池的工作原理工作原理:利用氧化还原反应在不同区域内进行,以适当方式连接起来,获得电流。
以铜锌原电池为例:1.在ZnSO4溶液中,锌片逐渐溶解,即Zn被氧化,锌原子失电子,形成Zn2+进入溶液,从锌片上释放的电子,经过导线流向铜片;CuSO4溶液中,Cu2+从铜片上得电子,还原成为金属铜并沉积在铜片上。
锌为负极,发生氧化反应,电极反应式为Zn-2e-===Zn2+;铜为正极,发生还原反应,电极反应式为Cu2++2e-===Cu。
总反应式为Zn+Cu2+===Zn2++Cu,反应是自发进行的。
2.闭合回路的构成:外电路:电子从负极到正极,电流从正极到负极,内电路:溶液中的阴离子移向ZnSO4溶液,阳离子移向CuSO4溶液。
3.盐桥盐桥中通常装有含琼胶的KCl饱和溶液。
当其存在时,随着反应的进行,Zn棒中的Zn 原子失去电子成为Zn2+进入溶液中,使ZnSO4溶液中Zn2+过多,带正电荷。
Cu2+获得电子沉积为Cu,溶液中Cu2+过少,SO2-4过多,溶液带负电荷。
当溶液不能保持电中性时,将阻止放电作用的继续进行。
盐桥的存在就避免了这种情况的发生,其中Cl-向ZnSO4溶液迁移,K+向CuSO4溶液迁移,分别中和过剩的电荷,使溶液保持电中性,反应可以继续进行。
知识点一原电池1.下列装置中能构成原电池产生电流的是( )答案 B解析A、D项中电极与电解质溶液之间不发生反应,不能构成原电池;B项符合原电池的构成条件,两电极发生的反应分别是Zn-2e-===Zn2+,2H++2e-===H2↑;C项中酒精不是电解质,故不能构成原电池。
专题一化学反应与能量变化第二单元化学能与电能的转化原电池的工作原理一.选择题1.下列关于原电池的叙述错误..的是()A.原电池中的电解质不一定处于溶液状态B. 若欲使原电池处于工作状态,必须形成闭合回路C. 排在金属活动性顺序表前面的金属总是作负极,排在后面的金属总是作正极D. 负极总是发生氧化反应,正极总是发生还原反应2.把a、b、c、d四块金属浸入稀H2SO4中,用导线两两相连可以组成各种原电池。
若a、b 相连时a溶解;c、d相连时c为负极;a、c相连时,c极上产生大量气泡;b、d相连时,b 为正极,则四种金属活动性顺序由强到弱为() A.a>b>c>d B.a>c>d>b C.c>a>b>d D.b>d>c>a3.一定量的锌与足量的稀盐酸反应,为了加快反应的速率,但又不影响生成氢气总量可以采取的措施是()A.加入少量醋酸钠固体B.加入少量硫酸铜溶液C.加入少量铜粉D.加入少量铁粉4.如图所示装置,电流计G发生偏转,同时A极逐渐变粗、B极逐渐变细,C 为电解质溶液,则A、B、C 应是下列各组中的()Array A.A是Zn,B是Cu,C为稀H2SO4B.A是Cu,B是Zn,C为稀H2SO4C.A是Fe,B是Ag,C为AgNO3液D.A是Ag,B是Fe,C为AgNO3液5.铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4,工作时的反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,下列结论正确的是()A.Pb为正极被氧化 B.溶液的pH不断减小SO只向PbO2处移动 D.电解质溶液pH不断增大C. 246.某原电池总反应的离子方程式为2Fe3++Fe=3Fe2+,可以实现上述反应的原电池()7.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO 2(s)+H 2O(l)==Zn(OH)2(s)+Mn 2O 3(s) 下列说法错误..的是 ( ) A .电池工作时,锌失去电子B .电池正极的电极反应式为:2MnO 2(s)+H 2O(1)+2e —=Mn 2O 3(s)+2OH —(aq)C .电池工作时,电子由正极通过外电路流向负极D .外电路中每通过0.2mol 电子,锌的质量理论上减小6.5g8.用铜片、银片、Cu (NO 3)2溶液、AgNO 3溶液、导线和盐桥(装有琼脂-KNO 3的U 型管)构成一个原电池。
高中化学学习材料鼎尚图文收集整理专题1 第2单元第1课时一、选择题1.有关原电池下列说法中正确的是()A.在外电路中电子由正极流向负极B.在原电池中,只有金属锌作负极C.原电池工作时,阳离子向正极方向移动D.原电池工作时,阳离子向负极方向移动【解析】在原电池中,电子由负极流向正极,阳离子向正极方向移动,阴离子向负极方向移动。
当有比Zn活泼的金属与Zn组成原电池时,一般Zn作正极。
【答案】 C2.将铁片和银片用导线连接置于同一稀盐酸中,并经过一段时间后,下列各叙述中正确的是() A.负极有Cl2逸出,正极有H2逸出B.负极附近Cl-的浓度减小C.正极附近Cl-的浓度逐渐增大D.溶液中Cl-的浓度基本不变【解析】Fe为负极:Fe-2e-===Fe2+;Ag为正极;2H++2e-===H2↑,Cl-的浓度基本不变。
【答案】 D3.某原电池总反应的离子方程式为2Fe3++Fe===3Fe2+,能实现该反应的原电池是()A.正极为铜,负极为铁,电解质溶液为FeCl3溶液B.正极为铜,负极为铁,电解质溶液为Fe(NO3)2溶液C.正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液D.正极为银,负极为铁,电解质溶液为CuSO4溶液【解析】由原电池总反应式:2Fe3++Fe===3Fe2+,可知负极反应为Fe-2e-===Fe2+,正极反应为2Fe3++2e-===2Fe2+,所以只有A项符合要求。
【答案】 A4.某原电池,将两金属X、Y用导线连接,同时插入相应的电解质溶液中,发现Y电极质量增加,则可能是下列情况中的()A.X是负极,电解质溶液为CuSO4溶液B.X是负极,电解质溶液为稀H2SO4溶液C .X 是正极,电解质溶液为CuSO 4溶液D .X 是正极,电解质溶液为稀H 2SO 4溶液【解析】 将金属X 、Y 用导线连接,同时,插入相应的电解质溶液中,构成原电池。
负极上发生氧化反应,失去电子,电子经外电路流向正极,溶液中的阳离子在正极得电子而被还原,若使Y 极质量增加,四个选项中,只有A 正确;X 是负极;Y 是正极,电解质是CuSO 4溶液。
专题一化学反应与能量变化
第二单元化学能与电能的转化
原电池的工作原理
一.选择题
的是()1.下列关于原电池的叙述错误
..
A.原电池中的电解质不一定处于溶液状态
B. 若欲使原电池处于工作状态,必须形成闭合回路
C. 排在金属活动性顺序表前面的金属总是作负极,排在后面的金属总是作正极
D. 负极总是发生氧化反应,正极总是发生还原反应
2.把a、b、c、d四块金属浸入稀H2SO4中,用导线两两相连可以组成各种原电池。
若a、b相连时a溶解;c、d相连时c为负极;a、c相连时,c极上产生大量气泡;b、d相连时,b为正极,则四种金属活动性顺序由强到弱为()A.a>b>c>d B.a>c>d>b C.c>a>b>d D.b>d>c>a 3.一定量的锌与足量的稀盐酸反应,为了加快反应的速率,但又不影响生成氢气总
量可以采取的措施是()A.加入少量醋酸钠固体B.加入少量硫酸铜溶液
C.加入少量铜粉D.加入少量铁粉
4.如图所示装置,电流计G发生偏转,同时A极逐渐变粗、B极逐渐变细,C 为电解质溶液,则A、B、C 应是下列各组中的()A.A是Zn,B是Cu,C为稀H2SO4
B.A是Cu,B是Zn,C为稀H2SO4
C.A是Fe,B是Ag,C为AgNO3液
D.A是Ag,B是Fe,C为AgNO3液
5.铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4,工作时的反应为
Pb+PbO2+2H2SO4=2PbSO4+2H2O,下列结论正确的是
()
A.Pb为正极被氧化B.溶液的pH不断减小
C. 2
SO只向PbO2处移动D.电解质溶液pH不断增大
4
6.某原电池总反应的离子方程式为2Fe3++Fe=3Fe2+,可以实现上述反应的原电池()
7.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
的是Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s) 下列说法错误
..
()
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
8.用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。
以下有关该原电池的叙述正确的是
()
①在外电路中,电流由铜电极流向银电极②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO 3溶液中发生的化学反应与该原电池反应相同
A .①②
B .②③
C .②④
D .③④
二.非选择题
9.依据氧化还原反应:2Ag
+(aq)+Cu(s) = Cu 2+(aq)+
2Ag(s)设计的原电池如图
所示。
回答下列问题:
(1)电极X 的材料是 ;电解质溶液Y 是 ;
(2)银电极为电池的 极,发生的电极反应为 ;X 电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。
10.普通锌-锰干电池是普遍使用的化学电池,其中含有MnO 2、NH 4Cl 、ZnCl 2等糊状物。
以锌筒为负极材料,石墨为正极材料。
工作时反应方程式是:
Zn +2MnO 2+2NH 4+=Zn 2++Mn 2O 2+2NH 2+H 2O
(1)试写出干电池放电时的正、负电极反应式:
正极:_______________________________负极:________________________________
Y
CuSO 4溶液
干电池用久了就会变软,其原因是_____________________________________ 。
(2)正极反应中,前后经历下列反应:2NH4++2e-=2NH3+H2;2MnO2+H2=Mn2O3+H2O,如果没有MnO2参与,干电池将难于持续稳定工作。
试说明理由:_________________________________________________________________。