肿瘤血管生成与血管生成抑制因子的研究进展
- 格式:docx
- 大小:27.95 KB
- 文档页数:8


姜黄素抗肿瘤血管生成分子机制研究进展高文;何彦津;梁凤鸣【摘要】姜黄素是从姜黄中提取的一种酚类色素,具有多种药理活性,具有抗炎、抗氧化、抗凝、降血脂、抗动脉粥样硬化、抗肿瘤、抗突变作用,其抗瘤作用机制不但与诱导肿瘤细胞凋亡相关,抗血管生成也是姜黄素抗肿瘤机制之一,主要机制为抑制血管内皮细胞增殖并促进其凋亡;抑制血管生成促进因子的表达,如通过抑制血管内皮生成因子(VEGF)及其对应受体,从而抑制肿瘤血管生成;降低基质金属蛋白酶(MMPs)的活性;通过磷脂酰肌醇-3-激酶(PI3K)信号途径抑制肿瘤血管形成:其机制为下调PI3K/AKT和促分裂原活化蛋白激酶(MAPK)途径,从而下调VEGF、Ang-1、Ang-2、VEGFR-2等.深入探讨姜黄素抗肿瘤血管生成的作用机制将为更有效的切断肿瘤血供奠定基础,有利于恶性肿瘤的防治.【期刊名称】《国际眼科杂志》【年(卷),期】2016(016)003【总页数】3页(P466-468)【关键词】姜黄素;肿瘤血管生成;血管内皮生成因子;基质金属蛋白酶;磷脂酰肌醇-3-激酶【作者】高文;何彦津;梁凤鸣【作者单位】300192,中国天津市,天津中医药大学第一附属医院眼科;300000,中国天津市,天津医科大学眼科医院;300192,中国天津市,天津中医药大学第一附属医院眼科【正文语种】中文姜黄素是从姜黄中提取的一种酚类色素,具有多种药理活性,具有抗炎、抗氧化、抗凝、降血脂、抗动脉粥样硬化、抗肿瘤、抗突变作用,其抗瘤作用机制不但与诱导肿瘤细胞凋亡相关,抗血管生成也是姜黄素抗肿瘤机制之一,主要机制为抑制血管内皮细胞增殖并促进其凋亡;抑制血管生成促进因子的表达,如通过抑制血管内皮生成因子(VEGF)及其对应受体,从而抑制肿瘤血管生成;降低基质金属蛋白酶(MMPs)的活性;通过磷脂酰肌醇-3-激酶(PI3K)信号途径抑制肿瘤血管形成:其机制为下调PI3K/AKT和促分裂原活化蛋白激酶(MAPK)途径,从而下调VEGF、Ang-1、Ang-2、VEGFR-2等。


厚朴对肿瘤血管生成的抑制作用机制研究随着人们对肿瘤治疗的不断探索,发现抑制肿瘤血管生成的疗法成为了一个重要的研究方向。
肿瘤血管生成是指肿瘤细胞通过血管形成新的供血网络,为肿瘤提供营养和氧气。
研究发现,抑制肿瘤血管生成可以有效阻断肿瘤的生长和转移。
在众多的中药中,厚朴(Magnolia officinalis)作为一种植物药材,被广泛应用于中医药领域。
近年来,研究人员发现厚朴具有抗肿瘤的作用,并对其抑制肿瘤血管生成的机制进行了深入研究。
一项研究发现,厚朴中的主要有效成分为厚朴酸,具有抑制肿瘤血管生成的作用。
厚朴酸通过调节多个信号通路,包括VEGF信号通路、FGF信号通路和IL-6信号通路等,来达到抑制肿瘤血管生成的效果。
这些信号通路在肿瘤血管生成过程中发挥重要作用,因此厚朴酸的作用机制十分复杂。
厚朴酸可以通过降低VEGF的表达来抑制肿瘤血管生成。
VEGF是一种促血管生成因子,参与了血管内皮细胞的迁移和增殖过程。
研究发现,厚朴酸可以通过抑制VEGF的表达来减少血管内皮细胞的迁移和增殖,从而降低了肿瘤血管生成。
另外,厚朴酸还可以抑制FGF信号通路。
FGF即成纤维细胞生长因子,也是一种与肿瘤血管生成密切相关的细胞因子。
研究发现,厚朴酸可以抑制FGF的表达,并通过减少FGF的活性来阻断FGF信号通路。
这样一来,血管内皮细胞的迁移和血管生成过程就会受到抑制。
除了上述两条主要机制外,厚朴酸还可以抑制IL-6信号通路。
IL-6是一种细胞因子,参与了肿瘤血管生成过程中的炎症反应。
研究发现,厚朴酸可以减少IL-6的表达,并降低IL-6信号通路的活性。
这样一来,炎症反应得到减轻,进而抑制了肿瘤血管生成。
此外,厚朴还具有抗氧化和抗炎作用,可以抑制氧化应激和炎症反应对肿瘤血管生成的促进作用。
氧化应激和炎症反应是肿瘤血管生成过程中的重要因素,因此厚朴的抗氧化和抗炎作用对于抑制肿瘤血管生成非常重要。
总结起来,厚朴通过多个信号通路的调节,包括VEGF信号通路、FGF信号通路和IL-6信号通路等,来抑制肿瘤血管生成。




研究中药抗肿瘤血管的生成进展【摘要】抗肿瘤血管生成为肿瘤的治疗提供了新的契机,中药均为有效的血管生成抑制剂,具有廉价无毒等优点,随着其抗肿瘤,血管生成等机制方面研究的不断深入,中草药极有希望成为理想而全面的癌症预防和治疗药物。
【关键词】肿瘤血管抑制因子综述近年来中药或有效成分抑制肿瘤血管生成研究非常活跃,也具有明显的广度和深度。
1 中草药研究动态去甲斑蝥素范跃祖等观察了去甲斑蝥素(NCTD)对胆囊癌肿瘤血管生成的抑制作用及其机制NCTD可有效抑制、破坏胆囊癌肿瘤血管生成,进而抑制胆囊癌的增殖与生长。
其机制可能与NCTD诱导血管内皮细胞凋亡、直接破坏血管内皮细胞、改变血管内皮细胞PCNA/凋亡比、下调血管生成因子VEGF、和上调血管抑制因子TSP、TIMP2表达有关。
小檗碱小檗碱(berberine)为黄连(毛茛科植物)、黄柏等(芸香科植物)植物的一种生物碱,作为抗菌药已有悠久的历史。
初步研究表明它在体内、体外对多种肿瘤细胞具有较强的抑制和杀伤作用。
娄金丽等研究小檗碱对bFGF 活化人脐静脉内皮细胞(HUVEC)增殖、细胞周期及细胞凋亡的影响,探讨其对肿瘤新生血管形成作用的机制。
方法:MTT法检测小檗碱对bFGF活化HUVEC的增殖作用;流式细胞仪检测用药后细胞周期的变化;激光共聚焦扫描显微镜下观察药物对细胞形态、细胞内钙的影响;流式细胞仪检测小檗碱对细胞凋亡的作用。
结果:小檗碱能明显抑制bFGF活化的HUVEC增殖,且存在剂量依赖关系;使细胞在期的比例明显增多;使细胞核浓缩、甚至裂解成碎块,同时使细胞内钙增多;并诱导活化HUVEC发生细胞凋亡。
结论:小檗碱可能通过将bFGF活化的HUVEC 细胞周期阻滞在期,抑制活化HUVEC的增殖;诱导活化HUVEC细胞发生凋亡等机制,阻止新生血管形成,发挥其抗肿瘤作用。
白藜芦醇白藜芦醇是广泛存在于葡萄、花生和多种药用植物中的一种多酚类化合物,目前至少已经在21个科,31个属的72种植物中发现了白藜芦醇。


胃癌抗血管生成治疗研究引言胃癌是全球范围内最常见的癌症之一,也是导致癌症死亡的主要原因之一。
尽管现有的治疗方法如手术切除、放疗和化疗已经取得了一定的成功,但是胃癌的预后仍然不容乐观。
因此,寻找新的治疗策略势在必行。
抗血管生成治疗在胃癌中的应用抗血管生成治疗是一种通过抑制肿瘤血管生成来阻断肿瘤生长和转移的策略。
在胃癌中,血管生成是肿瘤生长和转移的关键过程之一。
因此,抗血管生成治疗被认为是胃癌治疗的一种重要手段。
抗血管生成治疗的机制抗血管生成治疗主要通过以下几个机制发挥作用:1.抑制血管内皮生长因子(VEGF):VEGF是促进肿瘤血管生成的关键因子之一。
抑制VEGF的表达或活性可以减少肿瘤血管生成,从而抑制胃癌生长和转移。
2.阻断肿瘤微血管形成:另一种抗血管生成治疗的机制是通过阻断肿瘤微血管的形成来抑制肿瘤的生长和转移。
这可以通过抑制肿瘤细胞的迁移和侵袭能力来实现。
3.诱导血管生成抑制因子的表达:除了抗血管生成治疗可以直接抑制肿瘤血管生成外,它还可以通过诱导血管生成抑制因子的表达来间接起到抗肿瘤作用。
已有的抗血管生成治疗药物目前已经有多种抗血管生成治疗药物在胃癌治疗中得到应用。
其中最常用的药物包括:1.曲妥珠单抗(bevacizumab):曲妥珠单抗是一种抗VEGF的单克隆抗体,已经在胃癌的二线治疗中得到批准并获得了一定的疗效。
2.多西他赛(docetaxel):多西他赛是一种抗肿瘤的化疗药物,可以通过抑制微血管生成来发挥抗肿瘤作用。
3.西妥昔单抗(cetuximab):西妥昔单抗是一种抗肿瘤的单克隆抗体,可以通过抑制肿瘤细胞的迁移和侵袭来发挥抗血管生成作用。
抗血管生成治疗的研究进展近年来,针对胃癌的抗血管生成治疗的研究取得了一些进展。
以下是一些新的研究成果:1.组合治疗策略:研究人员发现,将抗血管生成药物与其他治疗方法如化疗和免疫治疗相结合,可以增强治疗效果。
例如,将曲妥珠单抗与化疗药物多西他赛联合使用,可以显著提高胃癌患者的生存率。
抗肿瘤新生血管生成抑制剂临床研究概况马小彦;张振;杨再昌【摘要】The growth and metastasis of tumor had a lose relationship with blood vessels , and inhibition of tumor angiogenesis can regulate tumor growth.In recent years , the drugs of inhibiting tumor angiogenesis became a hot research in the field of pharmacy , and some angiogenesis inhibitors entered clinical trials.The theory of tumor angiogenesis was outlined and the clinical studies of angiogenesis inhibitors were summarized.%肿瘤的生长和转移与血管有着密切的关系,抑制肿瘤血管生成可以调节肿瘤的生长。
近年来,抑制肿瘤新生血管的药物已成为药学领域的研究热点,一些新生血管抑制剂已经进入临床试验阶段,本文对抗肿瘤血管生成的理论进行了概述,并总结了新生血管生成抑制剂的临床研究情况。
【期刊名称】《广州化工》【年(卷),期】2014(000)017【总页数】4页(P40-42,53)【关键词】新生血管抑制剂;肿瘤【作者】马小彦;张振;杨再昌【作者单位】贵州理工学院制药工程学院,贵州贵阳 550003;贵州理工学院制药工程学院,贵州贵阳 550003;贵州大学化学与化工学院,贵州贵阳 550025【正文语种】中文【中图分类】R-1肿瘤已成为威胁人类生命和健康的第一大杀手。
随着肿瘤生物学研究的不断深入,肿瘤的诊断和治疗水平有了明显的提高。
肿瘤细胞循环和血管生成的分子机制和调控途径肿瘤细胞循环和血管生成是肿瘤发展和转移过程中的重要环节。
肿瘤细胞循环指的是肿瘤细胞通过血液或淋巴系统进入体内其他部位的过程,从而形成远处转移灶。
血管生成是指新生血管在肿瘤周围形成的过程,提供肿瘤细胞所需的氧气和营养物质,同时还为肿瘤细胞的转移提供通道。
肿瘤细胞循环和血管生成的分子机制和调控途径非常复杂,下面将从几个重要的方面进行介绍。
1.血管生成与VEGF家族:血管内皮生长因子(VEGF)家族是调控血管生成的重要家族基因。
VEGF主要包括VEGF-A、B、C、D和血管内皮生长因子蛋白表达赖氨酸酶(VEGF-E)。
VEGF-A是其中最重要的成员,能够促进血管内皮细胞的增殖和迁移。
这些VEGF通过结合细胞上的受体,如VEGFR-1、2和3来介导血管生成过程。
2.血管生成与炎症因子:炎症过程中产生的一系列炎症因子也能够调控血管生成。
例如,肿瘤组织中过度表达的白细胞介素-8(IL-8)和肿瘤坏死因子-α(TNF-α)会刺激血管内皮细胞的增殖和迁移。
此外,还有一些其他的炎症因子如炎症相关因子-α(LIF-α)、转化生长因子-β(TGF-β)等也被发现参与血管生成。
3.血管生成与纤维蛋白溶酶系统:纤维蛋白溶酶系统也是调控血管生成的重要机制之一、纤维蛋白溶酶系统由纤维蛋白溶酶原、纤维蛋白溶酶原激活物和纤维蛋白溶酶原激活物抑制物等多个组分组成。
当肿瘤组织需要血管生成时,纤维蛋白溶酶原会被激活为纤维蛋白溶酶,进而降解基底膜,为新血管的形成提供通路。
4. 血管生成与肿瘤相关因子:在肿瘤组织中,还有一些特殊的肿瘤相关因子也参与了血管生成的调控。
例如,肿瘤壮观霉素(Angiopoietin)家族成员是促进血管生成的重要因子。
调控血管生成的另一个重要因子是肿瘤血管内皮生长因子(Angiopoietin-like proteins),这些蛋白质被认为是VEGF和Angiopoietin成员的功能对抗物,其作用机制值得进一步研究。
血管生成与肿瘤转移的关系研究肿瘤转移是导致肿瘤死亡的关键过程,研究如何控制肿瘤转移一直是肿瘤学领域关注的热点问题。
近年来,肿瘤微环境研究表明,肿瘤转移涉及到多种因素的相互作用,其中血管生成在肿瘤微环境中具有重要作用。
本文将对血管生成与肿瘤转移的关系进行探讨。
一、血管生成的定义和过程血管生成是指从已有的血管系统中形成新的血管系统的过程,也称新生血管形成。
在该过程中,内皮细胞会从血管壁分化出来,进而形成管状结构并周围有周质细胞支持。
血管生成过程可分为以下四个步骤:1. 激活信号通路:血管生成的最初步骤是从细胞或化学物质中获得信号。
这一步骤将会激活细胞的生长和增殖,并诱导新的血管形成。
2. 血管母细胞移动:血管生成的第二个步骤是移动血管母细胞到新的生长点。
血管母细胞包括内皮细胞和外周神经系统的周围神经鞘细胞。
3. 血管分支:一旦血管母细胞到达新的生长点,其将形成血管结构,支撑新生血管的形成。
4. 血管收缩:新生血管通常必须经历一定的收缩过程,以使其不受牵拉或热度变化的影响,并支撑血液流动。
二、血管生成与肿瘤微环境关系多年来的研究表明,肿瘤的恶性程度和血管生成之间存在着密切的关系。
肿瘤由于内部缺乏血液供应,就需要通过创建新的血管系统以获得足够的营养和氧气供应,从而促进肿瘤的生长和转移。
肿瘤细胞和血管内皮细胞分泌血管生成因子,如VEGF、FGF、PDGF、TGF-β和IL-8等,这些因子诱导纤维肉瘤细胞、内皮细胞、成骨肉瘤细胞以及黑色素瘤细胞向肿瘤微环境内血管生长,在一定程度上,这些血管生长一方面提供了足够氧气和营养,然而,另一方面也促进了肿瘤生长和转移。
临床研究表明,大多数恶性肿瘤(如结直肠癌,乳腺癌,肺癌和肝癌),其肿瘤组织中富含血管活性物质,如VEGF等,这些物质会产生新的血管支持肿瘤的生长和转移,而血管生成的数量和质量的改变往往会伴随恶性程度的加重。
三、肿瘤转移与血管生成的关系目前的研究表明,血管生成在肿瘤转移中发挥着至关重要的作用。
张清媛教授:抗肿瘤血管生成治疗研究进展上世纪七十年代,Folkman 在《新英格兰医学杂志》中首次提出了肿瘤生长依赖于新血管生成的理论假说,随着 8 年后毛细血管内皮细胞培养技术的建立,11 年后第一个血管生成抑制剂的发现,13 年后第一个血管生成活性蛋白的纯化等,这一观点为越来越多的证据所支持,并逐渐使这一领域成为肿瘤研究的热点。
肿瘤的生长有两个明显不同的阶段,即从无血管的缓慢生长阶段转变为有血管的快速增殖阶段,血管生成使肿瘤能够获得足够的营养物质,是促成上述转变的关键环节。
如果没有血管生成,原发肿瘤的生长不会超过 1~2 mm3。
肿瘤侵袭转移是肿瘤治疗失败的主要原因,而在肿瘤发生侵袭转移的多步骤过程中,血管生成均发挥着重要作用。
与传统的抗癌治疗相比,抗血管生成治疗具有许多优点:(1)正常成年人的血管形成基本停止,内皮细胞常处于不分裂状态,只有在妊娠、月经周期、炎症、外伤和肿瘤等特殊情况,血管形成才被启动,因此,抗血管生成治疗对正常内皮细胞影响不大,具有良好的特异性;(2)血管内皮细胞暴露在血液中,药物能够直接发挥作用,无需渗透 Endostatin,所用药物剂量小、疗效高;(3)血管内皮细胞基因表达相对稳定,不易产生耐药;(4)作用具有放大效应,因为一个内皮细胞支持 50~100个肿瘤细胞生长。
因此,在过去的 30 多年中,人们一直在努力寻找合适的靶点以阻断和破坏肿瘤血管生成,研制有效的抗肿瘤血管生成药物,近年来取得了许多令人鼓舞的成绩。
一、肿瘤血管生成的机理Folkman 曾提出在肿瘤发生和发展过程中的存在"血管生成开关机制",揭示了肿瘤微血管形成的分子机制。
在肿瘤生长的最初阶段,并不是所有的实体瘤都具备血管生成表型,但随着肿瘤细胞不断分裂增殖,那些伴有癌基因或抑癌基因突变并具备了血管生成表型的肿瘤细胞逐渐增殖形成优势,它们通过多个途径诱导周围组织新生血管形成。
这些途径可分为以下几种:(1)肿瘤细胞癌基因的表达或抑癌基因的失活,可使肿瘤细胞获得血管生成表型,诱导局部新血管形成;(2)肿瘤细胞产生的各种趋化因子使单个核细胞浸润到肿瘤组织内,它们释放的促新生血管生长因子和多种蛋白酶有助于新生血管形成;(3)肿瘤生长到一定程度其内部处于明显低氧状态,低氧可使肿瘤血管内皮细胞生长因子(VEGF)表达明显增加,并以旁分泌的方式诱导新生血管生成;(4)内皮细胞通过自分泌途径加速新生血管的形成。
肿瘤血管生成的机制与治疗研究肿瘤是一种严重危害健康的疾病,世界卫生组织估计全球每年有900多万人死于癌症。
肿瘤内的血管生成(angiogenesis)是一种供应肿瘤需要的血管,是肿瘤发展的关键因素之一。
因此,研究肿瘤血管生成的机制以及开发相关治疗方法具有重要意义。
一、肿瘤血管生成的机制血管生成是指新生的血管从已有的血管或内皮细胞外形成,这一过程涉及许多调节因子和信号通路,并且与肿瘤细胞、肿瘤微环境、炎症及免疫系统的相互作用密切相关。
肿瘤血管生成的机制主要包括以下三个方面:1.肿瘤血管生成的刺激因子:血管内皮生长因子(VEGF)和血小板源性生长因子(PDGF)等是促进血管生成的主要分子。
2.血管生成的抑制因子:血管抑制素(endostatin)、血管基底膜抑素(angiostatin)等是已知的促进机体对肿瘤血管生成的负反馈调节因子。
3.肿瘤细胞和其微环境的相互作用:肿瘤细胞中的遗传变异、表观遗传改变和激素受体的作用如ER/PR等可引起VEGF等血管生成分子的异常表达。
肿瘤微环境中的炎症、氧化应激和蛋白质降解等因素也可对血管生成产生影响。
二、治疗肿瘤的方法通过研究肿瘤血管生成的机制,可以开发治疗肿瘤的方法。
目前,治疗肿瘤的方法主要包括:化学治疗、放疗、手术治疗、免疫治疗、靶向治疗等。
其中,针对肿瘤血管生成的靶向治疗,是近年来得到广泛关注和持续发展的研究方向之一。
靶向治疗主要针对肿瘤细胞表面和其周围的血管生成环境中的特异分子,以抑制肿瘤生长和扩散。
已经通过临床试验的一些肿瘤靶向治疗药物则主要促使肿瘤血管生成的阻遏,抑制肿瘤生长,并达到治疗效果。
比较典型的肿瘤靶向治疗药物就是阻断VEGF对内皮细胞的刺激,抑制血管生成及肿瘤生长的VEGF受体酪氨酸激酶抑制剂(TKI)。
目前,这类药物在临床试验中的疗效已得到证实,并已成为肾癌和结直肠肿瘤的治疗药物。
三、需要更深入的研究一个多年的长期临床实践表明,肿瘤靶向治疗不同于传统的化学治疗、放疗和手术治疗等,这种治疗方式的缺陷也越来越明显。
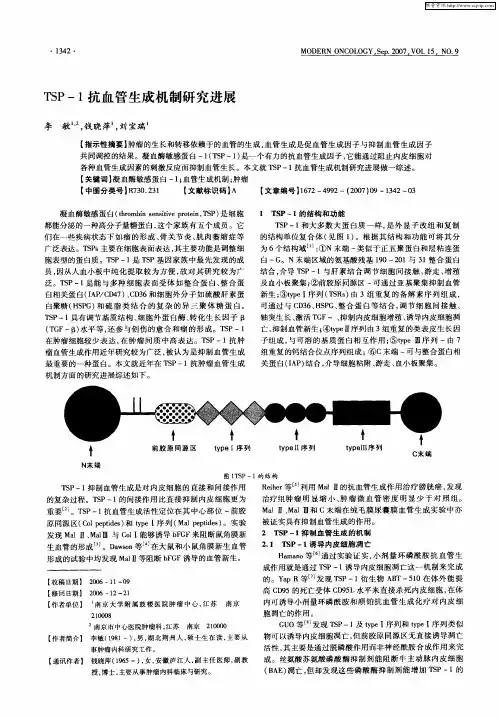
肿瘤血管生成与血管生成抑制因子的研究进展摘要:肿瘤血管生成在肿瘤的生长和转移中起着重要的作用,是肿瘤生长、侵袭、转移和复发的先决条件。
肿瘤的血管生成是一个复杂的生物学过程,包括血管内皮细胞的增殖、出芽和迁移等。
这一过程中有众多肿瘤血管生成因子和抑制因子参与调节和激活血管生成的开关。
因此, 研究肿瘤血管生成相关分子在肿瘤血管生成中的作用机制, 及其对肿瘤血管生成的调控,形成一种抗血管生成疗法,来达到控制肿瘤血管生长和转移的目的, 对肿瘤的治疗具有重要意义。
关键词:肿瘤血管生成;血管生成因子;血管生成抑制因子;血管生成开关恶性肿瘤的生长和转移依赖于血管生成。
当肿瘤体积超过2-3mm3后局部缺血缺氧[ 1] , 需要产生新的毛细血管以维持肿瘤的生长, 丰富的血管可向肿瘤提供足够的营养物质, 清除各种降解产物, 肿瘤细胞亦经血管进入血液循环发生血行转移, 否则肿瘤将发生退行性坏死[ 2].新血管的形成发展取决于血管生成生长因子和血管生成抑制因子之间的动态平衡,当血管生长因子与血管抑制因子达到平衡时,血管生成不被启动; 当此平衡趋向于血管生成时,血管开关被开启,新生血管开始生成。
在正常组织中, 由于缺少血管生成生长因子或生长因子被高水平的血管生成抑制因子严格控制,血管生成的开关处于关闭状态;但在肿瘤组织中, 生长因子过度表达, 抑制因子表达过低, 改变了这个平衡, 开启了肿瘤血管生成的表型, 导致新血管的生长。
因此,有学者认为肿瘤血管形成的始动因素是血管生长因子和血管抑制因子失衡,并且这种失衡会持续出现在肿瘤生长过程中,并提出了通过抑制血管生长因子信号通路,来抑制肿瘤生长和转移。
[3]1.肿瘤血管生成开关机制实验和临床数据表明,大多数人类肿瘤生成早期不诱导血管生成和并存在于原位,在无血供数月至数年后,肿瘤中的一些细胞向血管生成的表型转变,这种现象称为血管生成开关。
这一机制的分子基础可能是血管生成抑制剂的减少以及血管生成因子产量增加所致[4]。
因此,血管生成表型的开关是由血管生成因子与血管生成抑制因子的动态变化来调节。
肿瘤新生血管形成主要有以下三个步骤:①肿瘤血管生成的启动:当肿瘤体积>2 mm3 后, 肿瘤细胞自发性增殖, 导致局部缺血缺氧, 刺激血管生成的同时产生多种促血管生成因子, 这些因子刺激产生大量蛋白酶, 从而降解基膜并形成新生血管的牙胚[5] ;②血管内皮细胞的增殖和迁移:牙胚周围的血管内皮细胞在各种促血管生长因子的作用下迅速增殖并穿过牙胚向肿瘤组织定向迁移;③肿瘤新生血管的成熟:新增殖的血管内皮细胞进一步与血管外基质和周围的间质细胞相互作用, 形成完整的血管结构[6-7]。
2.肿瘤血管生成因子肿瘤血管生成过程中, 由肿瘤细胞、内皮细胞和支持细胞等所分泌的各种生长因子是肿瘤血管生成所必需的。
它们不仅调节了内皮细胞的增殖, 还控制了血管生成的过程。
主要有血管内皮生长因子(VEGF)、血小板衍生生长因子(PDGF)、成纤维细胞生长因子(FGF)、表皮生长因子(EGF)、大肠杆菌转化生长因子(TGF)、基质金属蛋白酶(MMPS)、肿瘤坏死因子(TNF)、血管生成素、缺氧诱导因子。
2.1血管内皮细胞生长因子(VEGF)血管内皮生长因子又称血管通透因子(Vascular permeability factor,VPF),是肿瘤血管生成过程中重要的调控因子。
VEGF是特异性作用于内皮细胞的糖基化细胞有丝分裂素,它的作用有诱导血管生成[8]、刺激内皮细胞的生长和增殖[9]作为内皮细胞的存活因子[10]、增强血管的渗透性[11]、抑制内皮细胞凋亡[12]。
VEGF的结构及分类:VEGF的编码基因由8个外显子和7个内含子构成,由于mRNA不同的剪切方式,产生了VEGF121、VEGF145、VEGF165、VEGF183、VEGF189和VEGF206等6种蛋白形式。
其中VEGF165是人类组织中VEGF主要的基因产物,也是VEGF家族中最重要的血管生成调节因子[13]。
VEGF家族包括5种型:VEGF-A、B、C、D和胎盘生长因子( PIGF) ,主要由肿瘤细胞和巨噬细胞分泌[14]。
VEGF 受体( VEGFR) : VEGFR 家族成员主要是三个酪氨酸酶受体( VEGFR1-3) ,主要表达在血管内皮细胞、单核细胞和造血祖细胞。
血管内皮生长因子受体( VEGFR) 由7 个胞外Ig 样区、一个单一短链跨膜序列和一个含酪氨酸蛋白激酶( PTK) 的胞内区组成,其信号传导途径与PTK 的级联反应有关。
VEGF 与受体胞外区结合后,受体二聚体化,进而诱导受体胞内区的酪氨酸残基自动磷酸化和细胞内信号蛋白的酪氨酸磷酸化,传导胞内信号,发挥生物学效[15]。
VEGFR-1和VEGFR-2最初在内皮细胞中被发现,后来发现也部分表达在造血细胞,主要参与肿瘤血管生成。
VEGFR-3主要参与淋巴管的生成与转移。
VEGFR-2是VEGF的主要功能受体,它在VEGF 的信号转导及血管内皮生成中起主导作用。
因此,可以通过阻断VEGF/VEGFR-2的信号传导通路而抑制肿瘤新生血管的生成。
2.2血小板源性生长因子(PDGF)血小板衍生因子(PDGF)可分为分子量为31KD含有7%糖的PDGFI及28KD含4%糖的PDGFⅡ。
两者均由两条高度同源的A链及B链组成,这使PDGF具有三种形式的二聚体结构,即PDGF-AA,PDGF-BB及PDGF-AB。
体内单核/巨噬细胞是主要合成PDGF 的细胞。
在生理状态下,PDGF以α颗粒的形式储存于血小板中,受损的内皮细胞及可以分泌PDGF。
2.3 成纤维细胞生长因子(FGF)FGF 主要有酸性成纤维细胞生长因子(aFGF)和碱性成纤维细胞生长因(bFGF)两种。
它们在正常生理条件下, 参与了对细胞生长, 分化,胚胎发育和血管生长的调节。
FGF 的受体包括4种同源的酪氨酸激酶受体, 这些受体胞外均具有3个免疫球蛋白样与FGF 结合的功能区, 一个跨膜区和具有酪氨酸激酶的胞内区[16] 。
其中以bFGF 与肿瘤血管的形成关系较为密切。
有文章表明,在肿瘤组织中有高水平的bFGF 表达, 而且在一些大型肿瘤组织, 阻断VEGF 的信号传导并不能抑制肿瘤的生长, 而bFGF 则能替代VEGF 的作用;此外, VEGF 和bFGF 在体外血管形成过程中, 也有协同作用:VEGF 体外血管生成作用以及诱导纤溶酶原激活物(PA)的能力依赖于由内皮细胞产生的bFGF[17] 。
2.4表皮生长因子(EGF)它由11名成员和4个表皮生长因子受体(EGFR)组成。
EGFR通路上调促血管生成因子,如VEGF等,因此被视为血管生成的间接调节因子[13]。
2.5转化生长因子(TGF)TGF-β是由两个结构相同或相近的、分子量的12.5kDa亚单位借二硫键连接的双体。
几乎每种细胞类型均可产生TGF-β,其可参与血管形成、胚胎发育和伤口愈合同时具有较强的生长抑制性能。
不同水平的TGF-β可分别对血管生成产生促进或者抑制作用。
低水平的TGF-β通过上调血管生成因子促进血管的生成,而高水平的TGF-β则通过阻止pRb磷酸化抑制内皮细胞的生长和增殖 [18].2.6基质金属蛋白酶(MMPS)基质金属蛋白酶是一个大家族,因其需要Ca、Zn等金属离子作为辅助因子而得名。
其家族成员具有相似的结构,一般由5个功能不同的结构域组成 :(1)疏水信号肽序列;(2)前肽区,主要作用是保持酶原的稳定。
当该区域被外源性酶切断后,MMPs酶原被激活;(3)催化活性区,有锌离子结合位点,对酶催化作用的发挥至关重要;(4)富含脯氨酸的铰链区;(5)羧基末端区,与酶的底物特异性有关。
其中酶催化活性区和前肽区具有高度保守性。
MMPs通过降解细胞外基质和释放血管生成丝裂原存储在基质中,诱导肿瘤血管生成。
MMP-9、MMP-2通过蛋白水解的方式裂解并活化潜在的TGF-β,促进肿瘤血管生。
[18]2.7肿瘤坏死因子(TNF)TNF是由巨噬细胞、肥大细胞和T淋巴细胞释放的细胞因子。
作为一种巨噬细胞活化因子,其并激活这些细胞分泌血管生成因子,促进血管生成。
2.8血管生成素血管生成素1和2可通过其对Tie受体的激动和拮抗作用分别作为促血管生成和抗血管生成因子。
血管紧张素1刺激Tie 2,而血管紧张素2不激活受体并作为血管紧张素1的竞争性抑制剂。
2.9缺氧诱导因子(HIF)缺氧是肿瘤和非肿瘤性疾病血管生成的重要刺激因素,缺氧诱导因子包含HIF-1、HIF-2两种,其中HIF-1在血管生成的作用最为重要。
3.肿瘤血管生成抑制因子,肿瘤血管生长抑制因子通过直接抑制肿瘤血管生成,或通过抑制肿瘤生长刺激因子的生成间接抑制肿瘤血管的生成,而实现对肿瘤的控制。
现已识别的血管生长抑制因子有: 干扰素(INF)、白细胞介素(IL)、基质金属蛋白酶抑制剂(TIMP)、血管抑素、内皮抑素。
3.1干扰素(INF)干扰素分为IFN-α、IFN-β、IFN-γ三个亚型。
干扰素具有抗病毒、调节免疫及抗肿瘤作用。
干扰素与细胞表面的特异性受体结合,除了能诱导经典的JAK-STAT 途径,还能诱导IRF 途径、P38MAPK 途径、IRS-PI3K 途径、CrKL 途径而发挥其生物学效应。
肿瘤新生血管可为不断浸润生长的原发肿瘤提供营养,它们在肿瘤的发展转移过程中起到了重要的促进作用。
干扰素具有抗肿瘤血管生成、抑制肿瘤转移的作用[19]。
目前,IFN -α在治疗肿瘤的直接浸润和转移方面的影响还是未知的,但是,IFN -α可通过IRF信号转导途径而呈现出其抗细胞增殖效应。
[20]3.2白细胞介素(IL)白细胞介素即是由多种细胞产生并作用于多种细胞的一类细胞因子。
白细胞介素(IL)的结构决定其功能的发挥,其具有促进或抑制血管生成的作用。
IL 1a 是由活化的巨噬细胞分泌的一种细胞因子,通过促血管生成因子表达的增加,诱导血管生成。
在人类肿瘤中,IL 12可抑制VEGF mRNA的表达,促进细胞凋亡和抑制增殖率,减少肿瘤血管密度[ 21,22 ]。
IL-10下调肿瘤相关巨噬细胞分泌的VEGF、IL-1β、TNFα、IL-6和 MMP 9 [ 23 ]。
3.3基质金属蛋白酶抑制剂(TIMP)内皮细胞的迁移和增殖过程需要基底膜的降解和细胞外基质的重塑。
在细胞外基质重塑的过程中,基质金属蛋白酶(MMPs)具有中枢作用,而TIMP则通过抑制周围基质的降解抑制新生血管生成。
TIMP-1、TIMP-2可以抑制βFGF诱导的内皮细胞增殖,从而抑制内皮细胞通过明胶迁移 [24]。
3.4血管抑素( AS)血管抑素是血浆纤维蛋白溶解酶原和( 或) 纤维蛋白溶解酶的降解产物,它在生理状态下并不产生,而是在原发肿瘤存在的状态下,由肿瘤细胞或肿瘤组织浸润细胞产生或活化某些蛋白酶水解纤溶酶原和( 或) 纤溶酶形成。