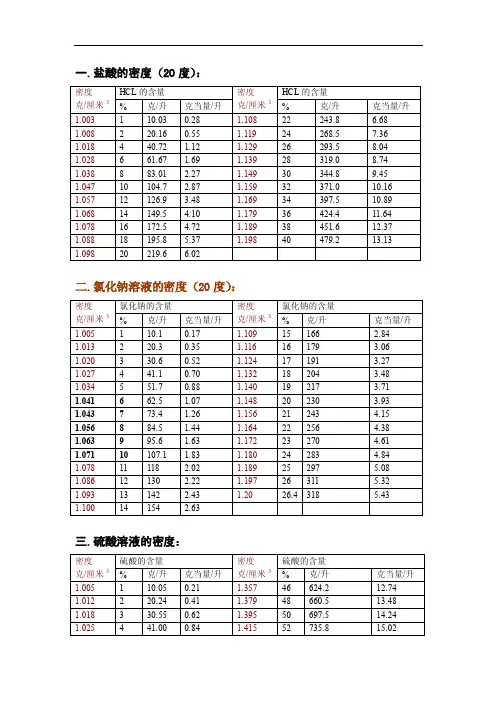
氯化钠溶液的密度
- 格式:docx
- 大小:8.94 KB
- 文档页数:3

氯化钠物理化学性质氯化钠(Sodium chloride),化学式NaCl,无色立方结晶或白色结晶,其来源主要是在海水中,是食盐的主要成分,无色立方结晶或细小结晶粉末,味咸。
接下来店铺为你整理了氯化钠物理化学性质,一起来看看吧。
氯化钠物理性质熔点:801°C(1074K)沸点:1465°C(1738K)密度:2.165克每立方厘米折光率:1.343(1mol/L溶液在589nm)氯化钠的晶体形成立体对称。
其晶体结构中,较大的氯离子排成立方最密堆积,较小的钠离子则填充氯离子之间的八面体的空隙。
每个离子周围都被六个其他的离子包围着。
这种结构也存在于其他很多化合物中,称为氯化钠型结构或石盐结构。
氯化钠是白色无臭结晶粉末。
熔点801℃,沸点1465℃微溶于乙醇、丙醇、丁烷,在和丁烷互溶后变为等离子体,易溶于水。
NaCl分散在酒精中可以形成胶体.,其水中溶解度因氯化氢存在而减少,几乎不溶于浓盐酸。
无臭味咸,易潮解。
易溶于水,溶于甘油,几乎不溶于乙醚。
以矿物岩盐广泛存在于自然界中。
把以矿盐形式存在地下的盐水蒸发而得井盐、岩盐;将海水用阳光晒干而得海盐;将井盐、岩盐或海盐精制而得纯净氯化钠。
氯化钠化学性质1、制取金属钠:2NaCl=电解=2NaCl2↑2、电解食盐水:2NaCl2H2O=电解=H2↑Cl2↑2NaOH3、和硝酸银反应:NaClAgNO3=NaNO3AgCl↓4、氯化钠固体中加入浓硫酸:2NaCl+H2SO4(浓)=加热=2HCl↑+Na2SO4NaCl+H2SO4(浓) =微热=HCl↑+NaHso4检验方法:1、向溶液中滴入硝酸酸化的硝酸银溶液,有白色沉淀产生。
2、用铂丝蘸取少量溶液,置于酒精灯上灼烧,火焰呈黄色,可证含有NaCl。
氯化钠储存方法操作注意事项:密闭操作,加强通风。
操作人员必须经过专门培训,严格遵守操作规程。
建议操作人员佩戴自吸过滤式防尘口罩,戴化学安全防护眼镜,穿防毒物渗透工作服,戴橡胶手套。

272氯化钠水溶液-沸点和密度272 氯化钠水溶液-沸点和密度背景氯化钠水溶液是海水淡化、海水养殖、食品加工、废水处理等领域的典型溶液,在研究冷冻浓缩、膜蒸馏、蒸发浓缩、冷热结晶等技术和设备时,常用作盐类料液的代表性实验料液。
常压沸点(1atm)计算公式(席华. 氯化钠溶液物性关系式[J]. 天津轻工业学院学报,1997,(2):72-74)t B=100.0+12.28x+48.04x2+56.86x3式中,t B为常压下氯化钠水溶液的沸点,℃;x为氯化钠水溶液的质量分数,无因次。
上式适用范围为x =0.0~0.25。
计算示例:当氯化钠水溶液的质量分数为0.2(即20%)时,其常压下沸点为:t B=100.0+12.28*0.2+48.04*0.22+56.86*0.23=104.8℃非常压沸点计算公式(姚玉英主编. 化工原理(上)[M]. 天津:天津大学出版社,1999,295-296)t N= t W + x(t BN -t BW)x =0.0162(t W +273)2/r W式中,t N为某压力下氯化钠水水溶液的沸点,℃;t W为该压力下纯水的沸点,℃;x为修正系数,无因次;t BN为常压下氯化钠水溶液的沸点,℃;t BW为常压下纯水的沸点,℃;r W为该压力下纯水的汽化潜热,kJ/kg。
计算示例:估算20%的氯化钠水溶液在20kPa时的沸点。
20℃时纯水的沸点约为60℃,汽化潜热约为2360kJ/kg.修正系数为:x =0.0162(t W +273)2/r W=0.0162*(60+273)2/2360=0.76常压下20%氯化钠水溶液的沸点为104.8℃,纯水的沸点为100℃。
20kPa时20%氯化钠水溶液的沸点约为:t N= t W + x(t BN -t BW)=60+0.76*(104.8-100)=63.6℃密度计算公式(席华. 氯化钠溶液物性关系式[J]. 天津轻工业学院学报,1997,(2):72-74)d=1006.0+737.7x-0.311t-0.001993t2式中,d为氯化钠水溶液的密度,kg/m3;x为氯化钠水溶液的质量分数,无因次;t为氯化钠水溶液的温度,℃。

饱和食盐水密度
常温常压下,饱和食盐水的密度是1.33g/cm^3。
食盐的主要成分是氯化钠,因此食盐水主要由氯化钠溶液组成。
工业上用电解饱和氯化钠溶液的方法来制取氢氧化钠、氢气和氯气,并以它们为原料生产一系列化工产品,称为氯碱工业。
比重为2.165(25/4℃)。
熔点801℃,沸点1442℃,相对密度为2.165克/立方厘米,味咸,含杂质时易潮解;溶于水或甘油,难溶于乙醇,不溶于盐酸,水溶液中性并且导电。
食盐的主要成分是氯化钠(NaCl),所以食盐水主要是由氯化钠溶液组成的。
氯碱工业是最基本的化学工业之一,其产品除应用于化学工业外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。
食盐水还可以用来卸妆、消毒杀菌、补水、治电解质紊乱等。
另外酶中加食盐水对酶的有催化作用。

化学实验报告【实验目的】1、练习配制一定溶质质量分数或量浓度一定的溶液。
2、加深对溶质的质量分数以及量浓度概念的理解。
【实验器材】托盘天平、烧杯、玻璃棒、药匙、量筒、胶头滴管。
氯化钠、浓盐酸溶液、蒸馏水、容量瓶、漏斗。
【实验步骤】1、配置质量分数为6%的氯化钠溶液(1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:NaCl:50g*6%=3g ;水:47g。
(2)称量:用托盘天平称取所需的氯化钠,放入烧杯中。
(3)量取:用量筒量取所需的水(水的密度可近似看作1g/cm3),倒入盛有氯化钠的烧杯中。
(4)溶解:用玻璃棒搅拌,使氯化钠溶解。
2、用已配制好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3%的氯化钠溶液。
(1)计算:所得溶液中,氯化钠的质量为50g*3%=1.5g,所以需要质量分数为6%的氯化钠溶液25g(体积为26ml),蒸馏水25g(体积约为25ml)(2)量取:用量筒量取所需的氯化钠溶液和水,倒入烧杯中。
(3)混匀:用玻璃棒搅拌,使溶液混合均匀。
将上述配制好的溶液分别转入试剂瓶内,并贴上标签,区分开来。
3、配制250ml,2mol/L的稀盐酸(1)计算所需浓盐酸的体积设所需浓盐酸的体积为V1,则C1*V1=0.25L*2mol/L12mol/L*V1=0.25L*2mol/L解得该体积为41.7ml(2)用量筒量取41.7ml的浓盐酸(3)在烧杯中加入少量(大大少于250ml)的水和量取好的浓盐酸,用玻璃棒搅拌稀释。
(4)使用漏斗将烧杯内的溶液转移到容量瓶中。
(5)用水洗涤盛过盐酸的量筒和烧杯,并把洗涤液转移至容量瓶。
(6)定容:用胶头滴管继续加水,直至溶液凹液面达到250ml刻度。
(7)压紧容量瓶瓶盖将溶液摇匀。
仅供个人用于学习、研究;不得用于商业用途。
For personal use only in study and research; not for commercial use.Nur für den persönlichen für Studien, Forschung, zu kommerziellen Zwecken verwendet werden.Pour l 'étude et la recherche uniquementà des fins personnelles; pas à des fins commerciales.толькодля людей, которые используются для обучения, исследований и не должны использоваться в коммерческих целях.以下无正文仅供个人用于学习、研究;不得用于商业用途。

一、概述渗透压是指在一定温度下,溶液中溶质的浓度。
在生物学和生物化学中,渗透压是一个重要的生物学参数,它对细胞膜的通透性、生长和代谢活动等有着重要影响。
测定渗透压需要标准物质,而氯化钠溶液常被用作标准物质。
本文将以渗透压摩尔浓度标准物质(氯化钠溶液)为主题,介绍其相关知识。
二、氯化钠溶液的制备1. 氯化钠(NaCl)的质量浓度计算公式:C = M/V,其中C为质量浓度,M为氯化钠的质量(g),V为溶液的体积(L)。
根据需要制备不同浓度的氯化钠溶液,可按公式计算所需质量和体积。
2. 将所需质量的氯化钠称量于容器中。
3. 加入适量的去离子水,并充分搅拌溶解。
三、氯化钠溶液的性质1. 密度:氯化钠溶液的密度随浓度的变化而变化,通常可以在标准条件下进行测定。
2. 折射率:氯化钠溶液的折射率也随浓度的变化而变化,可用折射计进行测定。
3. 渗透压:氯化钠溶液的渗透压随浓度的变化而变化,可通过渗透压计进行测定。
四、氯化钠溶液的应用1. 生物学实验:氯化钠溶液常用于生物学实验中,用作细胞培养液的基础成分或生理生化实验的试剂。
2. 医学诊断:氯化钠溶液也常用于医学诊断中,用作盐水冲洗、输液等。
五、渗透压摩尔浓度标准物质的重要性1. 在生物学和生物化学研究中,需要准确测定细胞内外的渗透压,而渗透压摩尔浓度标准物质(氯化钠溶液)可以提供准确的浓度参考。
2. 渗透压摩尔浓度标准物质的准确制备和使用,对实验结果的准确性和可重复性至关重要。
六、渗透压摩尔浓度标准物质的测定方法1. 渗透压计法:利用渗透压计通过测定氯化钠溶液的渗透压来确定其摩尔浓度。
2. 冰点降压法:利用氯化钠溶液的冰点降压来确定其摩尔浓度。
七、结语渗透压摩尔浓度标准物质(氯化钠溶液)是生物学和生物化学研究中的重要参考物质,其准确制备和使用对实验结果具有重要影响。
希望本文能够帮助读者更深入地了解渗透压摩尔浓度标准物质(氯化钠溶液)的相关知识,为科研工作者和实验人员提供参考与帮助。

氯化钠的摩尔体积氯化钠是一种常见的化学物质,化学式为NaCl。
在自然界中广泛存在,尤其是在海水和盐矿中。
氯化钠是一种白色结晶固体,可溶于水,在水中呈现出相对稳定的离子化合物状态。
摩尔体积是指在一定条件下一个摩尔物质所占据的体积。
对于气体,摩尔体积与温度、压力有关。
对于固体和液体,摩尔体积主要与密度相关。
在讨论氯化钠的摩尔体积之前,我们先介绍一下氯化钠的一些基本性质。
氯化钠的相对分子质量为58.44g/mol,密度为2.165 g/cm³。
这意味着,一个摩尔的氯化钠所占据的体积为:摩尔体积= 1 mol / (2.165 g/cm³)利用上述关系,我们可以计算出氯化钠的摩尔体积为:摩尔体积≈ 0.462 cm³/mol上述结果为氯化钠在常温常压下的摩尔体积。
需要注意的是,这个结果只是一个估算值,我们假设氯化钠的分子是紧密排列的球形颗粒,而实际情况可能会有所不同。
氯化钠在固态时呈现出晶格结构,具有离子键的特性。
在这种结构中,钠离子Na+和氯离子Cl-通过离子键相互吸引,形成一个三维的结晶结构。
这个结构导致了氯化钠晶体不易被压缩。
因此,摩尔体积与密度之间存在着一种反比关系。
除了固态,氯化钠还可以呈现出液态和气态。
在液态和气态下,氯化钠的分子之间的相互作用和排列状态会有所不同,从而导致摩尔体积的变化。
在液态和气态下,摩尔体积的计算需要考虑温度和压力等因素的影响。
总结起来,氯化钠的摩尔体积是一个复杂的问题,涉及到固态、液态和气态之间的相互转化,以及温度、压力等因素的影响。
在常温常压下,一个摩尔的氯化钠大致占据0.462 cm³的体积。
但需要注意的是,这个结果只是一个估算值,实际情况会因具体条件而有所不同。

化学实验报告配置氯化钠溶液实验目的:配置一定浓度的氯化钠溶液,并对其进行一系列的物理和化学性质测试,以了解氯化钠溶液的行为。
实验器材和药品:氯化钠(NaCl)、蒸馏水、容量瓶、滴定管、天平、滤纸、比色皿、pH计、电导仪、温度计等。
实验步骤:1.称取一定质量的氯化钠,精确称量并记录质量。
2.取一个容量瓶,倒入适量的蒸馏水,并记录初始体积。
3.将称取的氯化钠加入容量瓶中的蒸馏水中,尝试溶解氯化钠。
4.加入适量的蒸馏水,使溶液体积接近刻度线。
5.使用玻璃棒轻轻搅拌溶液,直到溶液均匀无明显沉淀。
6.使用天平重新称量容量瓶,记录加入氯化钠后的质量。
7.计算氯化钠溶液的摩尔浓度。
实验结果与分析:根据实验数据计算得到的氯化钠溶液摩尔浓度为X mol/L。
物理性质测试:1.外观:观察溶液的颜色和透明度。
2.pH值:使用pH计测量氯化钠溶液的pH值。
3.密度:使用密度计或天平测量氯化钠溶液的密度。
4.电导率:使用电导仪测量溶液的电导率。
化学性质测试:1.氯化钠溶液的中和反应:取一个比色皿,加入一定量的氯化钠溶液和酚酞指示剂,滴加硫酸,观察颜色变化并记录。
实验注意事项:1.在称取氯化钠时要使用干燥的药勺和干燥的天平。
2.在配置溶液时确保溶剂和容器均干燥,并使用铭有刻度的容量瓶。
3.搅拌溶液时要轻柔,以避免溶液溅出。
4.在测试物理和化学性质时,注意使用合适的仪器,并按照操作方法进行操作。
实验结论:通过实验,成功配置了一定浓度的氯化钠溶液,并进行了一系列的物理和化学性质测试。
根据实验结果分析,可以得出氯化钠溶液的特性,如外观、pH值、密度和电导率等。
此外,观察到氯化钠溶液发生了中和反应,并记录了其颜色变化。
实验结果可以用于进一步研究和分析氯化钠溶液的性质和行为。

化学实验报告【实验目的】1、练习配制一定溶质质量分数或量浓度一定的溶液。
2、加深对溶质的质量分数以及量浓度概念的理解。
【实验器材】托盘天平、烧杯、玻璃棒、药匙、量筒、胶头滴管。
氯化钠、浓盐酸溶液、蒸馏水、容量瓶、漏斗。
【实验步骤】1、配置质量分数为6%的氯化钠溶液(1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:NaCl:50g*6%=3g ;水:47g。
(2)称量:用托盘天平称取所需的氯化钠,放入烧杯中。
(3)量取:用量筒量取所需的水(水的密度可近似看作1g/cm3),倒入盛有氯化钠的烧杯中。
(4)溶解:用玻璃棒搅拌,使氯化钠溶解。
2、用已配制好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3%的氯化钠溶液。
(1)计算:所得溶液中,氯化钠的质量为50g*3%=1.5g,所以需要质量分数为6%的氯化钠溶液25g(体积为26ml),蒸馏水25g(体积约为25ml)(2)量取:用量筒量取所需的氯化钠溶液和水,倒入烧杯中。
(3)混匀:用玻璃棒搅拌,使溶液混合均匀。
将上述配制好的溶液分别转入试剂瓶内,并贴上标签,区分开来。
3、配制250ml,2mol/L的稀盐酸(1)计算所需浓盐酸的体积设所需浓盐酸的体积为V1,则C1*V1=0.25L*2mol/L12mol/L*V1=0.25L*2mol/L解得该体积为41.7ml(2)用量筒量取41.7ml的浓盐酸(3)在烧杯中加入少量(大大少于250ml)的水和量取好的浓盐酸,用玻璃棒搅拌稀释。
(4)使用漏斗将烧杯内的溶液转移到容量瓶中。
(5)用水洗涤盛过盐酸的量筒和烧杯,并把洗涤液转移至容量瓶。
(6)定容:用胶头滴管继续加水,直至溶液凹液面达到250ml刻度。
(7)压紧容量瓶瓶盖将溶液摇匀。
仅供个人用于学习、研究;不得用于商业用途。
For personal use only in study and research; not for commercial use.Nur für den persönlichen für Studien, Forschung, zu kommerziellen Zwecken verwendet werden.Pour l 'étude et la recherche uniquementà des fins personnelles; pas à des fins commerciales.толькодля людей, которые используются для обучения, исследований и не должны использоваться в коммерческих целях.以下无正文仅供个人用于学习、研究;不得用于商业用途。

实验探究∶一定溶质质量分数的氯化钠溶液的配制初中化学实验报告班级:学生姓名:日期:2019·02·25一【实验目的】1加深对溶质质量分数理解2简单了解配制过程及其操作步骤二【实验仪器与药品】氯化钠,烧杯,玻璃棒,量筒,胶头滴管,试剂瓶,托盘天平,药匙三、【实验步骤】1、配制质量分数为6%的氯化钠溶液。
(1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:氯化钠_______g;水__________g。
(2)称量:用_________称量所需的氯化钠,放入____________中。
(3)量取:用_____________量取所需的水(水的密度可近似看做1g/cm3),倒入盛有氯化钠的_____________中。
(4)溶解:用______________搅拌,使氯化钠溶解。
整个配制过程如下图所示。
2、配制质量分数为3%的氯化钠溶液。
用已配好的质量分数为6%的氯化钠溶液(密度约为1.041g/cm3),配制50g质量分数为3%的氯化钠溶液。
(1)计算:配制50g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液和水分别为:6%的氯化钠溶液____________g(体积__________ml);水__________g。
(2)量取:用________量取所需的氯化钠溶液和水,倒入________中。
(3)混匀:用____________搅拌,使溶液混合均匀。
3、把配制好的上述俩种氯化钠的溶液分别装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和溶液的溶质的质量分数),放到实验桌上。
【问题与交流】1.用量筒量取液体时,读数应注意什么?2.准确配制一定溶质质量分数的溶液,在实际应用中有什么意义?请举例;。

实验探究∶一定溶质质量分数的氯化钠溶液的配制初中化学实验报告班级:学生姓名:日期:2019·02·25一【实验目的】1加深对溶质质量分数理解2简单了解配制过程及其操作步骤二【实验仪器与药品】氯化钠,烧杯,玻璃棒,量筒,胶头滴管,试剂瓶,托盘天平,药匙三、【实验步骤】1、配制质量分数为6%的氯化钠溶液。
(1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:氯化钠_______g;水__________g。
(2)称量:用_________称量所需的氯化钠,放入____________中。
(3)量取:用_____________量取所需的水(水的密度可近似看做1g/cm3),倒入盛有氯化钠的_____________中。
(4)溶解:用______________搅拌,使氯化钠溶解。
整个配制过程如下图所示。
2、配制质量分数为3%的氯化钠溶液。
用已配好的质量分数为6%的氯化钠溶液(密度约为1.041g/cm3),配制50g质量分数为3%的氯化钠溶液。
(1)计算:配制50g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液和水分别为:6%的氯化钠溶液____________g(体积__________ml);水__________g。
(2)量取:用________量取所需的氯化钠溶液和水,倒入________中。
(3)混匀:用____________搅拌,使溶液混合均匀。
3、把配制好的上述俩种氯化钠的溶液分别装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和溶液的溶质的质量分数),放到实验桌上。
【问题与交流】1.用量筒量取液体时,读数应注意什么?2.准确配制一定溶质质量分数的溶液,在实际应用中有什么意义?请举例;。
20%氯化钠密度20%氯化钠溶液是一种常用的生理盐水浓度,其密度在实验室研究和临床应用中具有重要意义。
20%氯化钠溶液是一种含有20%氯化钠(NaCl)的溶液,其在医疗领域中被广泛用于静脉注射、药物稀释、灌洗和输液等多种用途。
20%氯化钠溶液的密度是指在标准条件下,单位体积的溶液所含的质量,通常用于描述溶液的浓度和稠度。
密度是物质单位体积内的质量,通常用来描述物质的浓度和稠度。
在20%氯化钠溶液中,氯化钠是主要的溶质,其密度受到溶质的种类、浓度、溶剂的性质等因素的影响。
20%氯化钠溶液的密度不仅受到化学成分的影响,还受到温度、压力、溶解度等因素的影响。
研究20%氯化钠溶液的密度可以帮助我们更好地理解其在医疗和实验室中的应用及性质。
20%氯化钠溶液的密度通常是在实验室中通过测量密度计来确定的。
密度计是一种用来测量液体密度的仪器,通过将一定量的溶液倒入密度计中,并测量其排入的体积和所含质量,从而计算出其密度。
在实验室中,20%氯化钠溶液的密度通常在特定温度下进行测量,并根据测量结果来进行调整和控制。
20%氯化钠溶液的密度是一个重要的物理性质,在医疗和实验室中具有广泛的应用。
在医疗领域中,20%氯化钠溶液的密度可以影响其在输液过程中的流动性和渗透性,从而影响其对病人的治疗效果。
在实验室研究中,20%氯化钠溶液的密度也可以用来描述其在溶液中的浓度和稠度,从而为实验数据的分析和解释提供帮助。
除了在医疗和实验室中的应用外,20%氯化钠溶液的密度还可以在工业和农业领域中找到广泛的应用。
在工业生产中,20%氯化钠溶液的密度可以影响其在制备过程中的流动性和稠度,从而影响产品的质量和性能。
在农业领域中,20%氯化钠溶液的密度可以用来调节灌溉水的溶解度和浓度,从而提高农作物的产量和质量。
梳理一下本文的重点,我们可以发现,20%氯化钠溶液的密度是一个重要的物理性质,其在医疗、实验室、工业和农业等领域中具有广泛的应用价值。
3% 的氯化钠溶液标签书写在医疗和实验室领域,氯化钠溶液是一种常见的液体,用于输液、洗涤和实验等。
正确书写氯化钠溶液的标签非常重要,可以确保溶液的正确性和安全性。
本文将介绍如何正确书写 3% 的氯化钠溶液标签。
下面是本店铺为大家精心编写的5篇《3% 的氯化钠溶液标签书写》,供大家借鉴与参考,希望对大家有所帮助。
《3% 的氯化钠溶液标签书写》篇13% 的氯化钠溶液是一种常用的液体,在医疗和实验室领域都有广泛的应用。
正确书写氯化钠溶液的标签非常重要,可以确保溶液的正确性和安全性。
下面是书写 3% 的氯化钠溶液标签的步骤:1. 标签应该包括以下信息:溶液名称、浓度、体积、生产日期和批号。
对于 3% 的氯化钠溶液,标签上应明确标注“3% 氯化钠溶液”或“3%NaCl 溶液”。
2. 浓度应该以百分数的形式表示,并在标签上醒目地标注。
对于 3% 的氯化钠溶液,浓度应标注为“3%”。
3. 标签上应标注溶液的体积,通常以毫升 (mL) 为单位。
例如,如果瓶中有 1000mL 的 3% 氯化钠溶液,则应在标签上标注“1000mL”。
4. 生产日期和批号也应该在标签上注明。
生产日期应按照年、月、日的格式标注,例如“2023 年 2 月 18 日”;批号应按照一定的格式标注,例如“230218-01”。
5. 标签的颜色和字体也应该一致,并且应该清晰易读。
建议使用黑色或蓝色的笔或打印机打印标签。
6. 标签的位置应该在瓶子的正面或侧面,以便于观察和识别。
如果瓶子有多个面,则应在每个面上都标注标签。
正确书写 3% 的氯化钠溶液标签非常重要,可以确保溶液的正确性和安全性。
《3% 的氯化钠溶液标签书写》篇23% 氯化钠溶液的标签应该包含以下信息:1. 产品名称:3% 氯化钠溶液2. 规格:1000ml/瓶3. 主要成分:氯化钠 30g/1000ml4. 性状:无色至微黄色透明液体5. 适应症:用于补充体液、纠正脱水、酸中毒及维持体内电解质平衡6. 用法用量:静脉滴注,用量视病情而定,成人每次 1-2 瓶,每日总量 2-4 瓶。