元素常用光谱特征线(绝大部分元素)
- 格式:doc
- 大小:84.00 KB
- 文档页数:4


X射线中元素的K线系谱
X射线中,元素的K线系谱是特征谱线,可用于元素定性分析。
以下是几种元素的K 线系谱:
1. 碳(C):K线系谱中有两条特征谱线,分别位于
2.29nm和4.70nm。
2. 氮(N):K线系谱中有三条特征谱线,分别位于2.46nm、
3.10nm和
4.30nm。
3. 氧(O):K线系谱中有两条特征谱线,分别位于2.03nm和2.23nm。
4. 钠(Na):K线系谱中有两条特征谱线,分别位于3.53nm和4.10nm。
5. 镁(Mg):K线系谱中有三条特征谱线,分别位于2.80nm、3.07nm和3.55nm。
6. 铝(Al):K线系谱中有三条特征谱线,分别位于3.05nm、3.48nm和4.20nm。
7. 硅(Si):K线系谱中有三条特征谱线,分别位于2.69nm、3.18nm和4.18nm。
8. 磷(P):K线系谱中有三条特征谱线,分别位于2.79nm、3.29nm和4.01nm。
9. 硫(S):K线系谱中有两条特征谱线,分别位于2.51nm和3.41nm。
10. 氯(Cl):K线系谱中有两条特征谱线,分别位于2.65nm和4.01nm。
这些元素的K线系谱都是通过实验测定的,它们是X射线光谱学中元素定性分析的基础。


一、光谱线的概念及其重要性光谱线是指由物质产生的特定波长的光线,在物质在低温下受到激发后,会发出特定的波长的光线,这些光线组成了光谱线。
光谱线的研究对于物质的表征和识别具有重要的意义,可以通过测量光谱线的位置、强度和形状来了解物质的组成、结构和性质。
二、光谱线的描述需要的参数及其含义1. 波长(Wavelength)波长是光谱线的一个重要参数,表示光的波长,通常用λ表示。
波长越长,光的能量越低,波长越短,光的能量越高。
在光谱线的描述中,波长可以用来区分不同的光谱线,也可以用来研究物质的结构和性质。
2. 位置(Position)光谱线的位置表示其在光谱中的具体位置,通常用频率或波数表示。
通过观测光谱线的位置,可以确定物质的特定特性,比如元素的组成和状态。
3. 强度(Intensity)光谱线的强度表示了光谱线的亮度,也可以反映物质的含量和浓度。
强度越大,表示物质含量越高,浓度越大。
4. 形状(Shape)光谱线的形状可以反映光的散射和吸收过程,通过观察光谱线的形状可以了解物质的电子结构和分子结构。
5. 极化(Polarization)光谱线的极化描述了光线的振动方向,可以用来研究物质的对称性和性质。
三、光谱线描述的方法和工具1. 光谱仪(Spectrometer)光谱仪是一种专门用来测量光谱线的仪器,可以测量从紫外到红外的整个光谱范围。
光谱仪通常包括光源、样品室、光栅和检测器等部件,可以通过调节光栅或检测器来测量不同波长或频率的光谱线。
2. 光谱分析软件(Spectroscopy Software)光谱分析软件是用来处理和分析光谱数据的工具,可以用来绘制光谱图、测量光谱线的位置、强度和形状,也可以用来对比和识别不同的光谱线。
3. 光谱数据库(Spectroscopy Database)光谱数据库包括了大量的已知光谱图谱和数据,可以用来对比和识别未知物质的光谱线,也可以用来研究物质的性质和特性。
四、光谱线研究的应用领域1. 化学分析光谱线可以用来识别和分析物质的成分和结构,比如质谱法和光谱法就是常用的化学分析技术。




元素是构成自然界和人造物质的基本组成单位,而由元素组成的物质发出的光谱线对于科学研究和工业应用具有重要意义。
本文将重点探讨元素与自己特征谱线对应的光现象。
一、元素的光谱线1. 普朗克辐射定律在物理学中,普朗克辐射定律描述了黑体辐射的光谱。
根据普朗克辐射定律,黑体辐射的能量密度与光的频率呈正比,而频率与波长之间存在着反比关系。
这一定律为理解元素光谱线的产生机制提供了重要的理论基础。
2. 光谱分析通过光谱分析,科学家们发现每种元素都有自己独特的光谱线,这些光谱线被称为元素的特征谱线。
通过观察元素特征谱线的频率和强度,可以对元素的性质和结构进行深入的研究。
3. 元素激发和辐射当元素受到能量激发时,其原子或分子内部的电子会发生跃迁。
这些跃迁释放出来的能量以光的形式辐射出去,形成了元素的光谱线。
不同元素的原子结构和能级差异导致了它们特征谱线的差异,因此可以通过观察元素的特征谱线来进行元素的鉴定和分析。
二、光谱线在科学研究中的应用1. 光谱分析技术光谱分析技术是现代科学研究中非常重要的一项工具。
通过测量物质发出的光谱线,可以对物质的组成、结构和性质进行分析。
光谱分析技术被广泛应用于化学、物理、生物等领域,为科学研究和工业生产提供了有力的支持。
2. 天体光谱学天体光谱学是天文学研究中的一个重要分支,通过观测天体发出的光谱线,可以了解天体的组成元素、温度、密度等重要信息。
天体光谱学的发展为人类对宇宙的认识提供了重要的数据支持。
3. 化学元素分析在化学领域,光谱分析被广泛应用于化学元素的分析。
通过测量化合物或化学反应产物的光谱线,可以确定其中所包含的元素种类和含量,为化学反应的研究和新材料的开发提供了重要的数据支持。
三、光谱线在工业应用中的意义1. 光谱仪器光谱仪器是一类广泛应用于工业生产中的检测设备,通过测量样品发出的光谱线来分析样品的成分和性质。
在冶金、材料、化工等工业领域,光谱仪器被用于质量控制、产品分析和新材料研发等方面。

写出c,o,si,br的基态光谱支项-概述说明以及解释1.引言1.1 概述概述光谱支项是指在元素的基态下,不同能级之间的跃迁所对应的光谱线。
通过研究基态光谱支项,我们可以深入了解物质的电子结构和能级分布情况。
本文旨在探讨碳(C)、氧(O)、硅(Si)和溴(Br)等元素的基态光谱支项,并分析它们的定义、意义和特点。
在2.1节中,我们将详细介绍基态光谱支项的定义和意义。
这一部分将解释什么是基态光谱支项以及为什么研究它们对于我们理解物质的性质和行为至关重要。
接着,在2.2节到2.5节,我们将分别探讨碳、氧、硅和溴元素的基态光谱支项。
这些元素具有不同的原子结构和化学性质,因此它们的基态光谱支项也会有所不同。
在3.1节中,我们将对本文的研究结果进行总结。
我们将回顾各个元素的基态光谱支项,并指出它们的特点和共同之处。
在3.2节中,我们将对论文中的内容进行讨论,分析研究结果的意义和可能的应用。
最后,在3.3节中,我们将展望未来的研究方向,提出一些可能的研究问题和发展方向。
通过对碳、氧、硅和溴元素的基态光谱支项进行研究,我们可以更加全面地了解这些元素的基本性质和行为规律。
这对于材料科学、化学和物理等领域的研究具有重要意义。
本文的研究结果将为相关领域的学术研究和实际应用提供有价值的参考,也有助于推动科学领域的发展和进步。
1.2 文章结构文章结构部分的内容如下:文章结构:本文将按照以下结构进行介绍和讨论基态光谱支项的形成和特征。
该结构包括引言、正文和结论三个部分。
引言部分旨在概述本文的主题并介绍基态光谱支项的重要性和研究价值。
同时,引言部分还会对文章的结构和内容进行简要的说明,以便读者能够清晰地了解整篇文章的逻辑和层次结构。
正文部分将详细探讨C、O、Si和Br元素的基态光谱支项。
首先,我们会介绍基态光谱支项的定义和意义,以确保读者对本文内容有充分的了解。
随后,我们将分别对四种元素的基态光谱支项进行详细的讨论。
针对C元素,我们将介绍其基态光谱支项的特征和形成机制;对于O元素,我们将对其基态光谱支项进行分析和解释;同时,我们还将探究Si和Br元素在基态光谱支项方面的特性和研究进展。
钙元素的特征谱线波长为
1.H线系列:这是钙的最突出特征谱线之一、H线系列包括Hα线(656.28纳米)、Hβ线(486.13纳米)、Hγ线(434.05纳米)和Hδ
线(410.17纳米)。
这些谱线通常用于测量天体中钙的丰度,以及识别
和分类恒星。
2.K线和L线系列:这些谱线是钙的核心特征谱线之一,也是X射线
荧光光谱分析中常用的谱线。
K线系列包括Kα线(393.37纳米)和Kβ
线(396.85纳米),L线系列包括Lα线(0.348纳米)和Lβ线
(0.313纳米)等。
3.2s-2p谱线:这些谱线是钙的外层电子能级的跃迁所产生的。
2s-
2p谱线包括2s-2p1/2谱线(657.3纳米)和2s-2p3/2谱线(849.8纳米)等。
4.D谱线:这是钙离子(Ca+)在电磁场中产生的谱线。
D谱线有D1
线(588.995纳米)和D2线(589.591纳米)两条。
5.M谱线:这些谱线是由钙分子的光辐射引起的。
M谱线有M1线(516
6.71纳米)、M2线(5169.03纳米)、M4线(5172.68纳米)和M5
线(5176.15纳米)等。
6.UV谱线:这些是钙的紫外可见光谱线。
UV谱线中,UV-A线(370
纳米以下)、UV-B线(280-315纳米)和UV-C线(100-280纳米)是常
见的谱线。
以上是一些常见的钙元素的特征谱线波长。
这些谱线的观测和分析有
助于研究钙在天体、化学和物理领域的性质和行为。
元素分析知识总结第一章. 原子吸收光谱1 •共振线,第一共振线共振吸收线:原子由基态跃迁到激发态所吸收的谱线。
第一共振线:由基态跃迁到能量最低的激发态所吸收的谱线。
这条谱线强度最大,灵敏度最高。
2•原子吸收谱线的自然宽度、中心频率、半峰宽原子吸收线并非是一条严格的几何线,而是占据着极窄的频率范围,具有一定的自然宽度。
原子吸收光谱的轮廓以原子吸收谱线的中心频率和半宽度来表征。
半宽度(△ v):是指在极大吸收系数一半处,吸收光谱线轮廓上两点之间的频率差。
海森堡测不准原理:当核外电子跃迁到激发态时,激发态的能级和电子在激发态停留的时间是测不准的,具有不确定度。
即:E1 :E1 ± A E t1 : t1 ±△t△E A t》h/2 n只有当A t-x,△ E-0,此时激发态的能量E1才有定值,但是电子在激发态的时间只有约10-8,所以激发态的能量E1是测不准的,只能是一个范围。
而电子在基态是稳定的,所以电子在基态停留时间的A t,所以A E-0,基态能量E0具有定值。
所以V (E1 - E0 ) /h是测不准的,中心频率具有不确定度,所以原子吸收线具有自然宽度。
自然宽度(A u N)一般为10-5nm数量3 •为什么原子吸收线具有自然宽度?根据海森堡测不准原理:A E A t > h/2 n电子在基态是稳定的,所以电子在基态停留时间的A t-x,所以A E-0,基态能量E0具有定值。
而电子在激发态的时间只有约10-8,所以激发态的能量E1是测不准的,只能是一个范围。
所以谱线的频率V (E1 - E0) /h是测不准的,中心频率具有不确定度,所以原子吸收线具有自然宽度。
自然宽度(A uN)一般为10-5nm数量级。
4•多普勒变宽、洛伦兹变宽、霍尔兹马克变宽多普勒变宽:(中心频率不变)一个运动着的原子所发射出的光,若运动方向朝向观察者(检测器),则观测到光的频率较静止原子所发出光的频率来得高(波长来得短);反之,若运动方向背向观察者,则观测到光的频率较静止原子所发出光的频率来得低(波长来得长)。
光谱分析与元素的识别光谱分析是一种重要的科学方法,通过研究物质在不同波长的光下产生的特定光谱,可以确定其组成和特征。
光谱分析广泛应用于化学、物理、天文学等领域,对于元素的识别和定量分析有着重要的意义。
一、光谱的基本原理光谱是指由不同波长的光组成的光线的分布情况。
根据物质对不同波长光的吸收、发射和散射特性,可以得到不同的光谱类型,如连续光谱、发射光谱和吸收光谱。
连续光谱是指由各种波长的光线连续组成的光谱,如可见光中的白光。
发射光谱是指物质在受激或加热后,由高能级跃迁到低能级所产生的光谱。
吸收光谱是指物质在受到一定波长光的照射后,由于吸收光的能量而跃迁到较高能级所产生的光谱。
二、光谱分析的方法1. 原子吸收光谱法(AAS)原子吸收光谱法是利用原子对特定波长光的吸收程度与元素浓度之间的关系来测定物质中某种元素的含量。
该法主要包括火焰原子吸收光谱法、电感耦合等离子体原子发射光谱法等。
2. 分子吸收光谱法分子吸收光谱法是利用分子对特定波长光的吸收程度与溶液中溶质的浓度之间的关系来测定溶液中某种物质的含量。
如紫外-可见吸收光谱法、红外光谱法等。
3. 质谱法质谱法是利用物质在电离后,根据质荷比对离子进行分离、检测和测量的方法。
通过离子的质荷比可以确定元素的存在和相对含量。
三、元素的识别光谱分析在元素的识别方面具有重要的应用价值。
每种元素都有其特定的光谱特征,通过对比未知样品的光谱与标准库中已知元素的光谱进行比对,可以对未知样品中存在的元素进行准确的识别。
例如,通过火焰原子吸收光谱法可以对金属元素进行快速的识别和定量分析。
不同金属元素在火焰中产生特定的光谱,通过测量吸收峰的强度和波长,可以确定样品中金属元素的种类和含量。
四、光谱分析的应用光谱分析在不同领域有着广泛的应用。
例如在环境检测中,通过吸收光谱法可以测定水中有害金属离子的浓度,从而评估水质的安全性。
在制药工业中,光谱分析可以用于药物成分的分析和质量控制。
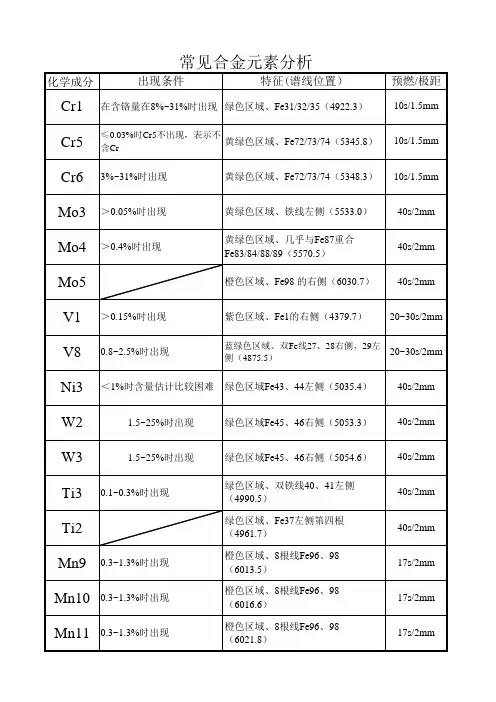
第五章分析图谱与标志5.1光谱分析谱线分析标志光谱分析是利用激发光源对试件〔样〕提供能量,使原子处于激发状态,借助看谱镜观察其排列有序的谱线进展分析的。
本节要掌握的知识点是:利用肉眼可见局部波长为7,700─3,900埃的区域内的谱线具有红、橙、黄、绿、青、蓝、紫七色,铁谱线在七色中均有分布,并有其固有的特征和分布规律,借助这一特征,将铁谱线作为基线〔起标志物作用〕来识别被分析原素是否存在;利用所存在的元素含量越高,该元素谱线的能量越大〔谱线亮度越强〕的谱线特性,来测定被分析元素量的多少。
因此分析信号的获取和正确识别是定性和定量分析的根底,分析标志就是将分析信号进展归类并列表,作为光谱分析定性和半定量分析辅助工具之一。
列入分析标志的铁基线特征明显,受干扰影响小,靠近元素谱线并按波长依次编号,同时也将被分析元素谱线根据其不同能级显示的波长位置依次编号。
铁基线的主要作用有两个,一是利用其各色区固有的特征作为定性分析时的特征线,帮助分析者找到该特征线左右的元素谱线;二是利用其相对固定的谱线亮度,作为相邻元素谱线能级的比照依据。
下面我们按元素为单位介绍光谱分析中铁基线与元素谱线的认定和利用分析标志进展光谱分析的方法。
5.2光谱分析定性与半定量分析光谱分析根据分析要求主要有两个,一是要求我们判定钢种类别,以黑色金属为例只要区分是否为合金钢,是合金钢时主要合金元素有哪几种,或是碳钢即可。
也就是分析者只要判定试件中根本的合金元素是否存在即可,这就是光谱的定性分析。
我们知道光谱分析的定性分析是确定某一元素是否存在,因此发现该元素最低含量谱线出现时,即可判定为该元素存在,这条〔组〕谱线也是该元素的最灵敏线。
当然作为某一元素的定性分析线,它必须是绝对可靠的不受干扰或干扰较小不影响判定的,所以在掌握光谱分析技术过程中我们必须了解各元素最灵敏线受干扰情况,包括要了解是受铁谱线干扰或是受某一元素谱线的干扰。
某一元素的最灵敏线受干扰时,该谱线就不能作为定性的最灵敏线,应该选用除最灵敏线外能级最低的谱线作为定性分析线。