东南大学 物理化学 第四章
- 格式:ppt
- 大小:1.18 MB
- 文档页数:75

物理化学课程教案
1
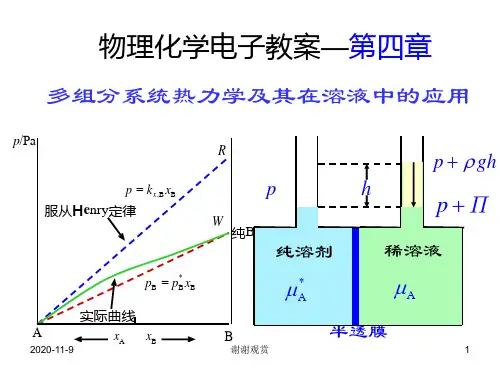
第四章溶液—多组分体
系热力学在溶液中的应用
§4.1 引言
1
1
溶液: 定义
溶液的种类:气体溶液,固体溶液,液体溶液。
电解质溶液和非电解质溶液。
多组分体系的偏摩尔量的概念。
溶液中各组分的化学势的概念。
§4.2 多组分系统组成的表示法
对于多组分系统,为描述它的状态,除压力、温度和体积外,还应标明各组分的浓度(即相对含量),其表示的方法也有多种。
对于混合物中任一组分B 的浓度常用如下几种方法表示。
(1)
B 的质量浓度
即用B 的质量除以混合物的体积V ,的单位是。
(2) B 的质量分数ωB
ωB =
即用B 的质量除以混合物的质量,为量纲一的量,单位为1。
(3)B 物质的量的浓度
定义:单位体积的溶液中所含的溶质的物质的量
(4)浓度物质量的分数 (摩尔分数)
定义:物质B的物质的量与溶液中总的物质的量之比
B ρ()V B m B /=ρ()B m B ρ3
-⋅m kg ()∑A
A
m B m /()B m ∑A
A
m ()3
3--⋅⋅m mol dm mol c B 或()33
--m dm
或)(L V m c B
B =
B x。


东南大学物化考研大纲(内部资料)第一章气体PVT方程1.理想气体状态方程:特别是理想气体模型,两个条件要记住,容易出简答2.理想气体混合物:混合物的理想气体方程表示,道尔顿定律,阿马加定律,这个知识点计算题可能会出,一般是结合第二章第三章出综合题目。
3.气体液化及临界参数:此章节做了解,知道一些概念的定义,包括饱和蒸汽压,沸点,临界状态,以及临界点处的特点。
4.真实气体状态方程:波义耳温度,真实气体p--Vm等温线示意图要注意一下,可能会出选择,该处曾出过一次证明题;范德华方程很重要,维里方程大体了解。
5.对应状态原理及普遍化压缩因子图:知道Z>1真实气体比理想气体难压缩即可,对应状态原理看一下即可,压缩因子图也是,此考点还未考过。
★第二章热力学第一定律★1.基本概念:了解基本概念过程与途径看一下,易出简答题2.◈ 2.2到◈ 2.12(带星号的除外):每章都很重要,几乎每年计算题必考,要仔细看,对照书上第二章后面的习题做一遍。
★第三章热力学第二定律★与第二章要求一样,每一节都要细看,通常二三章会结合起来出综合题。
几乎每年都是热力学肯定有一道,注意书上的例题。
第四章多组分系统热力学1.偏摩尔量:定义(注意要在恒温恒压下),P155的图要会看会分析,吉布斯--杜核母方程很重要,偏摩尔量之间的函数关系,注意书上的例题,需要理解,该处曾考过。
2.化学式:定义,多组分单项及多相系统的热力学公式,化学势判据非常重要,常出现在简答题目当中。
3.气体组分化学势:书上的四种都要看。
4.拉乌尔定理,亨利定律:注意拉乌尔定律用于溶剂,亨利定律用于溶质。
若第四章出计算,此公式必考。
5.理想液体混合物及理想稀溶液:定义,结合理想气体,曾出过简答题,问三者定义。
化学势的公式要记住,理想液体混合物的混合性质(四个),这个要会算。
理想稀溶液溶剂和溶质的化学势要知道,但一般不会考。
分配定律知道即可,一般常在选择题中出现。
6.系溶液的依数性:注意只适用于稀溶液。

东南大学-物理化学-复习提纲(总4页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--第一章 气体一.重要概念理想气体,分压,分体积,临界参数,临界状态 二.重要关系式(1) 理想气体:pV=nRT , n = m /M (2) 分压: p B = p y B(3) 分压定律,分体积定律 理想气体:nnV V p p y B B B B ===第二章 热力学第一定律与热化学一、 重要概念系统与环境,状态与状态函数,强度性质与广度性质,功、热、内能、焓,节流膨胀 二、 重要公式与定义式1. 体积功:W = -p 外dV (适用于各种变化过程)2. 热力学第一定律: U = Q +W , d U =Q +W 3.焓的定义: H =U + pV4.热容:摩尔定容热容 C V ,m = Q V /dT = ( U m / T )V摩尔定压热容 C p ,m = Q p /dT = ( H m / T )P J ·mol -1·K -1比定压热容C p = Q p /dT = (h / T )P J ·g -1·K -1 5. 标准摩尔反应焓:由标准生成焓 f H m ,B (T )或标准燃烧焓 c H m,B (T )计算 r H m = v B f H m ,B (T ) = - v B c H m ,B (T ) 6. 基希霍夫公式(适用于相变和化学反应过程)(状态函数法) r H m (T 2)= r H m (T 1)+ r C p ,m d T 二、各种过程Q 、W 、 U 、 H 的计算 1.pVT 变化过程(1)理想气体pVT 变化过程恒温过程dT =0, U = H =0, Q =-W ;非恒温过程, U = n C V ,m T , H = n C p ,m T ,单原子气体C V ,m =3R /2,C p ,m = C V ,m +R = 5R /2 双原子气体C V ,m =5R /2,C p ,m = C V ,m +R = 7R /2理想气体恒温可逆过程 功的计算:21lnV V nRT W =理想气体绝热可逆过程功计算,W= U = n C V ,m T (先根据可逆绝热方程计算出T 2)理想气体绝热不可逆过程功计算,W= U = n C V ,m T (先计算出T 2) 恒压过程:p 外=p =常数,无其他功W '=0W = -p 外(V 2-V 1), H = Q p =n C p ,m d T , U = H -(pV ),Q = U -W恒外压过程:W = -p 外(V 2-V 1) 真空膨胀过程p 外=0,W =0,Q = U 恒容过程 :d V =0 W =0,Q VU =n C V ,m d T , H = U +V p(2)凝聚态的pVT 变化过程由于压力对凝聚态的影响不大,当压力变化不大时,可以看成为恒压变化 2. 相变过程S ()→S():(1)可逆相变(正常相变或平衡相变):如在温度T 对应的饱和蒸气压下的相变,例:水在常压,100 ℃ 时的汽化或凝结过程。


物理化学经典习题二、问答题1.为什么热和功的转化是不可逆的?2.在绝热钢筒中进行一化学反应:H 2(g) + 21O 2(g) ═ H 2O(g),在反应自发进行。
问此变化中下述各量哪些为零,哪些大于零,哪些小于零?Q ,W ,∆U ,∆H ,∆S 和 ∆F 。
3.对单组分体系相变,将克拉贝龙方程演化为克-克方程的条件是什么?4.为什么有的化学反应速率具有负温度系数,即温度升高反应速率反而下降?5.为什么说,热化学实验数据是计算化学平衡常数的主要基础?三、计算题1.苯在正常沸点353K 下的∆vap H m ø = 30.77 kJ·mol -1,今将353K 及p ø下的1molC 6H 6(l)向真空等温蒸发为同温同压下的苯蒸气(设为理想气体)。
(1) 求算在此过程中苯吸收的热量Q 与所做的功W ;(2) 求苯的摩尔气化熵 ∆vap S m ø 及摩尔气化自由能 ∆vap G m ø;(3) 求环境的熵变 ∆S 环,并判断上述过程是否为不可逆过程。
2.把一定量的气体反应物A 迅速引入一个温度800K 的抽空容器内,待反应达到指定温度后计时(已有一部分A 分解)。
已知反应的计量方程为 2A (g) → 2B (g) + C (g) ,反应的半衰期与起始浓度无关;t=0时,p 总=1.316×104Pa ;t=10min 时,p 总 =1.432×104Pa ;经很长时间后,p 总 =1.500×104Pa 。
试求:(1) 反应速率常数k 和反应半衰期t 1/2 ;(2) 反应进行到1小时时,A 物质的分压和总压各为多少?3.A 和B 能形成两种化合物A 2B 和AB 2,A 的熔点比B 低,A 2B 的相合熔点介于A 和B 之间,AB 2的不相合熔点介于A 和A 2B 之间。
请画出该体系T ~ x 相图的示意图。
4.将正丁醇(M r = 74)蒸气聚冷至273 K ,发现其过饱和度(即p/ p°)约达到4方能自行凝结为液滴。

第一章热化学与能源考试内容:系统和环境,状态和状态函数,过程和过程变量,热和功。
热力学能和焓。
热力学第一定律。
恒容过程和恒压过程。
化学反应的热效应。
反应进度。
热化学标准状态。
盖斯定律。
热化学方程式。
化学反应热的有关计算。
能源的有效利用与新能源开发。
第二章化学反应的基本原理与大气污染考试内容:化学反应方向和系统的混乱度,熵。
热力学第二定律。
热力学第三定律。
吉布斯函数,标准摩尔反应吉布斯函数变,标准摩尔生成吉布斯函数;平衡常数,标准摩尔反应吉布斯函数变与平衡常数关系。
平衡常数与转化率的计算。
热力学等温方程式。
浓度、压力、温度对平衡常数的影响,平衡移动的总规律。
化学反应速度,化学反应速率方程,反应速率常数,反应级数。
浓度、温度、催化剂对化学反应速率的影响,阿仑尼乌斯方程式。
催化剂与化学平衡。
影响多相反应速率的因素。
大气污染物及控制。
第三章水化学与水污染考试内容:液体:纯液体的饱和蒸气压,溶液浓度的表示(质量分数,物质的量分数,物质的量浓度,质量摩尔浓度)。
非电解质溶液的依数性(蒸气压下降,沸点升高,凝固点下降)。
电解质溶液的依数性。
酸碱质子理论。
共轭酸碱对。
弱酸、弱碱的解离平衡。
解离平衡常数、解离度及有关计算。
同离子效应。
缓冲溶液及pH值计算。
缓冲溶液的选择和配制。
酸碱中和反应。
难溶电解质的沉淀和溶解。
溶度积与溶解度。
溶度积规则。
同离子效应。
盐效应。
沉淀的转化。
分步沉淀。
有关溶度积的一些应用和计算。
水污染及水处理化学。
第四章电化学与金属腐蚀考试内容:氧化还原反应,用氧化值法和离子一电子法配平氧化还原反应主程式。
原电池的组成、氧化型、还原型、电对、半反应。
化学电源的两极反应。
电极反应和电极的电势。
电极反应的标准电势,标准氢电极。
能斯特方程式。
电极电势的应用;比较氧化剂和还原剂的相对强弱;预测氧化还原反应进行的方向;判断氧化还原反应进行的程度。
电动势与标准摩尔反应吉布斯函数的关系。
析氢腐蚀,吸氧腐蚀,差异充气腐蚀。
东南大学物理化学各章复习指南(权威内部资料)物理化学是一门逻辑性很强的学科,并且对数学的要求很高。
在第一轮复习中,最好把公式推导一遍,这样有利于理解、记忆和运用。
还有重要的一点就是单位的运算。
一开始最好带单位计算,不然很容易出错。
第一章气体的pVT关系其实这一章重点是理想气体和真实气体的区别,以及它们的状态方程。
大家要理解的就是:p、V、T,随着每个因素的变化,会得出不同的结论。
这样就可以深刻理解p、V、T的关系,有利于做题。
第二章热力学第一定律1.热力学第一定律的本质是能量守恒。
2.要把系统和环境、状态和状态函数、过程和途径的概念搞清楚,可以为以后的解题打下基础。
当你们能够看清题目本质的时候,就知道基础是多么重要。
3.热力学第一定律是能量守恒的定律,一定要记清楚。
最好自己能够推导一下,有利于记忆。
4.后面每个概念的提出,都有其使用的条件。
在做题目的时候,不能想当然地就使用某个定义。
恒容和恒压的不同、恒容变温和恒压变温、凝聚态物质的变温过程等等。
在审题的时候,最好注意这些细节。
5.可能有的同学对于2.2节理解起来,比较困难。
我作出一些提示,希望有利于大家的理解。
第一,功的概念,到底是环境对系统做功,还是系统对环境做功,这样正负号问题解决,还有会计算功。
第二,热的概念,同理,也是这样理解。
第三,主要是比较体积的大小。
(也是最主要的),这个若能很好地理解,那么对于功和热,就没多大问题了。
6.对于2.5节的相变焓,大家要理解气、液、固三态,每两态的关系。
可以画三角图,有利于记忆。
第三章热力学第二定律1.热力学第二定律的本质是过程的方向和限度。
在第二定律的基础上提出熵的概念,以及A和G的概念。
2.卡诺循环要了解热机效率以及其推导过程。
这样有利于计算。
3.热力学第二定律就是过程的方向和限度的定律。
热力学第二定律的两种说法,克劳修斯和开尔文说法,问答题会考。
4.要会推导卡诺定理,以及了解熵的概念。
5.各种不同条件下的熵的计算。
第四章多组分系统热力学有溶剂A与溶质B形成必然组成的溶液。
此溶液中B的浓度为c B,质量摩尔浓度为b B,此溶液的密度为。
以M A,M B别离代表溶剂和溶质的摩尔质量,若溶液的组成用B的摩尔分数x B 表示时,试导出x B与c B,x B与b B之间的关系。
解:依照各组成表示的概念在25℃,1 kg水(A)中溶有醋酸(B),当醋酸的质量摩尔浓度b B介于和之间时,溶液的整体积求:(1)把水(A)和醋酸(B)的偏摩尔体积别离表示成b B的函数关系。
(2)时水和醋酸的偏摩尔体积。
解:依照概念当时60℃时甲醇的饱和蒸气压是 kPa ,乙醇的饱和蒸气压是 kPa 。
二者可形成理想液态混合物。
若混合物的组成为二者的质量分数各50 %,求60℃时此混合物的平稳蒸气组成,以摩尔分数表示。
解:甲醇的摩尔分数为58980049465004232500423250....x B =+=80℃时纯苯的蒸气压为100 kPa ,纯甲苯的蒸气压为 kPa 。
两液体可形成理想液态混合物。
如有苯-甲苯的气-液平稳混合物,80℃时气相中苯的摩尔分数,求液相的组成。
解:20℃下HCl 溶于苯中达平稳,气相中HCl 的分压为 kPa 时,溶液中HCl 的摩尔分数为。
已知20℃时苯的饱和蒸气压为 kPa ,若20℃时HCl 和苯蒸气总压为 kPa ,求100 g 苯中溶解多少克HCl 。
解:设HCl 在苯中的溶解符合亨利定律HCl HCl ,x HCl x k p = Pa .Pa .x p k HCl HCl HCl,x 610×3842=04250101325== HCl,x HCl ,x *HCl ,x *HCl HCl ,x *HCl k x k p x k x p x k x p p p p +1+=+苯苯苯苯苯苯苯苯总)-=()-(=+=96010×38421000010×384210132566...k p k p x HCl,x *HCl ,x =--=--=苯总苯 960=536+7810078100=..mx 苯 m = 1.867gA ,B 两液体能形成理想液态混合物。