酶的固定化
- 格式:docx
- 大小:19.84 KB
- 文档页数:5


多媒体教学参考资料/备课资料
酶的固定化方法
酶的固定化方法不下百种,归纳起来大致可以分为三类,即载体结合法、交联法和包埋法。
载体结合法是指将酶固定到非水溶性载体上的方法。
根据固定方式的不同,这种方法又可以分为物理吸附法、离子结合法和共价结合法。
物理吸附法是指将酶吸附到固体吸附剂表面的方法,固体吸附剂多为活性碳、多孔玻璃等。
离子结合法是指通过离子键将酶结合到具有离子交换基团的非水溶性载体上的方法,载体有离子交换树脂等。
共价结合法是指酶和载体以共价键的形式结合在一起的方法,这种方法需要酶和载体都具有氨基、羧基或羟基等官能团。
交联法是指通过双功能试剂,将酶和酶联结成网状结构的方法。
交联法使用的交联剂是戊二醛等水溶性化合物。
包埋法是指将酶包裹在多孔的载体中,如将酶包裹在聚丙烯酰胺凝胶等高分子凝胶中,或包裹在硝酸纤维素等半透性高分子膜中。
前者包埋成格子型,后者包埋成微胶囊型。
清华同方教育技术研究院。




固定化酶是将酶固定在载体上,形成固定化酶催化系统的过程。
通过固定化,可使酶的活性和稳定性得到提高,并能够重复使用。
常用的固定化酶方法包括吸附法、共价连接法、包埋法和交联法等。
1. 吸附法:利用载体表面与酶相互吸附的原理将酶固定在载体表面。
常用的载体包括硅胶、纤维素、聚丙烯酰胺凝胶等。
2. 共价连接法:通过将酶分子与载体分子之间的化学键共价连接,在载体表面上固定酶。
常用的共价连接剂包括辛二酸二酐、戊二酸二酐等。
3. 包埋法:将酶包裹在聚合物中,在聚合物内部形成微观环境,保护酶免受外界环境的影响。
常用的包埋材料包括明胶、蛋白质和聚乙烯醇等。
4. 交联法:将酶和载体分子之间形成交联结构,将酶牢固地固定在载体表面上。
常用的交联剂包括戊二醛、葡萄糖等。
固定化酶在生物技术、食品工业、医药工业等领域有着广泛的应用。
其中,利用固定化酶在生物技术领域中最为突出。
例如,固定化酶可以应用于产生大量纯度高的特定酶,用于DNA重组、制备抗体和识别特定分子等。
此外,在医药工业中也广泛使用固定化酶,如利用固定化酶制备药物、检测生物标志物等方面。
在食品工业中,固定化酶可用于生产乳制品、果汁、啤酒等食品中。
总之,固定化酶是一种重要的生物技术手段,具有广泛应用前景,可推动生物技术、食品工业、医药工业等领域的发展。


3、结合法选择适宜的载体,使之通过共价键或离子键与酶结合在一起的固定化方法称为结合法。
1) 离子键结合法:通过离子键使酶与载体结合的固定化方法称为离子键结合法所用载体是某些不溶于水的离子交换剂。
常用的有:DEAE-纤维素、TEAE-纤维素、DEAE-葡聚糖凝胶等。
2) 共价键结合法载体基质通常是水不溶性的,这些载体包括:(1 )天然载体:琼脂、琼脂糖、几丁质、纤维素、胶原蛋白等;(2)有机合成聚合物:聚亚胺酯、聚环氧丙烷、聚乙烯醇、尼龙等(3 )无机载体:玻璃、氧化铝、硅胶、磁铁矿、氧化镍等。
用于连接载体的酶蛋白氨基酸残基上的反应功能基团有:Asp Glu 侧链的一COOH、C-末端的一COOH ; Tyr 的苯酚基;Cys 的一SH; Lys 的&NH2、N-末端一NH2;Thr、Ser 的一OH ; His 的咪唑基。
在酶的固定化过程中,由于疏水性氨基酸通常被掩藏在酶蛋白分子的内部,所以疏水性氨基酸通常不参与形成共价键。
载体活化方法:(1 )重氮化法(2)叠氮法(3 )溴基化法(4)烷基化法等。
4、交联法借助双功能试剂使酶分子之间、酶分子之内、酶与惰性载体间进行相互交联,制成网状结构的固定化酶的方法,称为交联法。
常用的双功能试剂有戊二醛、已二胺、顺丁烯二酸酐、双偶氮联苯等。
其中戊二醛最为常用,酶表面含有不止一个一NH2,戊二醛与酶上的-NH2发生Schiff反应,形成席夫碱,形成一个复杂的酶交联网络。
交联酶法借助双功能试剂使可溶性酶分子之间发生交联作用,制成网状结构的固定化酶的方法。
可视为一种无载体的固定化方法。
如木瓜蛋白酶在0.2%酶蛋白浓度,2.3%戊二醛,pH5.2〜7.2, 0C下交联24h,可制成固定化酶。
共交联法共交联法是指酶分子在双功能试剂的作用下,与一些惰性蛋白或水不溶载体之间发生交联,可降低单纯酶分子之间交联反应所引起的活性丧失。
通常选用的惰性蛋白有牛血清蛋白、卵清蛋白、明胶、胶原蛋白、血红蛋白等。


酶固定化的原理
酶固定化是指将酶固定在载体上,形成酶固定化系统,用于生物催化反应。
其原理是将酶与载体通过物理或化学方法结合在一起,形成稳定的酶固定化系统,以提高酶的稳定性、重复使用性和操作性。
酶固定化的原理主要包括以下几个方面:
1. 物理方法:通过吸附、离子交换和包埋等物理方法将酶固定在载体上。
例如,将酶溶液与载体接触,通过物理吸附作用使酶附着在载体表面,形成酶固定化系统。
2. 化学方法:通过共价结合、交联和胶束等化学方法将酶固定在载体上。
例如,将酶与载体表面的功能基团发生共价键结合,形成稳定的酶固定化系统。
3. 复合方法:物理和化学方法可以结合使用,形成更稳定的酶固定化系统。
例如,先用物理方法将酶吸附在载体上,然后再进行化学修饰,增强固定效果。
酶固定化的原理主要是利用载体提供的稳定性和大面积接触酶的功能,从而增强酶的稳定性和重复使用性。
载体可以是天然的(如纤维素、凝胶等)或人工合成的(如高分子材料、纳米材料等)。
通过固定化酶,可以将其应用于工业生产中,提高反应效率,降低成本。
酶的固定化方法及优缺点以酶的固定化方法及优缺点为标题,本文将详细介绍酶的固定化方法以及各种方法的优缺点。
一、酶的固定化方法1. 物理吸附法:将酶直接吸附在固体载体表面,如活性炭、硅胶等。
这种方法简单易行,不需要化学反应,但酶容易失活和流失。
2. 共价键结合法:通过化学手段将酶共价键结合在载体表面,常用的方法包括交联、酯化、酰胺化等。
这种方法能够稳定地固定酶,但可能会影响酶的活性和稳定性。
3. 包埋法:将酶包裹在多孔载体中,如凝胶、微胶囊等。
这种方法能够保护酶免受外界环境的影响,但可能会降低酶的反应速率。
4. 共聚物法:利用聚合物将酶固定在载体上,如聚丙烯酰胺凝胶、聚乙烯醇等。
这种方法可以提高酶的稳定性和反应速率,但可能会影响酶的活性。
二、各种固定化方法的优缺点1. 物理吸附法的优点是操作简单、成本低廉,但缺点是酶容易失活和流失,固定效果不稳定。
2. 共价键结合法的优点是能够稳定地固定酶,固定效果较好,但缺点是可能会影响酶的活性和稳定性。
3. 包埋法的优点是能够保护酶免受外界环境的影响,固定效果较稳定,但缺点是可能会降低酶的反应速率。
4. 共聚物法的优点是可以提高酶的稳定性和反应速率,固定效果较好,但缺点是可能会影响酶的活性。
在实际应用中,选择适合的固定化方法需要考虑多个因素,如酶的特性、反应条件、载体的稳定性和成本等。
不同的固定化方法适用于不同的酶和反应条件。
例如,对于温度敏感的酶,可以选择物理吸附法或包埋法;对于活性较强的酶,可以选择共价键结合法或共聚物法。
总结起来,酶的固定化方法有物理吸附法、共价键结合法、包埋法和共聚物法等。
每种方法都有其优缺点,选择适合的固定化方法需要综合考虑多个因素。
通过固定化方法,可以提高酶的稳定性、反应速率和重复使用性,从而在酶工业和生物催化领域具有广泛的应用前景。
酶生物传感器中酶的固定化技术
酶生物传感器中的酶固定化技术是一种利用酶作为生物传感器的关键技术,可以将酶固定在传感器上,使得检测信号可以被有效地检测。
这一技术可以大大减少传感器中应用酶的成本,提升检测精度和灵敏度。
酶固定化技术是用来把酶固定在传感器上的一种技术,它使酶能够更加稳定的存在,也能够更好的发挥它的功能。
主要的酶固定化技术有以下几种:
1、固定化技术:通常使用交联剂、硅胶涂层等技术将酶固定在传感器表面上,这样可以有效地保护酶的活性,从而提高检测灵敏度。
2、基因工程技术:利用基因工程技术,可以将所需的酶基因组合到一起,形成一个新的基因,然后将这个新基因植入到传感器中,从而使得酶能够被固定在传感器中。
3 、纳米技术:纳米技术可以将酶固定在纳米粒子表面上,这样可以使得酶在纳米粒子表面上能够更好地展开功能,也能够显著提高检测灵敏度。
4、膜定向技术:膜定向技术的原理是将酶固定在膜的一侧,从而可以使得酶只能够通过膜的一侧进入传感器内部,这样可以大大提高检测效率。
酶生物传感器中的酶固定化技术可以让酶保持稳定的活性,从而提高检测灵敏度,减少成本。
不同的酶固定化技术都有其各自的优势,诸如交联剂可以显著提高检测精度,基因工程技术可以更好地控制酶的活性,纳米技术可以让酶发挥更强的活性,而膜定向技术可以提高检测的效率。
所以,酶生物传感器中的酶固定化技术是目前提升检测精度和灵敏度的重要技术,也是生物传感器的重要组成部分。
第三节酶的固定化随着酶学研究的深入和酶工程的发展,酶的应用越来越广泛。
将酶用物理或化学的方法固定在不溶于水的载体上,形成一种可以重复使用的酶,叫固定化酶。
固定化酶既保持了酶的催化特性,又克服了游离酶的不稳定性,具有可反复或连续使用、易与反应产物分离等显著优点,广泛应用于医药、轻工、食品等行业。
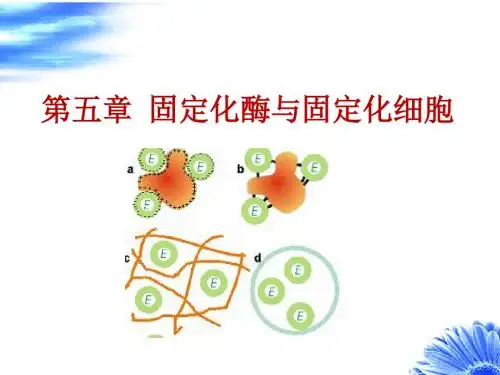
一、固定化酶的制备方法制备固定化酶的方法很多,有包埋法、吸附法、共价偶联法,以及交联法等(图2-3)。
1.包埋法将酶或含酶菌体包埋在多孔载体中,使酶固定化的方法称为包埋法。
包埋法根据载体材料和方法的不同,可以分为凝胶包埋法和微胶囊包埋法。
凝胶包埋法是将酶和含酶菌体包埋在各种凝胶内部的微孔中,制成一定形状的固定化酶的方法。
最常用的凝胶有琼脂、琼脂糖、海藻酸钙、卡拉胶、聚丙烯酰胺等。
微胶囊包埋法是将酶包埋在高分子半透膜中,制成微胶囊固定化酶的方法。
常用的半透膜有尼龙膜、醋酸纤维膜等。
2.吸附法利用各种固体吸附剂将酶或含酶菌体吸附在其表面而使酶固定化的方法称为吸附法。
吸附法常用的吸附剂有活性炭、氧化铝、硅藻土、多孔陶瓷、多孔玻璃、硅胶、羧基磷灰石等。
吸附法制备固定化酶,操作简便、条件温和,不会引起酶的变性失活,载体价廉易得,而且可反复使用。
但由于是靠物理吸附作用,结合力较弱,酶与载体结合不太牢固而易脱落。
3.共价偶联法利用酶活性中心外的非必需基团与固相载体上的基团共价结合而制成固定化酶的方法叫共价偶联法,也叫共价结合法。
这种方法的优点是酶与载体牢固,制得的固定化酶稳定性好。
缺点是制备过程中反应条件较为强烈,难以控制,易使酶变性失活。
共价偶联法常用的载体有纤维素、葡聚糖、琼脂糖、甲壳素等。
4.交联法交联法是采用双功能试剂使酶分子之间或酶分子与固相载体之间发生交联作用而制成固定化酶的方法。
常用的双功能试剂有戊二醛、己二胺、顺丁烯二酸酐、双偶氮苯等。
其中应用最广泛的是戊二醛。
用交联法制备的固定化酶结合牢固,可长时使用。
酶的固定化
固定化酶是酶工程的核心,利于实现酶的重复利用及产物与酶的分离。
下面以酶的固定化方法为核心,介绍一些有关固定化技术的研究新进展。
1 吸附法
利用多种固体吸附剂将酶或含酶细胞吸附在其表面上而使酶固定方法。
该方法最显著的优点是操作简便,条件温和,不会引起酶的变异失活,且载体价廉易得,可反复使用。
但酶与载体结合不牢,极易脱落,所以它的使用受到一定的限制。
因此,人们不断尝试使用新的载体来解决这易脱落的问题。
通常,吸附法分为物理吸附法和离子吸附法。
酶被载体吸附而固定的方法称为物理吸附法。
从载体对酶的适应性来看,这个方法效果是好的,酶蛋白的活性中心不易受破坏,酶的高级结构变化也不明显,但其缺点是酶与载体的相互作用较弱,被吸附的酶极易从载体表面上脱落下来,不能获得较高活力的固定化酶。
该方法常用的载体有活性炭、多孔陶瓷、纤维素及其衍生物、甲壳素及其衍生物等。
纵伟、刘艳芳等(2008)以磁性壳聚糖微球作为新型载体,并采用物理吸附法固定化脂肪酶,对影响固定化的各种因素进行考察,确定了最优条件,同时比较了游离酶和固定化酶的pH值和热稳定性。
结果表明,固定化的适宜条件为:加酶量600 U/g,温度5℃,pH 7.0,固定化时问2 h。
固定化酶的pH值和热稳定性都优于游离酶,
固定化酶连续使用5次后,其相对酶活仍为使用前的57.8%,具有较好的操作稳定性。
近年来,随着介孔分子筛制备技术的日臻成熟,人们正在考虑用其担当固定化酶的载体。
与其他材料相比,介孔分子筛规则的孔道、大的比表面积、极强的吸附性能、稳定的结构等特点,使其具有担当固定化酶载体得天独厚的优势。
王炎等(2008)以介孔分子筛MCM一41作为载体,采用物理吸附法对漆酶进行了固定化,考察了时间、pH和给酶量对固定化效果的影响,并对固定化酶的活性及其稳定性进行了研究,讨论了影响固定化过程和固定化酶性质的主要原因。
结果显示,在pH为3.0时,酶和载体比例为62.5 mg/g时吸附12 h固定化效果最好,固定化酶活性回收率为50%。
与游离漆酶相比,MCM一41固定化漆酶的最适反应pH略有升高,最适温度没有变化,其pH稳定性和热稳定性都显著优于游离漆酶。
固定化漆酶具有可重复操作的性质,与底物反应反复操作1O批次后剩余活性为4O%。
将酶与含有离子交换基团的水不溶性载体以静电作用力相结合
的固定化方法。
该方法的处理条件温和,且酶的高级结构和活性中心的氨基酸很少发生变化,因而可以得到较高活性的固定化酶。
采用此法固定的酶有葡萄糖异构酶、糖化酶、淀粉酶、纤维素酶等。
陈姗姗等(2008)以阴离子交换树脂为载体、戊二醛为交联剂,对果胶酶进行固定化分析,探讨了温度、pH值、时间、加酶量、戊二醛浓度、交联温度、交联时问对果胶酶固定化效果的影响,同时对固定化果胶酶的酶学特性进行研究。
研究结果表明,果胶酶的最佳固定化条件为:温
度40℃,pH值5.5,固定化6 h,加酶量为O.75 mL/g,戊二醛体积分数为0.1%,交联温度4℃,交联时间4 h。
在此条件下,固定化果胶酶的酶活回收率可达到80%以上。
酶学特性试验表明,固定化果胶酶最适温度为60℃,最适pH值为4.0,具有较好的操作稳定性。
徐娟等(2008)选择以D380大孔弱碱性丙烯酸系阴离子交换树脂为载体,通过先吸附后交联的方法固定化淀粉酶。
通过实验对影响固定化酶活力回收率的因素的进行了研究,得出较优的固定化条件为:戊二醛浓度0.1%、处理时间45 min、加酶量3 mg/g(蛋白量/载体)、酶液在pH5.8、25℃,固定化处理时间6~10 h的条件下,获得的固定化酶活力可达8O U/g(载体),并进一步对固定化酶的酶学性质作了初步研究。
2 交联法
交联法是用双功能试剂或多功能试剂进行酶分子之间的交联,使酶分子和双功能试剂或多功能试剂之间形成共价键嘲。
常用的交联剂是戊二醛,但单用戊二醛等试剂交联制备的固定化酶活力较低,因此常将此法与吸附法、包埋法结合使用,可以达到既提高固定化酶的活力。
刘颖、高晗等(2008)利用上述混合方法,将杏仁来源的B一葡萄糖苷酶以吸附法固定在用戊二醛交联的壳聚糖上,并对固定化条件进行优化,得到最佳条件:戊二醛浓度为1.5%,溶液pH5.5,在25℃水浴中振荡吸附4 h,固定化B一葡萄糖苷酶,其活力回收率27.34%。
王伟、杨开伦等(2008)以壳聚糖为载体,戊二醛为交联剂,用吸附交
联法对氨基酰化酶进行了固定化。
研究结果表明,在pH值为6.0,温度30℃的条件下,0.1 g壳聚糖微球与5 mL 1%戊二醛交联后,固定O.8 mg氨基酰化酶的固定化效果最佳。
固定化酶的最适温度和pH值分别为50℃和7.0,而游离酶的最适温度为40℃,最适pH值为7.5,固定化酶在50-70℃都保持了较高的酶活力,热稳定性远高于游离酶,固定化酶的Km值为l1.796×10-2之mol/L,较游离酶有所升高,该固定化酶具有良好的操作稳定性。
3 共价键结合法
共价键结合法是将酶与水不溶性载体以共价键结合的一种方法。
此法研究较为成熟,其优点是酶与载体间连接牢固,即使用高浓度底物或离子强度的溶液进行反应,也不会导致酶和载体的分离,因此具有良好的稳定性及重复使用性。
缺点是反应条件比较苛刻,常常会引起酶蛋白高级结构发生改变,导致酶的活性中心受损。
王宝康(2007)就采用分相法制作了多孔玻璃微珠FXBL载体,用物理吸附法、共价偶联法和重氮法分别固定淀粉酶,比较了它们的固定效果,并选择了共价偶联法作为研究多孔玻璃微珠的制作过程对固定淀粉酶的影响的实验方法。
实验结果显示,580℃分相玻璃优于560℃,分相时间到36 h后,分相对固定化酶活力影响不大,多孔玻璃用0-3 mo儿的KOH 溶液扩孑L 3 h最理想。
当盐酸的浓度为0.3 mol/L时侵蚀成孔,固定化淀粉酶活力达到最大值。
4 包埋法
包埋法是将聚合物的单体与酶溶液混合,再借助于聚合助进剂的
作用进行聚合,酶被包埋在聚合物中以达到固定化。
包埋法一般不需要与酶蛋白的氨基酸残基进行结合反应,很少改变酶的空间构象,酶活回收率较高,因此可以应用于许多酶的固定化。
但是此法只适用于小分子底物和产物的酶催化反应,因为只有小分子反应底物或产物,才可以通过高分子聚合物进行扩散。
于殿字、罗淑年等(2008)就以海藻酸钠、明胶为包埋材料,戊二醛为交联剂固定化磷酯酶。
对固定化条件和部分酶学特性进行了优化和研究,确定了最佳条件:海藻酸钠浓度2%,明胶浓度4%,CaCl2浓度7%,戊二醛0.4%。
固定化酶热稳定性增强,重复使用3次相对酶活力仍保留在70%以上。
肖志方、伍林等(2008)利用海藻酸钠凝胶颗粒固定化葡萄糖氧化酶(GOD),确定了固定化条件,并考察了温度、pH值、储存时间对固定化酶和游离酶酶活力的影响,测定了酶活回收率。
结果表明,固定化的最优条件为:CaC1:5.0%(质量体积比),海藻酸钠3.0%(质量体积比) 。
固定化酶的最适催化温度为3l℃、最适pH值为6.3,较游离酶分别提高7℃和0.6,固定化酶的平均酶活回收率为61.69%。
此外,酶的储存稳定性能也有所提高,可重复多次使用。