动物细胞工程(优秀版)
- 格式:ppt
- 大小:997.50 KB
- 文档页数:15




动物细胞工程教案一、教学目标1. 了解动物细胞工程的基本概念和原理。
2. 掌握动物细胞培养的基本步骤和操作技术。
3. 了解动物细胞融合的方法和应用。
4. 理解动物细胞工程在生物技术和医学领域的应用。
二、教学内容1. 动物细胞工程的定义和原理解释动物细胞工程的概念介绍动物细胞工程的基本原理2. 动物细胞培养的基本步骤动物细胞培养的流程和操作方法培养基的选择和配制细胞的分离和培养3. 动物细胞融合的方法介绍动物细胞融合的原理和方法细胞融合技术的应用和意义4. 动物细胞工程的应用动物细胞工程在生物技术领域的应用动物细胞工程在医学领域的应用三、教学方法1. 讲授法讲解动物细胞工程的基本概念和原理介绍动物细胞培养的基本步骤和操作技术2. 实验法进行动物细胞培养实验展示细胞融合技术的实验操作3. 案例分析法分析动物细胞工程在实际应用中的案例讨论动物细胞工程的优势和局限性四、教学评价1. 课堂参与度学生参与课堂讨论和问题解答的情况2. 实验报告评估学生在动物细胞培养实验中的操作技能和结果分析3. 小组讨论评估学生在案例分析中的思考和团队合作能力五、教学资源1. 教材和参考书籍《动物细胞工程》教材或其他相关书籍2. 实验材料和设备动物细胞培养实验室设备和材料3. 多媒体教学资源教学PPT、视频资料等相关教学资源六、教学步骤1. 引入:通过展示动物细胞工程的实际应用案例,引起学生对动物细胞工程的兴趣和好奇心。
2. 讲解:详细讲解动物细胞工程的基本概念、原理和基本步骤,包括动物细胞培养和细胞融合技术。
3. 演示:进行动物细胞培养实验,展示细胞融合技术的实验操作,让学生直观地了解动物细胞工程的技术过程。
4. 实践:学生分组进行实验操作,亲身体验动物细胞培养和细胞融合技术,培养学生的实践能力。
5. 讨论:组织学生进行小组讨论,分析动物细胞工程在实际应用中的案例,探讨动物细胞工程的优势和局限性。
七、教学安排1. 课时:本课程共计15课时,包括9课时理论教学和6课时实验教学。


实验一机械法分离培养动物细胞及计数一.实验目的1.掌握机械法分离培养动物细胞的原理及方法2.掌握细胞计数的方法二.实验原理在机体中,器官通常由几种组织构成,组织又由细胞通过紧密连接锚定连接、通讯连接构成组织。
采用机械法破坏细胞间的连接,能获得单个细胞。
本实验采用剪碎小白鼠肝组织的方法获取单个肝细胞,该方法简单易行。
三.实验材料1.动物:小白鼠(成年)2.试剂:PBS缓冲液,RPMI-1640培养液3.器材:手术器械、试管、滤网、离心管、离心机、显微镜等;四.实验方法1.无菌获取肝组织取成年小白鼠一只,断颈处死,腹部向上置于解剖盘中,碘酒消毒1-2次,75%酒精洗碘。
剪开腹壁,暴露肝脏组织,换手术器材,剪取0.3mm3肝脏组织块,置于培养皿中。
2.获取细胞剔除脂肪组织,加PBS缓冲液1ml,反复冲洗2-3次,剪碎组织块至1mm3,加RPMI-1640培养液,滤网过滤至离心管。
平衡、离心(1000rpm,5min),弃上清,加培养液1ml,吹打均匀,成细胞悬液。
3.细胞计数取细胞计数板一个,盖上盖玻片,去细胞悬液,沿盖玻片便于滴1滴,显微镜下计细胞数,原则:计上不计下,计左不计右4.细胞培养加细胞培养液,稀释至1X105个/ml,移入培养皿,37℃,CO25%培养箱中培养四.实验结果实验二酶消化法分离培养小鼠胎儿成纤维细胞一.实验目的掌握消化分离培养小鼠胎儿成纤维细胞的基本方法二.实验原理胰蛋白酶是一种消化酶,它通过作用于精氨酸或赖氨酸之剑的肽键,能破坏细胞间的连接,进而从组织块中分离获得单个细胞;细胞之间是通过CAM相连,而很多粘性分子只有在+2价金属离子,如Ca2+,Mg2+的存在下,才能行使这种功能,在胰蛋白酶中加EDTA的作用是熬合这些二价例子,使细胞被消成单细胞状态;本实验就是采用胰蛋白酶和EDTA消化小鼠胎儿肌肉细胞获得单个细胞。
三.实验器材1.试剂:10%犊牛血清(NBS)的1640培养液,0.25%胰蛋白酶,0.04%EDTA,PBS2.器械:离心机,滴管,普通天平,手术器械,血球计数板,离心管等3.材料:怀孕13-17天母鼠四.实验步骤1.取材:断颈处死怀孕小鼠,腹部向上置于解剖盘中,碘酒消毒1-2次,75%酒精脱碘,剪开腹壁,更换手术器械,取胎儿置培养皿中2.剔除和清洗:从子宫中挤出胎儿,剪去胎儿头、尾、四肢、内脏和脊柱后,反复用PBS冲洗3-4次3.剪碎:将冲洗干净后的胎儿组织块置另一培养皿中,剪碎至1mm3(剪15-20min)4.消化:加入4ml0.25%胰蛋白酶消化液,37℃消化5-7min5.终止:加入4ml含10%NBS的1640培养液终止消化6.收集细胞:离心用100目滤纱将细胞悬液过滤至离心管中,平衡离心(1000rpm,5min)7.制备细胞悬液:弃上清,加1ml1640培养液,吹打成细胞悬液8.细胞形态观察:取载玻片一张,滴细胞悬液一滴,盖上盖玻片,显微镜下观察9.细胞计数:按上一实验介绍方法计数10.培养细胞:将稀释至1X105个/ml细胞悬液加入培养皿中,置于5%CO2,37℃,75%湿度培养箱中培养实验三牛镜子细胞冷冻与活率检验一.实验目的1.掌握细胞冷冻解冻原理及方法2.掌握细胞活率检验原理及方法二.实验原理细胞培养液中加冷冻保护剂,并通过一定的冷冻程序冷冻细胞,一方面使细胞内形成的结晶体积较少,减少对细胞的机械性损坏;另一方面缓解细胞内因结晶引起的局部高渗对细胞的伤害。


绪论1.细胞培养与组织培养:属于体外培养,是指生物细胞和组织在离体条件下的生长和增值。
细胞的离体培养称为细胞培养,组织的离体培养称为组织培养。
2.细胞融合:又称细胞杂交,是指两个或两个以上的细胞融合形成一个细胞的过程。
3.细胞核移植:是利用显微镜操作技术将细胞核与细胞质分离,然后再将不同来源的核与质重组,形成杂合细胞的过程。
4.干细胞:是动物体内具有分化潜能、并能自我更新的细胞,分为胚胎干细胞和组织干细胞。
5.转基因动物:是通过基因工程技术将外源的目的基因导入受体动物染色体内,外源基因与动物基因整合后随细胞的分裂而扩增,在体内表达并能稳定地遗传给后代的动物。
第一章1.细胞工程实验室与其他一般实验室的区别:要求保持严格无菌环境、避免微生物及其他有害因素的影响。
2.细胞工程能进行的六方面工作:无菌操作、培养、制作、清洗、消毒灭菌处理和储藏。
3.植物细胞工程实验室特殊的设置:光照条件的培养箱、试管苗需要温室和移植驯化室。
4.细胞工程实验室通用的仪器设备:超净工作台、二氧化碳培养箱、倒置显微镜、电热干燥箱、水纯化装置、低温装置、高压蒸汽消毒器。
5.实验室的生物安全分为p1,p2 ,p3 和p4四个生物安全等级,其中P4生物安全实验室等级最高。
第二章1.清洗的主要目的是清除培养器皿中的杂质和微生物等影响细胞生长的成分。
2.细胞培养过程中主要使用两类消毒方法:物理灭菌法法和化学消毒法。
物理法灭菌法:a.紫外线法适用于无菌室或超净工作台的台面等大面积消毒。
紫外线照射工作台面的距离不应超过1.5cm,照射时间以30min左右为宜。
(注意:紫外灯关闭5min后方可进入使用)b. 湿热消毒:适用于含有不耐热成分的培养基和试剂的消毒,为121.3℃,20min .(注意点:加足水、排尽气、气压降到0时才能打开盖)c.干热消毒法:适用于消毒玻璃仪器,160℃以上,并保持90~120min,以杀死细菌和芽孢 d.过滤除菌:是将液体或气体用微孔薄膜过滤,薄膜0.22~0.45um直径。

动物细胞工程
1、动物细胞工程常用的技术手段有:
①(基础)、②、
③动物细胞、④生产等。
2、动物细胞培养就是从动物机体中取出相关的,将它分散成单个细胞,然后,放在适宜的中,让这些细胞生长和增殖。
(1)动物细胞的培养过程:
①将组织分散成许多单个细胞。
方法是从动物体内取出组织块,剪碎,用
或处理一段时间,这样组织就会分散成单个细胞。
②用培养液将分散的细胞稀释制成,动物细胞培养时制备的细胞悬液中分散的细胞很快就贴附在瓶壁,称为,要求培养瓶或培养皿的内表面、、易于。
当贴壁细胞分裂生长到时,细胞就会停止分裂增殖称为细胞的。
人们通常将动物组织消化后的初次培养称为。
③贴满瓶壁的细胞需要重新用等处理,然后分瓶培养,让细胞继续增殖,这样的培养通常称为。
④传代培养的细胞一般传至10代以后就不易下去了。
细胞在传至10~50代左右时,增殖会缓慢或停止。
少部分细胞会克服细胞寿命的自然极限获得,正在朝着等同于的方向发展。
目前使用的或保存的正常细胞通常为以内,以保持细胞正常的核型。
(2)动物细胞培养的条件:
①的环境;对培养液和所有培养用具进行处理,还要添加一定量的,还应定期更换。
②营养与体内基本相同;需要有、、、、
等,还要加入、等天然成分。
③适宜的;
④(主要是氧气和二氧化碳,二氧化碳是,通常采用培养皿或松盖培养瓶,将其置于的混合气体的培养箱中进行培养)。
(3)动物细胞培养技术的应用:①生产生物制品
②用于检测有毒物质,判断物质的毒性
③用于生理、病理、药理等方面的研究。
自然科学发展处业务说明1.引言自然科学发展处是负责促进和推动自然科学领域发展的机构。
本文档旨在对自然科学发展处的业务进行说明,包括业务范围、工作流程以及重要任务等。
2.业务范围自然科学发展处的业务范围包括以下几个方面:2.1 科学研究项目管理自然科学发展处负责管理和支持科学研究项目,包括项目申请、项目资金管理、项目进展监管等。
其任务包括但不限于:•审查科研项目的申请书,确保项目的科学性、可行性和创新性。
•监督和分配科研经费,确保项目经费的合理分配和使用。
•定期检查项目进展情况,及时发现和解决问题,保证项目按时完成。
2.2 科技成果转化推动自然科学发展处负责推动科技成果的转化和应用,使科学研究成果能够为社会和经济发展做出贡献。
其任务包括但不限于:•指导和支持科学家将研究成果转化为实际应用,推动科技成果的产业化。
•组织科技成果的推广和推出,鼓励企业和社会机构采用科技成果。
•开展科技成果评估和技术转让工作,促进科技成果的流通。
2.3 国际科学交流与合作自然科学发展处负责组织和推动国际科学交流与合作,加强我国与其他国家在自然科学领域的交流与合作。
其任务包括但不限于:•组织和参与重要国际学术会议,促进学者之间的学术交流和合作。
•推动我国科学家与国际科学家的合作项目,加强国际科学团队的组建。
•提供国际科学研究课题的信息和资源,支持科学家开展国际合作项目。
3.工作流程自然科学发展处的工作流程如下:3.1 申请阶段科研项目申请人需按照规定的格式提交项目申请书,包括项目的目标、方法、计划等内容。
自然科学发展处将对申请书进行初步审查,确保项目的科学性和可行性。
3.2 审批阶段经过初步审查合格的项目申请将进入审批阶段。
自然科学发展处将组织专家对项目申请进行评审,评估项目的科学性、重要性和创新性。
评审结果将作为决策的重要参考依据。
3.3 资金管理阶段经审批通过的科研项目将获得相应的资金支持。
自然科学发展处将负责科研经费的管理和分配,确保项目经费的合理使用和监督。
动物细胞工程试题1用动、植物成体的体细胞进行离体培养,下列叙述正确的是(C)A都须用液体培养基B都需用培养箱C都要在无菌条件下进行D都可体现细胞的全能性解析:动物细胞离体培养主要是获得细胞的代谢产物,植物体细胞离体培养体现的是全能性。
植物体细胞是固体培养基。
动物体细胞培养需要二氧化碳培养箱。
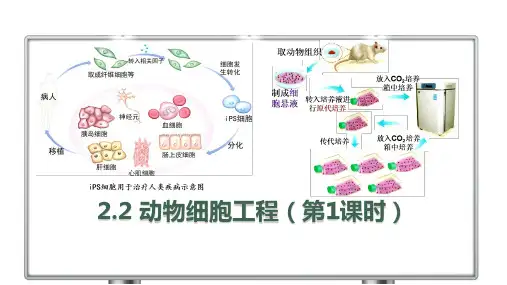
动物细胞培养:1、动物细胞的培养:动物细胞培养就是从动物机体中取出相关的组织,将它分散成单个细胞,然后放在适宜的培养基中,让这些细胞生长和繁殖。
2、动物细胞培养液的成分:葡萄糖、氨基酸、促生长因子、无机盐、微量元素等。
3、动物细胞培养液的特点:液体培养基含动物血清。
4、动物细胞培养需要满足以下条件(1)充足的营养供给——微量元素、无机盐、糖类、氨基酸、促生长因子、血清等。
(2)适宜的温度:36.5℃±0.5℃;适宜的pH:7.2~7.4。
(3)无菌、无毒的环境:培养液应进行无菌处理。
通常还要在培养液中添加一定量的抗生素,以防培养过程中的污染。
此外,应定期更换培养液,防止代谢产物积累对细胞自身造成危害。
(4)气体环境:95%空气+5%CO2。
O2是细胞代谢所必需的,CO2的主要作用是维持培养液的pH。
5、动物细胞培养的过程:取动物组织块(动物胚胎或幼龄动物的器官或组织)→剪碎→用胰蛋白酶或胶原蛋白酶处理分散成单个细胞→制成细胞悬液→转入培养瓶中进行原代培养→贴满瓶壁的细胞重新用胰蛋白酶或胶原蛋白酶处理分散成单个细胞继续传代培养。
2下列关于细胞工程的叙述,错误的是(D)A. 电刺激可诱导植物原生质体融合或动物细胞融合B. 去除植物细胞的细胞壁和将动物组织分散成单个细胞均需酶处理C. 小鼠骨髓瘤细胞和经抗原免疫小鼠的B淋巴细胞融合可制备单克隆抗体D. 某种植物甲乙两品种的体细胞杂交与甲乙两品种杂交后代的染色体数目相同解析:A正确诱导原生质体融合的方法有物理法(离心振动电刺激)化学法(聚乙二醇PEG)生物方法(灭活的病毒). B正确去除植物细胞壁需要纤维素酶和果胶酶,将动物组织分散成单个细胞需要胰蛋白酶或胶原蛋白酶处理一段时间。