SDS-PAGE凝胶配方表
- 格式:doc
- 大小:17.50 KB
- 文档页数:2
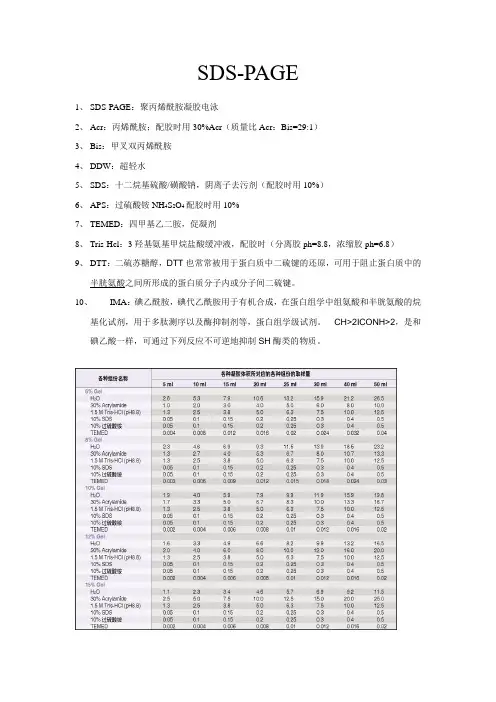
SDS-PAGE1、SDS-PAGE:聚丙烯酰胺凝胶电泳2、Acr:丙烯酰胺;配胶时用30%Acr(质量比Acr:Bis=29:1)3、Bis:甲叉双丙烯酰胺4、DDW:超轻水5、SDS:十二烷基硫酸/磺酸钠,阴离子去污剂(配胶时用10%)6、APS:过硫酸铵NH4S2O4配胶时用10%7、TEMED:四甲基乙二胺,促凝剂8、Tris-Hcl:3羟基氨基甲烷盐酸缓冲液,配胶时(分离胶ph=8.8,浓缩胶ph=6.8)9、DTT:二硫苏糖醇,DTT也常常被用于蛋白质中二硫键的还原,可用于阻止蛋白质中的半胱氨酸之间所形成的蛋白质分子内或分子间二硫键。
10、IMA:碘乙酰胺,碘代乙酰胺用于有机合成,在蛋白组学中组氨酸和半胱氨酸的烷基化试剂,用于多肽测序以及酶抑制剂等,蛋白组学级试剂。
CH>2ICONH>2,是和碘乙酸一样,可通过下列反应不可逆地抑制SH酶类的物质。
1)根据目的蛋白的分子量大小选择合适的凝胶浓度,再按照下面的表格配制SDS-PAGE的分离胶(即下层胶):注:如果配制非变性胶,参考上述配方,不加10%SDS即可配制成非变性PAGE胶。
1)按照如下表格配制SDS-PAGE的浓缩胶(也称堆积胶、积层胶或上层胶):TBST 缓冲液每2L体积中含:1)抗体去除液每50mL抗体去除液中含:SDS-PAGE电泳的基本原理:SDS-聚丙烯酰胺凝胶电泳,是在聚丙烯酰胺凝胶系统中引进SDS(十二烷基硫酸钠),SDS会与变性的多肽,并使蛋白带负电荷,由于多肽结合SDS的量几乎总是与多肽的分子量成正比而与其序列无关,因此SDS多肽复合物在丙稀酰胺凝胶电泳中的迁移率只与多肽的大小有关,在达到饱和的状态下,每克多肽可与1.4g去污剂结合。
当分子量在15KD到200KD之间时,蛋白质的迁移率和分子量的对数呈线性关系,符合下式:logMW=K-bX,式中:MW为分子量,X为迁移率,k、b均为常数,若将已知分子量的标准蛋白质的迁移率对分子量对数作图,可获得一条标准曲线,未知蛋白质在相同条件下进行电泳,根据它的电泳迁移率即可在标准曲线上求得分子量。
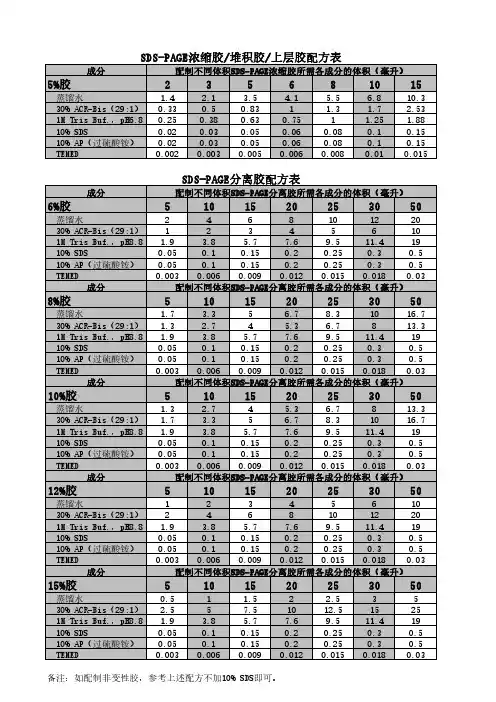
SDS-PAGE浓缩胶/堆积胶/上层胶配方表成分配制不同体积SDS-PAGE浓缩胶所需各成分的体积(毫升)5%胶235681015 蒸馏水 1.4 2.1 3.5 4.1 5.5 6.810.3 30% ACR-Bis(29:1)0.330.50.831 1.3 1.7 2.53 1M Tris Buf.,pH6.80.250.380.630.751 1.25 1.88 10% SDS0.020.030.050.060.080.10.15 10% AP(过硫酸铵)0.020.030.050.060.080.10.15 TEMED0.0020.0030.0050.0060.0080.010.015SDS-PAGE分离胶配方表成分配制不同体积SDS-PAGE分离胶所需各成分的体积(毫升)6%胶5101520253050 蒸馏水2468101220 30% ACR-Bis(29:1)12345610 1M Tris Buf.,pH8.8 1.9 3.8 5.77.69.511.419 10% SDS0.050.10.150.20.250.30.5 10% AP(过硫酸铵)0.050.10.150.20.250.30.5 TEMED0.0030.0060.0090.0120.0150.0180.03成分配制不同体积SDS-PAGE分离胶所需各成分的体积(毫升)8%胶5101520253050 蒸馏水 1.7 3.35 6.78.31016.7 30% ACR-Bis(29:1) 1.3 2.74 5.3 6.7813.3 1M Tris Buf.,pH8.8 1.9 3.8 5.77.69.511.419 10% SDS0.050.10.150.20.250.30.5 10% AP(过硫酸铵)0.050.10.150.20.250.30.5 TEMED0.0030.0060.0090.0120.0150.0180.03成分配制不同体积SDS-PAGE分离胶所需各成分的体积(毫升)10%胶5101520253050 蒸馏水 1.3 2.74 5.3 6.7813.3 30% ACR-Bis(29:1) 1.7 3.35 6.78.31016.7 1M Tris Buf.,pH8.8 1.9 3.8 5.77.69.511.419 10% SDS0.050.10.150.20.250.30.5 10% AP(过硫酸铵)0.050.10.150.20.250.30.5 TEMED0.0030.0060.0090.0120.0150.0180.03成分配制不同体积SDS-PAGE分离胶所需各成分的体积(毫升)12%胶5101520253050 蒸馏水12345610 30% ACR-Bis(29:1)2468101220 1M Tris Buf.,pH8.8 1.9 3.8 5.77.69.511.419 10% SDS0.050.10.150.20.250.30.5 10% AP(过硫酸铵)0.050.10.150.20.250.30.5 TEMED0.0030.0060.0090.0120.0150.0180.03成分配制不同体积SDS-PAGE分离胶所需各成分的体积(毫升)15%胶5101520253050 蒸馏水0.51 1.52 2.535 30% ACR-Bis(29:1) 2.557.51012.51525 1M Tris Buf.,pH8.8 1.9 3.8 5.77.69.511.419 10% SDS0.050.10.150.20.250.30.5 10% AP(过硫酸铵)0.050.10.150.20.250.30.5 TEMED0.0030.0060.0090.0120.0150.0180.03备注:如配制非变性胶,参考上述配方不加10% SDS即可。
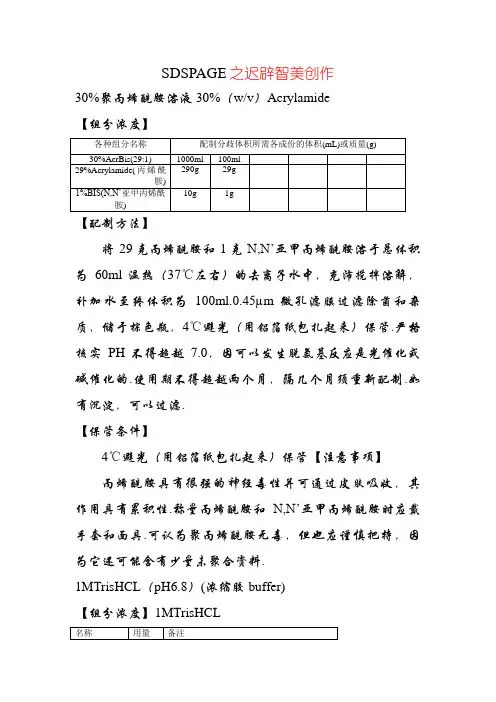
SDSPAGE之迟辟智美创作30%聚丙烯酰胺溶液30%(w/v)Acrylamide【组分浓度】【配制方法】将29克丙烯酰胺和1克N,N’亚甲丙烯酰胺溶于总体积为60ml温热(37℃左右)的去离子水中,充沛搅拌溶解,补加水至终体积为100ml.0.45µm微孔滤膜过滤除菌和杂质,储于棕色瓶,4℃避光(用铝箔纸包扎起来)保管.严格核实PH不得超越7.0,因可以发生脱氨基反应是光催化或碱催化的.使用期不得超越两个月,隔几个月须重新配制.如有沉淀,可以过滤.【保管条件】4℃避光(用铝箔纸包扎起来)保管【注意事项】丙烯酰胺具有很强的神经毒性并可通过皮肤吸收,其作用具有累积性.称量丙烯酰胺和N,N’亚甲丙烯酰胺时应戴手套和面具.可认为聚丙烯酰胺无毒,但也应谨慎把持,因为它还可能含有少量未聚合资料.1MTrisHCL(pH6.8)(浓缩胶buffer)【组分浓度】1MTrisHCL【配制方法】称量121.1gTris碱溶于800mL的去离子水,充沛搅拌溶解,加>0.7mL的浓HCL调节所需要的pH值(7.4年夜约0.7mL,7.6年夜约0.6mL,8.0年夜约0.42mL),将溶液定容至1L,高温高压灭菌后,室温保管.应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变动不同很年夜,温度每升高1℃,溶液的pH值年夜约降低0.03个单元.【保管条件】室温保管.【注意事项】对人体有安慰性,请注意适当防护.1.5MTrisHCL(pH8.8)(分离胶buffer)【配制方法】1L称量181.7gTris碱溶于800mL的去离子水,充沛搅拌溶解,加浓HCL调节所需要的pH值=8.8,将溶液定容至1L,高温高压灭菌后,室温保管.(1.5mmol/LTrisHCL(pH8.8):18.15gTris和48ml1mol/LHCL混合,加水稀释到100ml终体积.过滤后40C保管.)【保管条件】室温保管【注意事项】应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变动不同很年夜,温度每升高1℃,溶液的pH值年夜约降低0.03个单元.10%十二烷基硫酸钠SDS溶液10%(w/v)SDS【组分浓度】10%(w/v)SDS【配制方法】称取2g高纯度的SDS置于100~200ml烧杯中,加入约16ml的去离子水,68℃加热溶解,滴加浓盐酸调节PH至7.2,定容至20ml后,室温保管【保管条件】室温保管【注意事项】保管条件: 4℃保管. 注意事项:易燃,有腐蚀性,请注意防护.易挥发,使用后请盖紧瓶盖. 为了您的平安和健康,请穿实验服并戴一次性手套把持.保管条件: 4℃保管. 注意事项:易燃,有腐蚀性,请注意防护.易挥发,使用后请盖紧瓶盖. 为了您的平安和健康,请穿实验服并戴一次性手套对人体有害,请注意防护.10%过硫酸铵溶液10%(w/v)AP【组分浓度】10%(w/v) 过硫酸铵【配制方法】称取0.1g过硫酸铵置于1.5ml离心管,加1mL去离子水奏乐溶解,4℃保管【保管条件】4℃保管【注意事项】10%过硫酸铵溶液在4℃保管时,可使用2周左右,超越期限会失去催化作用5×Tris甘氨酸电泳缓冲液 5×TrisGlycine buffer (SDSPAGE 电泳缓冲液)【组分浓度】【配制方法】称取15.1gTris,94.0g甘氨酸(glycine),5.0gSDS,用800ml蒸馏水或去离子水溶解,充沛搅拌溶解,定容至1000ml,室温保管.得0.125mol/L Tris1.25mol/L甘氨酸电极缓冲液.临用前稀释5倍.【保管条件】室温保管,两年有效.【注意事项】配制好的电泳液使用时间不宜超越两周.电泳缓冲液可以回收,回收后可再使用12次,但为了取得最佳的电泳效果,应使用新电泳液.5×SDSPAGE加样缓冲液 5×SDSPAGE Loading Buffer【组分浓度】0.25MTrisHCL(pH6.8);10%(W/V)SDS;0.5%(W/V) BPB(溴酚蓝);50%(V/V) 甘油;5%(W/V)β巯基乙醇(2ME)【配制方法】量取 1.25mL 1MTrisHCL(pH6.8),0.5g SDS,25mg BPB,2.5mL甘油,置于10mL塑料离心管中,加去离子水溶解后,定容至5mL,小份(0.5mL/份)分装,于室温保管.使用前将25μL的2ME加入到每小份中.加入2ME的Loading Buffer可在室温下保管一个月左右.【保管条件】20℃保管,至少一年有效.【注意事项】SDSPAGE卵白上样缓冲液(5X)中含少量DTT和巯基乙醇,有轻微安慰性气味,必需完全溶解后再使用.摘自Takara 商品目录实验室惯例试剂配制方法TEMED原液直接使用考马斯亮蓝R250染色液【组分浓度】0.1%(w/v)考马斯亮蓝R250,25%(v/v)异丙醇,10%(v/v)冰醋酸考马斯亮蓝染色脱色液【组分浓度】10%(v/v)醋酸,5%(v/v)乙醇。
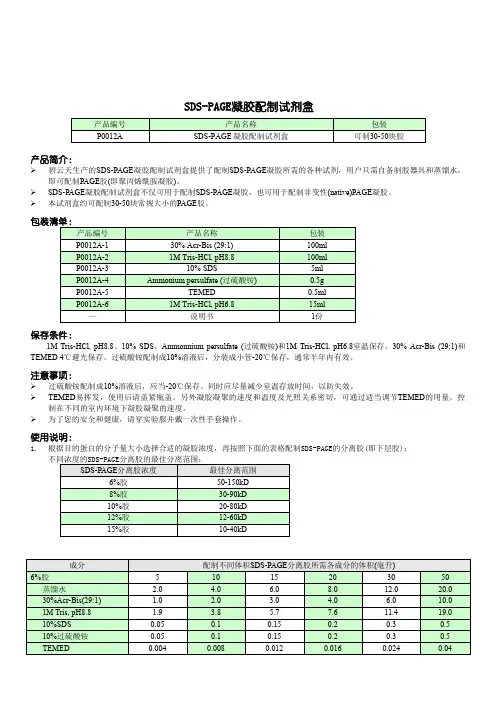
SDS-PAGE凝胶配制试剂盒产品简介:碧云天生产的SDS-PAGE凝胶配制试剂盒提供了配制SDS-PAGE凝胶所需的各种试剂,用户只需自备制胶器具和蒸馏水,即可配制PAGE胶(即聚丙烯酰胺凝胶)。
SDS-PAGE凝胶配制试剂盒不仅可用于配制SDS-PAGE凝胶,也可用于配制非变性(native)PAGE凝胶。
本试剂盒约可配制30-50块常规大小的PAGE胶。
保存条件:1M Tris-HCl, pH8.8、10% SDS、Ammonnium persulfate (过硫酸铵)和1M Tris-HCl, pH6.8室温保存。
30% Acr-Bis (29:1)和TEMED 4℃避光保存。
过硫酸铵配制成10%溶液后,分装成小管-20℃保存,通常半年内有效。
注意事项:过硫酸铵配制成10%溶液后,应当-20℃保存。
同时应尽量减少室温存放时间,以防失效。
TEMED易挥发,使用后请盖紧瓶盖。
另外凝胶凝聚的速度和温度及光照关系密切,可通过适当调节TEMED的用量,控制在不同的室内环境下凝胶凝聚的速度。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:1. 根据目的蛋白的分子量大小选择合适的凝胶浓度,再按照下面的表格配制SDS-PAGE的分离胶(即下层胶):使用本产品的文献:1. Deng XQ, Chen LL, Li NX.The expression of SIRT1 in nonalcoholic fatty liver disease induced by high-fat diet in rats.Liver Int. 2007 Jun;27(5):708-15.2. Wang PH, Gu ZH, Huang XD, Liu BD, Deng XX, Ai HS, Wang J, Yin ZX, Weng SP, Yu XQ, He JG.An immune deficiency homolog from the white shrimp, Litopenaeus vannamei, activates antimicrobial peptide genes. Mol Immunol. 2009 May;46(8-9):1897-904.3. Liang QL, Wang BR, Li GH.DcR3 and survivin are highly expressed in colorectal carcinoma and closely correlated to its clinicopathologic parameters. J Zhejiang Univ Sci B. 2009;10(9):675-82.4. Deng XQ, Cheng JL, Zhang YP, Li NX, Chen LL.Effects of caloric restriction on SIRT1 expression and apoptosis of islet beta cells in type 2 diabetic rats.Springer Verlag. 2009.5. Cao X, Zhang Y, Zou L, Xiao H, Chu Y, Chu X.Persistent oxygen-glucose deprivation induces astrocytic death through two different pathways and calpain-mediated proteolysis of cytoskeletal proteins during astrocytic oncosis.Neurosci Lett. 2010;479(2):118-22. Epub 2010 May 21.6. Cao X, Xiao H, Zhang Y, Zou L, Chu Y, Chu X.1, 5-Dicaffeoylquinic acid-mediated glutathione synthesis through activation of Nrf2 protects against OGD/reperfusion-induced oxidative stress in astrocytes. Brain Res. 2010;1347:142-8. Epub 2010 Jun 1.7. Huang L, Bi HC, Liu YH, Wang YT, Xue XP, Huang MCAR-mediated up-regulation of CYP3A4 expression in LS174T cells by Chinese herbal compounds.Drug Metab Pharmacokinet. 2011;26(4):331-40.8. Li Q, Lei RX, Zhou XD, Kolosov VP, Perelman JM.Regulation of PMA-induced MUC5AC expression by heparin in human bronchial epithelial cells.Mol Cell Biochem. 2012 Jan;360(1-2):383-91.9. Luan HF, Zhao ZB, Zhao QH, Zhu P, Xiu MY.Hydrogen sulfide postconditioning protects isolated rat hearts against ischemia and reperfusioninjury mediated by the JAK2/STAT3 survival pathway.Braz J Med Biol Res. 2012 May 31.10.Chen Z, Qing J, Qin G, Hu LConstruction and characterization of bifunctional TIM-3-EGFP fusion proteins.Protein Expr Purif. 2012 Nov;86(1):1-6. doi: 10.1016/j.pep.2012.08.004. Epub 2012 Aug 23.11.Huang L, Huang M, Li YH, Li RM, Zeng Y, Kuang SY, Zhang L, Wang YT, Bi HC.Up-regulatation of CYP3A expression through pregnent X receptor by praeruptorin D isolated from Peucedanumpraeruptorum Dunn.J Ethnopharmacol. 2013 Jul 9;148(2):596-602. doi: 10.1016/j.jep.2013.05.008. Epub 2013 May 20.12.Zhang H, Wang ZW, Wu HB, Li Z, Li LC, Hu XP, Ren ZL, Li BJ, Hu ZP.Transforming growth factor-β1 induces matrix metalloproteinase-9 expression in rat vascular smooth muscle cellsvia ROS-dependent ERK-NF-κB pathways. Mol Cell Biochem. 2013 Mar;375(1-2):11-21. doi: 10.1007/s11010-012-1512-7. Epub 2012 Dec 29.13.Liu R, Liu X, Zheng Y, Gu J, Xiong S, Jiang P, Jiang X, Huang E, Yang Y, Ge D, Chu Y.MicroRNA-7 sensitizes non-small cell lung cancer cells to paclitaxel.Oncol Lett. 2014 Nov;8(5):2193-2200. Epub 2014 Sep 4.14.Zhao W, Zhao J, Hou M, Wang Y, Zhang Y, Zhao X, Zhang C, Guo D.HuR and TIA1/TIAL1 are involved in regulation of alternative splicing of SIRT1 pre-mRNA.Int J Mol Sci. 2014 Feb 20;15(2):2946-58. doi: 10.3390/ijms15022946.。

SDS-PAGE 试剂配制
凝胶脱色染色方法:
溶液1:无水乙醇250mL,冰醋酸50mL,水200mL;
溶液2:无水乙醇50mL,冰醋酸37.5mL,水437.5mL;
溶液3:0.25g考马斯亮蓝R-250 溶于100mL 95%乙醇中,滤纸过滤,待用。
电泳结束,取出胶放在胶盒中,加约50mL溶液1,微波炉加热1min,摇床摇10-20nin;倒掉溶液1,加入溶液2,再加1mL溶液3,混匀,微波炉加热1min,摇床摇,直至条带染色清晰为止。
上样缓冲液(5×):(5×loading buffer)有
10%(W/V,g/ml)过硫酸铵(APs)的配制:(1ml)
1.称取0.1g过硫酸铵;
2.加入1ml的去离子水,将固体粉末彻底溶解;
3.贮存于4℃。
注意:10%过硫酸铵最好现配现用,配好的溶液在4℃保存可使用2周左右,过期会失去催化效果。
5×Tris-Glycine电泳缓冲液的配制:(1L)
1.称取Tris粉末15.1g、Glycine(甘氨酸)94g、SDS5.0g;
2.加入约800ml的去离子水,搅拌溶解;
3.加去离子水定容至1L,室温保存。
注意:加水时应让水延着壁缓缓流下,以避免由于SDS的原因产生很多泡沫。

SDSPAGE电泳原理:之吉白夕凡创作聚丙烯酰胺凝胶是由丙烯酰胺 (简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。
聚丙烯酰胺凝胶电泳可根据分歧蛋白质分子所带电荷的差别及分子大小的分歧所发生的分歧迁移率将蛋白质分离成若干条区带,如果分离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只分离出一条区带。
SDS是一种阴离子概况活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超出其自己原有的电荷,掩盖了各种蛋白分子间天然的电荷差别。
因此,各种蛋白质SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。
这种电泳方法称为SDS聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。
由于SDSPAGE 可设法将电泳时蛋白质电荷差别这一因素除去或减小到可以略而不计的程度,因此经常使用来鉴定蛋白质分离样品的纯化程度,如果被鉴定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带。
TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合。
过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基。
SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统。
本实验采取垂直板状不连续系统。
所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成。
在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,pH8.3)、浓缩胶缓冲液(Tris—HCl,pH6.8)、分离胶缓冲液(Tris—HCl,pH8.8),两种凝胶的浓度(即孔径)也不相同。
在这种条件下,缓冲系统中的HCl 几乎全部解离成Cl-,两槽中的Gly (pI=6.0,pK a=9.7)只有很少部分解离成Gly 的负离子,而酸性蛋白质也可解离出负离子。
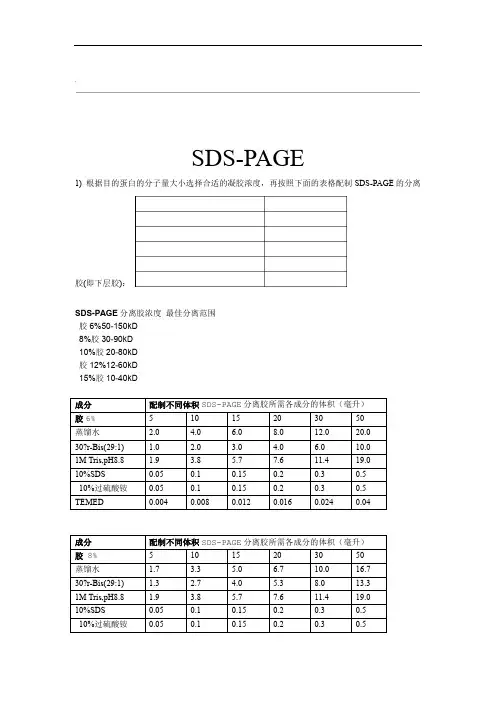
.SDS-PAGE1)根据目的蛋白的分子量大小选择合适的凝胶浓度,再按照下面的表格配制SDS-PAGE的分离胶(即下层胶):SDS-PAGE分离胶浓度最佳分离范围胶6%50-150kD8%胶30-90kD10%胶20-80kD胶12%12-60kD15%胶10-40kD.'.成分分离胶所需各成分的体积(毫升)配制不同体积SDS-PAGE胶。
即可配制成非变性注:如果配制非变性胶,参考上述配方,不加10%SDSPAGE 冰箱放两周,但是最好新鲜配置效果好。
10%过硫酸铵配好后可以在4D :(也称堆积胶、积层胶或上层胶)按照如下表格配制SDS-PAGE的浓缩胶1)1L电泳缓冲溶液5XTris-Glycine0.5% W/V SDS ,1.25M Glycine 0.125M Tris,Tris 15.1 gGlycine 95 gSDS 5.0 g.'.5X SDS-PAGE 加样缓冲液:5ml250mM Tris-HCl (pH6.8), 10% SDS, 0.5% BPB, 50% glycerol, 5% 2-ME 1M Tris-HCl (pH6.8): 1.25 mLSDS:0.5 gBPB: 25mgGlycerol: 2.5ml2-ME: 使用时加入小份(25微升),新鲜使用。
TBST 缓冲液每2L体积中含:1M TrisHCL(pH7.5) 100mLNacl 16g0.4g KCL1ml吐温1)抗体去除液50mL抗体去除液中含:每6.25mL pH6.80.5M TrisHCL()10mL 10%SDS0.175mL Beta-ME33.75mL 水.'.SDS-PAGE电泳的基本原理:SDS-聚丙烯酰胺凝胶电泳,是在聚丙烯酰胺凝胶系统中引进SDS(十二烷基硫酸钠),SDS会与变性的多肽,并使蛋白带负电荷,由于多肽结合SDS的量几乎总是与多肽的分子量成正比而与其序列无关,因此SDS多肽复合物在丙稀酰胺凝胶电泳中的迁移率只与多肽的大小有关,在达到饱和的状态下,每克多肽可与1.4g去污剂结合。

SDS-PAGE电泳原理:聚丙烯酰胺凝胶是由丙烯酰胺(简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。
聚丙烯酰胺凝胶电泳可根据不同蛋白质分子所带电荷的差异及分子大小的不同所产生的不同迁移率将蛋白质分离成若干条区带,如果分离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只分离出一条区带。
SDS是一种阴离子表面活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超过其本身原有的电荷,掩盖了各种蛋白分子间天然的电荷差异。
因此,各种蛋白质-SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。
这种电泳方法称为SDS-聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。
由于SDS-PAGE 可设法将电泳时蛋白质电荷差异这一因素除去或减小到可以略而不计的程度,因此常用来鉴定蛋白质分离样品的纯化程度,如果被鉴定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带。
TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合。
过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基。
SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统。
本实验采用垂直板状不连续系统。
所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成。
1.蛋白样品浓缩效应在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,、浓缩胶缓冲液(Tris—HCl,、分离胶缓冲液(Tris—HCl,,两种凝胶的浓度(即孔径)也不相同。
在这种条件下,缓冲系统中的HCl 几乎全部解离成Cl-,两槽中的Gly (pI=,pK a=只有很少部分解离成Gly 的负离子,而酸性蛋白质也可解离出负离子。

10%(W/V, g/ml)过硫酸铵(APs)的配制:(100 ml)1. 称取10g过硫酸铵;2. 加入100 ml的去离子水,将固体粉末彻底溶解;3. 贮存于4℃。
注意:10%过硫酸铵最好现配现用,配好的溶液在4℃保存可使用2周左右,过期会失去催化效果。
5×Tris-Glycine电泳缓冲液的配制:(1 L)1. 称取Tris粉末15.1 g、Glycine(甘氨酸)94 g、SDS 5.0 g;2. 加入约800 ml的去离子水,搅拌溶解;3. 加去离子水定容至1 L,室温保存。
注意:加水时应让水延着壁缓缓流下,以避免由于SDS的原因产生很多泡沫。
5×SDS-PAGE Loading Buffer的配制(方案一):(5 ml)(本方案摘自Takara网站)组分:Tris-HCl pH6.8(250 mM);SDS (10%);溴酚兰(0.5%);甘油(5 0%);β-巯基乙醇(5%)配制过程:1. 量取1M Tris-HCl (pH6.8) 1.25 ml;甘油2.5 ml;称取SDS固体粉末0.5 g;溴酚兰25 mg;2. 加入去离子水溶解后定容至5 ml;3. 小份(500 μl)分装后,于室温保存。
4. 使用前将25 μl的β-巯基乙醇加入到每小份中去。
5. 加入β-巯基乙醇的上样Buffer可以在室温下保存一个月左右。
5×SDS-PAGE Loading Buffer的配制(方案二):(10 ml)(本方案摘自《蛋白质技术手册》汪家政、范明)组分:Tris-HCl pH6.8(60 mM);SDS (2%);溴酚兰(0.1%);甘油(25%);β-巯基乙醇(14.4 mM)配制过程:1. 量取1M Tris-HCl (pH6.8) 0.6 ml;50%的甘油5 ml;10%的SDS溶液2 m l;1%的溴酚兰1 ml;2. 加入去离子水定容至10 ml;3. 分装;4. 在4℃可保存数周,-20℃可保存数月之久。
SDS-PAGE 凝胶配方及制胶12%分离胶试剂5ml 8ml 10ml 15ml 25ml30ml 60ml 90ml 120ml 30%Acr-Bis (ml ) 2 3.2 4610122436 48 1.5M Tris-HCl PH8.8(ml ) 1.25 2 2.5 3.75 6.25 7.5 15 22.5 30 ddH2O (ml ) 1.65 2.64 3.3 4.95 8.25 9.9 19.8 29.7 39.6 10%SDS (ul ) 50 80 100 150 250 300 600 900 1200 10%APS (ul ) 50 80100 150 250300 600 900 1200 TEMED (ul ) 3 4.8 6 9 15 18 36 54 725%浓缩胶试剂4ml 6ml 8ml 12ml 16ml 20ml 24ml 36ml 48ml 30%Acr-Bis (ml ) 0.66 0.99 1.32 1.98 2.64 3.3 3.96 5.94 7.92 1M Tris-HCl PH6.8(ml ) 0.5 0.75 1 1.5 22.5 34.56ddH2O (ml ) 2.74 4.14 5.48 8.28 11.02 13.7 16.56 24.84 33.12 10%SDS (ul ) 40 60 80 120 160 200 240 360 480 10%APS (ul ) 40 60 80 120 160 200 240 360 480 TEMED (ul )4681216202436481、按顺序加溶液,每加完一个溶液摇匀一下。
2、TEMED 要在通风橱中加,加入后混匀30秒左右后再注胶;吸打时枪头不出液面,以减少气泡3、分离胶配好后要用水封顶,聚合至少40min (也可聚合一夜)4、加入浓缩胶后插梳子(要洗干净),梳子倾斜插入,避免产生气泡。

SDS-PAGE30%聚丙烯酰胺溶液-----30%(w/v)Acrylamide将29克丙烯酰胺和1克N,N’-亚甲丙烯酰胺溶于总体积为60ml温热(37℃左右)的去离子水中,充分搅拌溶解,补加水至终体积为100ml。
0.45µm微孔滤膜过滤除菌和杂质,储于棕色瓶,4℃避光(用铝箔纸包扎起来)保存。
严格核实PH不得超过7.0,因可以发生脱氨基反应是光催化或碱催化的。
使用期不得超过两个月,隔几个月须重新配制。
如有沉淀,可以过滤。
【保存条件】4℃避光(用铝箔纸包扎起来)保存【注意事项】丙烯酰胺具有很强的神经毒性并可通过皮肤吸收,其作用具有累积性。
称量丙烯酰胺和N,N’-亚甲丙烯酰胺时应戴手套和面具。
可认为聚丙烯酰胺无毒,但也应谨慎操作,因为它还可能含有少量未聚合材料。
1MTris-HCL(pH6.8)(浓缩胶buffer)称量121.1gTris碱溶于800mL的去离子水,充分搅拌溶解,加>0.7mL的浓HCL调节所需要的pH 值(7.4-大约0.7mL,7.6-大约0.6mL,8.0-大约0.42mL),将溶液定容至1L,高温高压灭菌后,室温保存。
应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
【保存条件】室温保存。
【注意事项】对人体有刺激性,请注意适当防护。
1.5MTris-HCL(pH8.8)(分离胶buffer)称量181.7gTris碱溶于800mL的去离子水,充分搅拌溶解,加浓HCL调节所需要的pH值=8.8,将溶液定容至1L,高温高压灭菌后,室温保存。
(1.5mmol/LTris-HCL(pH8.8):18.15gTris和48ml1mol/LHCL 混合,加水稀释到100ml终体积。
过滤后40C保存。
)【保存条件】室温保存【注意事项】应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
SDS-PAGE1、SDS-PAGE:聚丙烯酰胺凝胶电泳2、Acr:丙烯酰胺;配胶时用30%Acr(质量比Acr:Bis=29:1)3、Bis:甲叉双丙烯酰胺4、DDW:超轻水5、SDS:十二烷基硫酸/磺酸钠,阴离子去污剂(配胶时用10%)6、APS:过硫酸铵NH4S2O4配胶时用10%7、TEMED:四甲基乙二胺,促凝剂8、Tris-Hcl:3羟基氨基甲烷盐酸缓冲液,配胶时(分离胶ph=8.8,浓缩胶ph=6.8)9、DTT:二硫苏糖醇,DTT也常常被用于蛋白质中二硫键的还原,可用于阻止蛋白质中的半胱氨酸之间所形成的蛋白质分子内或分子间二硫键。
10、IMA:碘乙酰胺,碘代乙酰胺用于有机合成,在蛋白组学中组氨酸和半胱氨酸的烷基化试剂,用于多肽测序以及酶抑制剂等,蛋白组学级试剂。
CH>2ICONH>2,是和碘乙酸一样,可通过下列反应不可逆地抑制SH酶类的物质。
1)根据目的蛋白的分子量大小选择合适的凝胶浓度,再按照下面的表格配制SDS-PAGE的分离胶(即下层胶):注:如果配制非变性胶,参考上述配方,不加10%SDS即可配制成非变性PAGE胶。
1)按照如下表格配制SDS-PAGE的浓缩胶(也称堆积胶、积层胶或上层胶):TBST 缓冲液每2L体积中含:1)抗体去除液每50mL抗体去除液中含:SDS-PAGE电泳的基本原理:SDS-聚丙烯酰胺凝胶电泳,是在聚丙烯酰胺凝胶系统中引进SDS(十二烷基硫酸钠),SDS会与变性的多肽,并使蛋白带负电荷,由于多肽结合SDS的量几乎总是与多肽的分子量成正比而与其序列无关,因此SDS多肽复合物在丙稀酰胺凝胶电泳中的迁移率只与多肽的大小有关,在达到饱和的状态下,每克多肽可与1.4g去污剂结合。
当分子量在15KD到200KD之间时,蛋白质的迁移率和分子量的对数呈线性关系,符合下式:logMW=K-bX,式中:MW为分子量,X为迁移率,k、b均为常数,若将已知分子量的标准蛋白质的迁移率对分子量对数作图,可获得一条标准曲线,未知蛋白质在相同条件下进行电泳,根据它的电泳迁移率即可在标准曲线上求得分子量。
SDS-PAGE电泳原理:聚丙烯酰胺凝胶是由丙烯酰胺 (简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。
聚丙烯酰胺凝胶电泳可根据不同蛋白质分子所带电荷的差异及分子大小的不同所产生的不同迁移率将蛋白质分离成若干条区带,如果分离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只分离出一条区带。
SDS是一种阴离子表面活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超过其本身原有的电荷,掩盖了各种蛋白分子间天然的电荷差异。
因此,各种蛋白质-SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。
这种电泳方法称为SDS-聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。
由于SDS-PAGE 可设法将电泳时蛋白质电荷差异这一因素除去或减小到可以略而不计的程度,因此常用来鉴定蛋白质分离样品的纯化程度,如果被鉴定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带。
TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合。
过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基。
SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统。
本实验采用垂直板状不连续系统。
所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成。
1.蛋白样品浓缩效应在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,pH8.3)、浓缩胶缓冲液(Tris—HCl,pH6.8)、分离胶缓冲液(Tris—HCl,pH8.8),两种凝胶的浓度(即孔径)也不相同。
在这种条件下,缓冲系统中的HCl 几乎全部解离成Cl-,两槽中的Gly (pI =6.0,pK a=9.7)只有很少部分解离成Gly 的负离子,而酸性蛋白质也可解离出负离子。
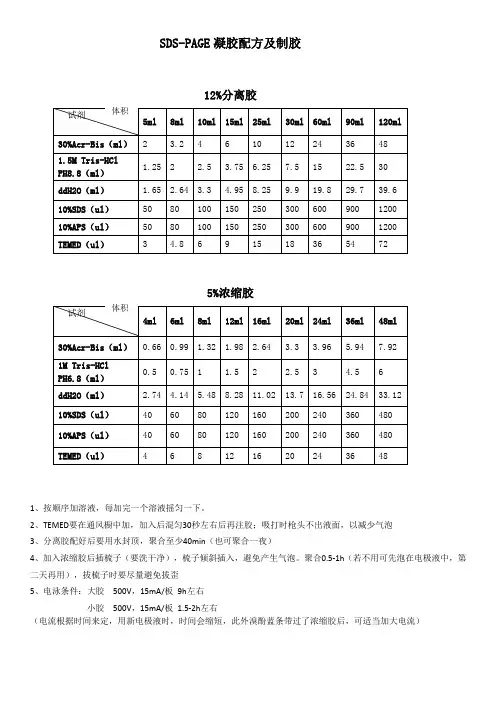
SDS-PAGE 凝胶配方及制胶12%分离胶试剂5ml 8ml 10ml 15ml 25ml30ml 60ml 90ml 120ml 30%Acr-Bis (ml ) 2 3.2 4610122436 48 1.5M Tris-HCl PH8.8(ml ) 1.25 2 2.5 3.75 6.25 7.5 15 22.5 30 ddH2O (ml ) 1.65 2.64 3.3 4.95 8.25 9.9 19.8 29.7 39.6 10%SDS (ul ) 50 80 100 150 250 300 600 900 1200 10%APS (ul ) 50 80100 150 250300 600 900 1200 TEMED (ul ) 3 4.8 6 9 15 18 36 54 725%浓缩胶试剂4ml 6ml 8ml 12ml 16ml 20ml 24ml 36ml 48ml 30%Acr-Bis (ml ) 0.66 0.99 1.32 1.98 2.64 3.3 3.96 5.94 7.92 1M Tris-HCl PH6.8(ml ) 0.5 0.75 1 1.5 22.5 34.56ddH2O (ml ) 2.74 4.14 5.48 8.28 11.02 13.7 16.56 24.84 33.12 10%SDS (ul ) 40 60 80 120 160 200 240 360 480 10%APS (ul ) 40 60 80 120 160 200 240 360 480 TEMED (ul )4681216202436481、按顺序加溶液,每加完一个溶液摇匀一下。
00000002、TEMED 要在通风橱中加,加入后混匀30秒左右后再注胶;吸打时枪头不出液面,以减少气泡 000000003、分离胶配好后要用水封顶,聚合至少40min (也可聚合一夜)00000004、加入浓缩胶后插梳子(要洗干净),梳子倾斜插入,避免产生气泡。
SDSPAGE电泳原理:之阿布丰王创作聚丙烯酰胺凝胶是由丙烯酰胺 (简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。
聚丙烯酰胺凝胶电泳可根据分歧蛋白质分子所带电荷的差别及分子大小的分歧所发生的分歧迁移率将蛋白质分离成若干条区带,如果分离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只分离出一条区带。
SDS是一种阴离子概况活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超出其自己原有的电荷,掩盖了各种蛋白分子间天然的电荷差别。
因此,各种蛋白质SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。
这种电泳方法称为SDS聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。
由于SDSPAGE 可设法将电泳时蛋白质电荷差别这一因素除去或减小到可以略而不计的程度,因此经常使用来鉴定蛋白质分离样品的纯化程度,如果被鉴定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带。
TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合。
过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基。
SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统。
本实验采取垂直板状不连续系统。
所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成。
1.蛋白样品浓缩效应在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,pH8.3)、浓缩胶缓冲液(Tris—HCl,pH6.8)、分离胶缓冲液(Tris—HCl,pH8.8),两种凝胶的浓度(即孔径)也不相同。
在这种条件下,缓冲系统中的HCl 几乎全部解离成Cl-,两槽中的Gly (pI=6.0,pK a=9.7)只有很少部分解离成Gly 的负离子,而酸性蛋白质也可解离出负离子。
SDSPAGE电泳原理:之答禄夫天创作聚丙烯酰胺凝胶是由丙烯酰胺 (简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。
聚丙烯酰胺凝胶电泳可根据分歧蛋白质分子所带电荷的差别及分子大小的分歧所发生的分歧迁移率将蛋白质分离成若干条区带,如果分离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只分离出一条区带。
SDS是一种阴离子概况活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超出其自己原有的电荷,掩盖了各种蛋白分子间天然的电荷差别。
因此,各种蛋白质SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。
这种电泳方法称为SDS聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。
由于SDSPAGE 可设法将电泳时蛋白质电荷差别这一因素除去或减小到可以略而不计的程度,因此经常使用来鉴定蛋白质分离样品的纯化程度,如果被鉴定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带。
TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合。
过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基。
SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统。
本实验采取垂直板状不连续系统。
所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成。
在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,pH8.3)、浓缩胶缓冲液(Tris—HCl,pH6.8)、分离胶缓冲液(Tris—HCl,pH8.8),两种凝胶的浓度(即孔径)也不相同。
在这种条件下,缓冲系统中的HCl 几乎全部解离成Cl-,两槽中的Gly (pI=6.0,pK a=9.7)只有很少部分解离成Gly 的负离子,而酸性蛋白质也可解离出负离子。