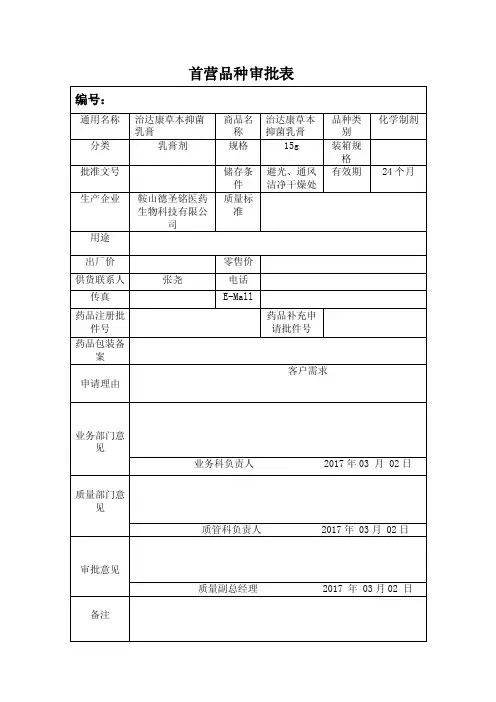
首营品种审批表
- 格式:docx
- 大小:22.03 KB
- 文档页数:1

医疗器械首营品种审批表医疗器械首营品种审批表1. 申请单位信息申请单位:___________________联系人:______________________________________2. 基本信息2.1 申请品种的通用名称请输入申请的医疗器械品种的通用名称,如心脏起搏器。
通用名称:___________________2.2 申请品种的商品名称请输入申请的医疗器械品种的商品名称,如品牌名称。
商品名称:____________________2.3 申请品种的注册证编号请输入申请的医疗器械品种的注册证编号。
注册证编号:___________________2.4 制造商信息请输入申请的医疗器械品种的制造商信息。
制造商名称:___________________制造商国家:___________________制造商地址:___________________2.5 供应商信息请输入申请的医疗器械品种的供应商信息。
供应商名称:___________________供应商地址:___________________2.6 品种主要用途请输入申请的医疗器械品种的主要用途。
品种主要用途:___________________3. 申请材料清单3.1 申请表请确认已完整填写并签署本申请表。
3.2 经销授权书请提供制造商或供应商签署的经销授权书。
3.3 注册证复印件请提供申请品种的注册证复印件。
3.4 质量体系文件请提供申请品种的制造商的质量体系文件,包括但不限于ISO 13485认证证书,生产工艺流程图等。
3.5 产品说明书请提供申请品种的产品说明书。
3.6 产品包装标签请提供申请品种的产品包装标签样本。
3.7 品牌授权书请提供申请品种的品牌授权书。
3.8 进口医疗器械批准文件请提供申请品种的进口医疗器械批准文件。
4. 申请审核流程4.1 提交申请请将完整的申请材料清单提交至指定的邮件地址或办公室。
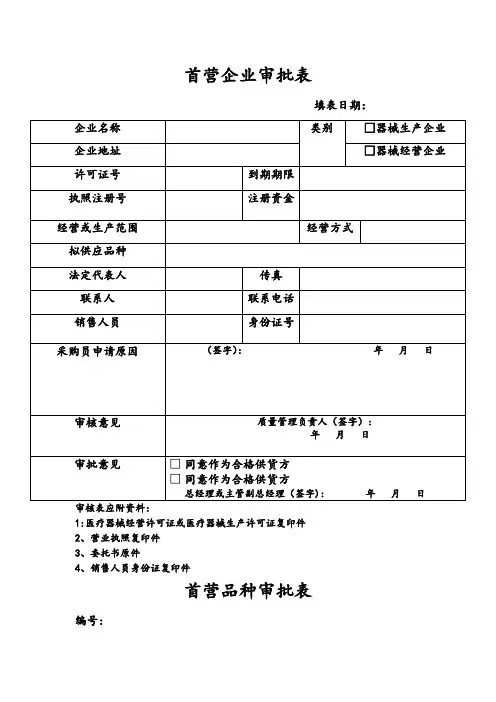
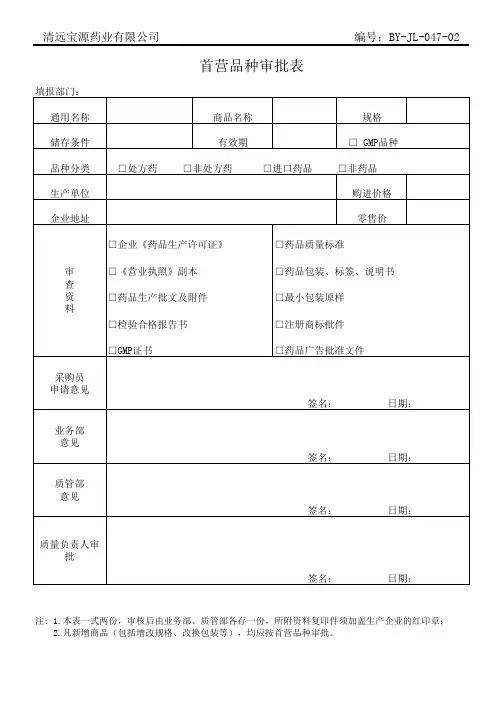
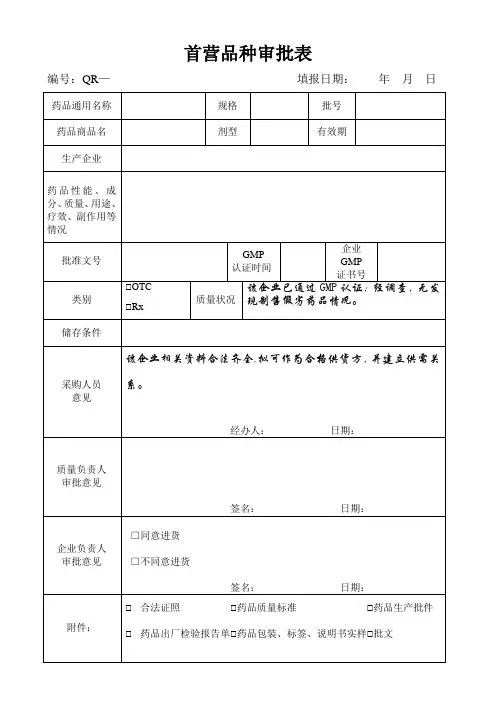
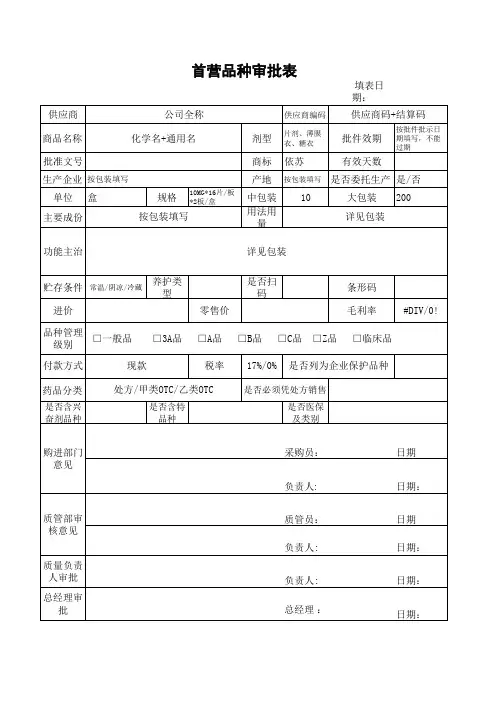

首营品种审批表背景为了保障国家食品安全,监管部门需要对所有涉及食品生产、销售的企业进行审批管理。
其中,批准新企业销售的食品品种称为首营品种,对于这些新品种的审批工作需要进行详细的记录和评估。
审批表内容一份完整的首营品种审批表需要包含以下信息:申请信息•申请企业名称/联系人•联系方式•申请日期•申请产品名称•产品分类/类型产品信息•产品名称•产品注册证号•生产国家/地区•生产商名称•生产商地址•包装规格•保存条件•规格及型号•规格及用途申报信息•原料或配料列表(含来源)•产品组成成分及比例•预期配送范围•产品批准文号•产品用途及效果•保质期审批状态•审批进度•审批结果•审批人员•审批日期应用场景首营品种审批表可以在生产销售食品的过程中使用。
具体应用场景如下:1.企业成立时首次申请销售某一款产品;2.企业准备销售新的食品品种;3.企业要新增包装规格或配料,需要重新申报。
使用建议为了更好地利用首营品种审批表,有以下几点使用建议:1.应该根据企业的实际情况选择合适的分类来填写;2.填写时应该全面、准确,尽可能避免错误信息;3.在审批结果有结果之前,请勿开展生产和销售行为;4.应将审核结果及时披露给相关企业;常见问题终审结果不通过,该怎么办?终审不通过通常有以下几种情况:产品质量不合格、配料不符合规定、质量标准不符合要求等。
若出现这种情况,应及时沟通,了解问题所在,进行相应的调整和改善,并重新递交审批申请。
如何保持审批信息的准确性?食品审批信息随着企业的发展和变化而不断变化。
因此,应该定期更改或更新审批信息,确保信息的及时性和准确度。
不要因为认为修改过程繁琐而忽略信息的更新。
结论首营品种审批表是为了保障食品安全而设定的一项管理措施。
针对不同的企业或食品品种,应该制定不同的审批标准,保证审批工作的高效性和准确性。

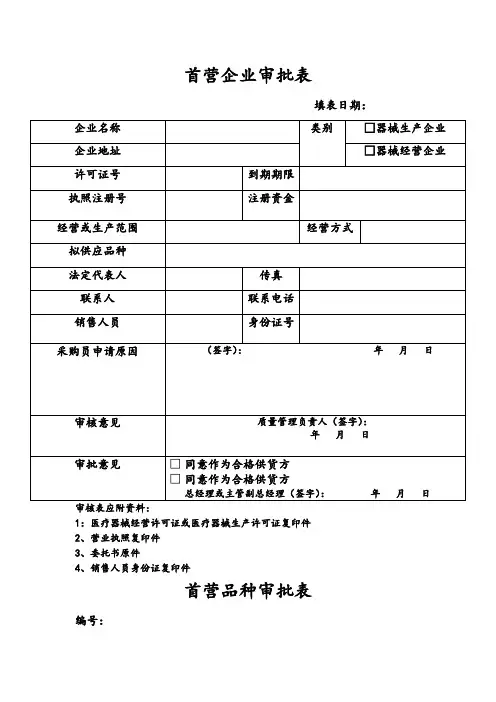

医疗器械首营品种审批表一、申请单位信息1. 企业名称:2. 企业地址:3. 联系方式:4. 法定代表人(负责人):5. 申请人(联系人):二、医疗器械信息1. 产品名称:2. 通用名称:3. 申请分类:4. 产品描述(包括主要功能、适应症、使用说明等):5. 生产厂家:6. 生产厂家地址:7. 型号规格:8. 包装规格:9. 执行标准:10. 注册证号:11. 注册证有效期:12. 产品图片:13. 其他相关文件:三、技术评价1. 技术鉴定报告(如有):2. 检测报告(如有):3. 产品质量控制计划:4. 对比分析报告(如有):四、临床试验1. 临床试验方案:2. 试验结果及分析:3. 安全性评估:4. 试验数据分析及结论:五、药品不良反应监测1. 近三年内的不良反应报告:2. 对于已上市的同类产品是否存在严重不良反应情况分析及结论:六、其他文件1. 相关法律法规及规章制度文件:2. 生产许可证、经营许可证、进出口许可证等证照复印件:3. 其他有关证明文件。
七、结论总结1、本文档所涉及简要注释如下:- 申请分类:指医疗器械的管理分类,按照国家食品药品监督管理局的相关规定进行分类。
- 执行标准:指产品需参照的技术标准或行业标准,需符合国家相关标准要求。
- 注册证号:指医疗器械审批后获取的相关证明文件编号。
- 注册证有效期:指注册证的有效期限,到期需要重新申请。
- 临床试验方案:指医疗器械在临床试验阶段所需遵守的试验方案标准。
- 生产许可证、经营许可证、进出口许可证等证照复印件:指企业在生产、经营、进出口等领域申请的相关证照复印件。
2、本文档所涉及的法律名词及注释如下:- 食品药品监督管理局:指中华人民共和国国家食品药品监督管理局,是负责监管和管理国家食品药品安全的行政机构。
- 医疗器械:指用于预防、诊断、治疗、缓解人体疾病、损伤或残疾的器具、设备、仪器和其他类似的产品。
- 药品不良反应监测:指对药品使用过程中可能出现的不良反应进行监测和评价的一系列工作。