有机合成 氧化反应 (2h)
- 格式:ppt
- 大小:527.00 KB
- 文档页数:20
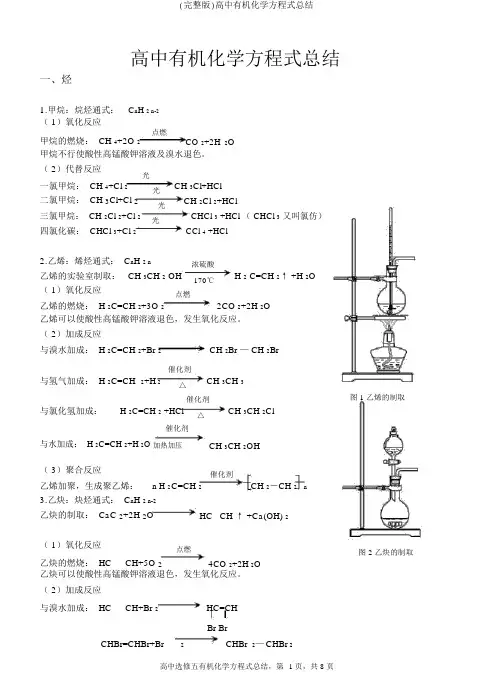
高中有机化学方程式总结一、烃1.甲烷:烷烃通式:C n H 2 n-2( 1)氧化反应甲烷的燃烧: CH 4+2O 2点燃CO 2+2H2O甲烷不行使酸性高锰酸钾溶液及溴水退色。
( 2)代替反应光一氯甲烷: CH 4+Cl 2CH 3Cl+HCl光二氯甲烷: CH 3Cl+Cl 2CH 2Cl 2+HCl光三氯甲烷: CH 2Cl 2+Cl 2CHCl 3 +HCl ( CHCl 3又叫氯仿)光四氯化碳: CHCl 3+Cl 2CCl 4 +HCl2.乙烯:烯烃通式: C n H 2 n浓硫酸乙烯的实验室制取: CH 3CH 2OH170℃H 2 C=CH 2↑ +H 2O( 1)氧化反应点燃乙烯的燃烧: H 2C=CH 2+3O 22CO 2+2H 2O乙烯可以使酸性高锰酸钾溶液退色,发生氧化反应。
( 2)加成反应与溴水加成: H 2C=CH 2+Br 2CH 2Br — CH 2Br与氢气加成: H 2C=CH催化剂CH 3CH 32+H 2△催化剂图 1 乙烯的制取与氯化氢加成:H 2C=CH 2 +HCl△CH 3CH 2Cl催化剂与水加成: H 2C=CH 2+H 2O 加热加压CH 3CH 2OH( 3)聚合反应催化剂n H 2CH 2-CH 2 n乙烯加聚,生成聚乙烯:C=CH 23.乙炔:炔烃通式: C n H 2 n-2乙炔的制取: CaC 2+2H 2O HC CH ↑ +Ca(OH) 2( 1)氧化反应点燃图 2 乙炔的制取乙炔的燃烧: HC CH+5O 24CO 2+2H2O乙炔可以使酸性高锰酸钾溶液退色,发生氧化反应。
( 2)加成反应与溴水加成: HC CH+Br 2HC=CHBr Br与氢气加成: HC催化剂CH+H 2△H 2C=CH 2与氯化氢加成: HC CH+HCl 催化剂=CHClCH 2△( 3)聚合反应Cl催化剂n 氯乙烯加聚,获得聚氯乙烯: nCH 2=CHCl CH —CH2催化剂乙炔加聚,获得聚乙炔:n HC CH CH=CH n4.苯:苯的同系物通式:C n H 2n-6( 1)氧化反应点燃苯的燃烧: 2C6H 6+15O12CO 2+6H 2O 苯不可以使溴水和酸性高锰酸钾溶液退色。


有机合成题引言有机合成是有机化学的一个重要分支,主要研究如何通过不同的化学变换,将简单的有机化合物转化为复杂的有机化合物。
有机合成不仅在制药、农药、染料等领域有着重要应用,同时也是有机化学研究的重要手段之一。
本文将以一个有机合成题为例,介绍有机合成的基本原理和方法。
题目描述将苯乙酮转化为苯甲醇。
反应路径苯乙酮(C₆H₅C(O)CH₃)转化为苯甲醇(C₆H₅CH₂OH)的反应路径如下:1.氧化反应:将苯乙酮氧化为苯乙酮酸。
2.还原反应:将苯乙酮酸还原为苯甲醇。
具体的反应步骤如下:氧化反应反应条件:溶液中加入碱性高锰酸钾(KMnO₄),反应在室温下进行。
反应方程式:C₆H₅C(O)CH₃ + 2KMnO₄ + 3H₂O → C₆H₅C(O)OH + 2MnO₂ + 2KOH+ 2H₂O反应机理:高锰酸钾是氧化剂,在碱性条件下可以氧化苯乙酮的羰基碳,形成苯乙酮酸。
还原反应反应条件:将苯乙酮酸与过量的还原剂甲酸钠(HCOONa)在乙醇中回流加热。
反应方程式:C₆H₅C(O)OH + 2HCOONa → C₆H₅CH₂OH + 2HCOONa反应机理:甲酸钠是强还原剂,可以将苯乙酮酸还原为苯甲醇。
实验步骤1.称取苯乙酮,加入适量的高锰酸钾溶液,溶解后得到紫红色的溶液。
2.将紫红色溶液回流加热,反应一段时间后,紫红色消失,转变为橙黄色。
3.加入过量的甲酸钠溶液,继续回流加热一段时间。
4.得到橙黄色溶液。
5.通过蒸馏或其他方法分离出苯甲醇。
机理解析在氧化反应中,高锰酸钾氧化苯乙酮的羰基碳,生成苯乙酮酸。
高锰酸钾中的高氧化态锰(MnO₄⁻)被还原为低氧化态锰(MnO₂),同时苯乙酮的羰基碳被氧化为羧基碳。
氧化反应在碱性条件下进行,碱性条件有利于高锰酸钾的氧化还原反应。
在还原反应中,甲酸钠还原苯乙酮酸,生成苯甲醇。
甲酸钠中的甲酸根离子(HCOO⁻)作为强还原剂,捕获苯乙酮酸中的羧基氧,同时还原甲酸根离子为甲醇基。


有机化学基础知识点氧化与还原反应的机理与应用氧化与还原反应是有机化学中非常重要的反应类型之一,它们广泛应用于许多有机合成、材料制备和药物研发等领域。
本文将介绍氧化与还原反应的基本机理以及在实际应用中的一些典型案例。
一、氧化反应的机理氧化反应是指物质失去电子或氢原子,并与氧原子结合形成氧化物或酮类化合物的过程。
氧化反应的机理可以分为两类:氧化剂获得电子或氢原子的机理和底物失去电子或氢原子的机理。
1. 氧化剂获得电子或氢原子的机理在这类氧化反应中,氧化剂会接受底物的电子或氢原子。
常见的氧化剂包括氧气、过氧化氢、高锰酸钾等。
氧化剂接受电子或氢原子形成还原态的化合物。
例如,二氧化锰(MnO2)被还原为二氧化锰(MnO):2 MnO2 + 2e- → 2 MnO2. 底物失去电子或氢原子的机理在这类氧化反应中,底物会失去电子或氢原子,形成氧化物或酮类化合物。
常见的底物包括醇、酚、醛、酮等。
例如,乙醇(C2H5OH)被氧化为乙醛(CH3CHO):C2H5OH → CH3CHO + 2H+ + 2e-二、还原反应的机理还原反应是指物质获得电子或氢原子,并与氢原子结合形成醇、酚、醛等化合物的过程。
还原反应的机理可以分为两类:还原剂失去电子或氢原子的机理和底物获得电子或氢原子的机理。
1. 还原剂失去电子或氢原子的机理在这类还原反应中,还原剂会失去电子或氢原子。
常见的还原剂包括金属、硫化物或其他含有可获得电子的配体的化合物。
例如,锌(Zn)可以被氧气(O2)氧化为氧化锌(ZnO):2 Zn + O2 → 2 ZnO2. 底物获得电子或氢原子的机理在这类还原反应中,底物会获得电子或氢原子,形成醇、酚、醛等化合物。
例如,乙醛(CH3CHO)被还原为乙醇(C2H5OH):CH3CHO + 2H+ + 2e- → C2H5OH三、氧化与还原反应的应用氧化与还原反应在有机合成和药物研发中有广泛应用。
以下是其中的一些典型案例:1. 氧化反应的应用氧化反应可以用于醇的合成。


醛和酮的氧化还原反应方程式总结在有机化学领域中,醛和酮是常见的有机化合物。
它们在化学反应中经常参与氧化还原反应。
在本文中,我将总结醛和酮的氧化还原反应方程式,并探讨这些反应对有机合成的重要性。
一、醛的氧化反应醛是含有羰基(C=O)官能团的化合物,通过氧化反应可将羰基上的氢原子氧化为羰基上的氧。
以下是一些常见的醛的氧化反应方程式:1. 向硄酸的氧化反应:醛+ [O] → 酸 + H2O其中,[O]表示氧化剂,如氧气(O2)或氧化性化合物。
2. 碳酸的氧化反应:醛+ [O] → 碳酸 + H2O这种反应通常由氧化性氧化剂催化,如过氧化氢(H2O2)或高锰酸钾(KMnO4)。
二、酮的氧化反应酮是含有两个有机基团通过碳原子连接的化合物,其氧化反应相对于醛来说比较困难。
以下是酮的氧化反应方程式的示例:1. 向羧酸的氧化反应:酮+ [O] → 羧酸 + H2O这种反应通常需要较强的氧化剂,如酸性高碘酸铵(NH4IO4)或高碘酸钾(KIO4)。
三、醛和酮的还原反应相对于氧化反应,醛和酮的还原反应则是将羰基上的氧还原为氢。
以下是一些常见的醛和酮的还原反应方程式:1. 醛的还原反应:醛+ 2H → 醇在还原反应中,氢气(H2)是常见的还原剂。
2. 酮的还原反应:酮+ 2H → 醇与醛的还原反应类似,酮的还原反应也需要氢气作为还原剂。
四、醛和酮的氧化还原反应机制醛和酮的氧化还原反应涉及一个重要的步骤,即羰基上的氢迁移。
在这一过程中,氧化剂接受羰基上的氢原子,产生醇或羧酸,同时还原剂提供氢原子,将羰基上的氧还原为氢。
这种氧化还原反应机制在有机化学的涉及到许多重要的合成反应,如制备醇、醛和酮的方法。
综上所述,醛和酮作为常见的有机化合物,在氧化还原反应中表现出一系列重要的反应。
醛可通过氧化反应形成酸或碳酸,而酮则通过氧化反应形成羧酸。
相反地,醛和酮也可以通过还原反应将羰基上的氧还原为氢,生成相应的醇。
理解和掌握醛和酮的氧化还原反应方程式及其机制对于有机化学的研究和应用具有重要意义。

有机化学反应方程式总结氧化还原反应氧化还原反应是有机化学中最常见的一类反应,也是有机合成和有机化工中重要的反应类型之一。
本文将总结常见的有机化学反应方程式,包括氧化反应和还原反应。
一、氧化反应1. 高价态氧化反应氧可以以不同的氧化态参与反应,其中最常见的是氧气(O2)和过氧化氢(H2O2)。
以下是一些常见的高价态氧化反应方程式:1) 醇氧化反应:醇+ [O] → 醛 + H2O2) 全氧氧化反应:碳氢化合物+ O2 → CO2 + H2O3) 羧酸氧化反应:羧酸+ O2 → 一般产物 + H2O2. 过氧化物氧化反应过氧化物是一类含有氧氧单键(O-O)的化合物,可以在氧化反应中作为氧化剂。
以下是一些常见的过氧化物氧化反应方程式:1) 过氧化氢氧化反应:过氧化氢 + 2H+ + 2e- → 2H2O2) 过氧化苯酚氧化反应:过氧化苯酚+ [O] → 苯醌 + H2O3) 过氧化乙酸氧化反应:过氧化乙酸+ [O] → 乙酸 + CO2 + H2O二、还原反应还原反应是氧化反应的逆过程,即被氧化物失去氧原子或获得氢原子。
以下是一些常见的有机化学还原反应方程式:1. 还原脱氧反应还原脱氧反应是有机化合物中含氧原子的官能团被还原为碳-碳键。
以下是一些常见的还原脱氧反应方程式:1) 脂肪酸还原脱氧反应:脂肪酸+ LiAlH4 → 醇 + Al(OH)32) 酮还原脱氧反应:酮+ NaBH4 → 醇3) 羧酸还原脱氧反应:羧酸+ LiAlH4 → 醇 + Al(OH)32. 氢化还原反应氢化还原反应是有机化合物中含氧或含氮官能团被还原为相应的醇或胺。
以下是一些常见的氢化还原反应方程式:1) 酮氢化反应:酮+ NaBH4 → 醇2) 醛氢化反应:醛+ NaBH4 → 醇3) 羧酸酯氢化反应:羧酸酯+ LiAlH4 → 醇结论:本文总结了有机化学中的氧化还原反应方程式,包括氧化反应和还原反应。
通过对这些反应方程式的了解,我们可以更好地理解氧化还原反应的原理和应用,为有机化学合成和化工工艺的设计提供指导。

考点16 人工合成有机化合物【核心考点梳理】一、常见有机化合物的合成以乙烯为原料合成乙酸乙酯(1)常规合成路线根据所学知识,常用的合成路线为此过程中发生反应的化学方程式及反应类型: ①CH 2===CH 2+H 2O ――→催化剂CH 3CH 2OH ,加成反应。
②2CH 3CH 2OH +O 2――→催化剂△2CH 3CHO +2H 2O ,氧化反应。
③2CH 3CHO +O 2――→催化剂2CH 3COOH ,氧化反应。
④CH 3COOH +C 2H 5OHCH 3COOC 2H 5+H 2O ,酯化反应或取代反应。
【典型例题】 例1.(2022·浙江高一月考)以乙烯为有机原料制备乙酸乙酯的合成路线中,最后一步化学反应的反应类型是( )A .氧化反应B .取代反应C .加成反应D .水解反应【答案】B【详解】以乙烯为原料制备乙酸乙酯的反应中,最后一步是乙醇与乙酸的酯化反应,该反应也属于取代反应,B 项正确。
例2.(2023春·高一课时练习)某高聚物的结构式如图:,其单体的结构简式为 A . B . C .和CH 3CH=CH 2 D . 和CH 2=CH 2【答案】D 【解析】由高聚物的结构可知,主链可含有6个C 原子,没有其他杂原子,其中含有1个C=C双键,为二烯烃和烯烃的加聚反应产物,按如图所示断键,其中双键中1个C-C断裂,再恢复原来的双键,CH=CH,答案选D。
故单体为,22例3.(2023·全国·高一专题练习)下列各组原料适合合成聚氯乙烯单体的是A.乙烷、氯气B.乙烯、氯气C.乙烯、氯化氢D.乙炔、氯化氢【答案】D【分析】聚氯乙烯的单体是氯乙烯(CH2=CHCl) ,据此分析解答。
【解析】A.乙烷和氯气发生取代反应,得到多种氯代烷和氯化氢的混合物,得不到CH2=CHCl,故A不选;B.乙烯和氯气发生加成反应,得到1,2-二氯乙烷,得不到CH2=CHCl,故B不选;C.乙烯和氯化氢发生加成反应,得到一氯乙烷,得不到CH2=CHCl,故C不选;D.乙炔和氯化氢按照物质的量1:1发生加成反应,得到CH2=CHCl,故D选;故选D。

烷烃1.燃烧氧化2.卤代反应烯烃1.催化加氢2.亲电加成1 卤化氢2卤素(反式加成)3 次卤酸(X加到含H多的)4 加水5 硫酸3.硼氢化反应(顺式加成、反马氏)(①BH3②H2o2/oh-)4.自由基加成(hcl不可以反应)有过氧化物/日光反马氏5.αH卤代反应(高温)(NBS再过氧化物下低温反应反马氏)6.氧化反应(1)高锰酸钾1稀kmno4 OH-(顺式二元醇)2KMNO4 /H+ 双键C带2H 氧化成co2 带一个H氧化成醛进一步成羧酸不带H氧化成酮(2)臭氧化反应(①O3 ②Zn,CH3cooh,H2O)醛或酮(3)催化氧化(Ag,250°)乙烯→环氧乙烷炔烃1.弱酸性(1)酸性S轨道成分越多H酸性越多(2)碱金属炔化物(①NaNH2②RX延长C链)(3)重金属炔化物的生成(末端炔烃鉴别反应CU(NH3)2+)2.加成反应(1)催化加氢1 H2/Pb 2 Lindar催化剂Pd-Baso4/喹啉3Na,液NH3 -78°C(反式烯烃)(2)亲电加成1 卤素(ccl4 -20°c)2 卤化氢 3 水(HgSO4,H2SO4催化)(3)氧化反应(酸性KMNO4)→羧酸二烯烃1.1,4-1,2加成反应(HBr)3.双烯合成脂环烃1.2.环(二)烯烃(1)亲电加成卤素卤化氢水硫酸(2)氧化同烯烃(3)环加成生成桥环化合物单环芳烃1.加成反应(1)催化加氢→环己烷(2)卤素→六六六2.苯环侧链反应(1)氧化反应α-H才能氧化成-COOH(2)自由基反应(光照/高温下加卤素αH)3.苯环上亲电取代反应(1)卤代X2+FeCl3 (2)硝化HNO3,H2SO4 (3)磺化H2SO4·so3 (4)付克烷基化(烯烃/醇/卤代烃+AlX3)(5)傅克酰基化(酰卤/酸酐+AlX3)(6)分子内烷基化酰基化多环芳烃1.联苯类亲电取代吸电子→对位供电子→邻位2.稠环芳烃(1)亲电取代卤代硝化磺化邻对位同环α位间位异环α位卤代烃1.亲核取代反应(1)-OH取代H2O,OH-(2)CN取代NaCN(3)烷氧基取代得醚RONa(4)被I离子取代NaI(5)AgNO3-乙醇溶液反应(SN1)(6)NH2取代(NH3,NH4BR)2.消除反应NAOH/KOH 乙醇溶液3.与金属Mg反应醇1.酸性Na2.与酸成酯H2SO43.脱水→烯烃分子内会重排用Al2O3不会→醚分子间脱水4.生成卤代烃(卢卡斯试剂鉴别叔仲伯C(ZnCl2+浓HCl)/HBr /PCl5/SOCl2 )5.氧化反应伯醇→醛→羧酸仲醇→酮叔醇→不反应醚1.珜盐生成2.醚键断裂(HI)先断裂小烃基3.过氧化物生成环氧乙烷(酸条件下断取代基多的)1.R-MgX2.H2O/OH-3.NH34.HX5.HCN6.Ph-OH,H+/OH-7.C2H5OH酚1.酚羟基反应(1)酸性NaOH(2)FeCl3 显色反应(3)与RX反应成醚2.苯环上的取代反应(1)卤代反应(2)硝化(3)磺化(4)烷基化酰基化3.氧化→醌醛酮1.亲核取代反应(1)HCN (所有醛,脂肪族甲基酮,C8以下环酮)PH=8(2)RMG-X(3)亚硫酸氢钠(醛,脂肪族甲基酮,C8以下环酮)(4)R-OH (无水强酸催化剂)缩醛(稀酸中水解成原来的)(5)胺的衍生物羟胺/肼/苯肼/氨基脲/二硝基苯肼(脱水)2.α-H活泼性(1)酮--烯醇式互变异构α-H酸性比较(2)羟醛缩合反应①自身缩合OH-②交叉缩合③分子内缩合(3)卤仿反应3.氧化菲林试剂(CU(OH)2 )托伦斯试剂Ag(NH3)2OH4.还原(1)还原成OH ①催化加氢②NABH4 只还原醛酮③LiAlH4 除了双键三建都氧化(2)还原成-CH2-①克莱门森Zn-Hg/HCl ②黄鸣龙NH2NH2,NaOH (双键不会加H,甲氧基不会断裂)(3)歧化反应→醇和羧酸甲醛总是氧化成COONa羧酸1.酸性NaHCO32.羧酸衍生物生成(1)酰卤PCl5 /SOCl2(2)酸酐单酐两分子羧酸混酐酰卤+羧酸钠(3)酯R-OH(4)酰胺NH33.α-H的卤代4.还原反应LiAlH4 →醇5.脱羧反应△吸电子基易发生二元羧酸1.酸性2.△0-1 -CO2 2-3 -H2O 4-5 -H2O-CO2羟基酸1.酸性2.脱水反应(1)α-H 两分子(2)Β-H分子内(3)Γδ形成五元六元环羧酸衍生物1.亲核取代反应(1)羧酸衍生物水解H2O,NaOH(2)醇解→酯生成(3)氨解→酰胺生成2.还原反应酰胺→胺其他→伯醇(1)LiAlH4 还原(2)金属na还原Na的乙醇溶液(3)PB so4,喹啉还原→醛3.格式试剂(1)酰卤可停留酮(2)酯成醇难停留成醇4.酰胺N原子上的反应(1)酰胺碱性(2)Hofmann降解反应→伯胺(naoh+X2)硝基化合物1.与碱反应2.硝基还原(1)还原剂(Fe,Sn,Hcl)NO2→NH2(2)选择性还原。

76%64% 第三章 反应与制备一、 氧化反应与应用1、氧化反应化学反应中,凡失去电子的反应称为氧化反应(Oxidation Reaction)。
有机化合物的氧化反应表现为分子中氢原子的减少或氧原子的增加。
在有机合成中,氧化反应是一类重要的单元反应,通过氧化反应,可以制取许多含氧化合物,例如醇、醛、酮、酸、酚、醌以及环氧化物等,应用十分广泛。
工业上常以廉价的空气或纯氧作氧化剂,但由于其氧化能力较弱,一般要在高温、高压的条件下才能发生氧化反应;实验室中常用的氧化剂有KMnO 4、Na 2Cr 2O 7、HNO 3等。
这些氧化剂氧化能力强,可以氧化多种基团,属于通用型氧化剂。
以KMnO 4作氧化剂,在不同的介质中,反应结果一样。
KMnO 4在中性或碱性介质中进行氧化时,锰原子的价态由+7下降为+4,生成二氧化锰,它不溶于水而被沉淀下来,在这个过程中,平均1mol 高锰酸根释放出1.5mol 原子氧:2KMnO 4 + H 2O 2MnO 2↓+ 2KOH + 3[O]在强酸性介质中,锰原子的价态则由+7降至+2,形成二价锰盐,平均1mol 高锰酸根释放出2.5mol 原子氧:2KMnO 4 + 3H 2SO 4 2MnSO 4↓+ 2K 2SO 4 + 3H 2O + 5[O]例如,在碱性条件下,如果将1mol 乙苯氧化为苯甲酸,则需要4molKMnO 4:相对来说,KMnO 4在中性介质中的氧化反应要温和一些,适合于由烯烃制备邻二醇:CH 3(CH 2)7CH=CH(CH 2)7COOH CH 3(CH 2)7CH ─CH(CH 2)7COOH在碱性介质中,KMnO 4可以将伯醇或醛氧化为相应的酸,也可以用来氧化芳烃上的侧链。
CH 3CHCH 2OH CH 3CHCOOHCH 2CH 3 COOH + 6[O] + CO 2 + 2H 2O KMnO 4,H 2O 0~10℃ OH OH KMnO 4,OH - CH 3 CH 3 COCH 3 CH 3 COOH COOH KMnO 4,OH -KMnO 4在酸性介质中的氧化反应常在25%以上的H 2SO 4溶液中进行。
有机化学基础知识胺的氧化反应和还原反应胺是有机化合物中含有氨基(-NH2)官能团的一类化合物,是有机化学中重要的功能团之一。
胺分为一级胺、二级胺和三级胺,它们在许多重要的有机反应中起着至关重要的作用。
本文将介绍胺的氧化反应和还原反应。
一、胺的氧化反应胺的氧化反应是指通过加氧剂将胺转化为其氧化产物的过程。
在氧化反应中,胺的氮原子减少氢原子的数目,同时与氧原子形成新的化学键。
胺的氧化反应通常采用过氧化氢、高锰酸钾等氧化剂。
1. 一级胺的氧化反应一级胺经氧化反应可生成亚硝胺和亚硝基产物。
亚硝胺是一类重要的中间体,可以进一步与胺反应生成亲电亚硝酯。
【化学方程式1】:R-NH2 + H2O2 → R-NH-NO + H2O2. 二级胺的氧化反应二级胺经氧化反应可生成亚硝胺和亚硝基产物。
与一级胺类似,亚硝胺也是二级胺氧化反应的中间产物。
【化学方程式2】:R2NH + H2O2 → R2N-N=O + H2O3. 三级胺的氧化反应三级胺经氧化反应生成惰性产物,主要形成胺N-氧化物。
【化学方程式3】:R3N + H2O2 → R3N=O + H2O二、胺的还原反应胺的还原反应是指将氧化胺经反应还原为原始胺的过程。
还原反应是氧化反应的反应逆过程,通过还原剂将胺的氮原子上的氧或氮原子与氢发生反应,还原为胺。
1. 亚硝胺的还原反应亚硝胺的还原反应是一级胺的还原反应,常用还原剂为金属、反硝化细菌等。
【化学方程式4】:R-NH-NO + H2 + 2H+ → R-NH2 + NO + H2O2. 氧化胺的还原反应氧化胺的还原反应是通过还原剂将胺的氧原子还原为氢原子的过程。
常用的还原剂有锌、亚砜等。
【化学方程式5】:R3N=O + 2H2 → R3N-H + 2H2O总结:胺的氧化反应和还原反应是有机合成中至关重要的反应类型。
通过氧化反应,可以将胺转化为其氧化产物,进一步参与其他有机反应。
而通过还原反应,可以将氧化胺还原为原始胺,为有机合成提供重要的前体和中间体。
2024年吉林、黑龙江普通高等学校招生考试(适应性演练)化学本试卷共8页。
考试结束后,将本试卷和答题卡一并交回。
注意事项:1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在考生信息条形码粘贴区。
2.选择题必须使用2B 铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字体工整、笔迹清楚。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效:在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 F 19 Al 27 Si 28S 32 Cl 35.5 Ca 40 Sr 88 I 127 Ba 137一、选择题:本题共15小题,每小题3分,共45分。
在每小题给出的四个选项中,只有一项符合题目要求。
1.春节是中华民族重要的传统节日,近日被确定为联合国假日。
以下有关春节习俗中的化学知识说法错误的是A.红烧肉烹饪过程中蛋白质变性涉及化学变化B.春晚演员的彩妆用品均属于无机物C.饺子与糯米年糕的口感差异与支链淀粉的含量有关D.陈年老酒的芳香气味与酯的形成有关2.“银朱”主要成分为HgS 。
《天工开物》记载:“凡将水银再升朱用,故名曰银朱…即漆工以鲜物采,唯(银朱)入桐油则显…若水银已升朱,则不可复还为汞。
”下列说法错误的是A.“银朱”可由Hg 和S 制备 B.“银朱”可用于制作颜料C.“桐油”为天然高分子 D.“水银升朱”不是可逆反应3.下列化学用语表述正确的是A.+2NO 的空间结构为V 形 B.顺-1,2-二溴乙烯结构式为C.-3N 的电子式为-[N N:N]D.基态Cr 原子价电子排布式为423d 4s 4.电解重水(2D O )是制取氘气(2D )的一种方法。
设A N 为阿伏加德罗常数的值。