物理化学课件第6讲-熵变的计算
- 格式:ppt
- 大小:511.00 KB
- 文档页数:24

化学反应与熵变计算方法在化学反应中,熵变(∆S)是描述反应混乱程度和无序程度的物理量。
熵变的计算对于预测反应的进行性以及评估反应的可逆性非常重要。
本文将介绍化学反应中熵变的计算方法。
一、熵变的基本概念熵变(∆S)定义为系统的总熵减去外界的熵。
熵是描述系统无序程度的物理量,可用于判断系统的混乱程度。
熵变的单位是焦耳/开尔文(J/K)。
二、熵变的计算方法1. 标准熵变(∆S°) 计算方法标准熵变是在标准状态下(298K和常压)的熵变值。
标准熵变的计算方法如下:a. 反应物和生成物的熵变之差(∆S°rxn):∆S°rxn = ΣnS°(生成物) - ΣmS°(反应物)其中,n和m分别是生成物和反应物的摩尔系数,S°为物质在标准状态下的摩尔熵。
根据反应物和生成物的物质摩尔比例,可以计算得到标准熵变。
b. 标准摩尔熵(∆S°):∆S° = ΣnS°(生成物) - ΣmS°(反应物)标准摩尔熵代表了反应物和生成物的摩尔熵之差。
通过查阅参考书或数据库,可以获得化学物质在标准状态下的摩尔熵值。
2. 熵变的计算方法对于非标准状态下的反应,可以通过以下方法计算熵变:a. 用各组分的摩尔熵计算反应熵(∆Srxn):∆Srxn = ΣnS(生成物) - ΣmS(反应物)其中,n和m分别是生成物和反应物的摩尔系数,S为物质的摩尔熵。
根据物质的摩尔熵以及物质的摩尔比例,可以计算得到反应的熵变。
b. 用标准熵变(∆S°rxn) 和温度计算反应熵(∆Srxn):∆Srxn = ∆S°rxn + ΣnR ln(P(生成物)/P(反应物))其中,∆S°rxn为反应的标准熵变,R为气体常数(8.314J/(mol·K)),P(生成物)和P(反应物)为反应物和生成物的分压。
三、熵变计算的应用熵变计算的方法可应用于以下方面:1. 预测反应的进行性:根据反应物和生成物的标准熵变差(∆S°rxn),可以判断反应的进行性。

求熵变的公式熵这个概念在物理学中可是有点神秘又有趣的哦!咱们来说说求熵变的公式。
熵变啊,简单来说就是系统的混乱程度发生的变化。
那求熵变的公式到底是啥呢?一般来说,对于一个可逆过程,熵变可以用克劳修斯等式来计算,公式是ΔS = ∫(dQ/T) ,这里的 dQ 表示微小的热量变化,T 是绝对温度。
我记得有一次给学生们讲这个公式的时候,发生了一件特别好玩的事儿。
那是一个阳光明媚的上午,教室里的气氛却有点紧张,因为大家都觉得这个公式有点难理解。
我就举了个例子,说假如咱们把一个房间想象成一个系统,房间里的东西乱七八糟地放着,这就相当于熵比较大。
如果我们把东西都整理得井井有条,这个过程就像是熵在减小。
而温度就好比是我们整理东西的速度。
然后有个调皮的学生就问我:“老师,那要是房间里突然来了一阵龙卷风,把东西都吹乱了,这熵变得多大呀?”这问题一出来,全班都哄堂大笑。
我笑着回答他:“那这熵变可就大得没法计算啦,就像你的脑袋现在一样混乱!”大家笑得更厉害了,不过通过这个小小的玩笑,大家对熵变的概念好像也没那么害怕了。
再来说说这个公式里的积分。
积分这东西有时候确实让人头疼,但是咱们别怕。
想象一下,积分就像是把一段路程分成很多小段,然后把每一小段的情况加起来。
对于熵变的计算,就是把热量变化除以温度的这些小部分都加起来,得到总的熵变。
在实际应用中,这个公式能帮助我们解决很多问题。
比如说在热传递的过程中,我们可以通过计算熵变来判断这个过程是否可逆。
如果熵变等于零,那就是可逆过程;如果熵变大于零,那就是不可逆过程。
还有啊,在研究化学反应的时候,熵变也是个很重要的指标。
通过计算反应前后的熵变,我们可以判断这个反应在热力学上是不是容易发生。
总之,求熵变的公式虽然看起来有点复杂,但只要我们多想想实际的例子,多做做练习题,就一定能掌握它。
就像我们整理房间一样,一开始可能觉得乱得无从下手,但只要有耐心,一点一点来,最后总能变得整洁有序。
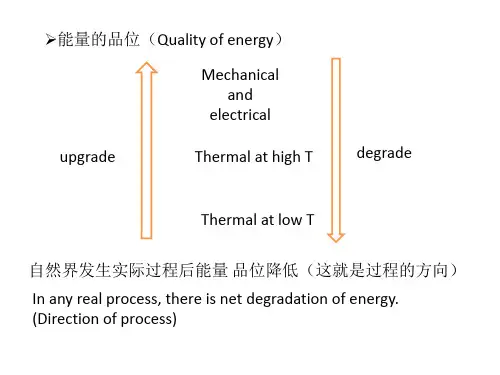




24熵变的计算资料熵变是热力学中的一个重要概念,用来描述系统内部的混乱程度或者无序程度的增加或减少。
在热力学中,熵是一个状态函数,它的变化只与初末态有关,而与路径无关。
熵的计算可以通过以下公式进行:∆S=S_f-S_i其中,∆S表示熵变,S_f表示末态的熵值,S_i表示初态的熵值。
要计算熵变,首先需要知道物质的热容和温度变化。
热容是物质在温度变化下所吸收或释放的热量,其单位是焦/摄氏温度。
当物质的热容为常数时,可以使用以下公式计算熵变:∆S = Cp * ln(Tf/Ti)其中,Cp表示物质的热容,Tf表示末态的温度,Ti表示初态的温度。
如果物质的热容随温度变化而变化,需要使用积分的形式进行计算:∆S=∫Cp(T)dT其中,Cp(T)表示温度为T时的热容,积分的上下限为初态和末态的温度。
除了温度变化外,物质的相变也会导致熵变。
在物质相变时,熵变可以通过以下公式进行计算:∆S=Q/T其中,Q表示相变过程中吸收或释放的热量,T表示相变温度。
需要注意的是,熵的单位是焦/摄氏温度,但在计算中也常常使用焦/开尔文。
举例来说,我们可以计算一下水从0℃转化为100℃的熵变。
不考虑温度对热容的影响,假设水的热容为4.18焦/摄氏温度,可以使用上述公式计算得到:∆S = 4.18 * ln(100/0) = 4.18 * ln(100) ≈ 29.50焦/摄氏温度这表示水从冰点到沸点的熵增加了29.50焦/摄氏温度。
总结起来,熵变的计算需要同时考虑温度变化和相变等因素,并通过热容、热量和温度等参数进行计算。
计算时需要注意单位的一致性,同时要根据具体情况选择合适的公式进行计算。

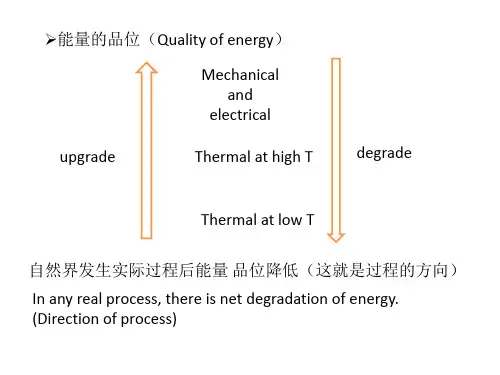


化学反应中的熵变与平衡常数熵(Entropy)是热力学中一个重要的物理量,用来描述物质的无序程度。
在化学反应中,熵变(ΔS)的概念被广泛应用,以解释反应的自发性和平衡状态。
本文将探讨化学反应中的熵变与平衡常数之间的关系。
1. 熵变的定义和计算方法熵变是指系统在反应过程中发生的熵的变化,可以通过以下公式计算:ΔS = ∑S产物 - ∑S反应物其中,∑S产物表示反应产物的熵总和,∑S反应物表示反应物的熵总和。
根据熵的性质,若系统的无序程度增加,熵变ΔS取正值;若系统的无序程度减少,熵变ΔS取负值。
2. 熵变与反应的自发性根据熵变的概念,反应在热力学上是自发进行的当且仅当ΔS > 0。
这是因为自然趋向于增加无序的程度,即增加系统的熵。
一方面,化学反应中的物质通常从有序状态转变为无序状态,导致ΔS > 0。
另一方面,熵变ΔS与返还的热量有关,若系统吸收的热量(q)越多,根据热力学第二定律,熵变ΔS越大,反应越自发。
3. 平衡常数与熵变的关系平衡常数(K)是描述化学反应达到平衡状态时反应物和产物浓度之间关系的定量指标。
与熵变ΔS之间存在着一定的关系。
根据吉布斯自由能(Gibbs free energy)的定义,ΔG = ΔH - TΔS,其中ΔH为焓变,T为温度。
在恒温恒压下,反应的自由能变化与平衡常数之间存在如下关系:ΔG = -RT lnK其中,R为气体常数,T为绝对温度,ln为自然对数。
上式可以改写为:ΔG° = -RT lnK其中,ΔG°表示标准自由能变化,即在标准状态下反应的自由能变化。
根据上式,平衡常数与熵变之间存在相关性。
当ΔG° < 0时,反应向右(产物方向)进行,平衡常数K大于1;当ΔG° > 0时,反应向左(反应物方向)进行,平衡常数K小于1。
4. 应用实例为了更好地理解熵变与平衡常数的关系,以下以一些实际化学反应为例进行说明。
物理化学气体简单状态变化过程熵变的计算可逆过程:R rQ S T W T ∆−==0U ∆=R rQ W =−2r 112l ln n VW nRT V p nRT p=−=12ln pnR p =21ln V nR V =不可逆过程:设计始终态相同的可逆过程来计算 熵的变化值。
理想气体恒温过程恒容变温过程 T nC U Q V V d d δm ,==TnC H Q p p d d δm ,==恒压变温过程 气体恒压变温或恒容变温过程可逆变化,非体积功等于零。
0=δ'W Vp U Q d d r +=δV VnR T T nC T V p T U T QS V d d d d δd m ,r +=+==∫∫+=2121d d Δm ,V V T T V VVnR T T nC S 理想气体pVT 变化过程熵变的计算理想气体pVT 变化过程熵变的计算绝热不可逆过程222111T PV T PV=n A ,P A , V , T n B ,P B , V , T n A +n B ,P A +P B , V , T,0,0=∆+∆=∆=∆=∆B A B A S S S S S 理想气体的恒温恒压混合过程 满足分压定律时:n A , p, V A , T n B , p, V B , Tn A +n B , p, V A +V B , TA A AB A A B A A A Ax R n n n n R n pn n n p R n S ln ln ln −=+=+=∆满足分体积定律时:理想气体的恒温恒压混合过程BB BB AB BA B B B x R n n n n R n p n n n p R n S ln ln ln −=+=+=∆)ln ln (B B A A B A x R n x R n S S S +−=∆+∆=∆∑−=∆i i i mix xn R S ln 推广 理想气体的恒温恒压混合过程物理化学。
2.3 熵变的计算计算过程的熵变时,应注意熵是状态函数,确定体系的始末态,在始末态之间设计一个可逆过程来求体系的熵变。
2.3.1 理想气体简单状态变化的体系熵变的计算 (1)单纯的状态变化⎰⎪⎭⎫⎝⎛=-=∆BA r AB T Q S S S δ(1)恒压过程:⎰⎰==∆BAp BA T dT C T dHS (2)恒容过程:⎰⎰==∆BAV BA T dT C T dUS (3)恒温过程:TW U T Q S r r -∆==∆ (4)一般过程:A B V A B T TC V V nR S ln ln+=∆ (8)A B A B p p p nR T T C S ln ln-=∆ (9)AB V A B p p pC V V C S ln ln+=∆ (10)环境和隔离体系熵变的计算环境熵变按定义S ∆环-=⎰BA T Q 环δ 计算。
Q δ为体系实际进行的过程中体系所吸收的热,不是虚拟的过程中体系所吸收的热。
上例中体系实际进行的过程中体系所吸收的热和虚拟的过程中体系所吸收的热是相等的,因为两个过程都是恒压的。
体系的热效应可能是不可逆的,但由于环境很大,对环境可看作是可逆热效应,所以,任何可逆变化时环境的熵变R d ()()/()S Q T =-δ环体系环2.3.2 相变过程的熵变(a )可逆相变 相变分可逆相变和不可逆相变。
在相平衡条件下发生的相变为可逆相变。
如一大气压下,100℃的水蒸发为100℃的水蒸气就是可逆相变;0℃的冰融化为0℃的水也是可逆相变。
对于恒温恒压非体积功为零的条件下发生的可逆相变,THT Q S r ∆==∆ (24)(b )等温等压不可逆相变 不在相平衡条件下发生的相变为不可逆相变。
如一大气压下,(-10)℃的冰融化为(-10)℃的水就是不可逆相变。
过冷蒸气的液化、过冷液体的凝固及过热液体的气化等过程,均属于不可逆相变过程.对这一类不可逆过程,利用状态函数法,可以设计一个可逆相变过程来求解。