—碳酸钠的制备与定量分析PPT课件
- 格式:ppt
- 大小:252.50 KB
- 文档页数:15









碳酸钠的含量滴定原理碳酸钠的含量滴定原理是通过滴定法来测定样品中碳酸钠的含量。
滴定法是一种常用的定量分析方法,通常使用一种称为滴定液的溶液与待测样品反应,并用另一种称为指示剂的物质来指示滴定终点的达到。
下面对碳酸钠的含量滴定原理进行详细介绍。
滴定法中重要的步骤之一是选择合适的滴定酸和指示剂。
在测定碳酸钠的含量时,一种常用的滴定酸是盐酸(HCl),而靛蓝指示剂则常常被用来指示滴定终点。
盐酸可以与碳酸钠反应生成氯化钠和二氧化碳,反应方程式如下所示:Na2CO3 + 2HCl →2NaCl + H2O + CO2根据反应方程式可以知道,每个摩尔的碳酸钠消耗2个摩尔的盐酸。
因此,可以通过滴定法来测定样品中碳酸钠的含量。
具体实验操作如下:步骤一:准备样品溶液。
将待测样品溶解在适量的去离子水中,得到已知浓度的碳酸钠溶液。
步骤二:准备滴定液。
将所需量的盐酸溶液用去离子水稀释到适当的浓度,根据滴定液和样品溶液的反应比例来计算盐酸的用量。
步骤三:滴定操作。
将碳酸钠溶液加入滴定瓶中,加入几滴靛蓝指示剂。
然后,用盐酸滴定溶液滴定样品溶液,直到出现由蓝色变为无色的变化。
这个变化表示碳酸钠与盐酸的反应已经完全进行。
步骤四:记录滴定液的用量。
滴定结束后,需要记录滴定液的用量,以用于计算样品溶液中碳酸钠的含量。
步骤五:计算碳酸钠的含量。
根据滴定液的用量和反应的计量关系,可以计算出样品溶液中碳酸钠的含量。
例如,假设滴定液的浓度为0.1 mol/L,用了20 mL 的滴定液,那么样品溶液中碳酸钠的含量可以计算为:0.1 mol/L ×20 mL ×2/1 = 4 mmol。
以上就是碳酸钠的含量滴定原理的详细说明。
通过滴定法可以准确快速地测定样品中碳酸钠的含量,对于许多实验和工业应用非常有用。
但需要注意,滴定法的精确度和准确性很大程度上取决于实验者的经验和技术操作水平,因此在进行滴定实验时需要严格遵循实验操作规范。
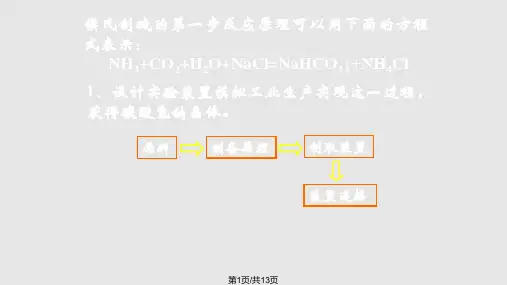
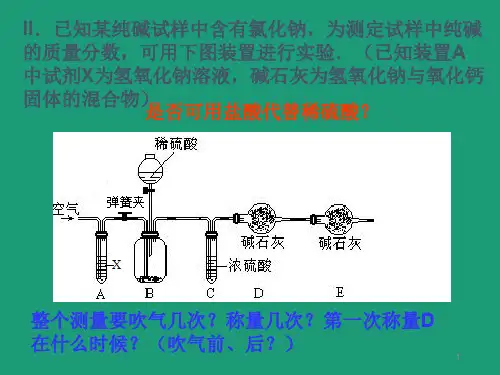
碳酸钠基准物质1. 引言碳酸钠(Na2CO3)是一种无机化合物,常见的化学品之一。
它是碱性的固体,在工业生产中有着广泛的应用。
为了确保质量控制和实验结果的准确性,需要使用基准物质来进行校准和比对。
本文将介绍碳酸钠基准物质的定义、特性、制备方法以及在实验室和工业中的应用。
2. 碳酸钠基准物质的定义碳酸钠基准物质是指具有已知纯度和化学组成,可作为标准参照物来校正和比对其他样品的化学分析方法。
它通常由国家或国际标准组织认可,并通过严格的测试程序进行验证。
3. 碳酸钠基准物质的特性3.1 物理性质•外观:白色结晶固体•密度:2.54 g/cm³•熔点:851 °C•沸点:1600 °C3.2 化学性质碳酸钠是一种强碱,可与酸反应生成盐和水。
它也是一种重要的缓冲剂,在调节溶液pH值时起到稳定作用。
4. 碳酸钠基准物质的制备方法碳酸钠基准物质的制备通常分为以下几个步骤:4.1 原料准备选择高纯度的氢氧化钠(NaOH)和二氧化碳(CO2)为原料。
这些原料通常经过多次反复提纯,以确保最终产品的纯度。
4.2 反应制备将适量的氢氧化钠溶解在水中,生成氢氧化钠溶液。
然后通过通入二氧化碳气体来反应生成碳酸钠。
4.3 结晶与干燥将反应得到的碳酸钠溶液进行结晶,得到固体碳酸钠。
随后对固体进行干燥处理,以去除残留的水分和杂质。
4.4 纯化与包装对干燥后的固体进行粉碎和再结晶,以提高其纯度。
最后将纯化后的碳酸钠基准物质按照规定的包装要求进行包装和封存。
5. 碳酸钠基准物质的应用5.1 实验室应用碳酸钠基准物质在实验室中有广泛的应用,主要用于以下方面: - 校准和比对分析仪器,如pH计、电导仪等。
- 作为标准溶液,用于定量分析和质量控制。
- 作为缓冲剂,在调节溶液pH值时使用。
5.2 工业应用碳酸钠基准物质在工业生产中也起到重要作用,具体应用包括: - 玻璃制造:碳酸钠是玻璃制造过程中的重要原料之一,可调节玻璃的成分和性质。