化学说题
- 格式:ppt
- 大小:1.68 MB
- 文档页数:10


01化学基础知识回顾Chapter原子结构与元素周期表元素周期表原子结构根据原子序数(核电荷数)从小到大排序,将化学元素排列成表格,反映了元素性质的周期性变化。
周期律化学键与分子间作用力化学键原子或离子之间通过共用电子对或电子转移形成的强烈相互作用,包括离子键、共价键和金属键等。
分子间作用力分子之间存在的相互作用力,包括范德华力和氢键等,决定了物质的物理性质。
晶体类型根据构成晶体的微粒和微粒间的作用力不同,晶体可分为离子晶体、分子晶体、原子晶体和金属晶体等。
化学反应基本原理化学反应速率化学平衡酸碱反应氧化还原反应01020304溶液溶解度胶体溶液浓度溶液、胶体及其性质02化学说题比赛题型解析Chapter01仔细阅读题干,明确题目要求。
020304分析选项,运用排除法逐一筛选。
注意题干中的关键词和限定条件,避免陷阱。
对于不确定的选项,要仔细比较和分析,选择最符合题意的答案。
选择题答题技巧与陷阱识别010204填空题答题规范与得分点把握准确理解题意,明确填空要求。
填写答案要简洁、明了,避免冗余。
注意单位、符号的书写规范。
对于多空题,要逐一分析每个空格,确保答案的完整性和准确性。
03计算题解题思路及步骤展示01020304实验操作题注意事项和常见错误分析注意实验器材的使用方法和注意事项。
对于实验数据的处理和分析要准确、客观,避免主观臆断。
熟悉实验原理和操作步骤,明确实验目的。
严格遵守实验安全规范,避免事故发生。
常见错误包括操作不规范、数据记录不准确、实验结论不合理等。
03历年真题演练与解析Chapter历年真题回顾及难度分析提供每道题的详细答案和解析,帮助考生理解解题思路和方法。
针对同类题型进行归纳总结,提炼解题技巧和要点。
挑选历年真题中的经典题型,如推断题、计算题、实验题等,进行深入剖析。
经典题型剖析和答案详解考生易错点汇总及纠正方法汇总考生在历年真题中容易出现的错误点,如概念混淆、计算失误、实验操作不当等。

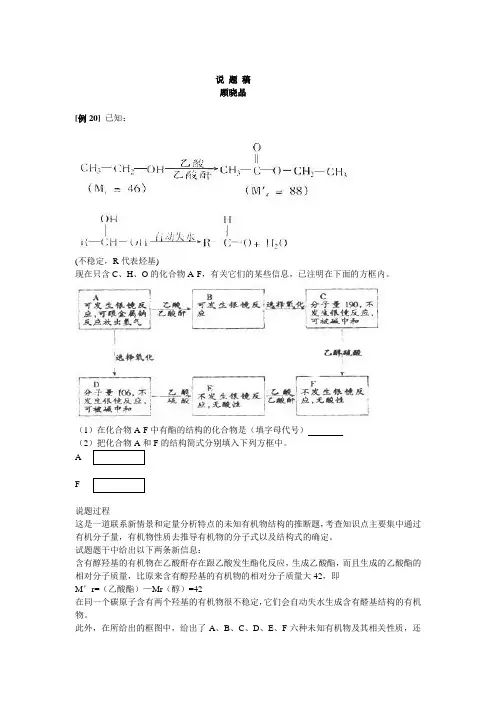
说题稿顾晓晶[例20]已知:(不稳定,R代表烃基)现在只含C、H、O的化合物A-F,有关它们的某些信息,已注明在下面的方框内。
(1)在化合物A-F中有酯的结构的化合物是(填字母代号)(2)把化合物A和F的结构简式分别填入下列方框中。
AF说题过程这是一道联系新情景和定量分析特点的未知有机物结构的推断题,考查知识点主要集中通过有机分子量,有机物性质去推导有机物的分子式以及结构式的确定。
试题题干中给出以下两条新信息:含有醇羟基的有机物在乙酸酐存在跟乙酸发生酯化反应,生成乙酸酯,而且生成的乙酸酯的相对分子质量,比原来含有醇羟基的有机物的相对分子质量大42,即M’r=(乙酸酯)—Mr(醇)=42在同一个碳原子含有两个羟基的有机物很不稳定,它们会自动失水生成含有醛基结构的有机物。
此外,在所给出的框图中,给出了A、B、C、D、E、F六种未知有机物及其相关性质,还给出了这六种有机物间相互联系和转化的反应条件。
要做好这道未知有机物结构的推断,还要从框图中找出以下的解题信息:从有机物A能发生银镜反应,又能跟金属钠反应放出氢气,说明有机物A的分子中既含有醛基,又含有羟基。
②从有机物A经“选择氧化”后生成的新有机物D,不发生银镜反应,可被碱中和,说明“选择氧化”是指有机物分子中的醛基被氧化为羧基的反应,“选择”二字的含意在于同时含有醛基和羟基的有机物只有醛基被氧化,羟基不被氧化。
上述分析,可从B经选择氧化变为C,C又经酯化变成F,可以得到进一步证实。
③含有羟基和羧基双官能团的有机物(本题中的羧基由醛基经“选择氧化”而来),跟乙酸、乙酸酐反应时,是该有机物分子中醇羟基的酯化反应;当有机物跟乙醇、浓硫酸反应时,是该有机物分子中羟基的酯化反应。
(4)含有醛基、羟基的有机物A,经醇羟基酯化转变为B,又经选择氧化醛基变为羧基生成有机物C,再经羧基酯化变为最终有机物F,在有机物F中,不含有羟基、醛基和羧基,它们已全部转变为酯基。
上述分析,可从A→D→E→F可以加以证实。

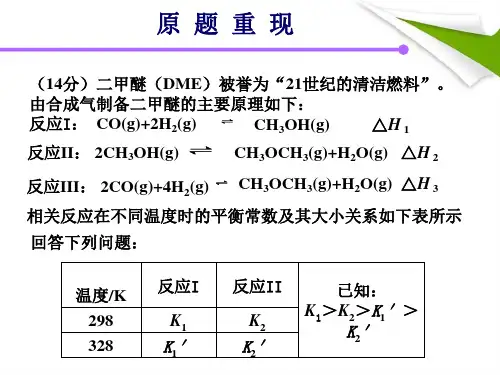
化学科组说题稿原题再现33.(16分)硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2(该反应△H>0)某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。
(1)吸硫装置如图所示。
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是,表明SO2吸收效率低的实验现象是B中溶液。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是、。
(写出两条)(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。
(室温时CaCO3饱和溶液的pH=10.2)限选..试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。
则c(Na2S2O3)=_________mol·L-1。
(只列出算式,不作运算)已知:IO3-+5I-+6H+=== 3I2+3H2O 2S2O32-+I2===S4O62-+2I-说题过程:各位老师,大家晚上好。
我今晚说题的题目是2014年广州一模理综卷的第33题。
一、考点分析这是一道无机化学综合题,考查的知识点主要是无机化学基础知识的应用、化学反应原理、化学实验方案设计和滴定计算。
这种题型以新物质制备为背景,涉及知识面广,综合考查了学生对化学基础知识的掌握,对反应原理的理解,对实验方案的设计,对化学语言的准备把握,还要较强的化学计算能力,属于中等偏难题目。
二、试题讲解与评价――讲解:本题涉及内容篇幅比较大,需要具备较强的信息获取能力才能够顺利解题。

高考真题化学说题高考化学真题题目是中学生备考的一大焦点,其题型包括选择题、填空题、解答题等。
其中,解答题中的“说题”要求考生阐述某一现象或问题的原理、过程、应用等,为考生综合运用所学知识的一个重要考察点。
下面我们就以一道高考真题为例,探讨化学说题的解答技巧。
【高考真题】某地某学校的实验室,用过氧化氢和亚硝酸钠溶液反应制备新鲜的氧气气体。
实验中观察到氧气气体反应管中有深蓝色气泡产生,并且有可燃气体逸出。
求解释氧气气体的产生原理及深蓝色气泡的成因。
解题步骤如下:1. 了解实验反应类型和条件。
根据题目描述,可以确定这是一道氧化还原反应的实验。
其中,过氧化氢是氧化剂,在亚硝酸钠存在下被还原为氧气;亚硝酸钠是还原剂,在过氧化氢存在下被氧化。
2. 分析氧气气体的生成原理。
根据反应类型,过氧化氢在亚硝酸钠溶液中被还原的过程产生氧气气体。
氧气气体生成量与反应物的摩尔比成正比,可以利用化学计量关系计算生成氧气的量。
3. 推导深蓝色气泡的成因。
由于题目描述实验中观察到深蓝色气泡产生,并且有可燃气体逸出,可以判断深蓝色气泡是氧气气体与空气中的某种成分发生反应形成的产物,且反应是可燃气体逸出的充分条件。
4. 总结实验结果及分析。
根据上述步骤的分析,可以得出结论:氧气气体来自过氧化氢和亚硝酸钠反应,深蓝色气泡由氧气与其他成分反应而成,并伴有可燃气体逸出。
为了进一步分析深蓝色气泡的成因,可以进行实验室测试,找出深蓝色气泡的组成成分及反应机制。
通过以上解题步骤,我们对化学真题中的说题类型有了初步了解。
在解答化学真题时,考生应该注重对实验现象的描述、反应过程的分析、物质转化的计量关系等方面的应用,合理运用所学知识,清晰表达观点,把握解题思路,切忌模糊不清或跑题偏离。
希望广大考生在备考过程中充分掌握高考化学说题的解答技巧,取得优异的成绩。



第1篇一、活动背景随着新课程改革的不断深入,高中化学教学面临着前所未有的挑战和机遇。
为了提高化学教学质量,促进教师专业成长,我校化学教研组定期开展教研活动,旨在通过集体备课、教学观摩、课题研究等方式,提升教师的教学水平和教研能力。
本次教研活动以“说题”为主题,旨在通过教师对试题的分析与解读,探讨如何提高学生的化学素养,培养学生的科学思维能力。
二、活动目的1. 提高教师对高考化学试题的理解和把握能力。
2. 分析高考化学试题的特点和趋势,为教师教学提供参考。
3. 促进教师之间的交流与合作,共同探讨提高学生化学素养的有效途径。
4. 培养学生的科学思维能力,提高学生的化学学习成绩。
三、活动内容1. 教师说题:每位教师选取一道具有代表性的高考化学试题,从试题背景、解题思路、考点分析、教学反思等方面进行详细讲解。
2. 小组讨论:针对教师说题的内容,各小组展开讨论,提出自己的观点和建议。
3. 总结与提升:教研组长对本次教研活动进行总结,并对今后的教学工作提出要求。
四、活动过程1. 教师说题(1)教师A:以2019年高考化学试题为例,选取一道选择题,从试题背景、解题思路、考点分析等方面进行讲解。
(2)教师B:选取一道实验探究题,分析试题中的实验设计、数据分析、结论验证等环节,并结合实际教学经验,探讨如何引导学生进行实验探究。
(3)教师C:针对一道计算题,讲解解题步骤、解题技巧,并分析学生在解题过程中容易出现的错误。
2. 小组讨论各小组针对教师说题的内容,展开了热烈的讨论。
教师们从试题的难度、题型、知识点分布等方面进行了分析,并结合自身教学实践,提出了以下建议:(1)注重基础知识的教学,提高学生的基本技能。
(2)加强实验教学,培养学生的实验操作能力和科学思维能力。
(3)关注试题的情境设计,提高学生的应用能力和创新意识。
3. 总结与提升教研组长对本次教研活动进行了总结,并提出了以下要求:(1)教师要深入研究高考化学试题,把握试题特点和趋势。
高中化学说课面试题及答案【面试题】1. 请简述化学键的基本概念及其在化学反应中的作用。
2. 描述一下什么是氧化还原反应,并举例说明。
3. 阐述化学平衡的概念及其在工业生产中的应用。
4. 请解释什么是酸碱中和反应,并解释其在日常生活中的应用。
5. 讨论元素周期表的结构及其对化学元素性质预测的意义。
【答案】1. 化学键是原子之间通过共享、转移或提供电子而形成的相互作用。
它在化学反应中起着至关重要的作用,因为化学反应本质上是化学键的断裂和形成。
化学键的类型包括离子键、共价键和金属键,每种键都有其特定的形成机制和特性。
2. 氧化还原反应是指在化学反应中,原子或离子之间发生电子转移的过程。
在这类反应中,一个物质失去电子(被氧化),而另一个物质获得电子(被还原)。
例如,铁与氧气反应生成铁的氧化物,铁被氧化,氧气被还原。
3. 化学平衡是指在一个可逆反应中,正向反应和逆向反应的速率相等,系统达到动态平衡的状态。
在工业生产中,化学平衡的概念用于优化反应条件,例如温度、压力和浓度,以提高产率和选择性。
4. 酸碱中和反应是指酸和碱在反应中中和对方的性质,生成水和盐。
这种反应在日常生活中有很多应用,如胃酸过多时使用抗酸剂,或在农业中用于调节土壤的pH值。
5. 元素周期表是按照原子序数排列的元素表,它展示了元素的周期性和族性。
周期表的结构有助于预测元素的化学性质,如电子排布、原子半径、电负性等。
通过周期表,我们可以预测元素之间的相似性和差异性,为化学研究和应用提供指导。
结束语:通过上述问题和答案的讨论,我们可以看出化学是一门基础而广泛的学科,它不仅涉及到理论的深入理解,还与实际应用紧密相连。
掌握化学的基本概念和原理,对于理解自然界的现象和解决实际问题具有重要意义。