滴定管的使用和校正练习
- 格式:doc
- 大小:131.00 KB
- 文档页数:4


滴定管的使用及校正练习摘要:在化学仪器使用过程中,容量器皿的容积与其所标出的体积并非完全相符,在使用过程中,也会有各种误差的出现。
本实验对使用的酸式及碱式移液管进行了绝对校正,采用衡量法,用天平称得滴定管放出的纯水的质量,然后根据水的质量和密度,计算出滴定管在标准温度20℃时的实际容积。
关键词:滴定管分析天平绝对校正前言:容量器皿的容积与其所标出的体积并非完全相符。
因此,在准确度要求较高的分析工作中,必须对容量器皿进行校正。
由于玻璃具有热胀冷缩的特性,在不同温度下容量器皿的容积也有所不同。
因此校准玻璃容量器皿是,必须规定一个共用的温度值,这一规定温度值称标准温度,国际上规定玻璃容量器皿的标准温度为20℃,即在校准时都将玻璃容量器皿的容积校准到20℃是的实际容积。
容量器皿常应用两种校准方法:相对校准和绝对校准。
本实验对滴定管的校正就是采用绝对校准法。
1.实验部分1.1仪器设备1)50ml滴定管,酸式、碱式各一支2)称量瓶一只3)普通温度计(公用)4)容量瓶(50ml)一只5)分析天平1.2实验方法1.2.1 滴定管的使用1)清洗酸式滴定管和碱式滴定管各一支;2)用自来水充满酸式滴定管,将其放在滴定管架上静置约2min,观察有无水滴漏下。
然后将旋塞选择180°,再如前检查; 3)用蒸馏水润洗滴定管2—3次; 4)装入蒸馏水; 5)排气泡;6)调节滴定管至10.00刻度线左右,记录初读数; 7)按正确的操作,放出3-5ml 水于准备好的称量瓶中称量;8)继续按以上操作往称量瓶中放水,每3-5ml 称量一次,直至滴定管到40ml 刻度线左右。
1.2.2分析天平的使用1. 将洁净的称量瓶放在分析天平上,清零;2. 待滴定管中放入纯水后,拿出称量瓶,再放至分析天平上称量,记录此次天平读数。
1.2.3 平行测定酸式及碱式滴定管分别重复操作3次,将称量结果记录在表格内。
2.结果与讨论14T =℃时,10.9980.g ml ρ-=2.1 酸式滴定管的校正将三次校正数据记录表中表1 第一次酸式滴定管校正表V 读/ml V 表/ml 水重/g V 计/ml /ml 酸式A10.1213.20 3.08 3.1004 3.11 0.03 16.05 5.93 5.9043 5.92 -0.01 19.00 8.88 8.9012 8.92 0.04 22.00 11.88 11.8994 11.92 0.04 25.01 14.89 14.9122 14.94 0.05 28.00 17.88 17.8925 17.93 0.05 30.9820.8620.859820.900.04表2 第二次酸式滴定管校正表V 读/ml V 表/ml 水重/g V 计/ml V 总校/ml 酸式B10.05 13.00 2.95 2.9644 2.97 0.02 16.00 5.95 5.9284 5.94 -0.01 19.07 9.02 9.0457 9.06 0.04 22.00 11.95 11.9852 12.01 0.06 25.1015.0515.057515.090.0428.00 17.95 17.96218.00 0.05 30.01 19.96 19.959120.00 0.04表3 第三次酸式滴定管校正表V读/ml V表/ml 水重/g V计/ml V总校/ml酸式C 10.0013.00 3.00 3.0086 3.01 0.01 16.01 6.01 5.9857 6.00 -0.01 19.05 9.05 9.08159.10 0.05 22.01 12.01 12.044112.07 0.06 26.01 16.01 16.020616.05 0.04 29.00 19.00 19.016919.06 0.06 32.20 22.20 22.195722.24 0.04 35.02 25.02 25.007125.06 0.04 40.00 30.00 30.000130.06 0.06用matlab做出三组酸式滴定管校正值图像:图1 酸式滴定管校正曲线所以,实际实验中,可用图1对测定值进行校正。


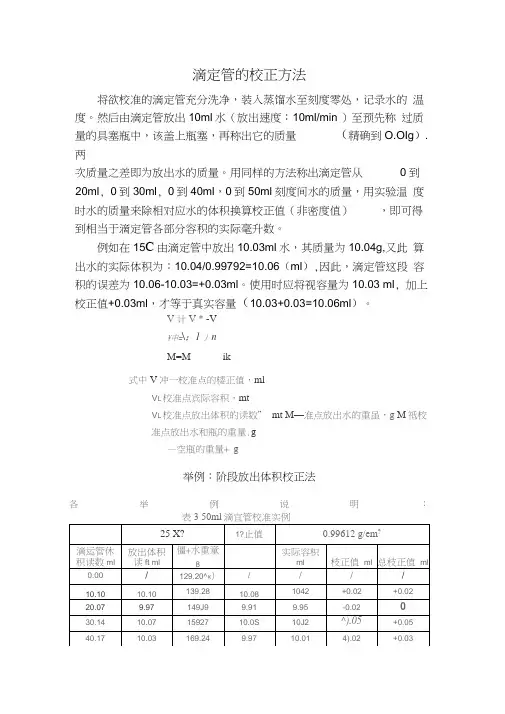
滴定管的校正方法将欲校准的滴定管充分洗净,装入蒸馏水至刻度零处,记录水的温度。
然后由滴定管放出10ml水(放出速度:10ml/min )至预先称过质量的具塞瓶中,该盖上瓶塞,再称出它的质量(精确到O.OIg).两次质量之差即为放出水的质量。
用同样的方法称出滴定管从0到20ml, 0到30ml, 0到40ml,0到50ml刻度间水的质量,用实验温度时水的质量来除相对应水的体积换算校正值(非密度值),即可得到相当于滴定管各部分容积的实际毫升数。
例如在15C由滴定管中放出10.03ml水,其质量为10.04g,又此算出水的实际体积为:10.04/0.99792=10.06(ml),因此,滴定管这段容积的误差为10.06-10.03=+0.03ml。
使用时应将视容量为10.03 ml, 加上校正值+0.03ml,才等于真实容量(10.03+0.03=10.06ml)。
V 计V * -V¥申=\;1丿nM=M ik式中V冲一校准点的楼正值,mlV L校准点宾际容积,mtV L校准点放出体积的读数” mt M—准点放出水的重虽,g M祗校准点放出水和瓶的重量.g—空瓶的重量+ g举例:阶段放出体积校正法各举例说明:25ml 滴定管校正举例(总体积校正法)水温25度校正值 0.99612g/ml滴定管体积 读数ml 放出体积数ml 瓶重+水重g水重g 实际容积ml 总校正值ml0.00 / 50.00 / / 0.00 5.02 5.02 55.00 5.00 5.02 0.00 10.01 10.01 59.98 9.98 10.02 0.01 15.03 15.03 64.96 14.96 15.02 -0.01 20.0420.04 69.95 19.95 20.03 -0.01 25.0025.0074.9424.9425.040.04滴定管校正曲线的绘制滴定管校正曲线120. 05 0、04 0. 03 0. 02 0. 01 0. 00 7 01溶液温度补正值注:1本表数值是以20 C为标准温度以实测法测出。
![[训练]滴定管、容量瓶和移液管的使用与校正](https://uimg.taocdn.com/42df9f685bcfa1c7aa00b52acfc789eb172d9ef8.webp)
实验一滴定管、容量瓶和移液管的使用与校正摘要滴定管、容量瓶和移液管是化学实验常用的仪器,正确的使用与校正滴定管、容量瓶和移液管是做好分析化学实验、减少误差的必经之路,所以学习这些仪器的使用至关重要。
本次实验通过实际操作使我们熟悉这些仪器的操作,并通过水的密度计算对其进行误差矫正,使得我们在今后的试验中能够做到更加精确。
关键词:容量瓶滴定管移液管使用与校正实验目的1、初步掌握滴定管、容量瓶、移液管的使用方法。
2、学习滴定管、容量瓶、移液管的校准方法,并了解容量器皿的校准的意义,并在实验中应用。
实验原理容量器皿的体积与其所标出的体积并非完全相符。
因此,在准确度要求较高的分析工作中,必须对容量器皿进行校正。
由于玻璃具有热胀冷缩的性质,在不同的温度下容量器皿的容积也会有所不同。
因此校准玻璃容量器皿时,必须规定一个共用的温度值,这一规定温度值称标准温度,国际上规定玻璃容量器皿的标准温度为20℃。
即在校准时都将玻璃容量器皿的容积校准到20℃时的实际容积。
实际应用时,只要称出被校准的容量器皿容纳或放出纯水的质量,再除以该温度时水的密度值,便是该容量器皿在20℃时的实际容积实验仪器1、50 ml 滴定管,酸式、碱式各一只。
2、容量瓶(250 ml)一只3、移液管(25 ml)一支4、锥形瓶(50 ml,具有玻璃磨口塞或橡皮塞)一只5、普通温度计(0~50℃或0~100℃,公用)6、橡皮膏或透明胶纸实验步骤1、滴定管的使用和校准:(1)、清晰酸式和碱式滴定管各一只。
(2)、练习并掌握酸式滴定管玻璃塞涂脂的方法和滴定管内气泡消除方法。
(3)、练习并掌握酸式和碱式滴定管的操作以及控制液滴大小和滴定速度的方法。
(4)、练习并掌握滴定管的正确度数方法。
2、校正滴定管一支(必须在基本掌握滴定操作和正确度数方法的基础上进行)。
步骤如下:将具塞的50 ml 锥形瓶洗净,外部擦干,在分析天平上称出其质量,准确至小数点后第二位。
在洗净的滴定管中,装满纯水,调节至0.00刻度,记下度数,按正确的操作,以每分钟不超过10 ml的速度,放出约10 ml 水于已经称量好的锥形瓶中,盖紧盖子,称出“瓶+水”的质量。

实验0 仪器的校准(移液管、滴定管、容量瓶)一、实验目的1、掌握滴定管、移液管、容量瓶的使用方法2、练习滴定管、移液管、容量瓶的校准方法,并了解容量器皿校准的意义二、实验原理滴定管,移液管和容量瓶是滴定分析法所用的主要量器。
容量器皿的容积与其所标出的体积并非完全相符合。
因此,在准确度要求较高的分析工作中,必须对容量器皿进行校准。
由于玻璃具有热胀冷缩的特性,在不同的温度下容量器皿的体积也有所不同。
因此,校准玻璃容量器皿时,必须规定一个共同的温度值,这一规定温度值为标准温度。
国际上规定玻璃容量器皿的标准温度为20℃。
既在校准时都将玻璃容量器皿的容积校准到20℃时的实际容积。
容量器皿常采用两种校准方法。
1、相对校准要求两种容器体积之间有一定的比例关系时,常采用相对校准的方法。
例如,25mL移液管量取液体的体积应等于250mL容量瓶量取体积的10%。
2、绝对校准绝对校准是测定容量器皿的实际容积。
常用的校准方法为衡量法,又叫称量法。
即用天平称得容量器皿容纳或放出纯水的质量,然后根据水的密度,计算出该容量器皿在标准温度20℃时的实际体积。
由质量换算成容积时,需考虑三方面的影响:(1)水的密度随温度的变化(2)温度对玻璃器皿容积胀缩的影响(3)在空气中称量时空气浮力的影响。
为了方便计算,将上述三种因素综合考虑,得到一个总校准值。
经总校准后的纯水密度列于表(空气密度为0.0012g·cm-3,钙钠玻璃体膨胀系数为2.6×10-5℃-1)实际应用时,只要称出被校准的容量器皿容纳和放出纯水的质量,再除以该温度时纯水的密度值,便是该容量器皿在20℃时的实际容积。
实验步骤:1.移液管(单标线吸量管)的校准取一个50ml洗净晾干的具塞锥形瓶,在分析天平上称量至mg位。
用铬酸洗液洗净20ml移液管,吸取纯水(盛在烧杯中)至标线以上几mm,用滤纸片擦干管下端的外壁,将流液口接触烧杯壁,移液管垂直、烧杯倾斜约30˚ 。


如何校准滴定管的刻度滴定管是化学实验中常用的一种量具,用于精确测量和添加溶液的体积。
为了确保滴定管的刻度准确可靠,需要进行校准。
下面将介绍如何校准滴定管的刻度。
滴定管的刻度校准是为了确保其显示的体积与实际添加或取出的体积相符。
刻度校准可以通过以下步骤进行:步骤一:准备工作首先,准备好所需的实验器材,包括滴定管、容量瓶、蒸馏水和定量容器。
确保这些器材是干净的,并避免有任何杂质。
步骤二:标定滴定管容量选择一个已经准确知道容量的容量瓶,如100毫升容量瓶。
使用滴定管准确地向容量瓶中加入一定体积的蒸馏水,例如加入50毫升蒸馏水。
此时,用眼仔细观察滴定管刻度线和蒸馏水界面的位置,记录刻度线所在的液面位置。
步骤三:校准滴定管刻度将滴定管中的蒸馏水排空,并用蒸馏水冲洗干净。
然后,用滴定管取出较大体积的蒸馏水,例如取出80毫升蒸馏水。
每次取出一定体积后,都要仔细观察滴定管刻度线所在的液面位置,并记录下来。
步骤四:比较并计算比较滴定管刻度线与已知容量瓶液面的位置,计算两者之间的差异。
如果滴定管刻度线显示的体积与已知容量瓶液面的体积不一致,可以通过计算得到校准因子。
校准因子等于已知容量除以滴定管显示的体积。
步骤五:校准滴定管刻度校准滴定管的刻度可以通过乘以校准因子来实现。
根据校准因子,将滴定管上每个刻度线的数值进行修正。
修正后的刻度线将更准确地反映出实际体积。
步骤六:验证校准结果校准后的滴定管刻度应该能够准确显示所测量的体积。
可以使用已知体积的溶液进行验证。
取出一定体积的溶液,使用校准后的滴定管进行测量,并与溶液的实际体积进行比较。
如果测量结果与实际体积相符,则说明滴定管的刻度已经校准成功。
在日常实验中,刻度准确的滴定管对于获得可靠的实验结果至关重要。
因此,定期进行滴定管的刻度校准是必要的。
通过以上步骤的操作,可以使滴定管的刻度更加准确,提高实验的精确度和可靠性。
总结起来,校准滴定管刻度的关键步骤包括准备工作、标定滴定管容量、校准滴定管刻度、比较并计算、校准滴定管刻度以及验证校准结果。

滴定管校正操作方法
1. 准备标准溶液:将标准物质称取一定量,溶解于适量的溶剂中,转移至容量瓶中,加溶剂定容,摇匀,得到已知浓度的标准溶液。
2. 计量取样:用容量管或移液管将待测溶液定量移入滴定瓶中,注意取样量应与标准溶液反应当量的相应体积相等。
3. 滴定:取一定量的标准溶液滴定至待测溶液中,记录加入标准溶液的体积。
4. 监测滴定终点:根据滴定反应的特点选择合适的指示剂,根据指示剂的颜色变化监测滴定终点。
5. 处理数据:根据滴定反应的当量关系计算出待测溶液的浓度,并计算出滴定管的误差。
6. 校正滴定管:根据计算结果,确定滴定管的校正系数,进行校正。
校正方法可以有两种:一种是根据已知溶液直接进行校正,另一种是通过加入已知体积的水,测定滴定管实际体积,计算得出校正系数。
7. 重复操作:校正过后,再次进行滴定实验,以检查滴定管是否校准成功。
如若没有,需要重新进行滴定管校正操作。

滴定管校正方法一、前言滴定管是化学实验中常用的量具,用于测量溶液中某种物质的浓度。
但是,由于滴定管本身的制造工艺和使用过程中的磨损等原因,其刻度可能会出现误差。
为了保证实验结果的准确性,需要对滴定管进行校正。
二、校正前准备1. 工具:滴定管、容量瓶、酚酞指示剂、氢氧化钠固体。
2. 材料:纯水、稀盐酸溶液(0.1mol/L)。
3. 实验室环境:温度稳定,无风无震动。
三、校正步骤1. 校正前检查:检查滴定管是否有裂纹或污垢,并清洗干净。
2. 初次称量:将一只干净的容量瓶称重,并记录称重值。
3. 加入水:向容量瓶中加入足够的纯水,使其接近刻度线。
然后使用酚酞指示剂将水溶液调成深粉色。
4. 滴加盐酸溶液:使用已经校准过的滴定管向水溶液中缓慢滴加0.1mol/L的稀盐酸溶液,直到水溶液变为无色。
5. 重复滴定:重复以上步骤3和4,直到连续三次滴定结果相同。
6. 记录数据:记录每次滴定前后容量瓶的质量和每次加入盐酸溶液的体积。
7. 计算结果:根据实验数据计算出滴定管的准确刻度。
四、计算方法1. 计算每次加入盐酸溶液的体积:用最终的盐酸溶液体积减去初始时盐酸溶液体积即可得到每次加入盐酸溶液的体积。
2. 计算平均值:将三次滴定结果相加并除以三即可得到平均值。
3. 计算准确刻度:将平均值除以每次加入盐酸溶液的体积,即可得到滴定管的准确刻度。
五、注意事项1. 滴定管在使用过程中要注意保持干燥和清洁,避免污染或损坏。
2. 滴定管在存放过程中要避免受到阳光直射和高温。
3. 滴定管的校正应该定期进行,以保证实验结果的准确性。
4. 在进行滴定时要注意滴加速度的均匀,避免过快或过慢。
5. 在记录数据时要注意精确度,尽量避免误差。
六、结论通过以上步骤和计算方法,可以得到滴定管的准确刻度,并保证实验结果的准确性。
在实验中,需要严格按照操作步骤进行,并注意实验环境和数据记录的精确性。
滴定管、容量瓶和移液管的使用和校准练习摘要:滴定管、容量瓶和移液管的使用过程中,容量器皿的实际容量与标称容量并不完全一致。
因此,在准确要求较高的分析工作中,必须对容量器皿进行校准。
本次实验学习和掌握滴定管的使用以及校准方法,并了解容量器皿校准的意义。
容量器皿常用两种校准方法:相对校准和绝对校准。
本次实验将采用绝对校准方法。
关键词:热胀冷缩;标准温度;相对校准;绝对校准引言:容量器皿的实际容量随着使用的次数和时间长短将发生一定的变化。
因此,对容量器皿的校准是非常重要的。
由于玻璃具有热胀冷缩的特性,在不同温度下容量器皿的容积也有所不同。
因此校准玻璃容量器皿时,必须规定一个公用的温度计,这一规定温度值称标准温度,国际上规定玻璃容量器皿的标准温度为20℃。
即在校准时都将玻璃器皿的容积校准到20℃时的实际容积。
1 实验方法1.1 仪器与试剂50ml滴定管,酸式、碱式各1支;容量瓶(250ml)1只;移液管(25ml)1支;锥形瓶(50ml,具有玻璃磨口塞或橡皮塞)1只;普通温度计(0~50℃或0~100℃,公用);橡皮膏或透明胶纸;分析天平。
蒸馏水。
1.2 实验步骤(1)清洗酸式和碱式滴定管各1支。
(2)练习并掌握酸式滴定管的玻璃涂脂的方法和滴定管内气泡的消除方法。
(3)练习并初步掌握酸式滴定管和碱式滴定管的滴定操作以及控制液滴大小和滴定速度的方法。
(4)练习并掌握滴定管的正确读数方法。
(5)校准滴定管1支(必须在基本掌握滴定操作和正确读数的基础上进行),平行进行3次校准。
2 结果与讨论2.1 不同温度下纯水的密度水的密度随着温度的改变而改变,水最大相对密度时的温度:3.98℃。
不同温度下纯水的密度值见表一。
表一不同温度下纯水的密度值摘录于:中华人民共和国计量器具检定规程《基本玻璃量器》,国家计量局,19802.2 酸式滴定管的玻璃涂脂和操作活塞活塞、活塞槽用滤纸擦干;滴定管(包括活塞槽部分)平放在桌上操作;凡士林量合适:在活塞的两头涂以少量,或在孔的两边沿圆周涂一薄层(不涂孔);活塞插入活塞槽后向同一方向转动,直到全部透明;凡士林涂好后,套上橡皮筋或橡皮圈。
滴定管的使用方法及注意事项滴定管是化学实验室常用的一种量液器具,主要用于溶液的滴定和加液。
正确的使用滴定管可以保证实验结果的准确性,同时也可以确保实验安全。
下面就滴定管的使用方法及注意事项进行详细介绍。
一、滴定管的使用方法。
1. 滴定管的选择。
在进行滴定实验时,要根据所需的滴定液量选择合适的滴定管,一般选择1ml、5ml、10ml等规格的滴定管。
同时,要检查滴定管的刻度是否清晰,是否有损坏,以确保准确读取液体体积。
2. 滴定管的清洗。
在使用滴定管之前,必须进行清洗和干燥。
清洗时,首先用清水冲洗,然后用洗涤剂清洗,最后用蒸馏水冲洗干净,放置晾干。
3. 滴定管的校准。
在使用滴定管之前,需要进行校准,以确保其准确度。
校准方法一般为用蒸馏水或标准溶液充满滴定管,然后读取刻度,校正误差。
4. 滴定管的使用。
在进行滴定实验时,首先将滴定管放置于垂直位置,然后用手指捏住滴定管的橡胶头,将吸管插入容器中的溶液中,松开手指,使溶液进入滴定管。
当溶液接近所需滴定体积时,要小心调节滴定管的倾斜角度,以控制滴液速度,避免滴液过快或过慢。
5. 滴定管的排液。
在滴定结束后,要小心将滴定管放置于容器中,轻轻挤压橡胶头,使滴定管中的溶液排出,避免滴定管内残留溶液对下次实验产生影响。
二、滴定管的注意事项。
1. 注意安全。
在使用滴定管时,要注意安全,避免溶液溅出或滴液到皮肤上,造成伤害。
在操作时要佩戴实验手套,并注意实验台面的清洁,避免溶液外溢。
2. 注意准确度。
在使用滴定管进行滴定实验时,要注意准确读取滴定管的刻度,控制滴液速度,确保实验结果的准确性。
3. 注意保存。
使用完滴定管后,要进行清洗和干燥,并妥善保存,避免受潮或受损,影响下次使用。
4. 注意校准。
定期对滴定管进行校准,确保其准确度,避免因滴定管误差影响实验结果。
5. 注意使用范围。
滴定管主要用于溶液的滴定和加液,不宜用于其他用途,避免污染或损坏。
通过以上介绍,相信大家对滴定管的使用方法及注意事项有了更清晰的认识。
滴定管的使用及校正练习摘要:在化学仪器使用过程中,容量器皿的容积与其所标出的体积并非完全相符,在使用过程中,也会有各种误差的出现。
本实验对使用的酸式及碱式移液管进行了绝对校正,采用衡量法,用天平称得滴定管放出的纯水的质量,然后根据水的质量和密度,计算出滴定管在标准温度20℃时的实际容积。
关键词:滴定管分析天平绝对校正前言:容量器皿的容积与其所标出的体积并非完全相符。
因此,在准确度要求较高的分析工作中,必须对容量器皿进行校正。
由于玻璃具有热胀冷缩的特性,在不同温度下容量器皿的容积也有所不同。
因此校准玻璃容量器皿是,必须规定一个共用的温度值,这一规定温度值称标准温度,国际上规定玻璃容量器皿的标准温度为20℃,即在校准时都将玻璃容量器皿的容积校准到20℃是的实际容积。
容量器皿常应用两种校准方法:相对校准和绝对校准。
本实验对滴定管的校正就是采用绝对校准法。
1.实验部分1.1仪器设备1)50ml滴定管,酸式、碱式各一支2)称量瓶一只3)普通温度计(公用)4)容量瓶(50ml)一只5)分析天平1.2实验方法1.2.1 滴定管的使用1)清洗酸式滴定管和碱式滴定管各一支;2)用自来水充满酸式滴定管,将其放在滴定管架上静置约2min,观察有无水滴漏下。
然后将旋塞选择180°,再如前检查; 3)用蒸馏水润洗滴定管2—3次; 4)装入蒸馏水; 5)排气泡;6)调节滴定管至10.00刻度线左右,记录初读数; 7)按正确的操作,放出3-5ml 水于准备好的称量瓶中称量;8)继续按以上操作往称量瓶中放水,每3-5ml 称量一次,直至滴定管到40ml 刻度线左右。
1.2.2分析天平的使用1. 将洁净的称量瓶放在分析天平上,清零;2. 待滴定管中放入纯水后,拿出称量瓶,再放至分析天平上称量,记录此次天平读数。
1.2.3 平行测定酸式及碱式滴定管分别重复操作3次,将称量结果记录在表格内。
2.结果与讨论14T =℃时,10.9980.g ml ρ-=2.1 酸式滴定管的校正将三次校正数据记录表中表1 第一次酸式滴定管校正表V 读/ml V 表/ml 水重/g V 计/ml /ml 酸式A10.1213.20 3.08 3.1004 3.11 0.03 16.05 5.93 5.9043 5.92 -0.01 19.00 8.88 8.9012 8.92 0.04 22.00 11.88 11.8994 11.92 0.04 25.01 14.89 14.9122 14.94 0.05 28.00 17.88 17.8925 17.93 0.05 30.9820.8620.859820.900.04表2 第二次酸式滴定管校正表V 读/ml V 表/ml 水重/g V 计/ml V 总校/ml 酸式B10.05 13.00 2.95 2.9644 2.97 0.02 16.00 5.95 5.9284 5.94 -0.01 19.07 9.02 9.0457 9.06 0.04 22.00 11.95 11.9852 12.01 0.06 25.1015.0515.057515.090.0428.00 17.95 17.96218.00 0.05 30.01 19.96 19.959120.00 0.04表3 第三次酸式滴定管校正表V读/ml V表/ml 水重/g V计/ml V总校/ml酸式C 10.0013.00 3.00 3.0086 3.01 0.01 16.01 6.01 5.9857 6.00 -0.01 19.05 9.05 9.08159.10 0.05 22.01 12.01 12.044112.07 0.06 26.01 16.01 16.020616.05 0.04 29.00 19.00 19.016919.06 0.06 32.20 22.20 22.195722.24 0.04 35.02 25.02 25.007125.06 0.04 40.00 30.00 30.000130.06 0.06用matlab做出三组酸式滴定管校正值图像:图1 酸式滴定管校正曲线所以,实际实验中,可用图1对测定值进行校正。
滴定管校正方法
滴定管的校正方法
将欲校准的滴定管充分洗净,装入蒸馏水至刻度零处,记录水的温度。
然后由滴定管放出10ml 水(放出速度:10ml/min)至预先称过质量的具塞瓶中,该盖上瓶塞,再称出它的质量(精确到0.01g).两次质量之差即为放出水的质量。
用同样的方法称出滴定管从0到20ml,0到30ml,0到40ml ,0到50ml刻度间水的质量,用实验温度时水的质量来除相对应水的体积换算校正值(非密度值),即可得到相当于滴定管各部分容积的实际毫升数。
例如在15℃由滴定管中放出10.03ml水,其质量为10.04g,又此算出水的实际体积为:10.04/0.99792=10.06(ml),因此,滴定管这段容积的误差为10.06-10.03=+0.03ml。
使用时应将视容量为10.03 ml,加上校正值+0.03ml,才等于真实容量(10.03+0.03=10.06ml)。
举例:阶段放出体积校正法
25ml滴定管校正举例(总体积校正法)
滴定管校正曲线的绘制
溶液温度补正值
注:
1 本表数值是以20℃为标准温度以实测法测出。
2 表中带有+”、“-”号的数值是以20℃为分界。
室温低于20℃的补正值均为“+”,高于20℃的补正值均为“-”。
3 本表的用法:如1L硫酸溶液〔c(1/2H2SO4)=1mol/L〕由25℃换算为20℃时,其体积修正值为-1.5mL,故40.00mL换算为20℃时的体积为V20=40.00-1.5/1000×40.00=39.94mL。
滴定管校准的步骤嘿,咱今天就来讲讲滴定管校准那些事儿哈!你可别小瞧这滴定管校准,就像咱走路得先迈对脚一样重要呢!先来说说准备工作,这就好比要出门得先找好钥匙一样。
咱得把滴定管洗得干干净净的,一点杂质都不能有,不然那可就像眼睛里进了沙子,怎么都别扭。
然后呢,找个水平的地儿把它放好,这要是歪了可不行,就像桌子腿不一样长,那能稳当嘛!接下来就是注水啦!把水慢慢地灌进去,可别着急,就像给小娃娃喂饭似的,得慢慢来。
灌到刻度线附近的时候,更得小心了,得看准了,不能多也不能少。
这时候你就想想,要是做菜盐放多了或者放少了,那味道能好嘛!注好水了,开始调零点。
把液面调到刻度线那里,要调得稳稳当当的,这可是关键的一步呢。
然后把滴定管固定好,可不能让它乱动。
再然后就是称重啦!称一称这水有多重,这就像给东西称体重一样。
称好了记下来,这可不能记错了,不然前面的功夫不就白费啦!接着再注水,再称重,反复这么几次。
每次都得认真对待,不能马虎。
这就好像走路,一步一步都得走踏实了,不然就容易摔跟头。
校准的过程中还得注意观察,看看有没有漏水啊,刻度准不准啊。
要是有问题,那可得赶紧解决,不能拖着。
这就像身体不舒服,得赶紧去看医生,不能等病严重了才重视。
哎呀呀,你说这滴定管校准是不是挺有意思的?虽然有点麻烦,但这都是为了保证实验结果的准确呀!你想想,如果滴定管都不准,那得出的结果能靠谱嘛!所以啊,咱可不能嫌麻烦,得认真做好每一步。
到最后,当你看到校准好的滴定管,就像看到自己精心培育的花儿开了一样,那心里别提多高兴啦!这就是滴定管校准的步骤,咱可得记住咯,以后做实验就靠它啦!。
滴定管的使用和校正练习应用化学2009级刘延指导老师吴明君摘要:本文介绍了滴定管的常用校正方法,说明了玻璃仪器在使用过程中产生误差的原因。
并对50mL的酸式和碱式滴定管进行校正,得出了两只滴定管的校正曲线。
关键词:校正,酸式滴定管,碱式滴定管,误差The Burette’s corrective and exerciseLIU Yan Apply Chemistry,Grade 2009Directed by WU Ming-junAbstract:This essay introduced burettes the commonly corrective method,showed the glassware has error's reason and in the use process acidicand the basic burets correcte bereette to 50mL carries on the adjustment,And Has obtained the calibration curve which two buret.综述:容量器皿的容积与其所标出的体积并非完全相符。
因此,在准确要求较高的分析的工作中,必须对容量器皿进行校准。
由于玻璃仪器具有热胀冷缩的特性,在不同温度下容量器皿的容积也有所不同,所以在校准容量器皿时必须在一个共同的温度下进行。
容量器皿常用两种校准方法:相对校准和绝对校准。
相对校准时要求对两种容器之间的容积有一定的比例关系时常采用的方法;绝对校准是测定容量器皿的实际容积,常用称量法。
1 实验部分1.1仪器和试剂:50mL滴定管,酸式、碱式各一支;锥形瓶(50mL,具有玻璃磨口)一只;温度计一支;蒸馏水;分析天平,凡士林。
1.2试验方法:1.2.1 酸式滴定管的校正首先把滴定管洗净,检查是否漏液,如果漏液则把滴定管的活塞取出,用吸水纸把活塞和插活塞的孔的水吸干,再在活塞上均匀的涂抹上少量凡士林,切记活塞上有孔的几个面不能涂抹,否则会将孔堵住。
滴定管的使用和校正练习
应用化学2009级刘延
指导老师吴明君
摘要:本文介绍了滴定管的常用校正方法,说明了玻璃仪器在使用过程中产生误差的原因。
并对50mL的酸式和碱式滴定管进行校正,得出了两只滴定管的校正曲线。
关键词:校正,酸式滴定管,碱式滴定管,误差
The Burette’s corrective and exercise
LIU Yan Apply Chemistry,Grade 2009
Directed by WU Ming-jun
Abstract:This essay introduced burettes the commonly corrective method,showed the glassware has error's reason and in the use process acidicand the basic burets correcte bereette to 50mL carries on the adjustment,And Has obtained the calibration curve which two buret.
综述:
容量器皿的容积与其所标出的体积并非完全相符。
因此,在准确要求较高的分析的工作中,必须对容量器皿进行校准。
由于玻璃仪器具有热胀冷缩的特性,在不同温度下容量器皿的容积也有所不同,所以在校准容量器皿时必须在一个共同的温度下进行。
容量器皿常用两种校准方法:相对校准和绝对校准。
相对校准时要求对两种容器之间的容积有一定的比例关系时常采用的方法;绝对校准是测定容量器皿的实际容积,常用称量法。
1 实验部分
1.1仪器和试剂:
50mL滴定管,酸式、碱式各一支;锥形瓶(50mL,具有玻璃磨口)一只;温度计一支;蒸馏水;分析天平,凡士林。
1.2试验方法:
1.2.1 酸式滴定管的校正首先把滴定管洗净,检查是否漏液,如果漏液则把滴定管的活塞取出,用吸水纸把活塞和插活塞的孔的水吸干,再在活塞上均匀的涂抹上少量凡士林,切记活塞上有孔的几个面不能涂抹,否则会将孔堵住。
当活塞旋转灵活无噪音即可。
不再漏液后装入蒸馏水,再排气,并使液面位于零刻度线处。
记录实验温度,把锥形瓶洗干净,并把瓶外壁的水分擦干,用分析天平称量后记下空瓶的质量(保留3为小数)。
依次将滴定管内的水放进锥形瓶,用分析天平称量其质量,精确到小数点后三位并记录。
分别将几次的数据记录并分析。
将上述实验重复做3次,并取平均值。
1.2.2碱式滴定管的校正先洗净滴定管,检查是否漏液,如果漏液,更换乳胶管和其中的玻璃球。
其余操作与酸式滴定管相同。
2 结果与讨论:
2.1酸式滴定管的校正将三次的数据归纳统计记入下表,用滴定管的读数减去上一次的滴定管的读数,算出读出总体积。
用分析天平的读数减去上一次的读数,得到总水的体积。
实验温度为17.2°C,查表得此温度下水的密度为0.9976g.cm-1[1]。
利用V=m/ρ算出水的实际体积。
再用实际容量值减去读出总容积,得到总校准值。
如表1‐1,表1‐2,表1‐3。
表1‐1式滴定管第一次校正数据
初读数/mL 读出体
积/mL
瓶+水质
量g
实际水
质量g
实际体
积/mL 校正值总校正值
0.00 0.00 53.286
8.00 8.00 61.193 7.91 7.93 -0.07 -0.07
15.00 7.00 68.198 7.01 7.02 0.02 -0.05 22.80 7.80 75.981 7.78 7.80 0.00 -0.05
26.45 3.65 79.609 3.63 3.64 -0.01 -0.06
27.23 0.78 80.428 0.82 0.82 0.04 -0.02
28.71 1.48 81.935 1.51 1.51 0.03 0.01
表1‐2式滴定管第二次校正数据
初读数/mL 读出体
积/mL
瓶+水质
量g
实际水
质量g
实际体
积/mL 校正值总校正值
0.00 53.589
16.20 16.20 69.485 15.90 15.93 -0.27 -0.27
21.45 5.25 73.989 4.50 4.51 -0.74 -1.00
22.99 1.54 76.481 2.49 2.50 0.96 -0.04 24.23 1.24 77.838 1.36 1.36 0.12 0.08
26.20 1.97 79.677 1.84 1.84 -0.13 -0.05
27.88 1.68 81.389 1.71 1.72 0.04 -0.01 29.71 1.83 83.273 1.88 1.89 0.06 0.05 31.80 2.09 85.325 2.05 2.06 -0.03 0.01
表1‐3式滴定管第三次校正数据
初读数/mL 读出体
积/mL
瓶+水质
量g
实际水
质量g
实际体
积/mL 校正值总校正值
0.00 53.497
13.50 13.50 66.882 13.39 13.42 -0.08 -0.08 20.30 6.80 73.667 6.79 6.80 0.00 -0.08
22.21 1.91 75.616 1.95 1.95 0.04 -0.04
23.84 1.63 77.235 1.62 1.62 -0.01 -0.05 25.50 1.66 78.875 1.64 1.64 -0.02 -0.07 27.23 1.73 80.740 1.86 1.87 0.14 0.07 29.38 2.15 82.799 2.06 2.06 -0.09 -0.02 31.39 2.01 84.829 2.03 2.03 0.02 0.00
将上表中数据绘制在图1-1中
图1-1
由图中得出酸式滴定管滴定时会出现0.06mL±的绝对误差,在20~30mL时误差的变化值较大。
在用此酸性滴定管时,可利用图1-1进行读数的修正。
2.2碱式滴定管的校正酸式滴定管的计算,将碱式滴定管的校准数据归纳得出:
表2‐1式滴定管第一次校正数据
初读数/mL 读出体
积/mL
瓶+水质
量g
实际水
质量g
实际体
积/mL 校正值总校正值
0.00 53.543
19.70 19.70 73.144 19.60 19.65 -0.05 -0.05 21.63 1.93 75.099 1.96 1.96 0.03 -0.02
23.42 1.79 76.898 1.80 1.80 0.01 -0.01
24.35 0.93 77.804 0.91 0.91 -0.02 -0.03
25.83 1.48 79.293 1.49 1.49 0.01 -0.02
26.90 1.07 80.315 1.02 1.02 -0.05 -0.06 28.01 1.11 81.459 1.14 1.15 0.04 -0.03 30.10 2.09 83.503 2.04 2.05 -0.04 -0.07
表2‐2 滴定管第二次校正数据
初读数/mL 读出体
积/mL
瓶+水质
量g
实际水
质量g
实际体
积/mL 校正值总校正值
0.00 53.532
8.85 8.85 61.354 7.82 7.84 -1.01 -1.01 15.50 6.65 68.967 7.61 7.63 0.98 -0.03 21.52 6.02 74.956 5.99 6.00 -0.02 -0.04
23.33 1.81 76.772 1.82 1.82 0.01 -0.03
24.82 1.49 78.267 1.49 1.50 0.01 -0.03 26.80 1.98 80.186 1.92 1.92 -0.06 -0.08 29.90 3.10 83.291 3.10 3.11 0.01 -0.07 37.03 7.13 90.394 7.10 7.12 -0.01 -0.08 43.60 6.57 96.932 6.54 6.55 -0.02 -0.10
将上表中数据绘制在图2-1中
图2-1
由图中得出碱式滴定管滴定时会出现0.06mL±的绝对误差,在20~30mL时误差的变化值较大。
在用此碱式滴定管时,可利用图2-1进行读数的修正。
结论:
通过本次实验了解到玻璃量器在量体积时会产生误差,以及校正玻璃仪器的一般方法。
了解了酸式滴定管以及碱式滴定管的校正过程,并画出了滴定管校正曲线。
文献:[1] 四川大学化工学院. 分析化学实验(第三版)[M]. 北京:高等教育出版社,2003:70
致谢:
感谢吴明君老师对本次实验的精心指导。
吴老师细心的教我们涂凡士林和使用滴定管,让我知道了对实验仪器的爱惜,对化学实验需要严谨的态度。
在此为吴老师献上诚挚的谢意。