二芳基或杂环磺酰胺类新型有丝分裂阻滞剂研究进展
- 格式:pdf
- 大小:317.37 KB
- 文档页数:5

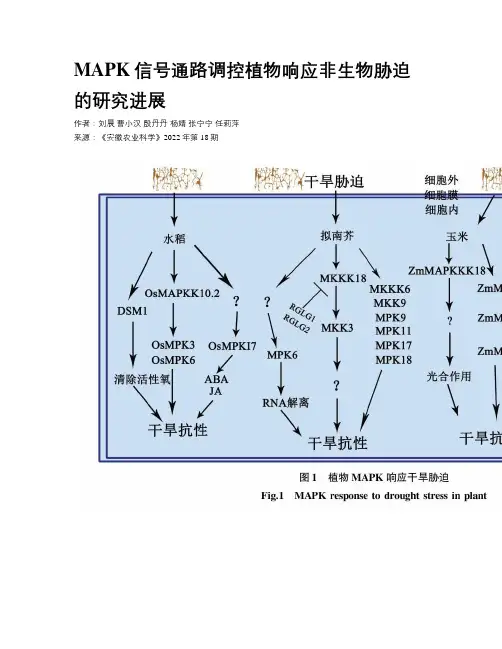
MAPK信号通路调控植物响应非生物胁迫的研究进展作者:刘晨曹小汉殷丹丹杨婧张宁宁任莉萍来源:《安徽农业科学》2022年第18期摘要丝裂原活化蛋白激酶(MAPK)级联信号通路是真核生物中广泛存在的信号转导途径。
非生物胁迫是植物面临的首要挑战,随着极端气候的频发和环境污染问题的加剧,开展植物MAPK级联信号通路在非生物胁迫下的机理研究迫在眉睫。
对近年模式植物拟南芥,主要农作物水稻、玉米和小麦等,以及重要园艺作物中MAPK信号通路响应干旱、盐胁迫、极端温度及营养匮乏等方面的研究进行了总结归纳,并对其进一步的研究工作进行了展望。
结果表明,MAPK作用于植物响应非生物胁迫信号转导,并在植物抗逆过程中扮演重要角色。
研究MAPK作用机制将对阐明植物抗逆分子网络,培育抗性品种和提高作物产量等方面具有重要意义。
关键词植物;非生物胁迫;MAPK;信号通路中图分类号 Q945.78 文献标识码 A 文章编号 0517-6611(2022)18-0009-08doi:10.3969/j.issn.0517-6611.2022.18.003开放科学(资源服务)标识码(OSID):Research Progress of MAPK Signaling Pathway in Regulating Plants Response to Abiotic Stress LIU Chen1, CAO Xiao-han2, YIN Dan-dan2 et al(1.Nanjing Institute of Agricultural Sciences, Nanjing, Jiangsu 210046; 2. Biology and Food Engineering School, Fuyang Normal University, Fuyang, Anhui 236037)Abstract Mitogen-activated protein kinase (MAPK) cascade signaling pathway is a widespread signal transduction pathway in eukaryotes. Abiotic stress is the primary challenge of plants. With the frequent occurrence of extreme climate and the aggravation of environmental pollution, it is extremely urgent to study the mechanism of MAPK cascade signaling pathway in plants under abiotic stress. In this paper, the response of MAPK signaling pathway to drought, salt stress, extreme temperature and nutrient deficiency in model plant arabidopsis, major crops (rice, maize and wheat) and important horticultural crops in recent years were summarized. The future researches of MAPK signaling pathway were prospected. The results show that MAPK signal transduction plays an important role in plant response and resistance to abiotic stress. The studies of the mechanism of MAPK will be of great significance to elucidate the molecular network of plant stress resistance, cultivate resistant varieties and improve crop yield.Key words Plants;Abiotic stress;MAPK;Signaling pathway相對于动物而言,植物在整个生命过程中通常都是无法移动的[1]。

鹿茸多肽通过SDF-1α/CXCR4轴调控PI3K/AKT信号通路促进下肢动脉硬化性闭塞症大鼠血管新生的作用机制丁爱国1,王雁彬2,李廷荃2,李子娟3,王继尧3,曹佳颖3摘要目的:探索鹿茸多肽通过基质细胞衍生因子(SDF-1α)/趋化因子受体(CXCR4)轴对磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B (AKT)通路促进下肢动脉硬化性闭塞症(PAD)大鼠血管新生的作用机制㊂方法:采用结扎并离断大鼠股动脉及分支造成肢体缺血㊁给予高脂饲料喂养制作大鼠下肢动脉硬化闭塞症模型㊂将100只雄性Sprague Dawley(SD)大鼠随机分为10组,分别为空白组㊁模型组㊁假手术组,鹿茸多肽低剂量组㊁鹿茸多中剂量肽组㊁鹿茸多肽高剂量组㊁抑制剂LY294002组㊁鹿茸多肽低剂量+抑制剂LY294002组㊁鹿茸多肽中剂量+抑制剂LY294002组㊁鹿茸多肽高剂量+抑制剂LY294002组㊂将空白组㊁模型组及假手术组灌胃等容量蒸馏水㊂鹿茸多肽低㊁中㊁高剂量组+抑制剂LY294002组先行腹腔注射再灌胃,于造模完第1天开始给药,每日1次,28d后处死㊂采用流式细胞术检测给药后外周血㊁骨髓中造血干细胞(CD34+细胞)比例;免疫荧光法检测给药后患侧腓肠肌SDF-1α㊁PI3K的阳性细胞数比例㊂结果:造血干细胞(CD34+细胞)比例模型组均显著高于空白组(P<0.05);其中鹿茸多肽低剂量组较鹿茸多肽低剂量+抑制剂LY294002组阳性细胞比例升高,鹿茸多肽中剂量组较鹿茸多肽中剂量+抑制剂LY294002组阳性细胞比例升高,鹿茸多肽高剂量组较鹿茸多肽高剂量+抑制剂LY294002组阳性细胞比例升高(P<0.05);给药组SDF-1α㊁PI3K的阳性细胞数高于模型组及抑制组(P<0.05),鹿茸多肽中剂量组高于鹿茸多肽低剂量组(P<0.05),鹿茸多肽高剂量组高于鹿茸多肽高剂量组+ LY294002组(P<0.05)㊂结论:鹿茸多肽通过SDF-1α/CXCR4轴影响PI3K/AKT信号通路促进了内皮祖细胞的增殖及分化㊁PAD血管新生㊂关键词下肢动脉硬化性闭塞症;鹿茸多肽;内皮祖细胞;血管新生;实验研究d o i:10.12102/j.i s s n.1672-1349.2024.08.012The Mechanism of Antler Polypeptide Regulating PI3K/AKT Signaling Pathway through SDF-1α/CXCR4Axis Promotes Angiogenesis on Rats with Lower Extremity Arteriosclerotic ObliteransDING Aiguo,WANG Yanbin,LI Tingquan,LI Zijuan,WANG Jiyao,CAO JiayingShuozhou People's Hospital,Shuozhou036000,Shanxi,ChinaCorresponding Author WANG Yanbin,E-mail:****************Abstract Objective:To explore the effect of antler polypeptides on phosphatidylinoinosidine-3-kinase(PI3K)/protein kinase B(AKT) pathway through stromal cell derived factor(SDF-1α)/receptor(CXCR4)axis,and to promote angiogenesis on rats with lower limb arteriosclerotic obliterans(PAD).Methods:The rats model with lower extremity arteriosclerosis obliterans were established by ligation and severing of femoral artery and branches to construct limb ischemia and feeding with high fat diet.One hundred male SD rats were randomly divided into blank group,model group and sham operation group;antler polypeptide low dose group,medium dose antler polypeptide medium dose group,antler polypeptide high dose group,inhibitor LY294002group,LY294002+antler polypeptide low dose group,LY294002+antler polypeptide medium dose group,LY294002+antler polypeptide high dose group.The blank group,model group and sham group were gavaged equal volume of distilled water.LY294002+antler polypeptide low dose group,LY294002+antler polypeptide medium dose group,LY294002+antler polypeptide high dose group were first injected intraperitoneally and then gavaged with intragastric administration,once a day after modeling,and rats,were executed after28days.Flow cytometry was used to detect the proportion of hematopoietic stem cells(CD34+cells)in peripheral blood and bone marrow after administration.The proportion of SDF-1αand PI3K positive cells in gastrocnemius muscle was detected by immunofluorescence assay.Results:The proportion of hematopoietic stem cells(CD34+cells)in model group was higher than that in blank group(P<0.05).The proportion of positive cells in antler polypeptide low dose group was higher than that in LY294002+antler polypeptide low dose group,the proportion of positive cells in antler polypeptide medium dose group was higher than that in LY294002+antler polypeptide medium dose group,and the proportion of positive cells in antler polypeptide high dose group was higher than that in LY294002+antler polypeptide high dose group(P<0.05). The proportion of positive cell number of SDF-1αand PI3K in administration group was significantly higher than that in model group and inhibition group(P<0.05),the antler polypeptide medium dose group was higher than that in LY294002+antler polypeptide medium dose group group,and the antler polypeptide medium dose group was higher than that in antler polypeptide low dose group group(P<0.05),antler polypeptide high dose group was higher than LY294002+antler polypeptide high dose group(P<0.05). Conclusion:Antler polypeptide affected the PI3K/AKT signaling pathway through SDF-1α/receptor(CXCR4)axis thereby promoting the proliferation and differentiation of endothelial progenitor cells,and facilitating the angiogenesis of PAD.Keywords arteriosclerotic obliterans of lower extremity;antler polypeptide;endothelial progenitor cells;angiogenesis;experimental study基金项目国家自然科学基金委员会资助项目(No.81874474);山西省自然基金项目(No.20210302124563);国家中医药管理局中医药领军人才培养项目岐黄学者支持项目作者单位 1.朔州市人民医院(山西朔州036000);2.山西中医药大学附属医院(太原030024);3.山西中医药大学通讯作者王雁彬,E-mail:****************引用信息丁爱国,王雁彬,李廷荃,等.鹿茸多肽通过SDF-1α/CXCR4轴调控PI3K/AKT信号通路促进下肢动脉硬化性闭塞症大鼠血管新生的作用机制[J].中西医结合心脑血管病杂志,2024,22(8):1423-1428.下肢动脉硬化性闭塞症(peripheral artery disease in the lower extremity,PAD)是我国老年人的常见病㊁多发病[1]㊂研究表明,有症状的PAD是全身血管系统硬化的重要标志,在早期以肢体发凉㊁怕冷及间歇性跛行为主[2-3],发展到后期常出现肢体末端坏疽而面临截肢,其病理特点往往表现为动脉粥样硬化导致的动脉狭窄㊁闭塞㊁局部缺血,所以该病治疗集中在缺血部位的血管再通和血管新生方面[4]㊂鹿茸能够补肾㊁填精㊁益髓,其核心成分是鹿茸多肽,探究鹿茸多肽调控内皮祖细胞(EPCs)动员㊁归巢及促进PAD缺血区血管新生的机制意义重大㊂本课题组前期动物实验已经证实,鹿茸能够改善内皮细胞,通过磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)信号通路调控EPCs的动员及归巢,促进PAD大鼠的血管新生[5-7]㊂鹿茸主要成分是鹿茸多肽,鹿茸多肽对成纤维细胞及表皮细胞有显著促进增殖作用,可以加速疮面的愈合,促进其血管内皮细胞增殖分化及迁移[8],对EPCs的特征和鹿茸多肽信号传导途径的充分理解更有利于研究PAD的分子生物学机制㊂本研究旨在分析鹿茸多肽通过基质细胞衍生因子(SDF-1α)/趋化因子受体4(CXCR4)轴对PI3K/AKT通路的影响,探讨促进PAD大鼠血管新生的作用机制㊂1材料与方法1.1实验材料1.1.1实验动物100只2月龄雄性Sprague Dawley(SD)大鼠,清洁级,体质量250~300g,由山西省中医药研究院提供,实验动物合格证号:1103221911003889[9]㊂1.1.2饲料制备高脂饲料:80.3%基础饲料+15%猪油+0.5%淡黄色胆酸钠+0.2%丙硫氧嘧啶+4%胆固醇㊂1.1.3药物与试剂鹿茸多肽采用马鹿茸多肽,鹿茸多肽冻干粉购于陕西斯诺特生物科技技术有限公司,储存于室温,鹿茸多肽冻干粉溶于去离子水,配置为浓度4.5mg/mL的溶液,置于EP管中,储存在2~6ħ冰箱中[9];PI3K 抑制剂LY294002采购于美国辉瑞公司,用非质子溶剂二甲基亚砜(DMSO)配置母液(10mg PI3K抑制剂溶于6.5075mL二甲基亚砜中)在-20ħ冰箱保存,每日所配置的当日所需工作液由10%母液+40% PEG300+5%Tween-80+45%生理盐水组成,即用即配[9];维生素针剂D3购于哈尔滨摩天农科兽药有限公司;造血干细胞CD34抗体及同型对照抗体购于BD公司;SDF-1α㊁PI3K购于英国Abcam公司㊂1.1.4仪器德国EPPENDORF移液器;电子天平购于瑞士METTER公司;中国中衫金桥有限公司微量加样吸头;法国Froilabo烘箱;日本OLYMPUS显微镜;脱水机㊁包埋机及冻台购于武汉俊杰电子公司;病理切片机购于上海徕卡科技公司;烤箱㊁微波炉及冰箱购于美的电器制造有限责任公司;流式细胞仪购于美国贝克曼库尔特公司;恒温水浴箱购于江苏太仓医用仪器厂;高速搅拌器为德国Fluko公司㊂1.2实验方法1.2.1分组按随机数字表法将100只大鼠分为10组:空白组㊁模型组㊁假手术组㊁给药组(包括鹿茸多肽低剂量组㊁鹿茸多肽中剂量组㊁鹿茸多肽高剂量组㊁鹿茸多肽低剂量+抑制剂LY294002组㊁鹿茸多肽中剂量+抑制剂LY294002组㊁鹿茸多肽高剂量+抑制剂LY294002组)㊁抑制剂LY294002组,每组10只㊂1.2.2PAD模型制作将SD雄性大鼠,腹腔麻醉(5%水合氯醛溶液7mL/kg),取平卧位,固定于手术台中央,左腹股沟区域碘消毒,纵向切口约1.5cm,暴露血管鞘,分离其股动脉及其分支,齿镊钳夹约30s,结扎并离断左侧股动脉的分支;用0号线缝合皮肤及皮下组织,在SD大鼠背部皮下注射生理盐水10mL补液抗休克治疗,观察大鼠各项生命体征,平稳后放回鼠笼;肌肉注射30ˑ104U 青霉素3d,预防感染;饲料为高脂饲料并且喂养12周[8-9];给予维生素D3(30ˑ104U/kg),右下肢肌肉注射,每月1次[10]㊂1.2.3给药方法鹿茸多肽低㊁中㊁高剂量组分别灌胃给药0.143 g/(kg㊃d)㊁0.286g/(kg㊃d)㊁0.572g/(kg㊃d)㊂抑制剂LY294002组腹腔注射LY2940021mg/(kg㊃d);空白组㊁模型组和假手术组灌胃等容量蒸馏水;鹿茸多肽低中㊁高剂量+抑制剂LY294002组先进行腹腔注射然后再灌胃;在造模后的第1天给药,连续28d,每日1次,28d后处死大鼠[9]㊂1.2.4采集标本及处理方法将大鼠麻醉,用小镊子摘去其中一只眼球,收集外周血到微量离心管(EP)管中;取大鼠结扎及分离后术侧的下肢股骨,用注射器抽吸磷酸缓冲盐溶液(PBS)反复冲洗下肢股骨骨髓腔,过滤㊁离心及吹打后制成密度均匀的骨髓悬液,收集到EP管中,温度调至-70ħ冻存[9]㊂1.2.5检测指标1.2.5.1 一般状态观察SD 大鼠的一般状态,包括大鼠的精神状态和毛色,大鼠的皮温和活动灵敏度等㊂1.2.5.2 大鼠血脂水平分别于手术后第6周㊁12周时测量与记录空白组和给药组大鼠体质量,用乙醇棉球擦拭固定好的大鼠尾部,将尾静脉血抽取作为标本,用生化分析仪检测空白组和给药组低密度脂蛋白(LDL )㊁总胆固醇(TC )㊁三酰甘油(TG )水平[9]㊂1.2.5.3 采用流式细胞术检测外周血㊁骨髓中CD 34+细胞比例将每只大鼠各设置5个测定管,2个单染管及同型对照管,另加1个三染测定管,在抗凝管中加入红细胞裂解液5mL ,放入37ħ恒温水温箱中,避光孵育10min ,1500r/min 离心5min ,弃上清,在抗凝管中加红细胞裂解液5mL ,再次放入37ħ恒温水温箱中避光孵育10min ,1500r/min 离心5min ,弃上清后加PBS 350μL ,将每个样品分装到5个1.5mL 的离心管中,每管给予50μL ,按CD 34检测㊁CD 34对照及三色检测顺序标明各管,将各管中加入所对应的抗体,放入4ħ恒温水温避光孵育20~25min ,各管加1mL PBS 缓冲液洗涤1次,再以1500r/min 离心5min ,弃上清液,加入PBS 缓冲液定容至500μL ,样本按CD 34检测㊁CD 34对照㊁三色检测移至流式管中备用,最后将样品重悬,按CD 34检测㊁CD 34对照㊁三色检测顺序上机检测,软件分析各管双阳性细胞所占比例[12]㊂1.2.5.4 免疫荧光技术检测下肢腓肠肌中SDF -1α㊁PI3K 的阳性细胞数将样本涂片后用多聚甲醛固定10min ;PBS 溶液微振荡洗涤5min ˑ2次,加0.4%裂解缓解液T riton -X100破膜5~10min ,然后用PBS 微振荡洗涤3min ˑ3次;再用1%PBS 溶液封闭30min 至1h ;给予0.5%PBS 溶液稀释一抗,比例为1ʒ100;4ħ过夜;冰箱取出后需37ħ复温45min ;或在室温下2~3h ;或37ħ1h ,用0.5%PBS 溶液稀释二抗,比例为1ʒ400;室温30min 至1h ;孵育后洗涤5min ˑ3次;荧光染料DAPI 原液为1g/mL ,将其稀释为1ʒ1000浓度,快速染色10s ,再用蒸馏水冲洗和用防淬灭的封片剂封片,在荧光显微镜高倍视野下观察[9]㊂1.3 统计学处理应用SPSS 25.0软件进行统计分析,定量资料符合正态分布且方差齐时用独立样本t 检验,以均数ʃ标准差(x ʃs )表示;不符合正态分布时用秩和检验,方差不齐时用校正t 检验㊂以P <0.05为差异有统计学意义㊂2 结 果2.1 大鼠一般状态空白组和假手术组大鼠毛色光泽,活动灵敏,下肢温度正常;模型组和给药组大鼠毛色暗淡,活动欠灵敏,下肢温度降低㊂2.2 空白组与给药组大鼠血脂水平变化空白组的LDL ㊁TC ㊁TG 在实验第6周与第12周比较,差异均无统计学意义(P >0.05)㊂给药组各时期TC 及LDL 与空白组比较,差异有统计学意义,LDL第12周较第6周上升(P <0.05)㊂详见表1㊂表1 空白组与给药组TG ㊁TC ㊁LDL 水平比较(x ʃs )单位:mmol/L组别只数 LDL 第6周第12周TC 第6周第12周TG 第6周第12周空白组100.21ʃ0.050.23ʃ0.030.65ʃ0.061.95ʃ0.230.62ʃ0.030.65ʃ0.06给药组100.46ʃ0.03①0.91ʃ0.02①②1.55ʃ0.20①2.86ʃ0.35①1.84ʃ0.053.26ʃ0.54①注:与空白组同期比较,①P <0.01;与同组第6周比较,②P <0.05㊂2.3 流式细胞术检测给药后外周血和骨髓中CD 34+细胞比例与空白组比较,模型组外周血和骨髓中CD 34+阳性细胞比例升高;与鹿茸多肽低剂量+抑制剂LY294002组比较,鹿茸多肽低剂量组㊁鹿茸多肽中剂量组㊁鹿茸多肽中剂量+抑制剂LY294002组㊁鹿茸多肽高剂量组㊁鹿茸多肽高剂量+LY294002组外周血和骨髓中CD 34+阳性细胞比例升高;鹿茸多肽中剂量组较鹿茸多肽中剂量+抑制剂LY294002组外周血和骨髓中CD 34+阳性细胞比例升高;鹿茸多肽高剂量组㊁鹿茸多肽高剂量+抑制剂LY294002组较鹿茸多肽中剂量+LY294002组外周血和骨髓中CD 34+阳性细胞比例升高;鹿茸多肽高剂量组较鹿茸多肽高剂量+抑制剂LY294002组外周血和骨髓中CD 34+阳性细胞比例升高;与模型组比较,假手术组㊁给药组外周血和骨髓中CD 34+阳性细胞比例升高㊂详见表2㊂表2各组大鼠外周血和骨髓中CD34+阳性细胞比例比较(xʃs)组别只数外周血骨髓空白组10 1.93ʃ0.470.97ʃ0.24假手术组10 1.97ʃ0.24⑤0.98ʃ0.13⑤模型组10 2.87ʃ0.06① 1.57ʃ0.06①鹿茸多肽低剂量+抑制剂LY294002组10 3.70ʃ0.12①⑤ 1.64ʃ0.15①⑤鹿茸多肽低剂量组10 4.17ʃ0.19①②⑤ 2.21ʃ0.15①②⑤鹿茸多肽中剂量+抑制剂LY294002组10 4.77ʃ0.03①②⑤ 2.97ʃ0.04①②⑤鹿茸多肽中剂量组10 5.17ʃ0.21①②③⑤ 3.17ʃ0.18①②③⑤鹿茸多肽高剂量+抑制剂LY294002组10 6.39ʃ0.17①②③⑤ 3.55ʃ0.13①②③⑤鹿茸多肽高剂量组107.63ʃ0.27①②③④⑤7.92ʃ0.36①②③④⑤抑制剂LY294002组10 2.54ʃ0.24① 1.25ʃ0.15①注:与空白组比较,①P<0.05;与鹿茸多肽低剂量+抑制剂LY294002组比较,②P<0.05;与鹿茸多肽中剂量+抑制剂LY294002组比较,③P<0.05;与鹿茸多肽高剂量+抑制剂LY294002组比较,④P<0.05;与模型组比较,⑤P<0.05㊂2.4免疫荧光法检测给药后腓肠肌中SDF-1α㊁PI3K 阳性细胞数与抑制剂LY294002组比较,模型组及给药组抑制剂LY294002组SDF-1α㊁PI3K阳性细胞数增加(P< 0.05);与模型组比较,给药组㊁模型组SDF-1α㊁PI3K阳性细胞数增加(P<0.05);与鹿茸多肽低剂量组比较,鹿茸多肽中剂量组㊁鹿茸多肽中剂量+抑制剂LY294002组㊁鹿茸多肽高剂量组㊁鹿茸多肽高剂量+抑制剂LY294002组较鹿茸多肽低剂量组阳SDF-1α㊁PI3K阳性细胞数增加(P<0.05)㊂详见表3及图1㊁图2㊂表3各组大鼠腓肠肌中SDF-1α㊁PI3K阳性细胞数比较(xʃs)组别只数SDF-1αPI3K空白组10 1.36ʃ1.02 3.21ʃ2.51假手术组109.11ʃ0.0610.03ʃ0.11抑制剂LY294002组1025.15ʃ2.0617.52ʃ1.36模型组1027.22ʃ3.17①17.46ʃ2.02①鹿茸多肽低剂量组1038.03ʃ1.24①②32.92ʃ2.36①②鹿茸多肽低剂量+抑制剂LY294002组1027.55ʃ2.13①②53.21ʃ3.45①②鹿茸多肽中剂量组1049.17ʃ2.21①②③41.10ʃ2.16①②③鹿茸多肽中剂量+抑制剂LY294002组1042.72ʃ2.03①②③37.91ʃ3.24①②③鹿茸多肽高剂量组1053.21ʃ3.45①②③62.86ʃ3.19①②③鹿茸多肽高剂量+抑制剂LY294002组1049.30ʃ2.05①②③54.78ʃ2.12①②③注:与抑制剂LY294002组比较,①P<0.05;与模型组比较,②P<0.05;与鹿茸多肽低剂量组比较,③P<0.05㊂图1免疫荧光法检测各组腓肠肌中SDF-1α阳性细胞数图2免疫荧光法检测各组腓肠肌中PI3K阳性细胞数3讨论PAD的病理特点往往表现为动脉狭窄㊁闭塞㊁局部缺血,所以该病治疗集中在缺血部位的血管再通和血管新生方面[9]㊂外科手术和介入难以从根本上解决术后再狭窄和术后血管远期通畅率㊂有文献报道,在膝上股-腘动脉人工血管移植后3年的通畅率为60%~ 80%,膝下3年通畅率仅20%~30%,并且外科治疗在基层医疗机构推广应用困难[10]㊂血管新生的研究为临床治疗PAD提供了新的思路,是指通过药物促进缺血组织在原有微血管基础上形成新毛细血管与原有血管网相交汇,通过加速和增加侧支动脉发育来治疗血管狭窄㊁阻塞引起的缺血[11]㊂EPCs源于骨髓,具有调控缺血区定向归巢的作用,成熟的内皮细胞与血管新生有密切关系,直接参与血管新生㊂中药干预在治疗PAD方面有极大潜力㊂鹿茸能够补肾㊁填精㊁益髓,其核心成分是鹿茸多肽,探究鹿茸多肽调控EPCs 动员㊁归巢及促进PAD缺血区血管新生的机制意义重大㊂PAD病本在肾,病位在脉,补肾是关键㊂中医学将PAD归为 脉痹 阴疽 脱疽 范畴,其病本在肾,病位在脉㊂本病的发生多与肾虚血瘀有关㊂人到老年,随着年龄的增长,肾精渐亏,肾阳渐衰,导致气血亏虚,运行无力,脉络不通,筋脉痹阻,肢体缺乏血液的濡养,故出现发凉㊁麻木㊁间歇性跛行等㊂‘景岳全书“: 血即精之属也 ,精髓是化生血液的基本物质㊂清代王士雄‘温热经纬“曰: 人体血生于脾,藏于肝,脉源于肾而主于心 ,也就是说其资始于肾,即脉形成的物质基础是肾精,所以脉络生成受到 肾 的调控㊂鹿茸补肾生髓,鹿茸中含有大量的氨基酸㊁蛋白质㊁糖类化合物㊁多肽,其中鹿茸多肽为其主要成分[12]㊂鹿茸多肽含有许多细胞生长因子和内生的抗氧化酶,如血管内皮生长因子(VEGF)㊁谷胱甘肽过氧化物酶(GPX)和过氧化氢酶(CAT)等多种在疾病治疗中起主要作用的生物活性成分[13-15]㊂SDF-1α/CXCR4轴在EPCs归巢到缺血组织过程中起着重要作用㊂基质细胞衍生因子-1α(stromal cell derived factor-1,SDF-1α),属于CXC型趋化因子,参与缺血诱导的EPCs动员及介导EPCs在缺血组织中趋化和归巢[16]㊂CXCR4作为SDF-1α的唯一受体,是一种具有7个跨膜结构域的G蛋白偶联受体[17],研究证明,缺血组织SDF-1α表达增强,进而导致外周血SDF-1α水平升高,组织缺血同时诱导骨髓SDF-1α表达下调,骨髓对EPCs的滞留作用减弱,外周血对EPCs 的趋化作用增强,从而导致骨髓源性EPCs动员到外周血,参与缺血组织新生血管的形成[18]㊂PI3K/AKT信号转导通路处于SDF-1α/CXCR4轴的下游,调控EPCs的迁移及归巢,抑制受体CXCR4可显著降低SDF-1α诱导的骨髓EPCs归巢到下肢缺血区域的数量[19-20]㊂鹿茸多肽促进外周血及骨髓EPCs缺血区血管新生㊂本实验通过SDF-1α/CXCR4轴调控PI3K/AKT信号通路促进EPCs的动员及归巢,促进血管新生㊂因此,本实验检测CD34+阳性细胞比例㊁SDF-1α㊁PI3K的阳性细胞数,结果显示CD34+细胞比例模型组高于空白组(P<0.05);其中鹿茸多肽低剂量组较鹿茸多肽低剂量+抑制剂LY294002组阳性细胞数升高,鹿茸多肽中剂量组较鹿茸多肽中剂量+抑制剂LY294002组阳性细胞数升高,鹿茸多肽高剂量组较鹿茸多肽高剂量+抑制剂LY294002组阳性细胞数升高(P<0.05);给药组SDF-1α㊁PI3K的阳性细胞数数高于模型组及抑制剂组(P<0.05),鹿茸多肽中剂量组高于鹿茸多肽低剂量组(P<0.05),表明大鼠下肢动脉硬化闭塞缺血激活了SDF-1α/CXCR4轴从而调控PI3K/AKT信号通路,在鹿茸多肽干预下促进了EPCs的增殖及分化,影响下肢动脉硬化闭塞症大鼠,促进PAD大鼠血管新生[9]㊂综上所述,鹿茸多肽可以促进PAD大鼠血管新生,通过SDF-1α/CXCR4轴调控PI3K/AKT信号通路促进了EPCs的增殖及分化,鹿茸多肽提高外周血及骨髓CD34+细胞比例,给药后提高腓肠肌中SDF-1α㊁PI3K阳性细胞数比例㊂参考文献:[1]徐义岩,王海洋.下肢动脉硬化闭塞症的治疗进展[J].医学论述,2020,26(24):4892-4895.[2]TICKNER A,KLINGHARD C,ARNOLD J F,et al.Total contact castuse in patients with peripheral arterial disease:a case series andsystematic review[J].Wounds,2018,30(2):49-56.[3]GIANNOPOULOS G,ANGELIDIS C,VOGIATZI G,et al.Antioxidant treatment in peripheral artery disease:the rationale isthere,but what about clinical results?[J].Curr Opin Pharmacol,2018,39:53-59.[4]LEE S C,JOH J H,CHANG J H,et al.Hybrid treatment ofmultilevel revascularization in patients with peripheral arterialdisease--a multi-centre study in Korea[J].Vasa,2018,47(3):235-241.[5]王雁彬,化金凤,张晓园,等.鹿茸对大鼠下肢缺血模型CD34+㊁FLK-1+阳性细胞比例影响[J].辽宁中医药大学学报,2015,17(1):24-26.[6]化金凤,索炜,李廷荃.鹿茸对大鼠缺血下肢骨骼肌毛细血管密度的影响[J].中西医结合心脑血管病杂志,2014,12(1):80-81. [7]化金凤,索伟,李廷荃.鹿茸对大鼠下肢缺血模型VEGF表达的影响[J].辽宁中医药大学学报,2014,16(2):34-36.[8]李琳,叶彤,陈文凤,等.鹿茸多肽功能的研究进展[J].吉林医药学院学报,2020,41(1):54-56.[9]李子娟,李廷荃,王雁彬,等.鹿茸通过PI3K/AKT信号通路促进下肢动脉硬化性闭塞症大鼠血管新生的作用机理[J].时珍国医国药,2021,32(9):2061-2066.[10]MINGOLI A,SAPIENZA P,FELDHAUS R J,et parison offemorofemoral and aortofemoral bypass for aortoiliac occlusivedisease[J].J Cardiovasc Surg(Torino),2001,42(3):381-387. [11]MANUNEEDHI CHOLAN P,CARTLAND S P,KAVURMA M M.NADPH oxidases,angiogenesis,and peripheral artery disease[J].Antioxidants(Basel),2017,6(3):E56.[12]GILBEY A,PEREZGONZALEZ J D.Health benefits of deer andelk velvet antler supplements:a systematic review of randomisedcontrolled studies[J].N Z Med J.2012,125(1367):80-86. [13]CHENG S L,JIAN Y L,CHEN C M,et al.Relationships betweenantioxidants and quality characteristics from velvet antlers offormosan sambar deer[J].Korean J Food Sci Anim Resour,2017,37(4):542-551.[14]PITA-THOMAS W,NIETO-SAMPEDRO M,MAZA R M,et al.Factors promoting neurite outgrowth during Deer antlerregeneration[J].J Neurosci Res,2010,88(14):3034-3047. [15]XIAO X,XU S,LI L,et al.The effect of velvet antler proteins oncardiac microvascular endothelial cells challenged with ischemia-hypoxia[J].Front Pharmacol,2017,8:601.[16]DE FALCO E,PORCELLI D,TORELLA A R,et al.SDF-1involvement in endothelial phenotype and ischemia-inducedrecruitment of bone marrow progenitor cells[J].Blood,2004,104(12):3472-3482.[17]T ARASOV A N I,RICE W G,MICHEJDA C J.Inhibition of G-protein-coupled receptor function by disruption of transmembrane domaininteractions[J].J Biol Chem,1999,274(49):34911-34915. [18]WALTER D H,HAENDELER J,REINHOLD J,et al.ImpairedCXCR4signaling contributes to the reduced neovascularizationcapacity of endothelial progenitor cells from patients withcoronary artery disease[J].Circ Res,2005,97(11):1142-1151. [19]CHA V AKIS E,CARMONA G,URBICH C,et al.Phosphatidylinositol-3-kinase-gamma is integral to homing functions of progenitor cells[J].Circ Res.2008,102(8):942-949.[20]ZHENG H,FU G,DAI T,et al.Migration of endothelial progenitorcells mediated by stromal cell-derived factor-1αlpha/CXCR4viaPI3K/Akt/eNOS signal transduction pathway[J].J CardiovascPharmacol,2007,50(3):274-280.(收稿日期:2023-11-27)(本文编辑王雅洁)。

2-芳基苯并噻唑的合成研究进展摘要:2-芳基苯并噻唑是一类非常重要的杂环化合物,是构建药物分子、天然产物、功能材料和很多生物活性分子的骨架。
由于这些良好的特性,2-取代的苯并噻唑类化合物在医药方面有着很广泛的应用,它在抗菌、抗肿瘤、抗过敏、抗惊厥、消炎、保护神经系统和免疫调节等方面都有较好的活性。
关键词:2-芳基苯并噻唑;合成;研究一、2-芳基苯并噻唑的的重要性2-芳基苯并噻唑是一类非常重要的杂环化合物,是构建药物分子、天然产物、功能材料和很多生物活性分子的骨架[1] 例如,唑泊习他(zopolrestat1)是一种抑制醛糖还原酶的药物,能够治疗糖尿病[2];2-(4-氨基苯基)苯并噻唑及其衍生物(如5F203(2)和PMX610(3))是一类高效且具有良好选择性的抗肿瘤试剂,对人类乳腺癌、卵巢癌和结肠癌有毫微摩尔级的抑制活性;席夫碱(4)可用作类淀粉蛋白抑制剂,用于治疗老年痴呆症(图1)。
图1含取代基团的苯并噻唑类药物苯并噻唑类化合物在农用化学品中也表现出除草、抗菌和杀毒等方面的活性。
除草剂Benazoline是人工合成的具有生物活性的苯并噻唑衍生物。
另外,苯并噻唑类化合物在工程材料领域中也有着广泛应用,被用作塑料染色剂、橡胶硫化促进剂以及荧光探针材料等。
例如,荧光素存在于萤火虫中,在其体内经酶氧化导致生物发光;2-巯基苯并噻唑作为自由基转移试剂,在聚丁二烯和聚异戊二烯的硫化反应中起催化作用。
二、2-芳基苯并噻唑的合成研究进展1.以邻氨基芳基硫酚为原料合成2-芳基苯并噻唑最常用的方法是以邻氨基芳基硫酚为原料,和羧酸、醛、腈类、β-二酮或苄胺等缩合,该类反应经过了中间体邻酰氨基苯硫酚。
当使用芳基羧酸和邻氨基芳基硫酚反应时,一般需要在强酸或者高温条件下才能够得到较高产率的2-芳基苯并噻唑。
邻氨基苯硫酚和芳香醛也能够缩合得到2-芳基苯并噻唑,该方法一般需要Lewis酸或者强氧化剂。
除此之外,能够提供苯甲酰基的化合物都能与邻氨基苯硫酚反应生成2-芳基苯并噻唑。

写给非农化专业同事的除草剂药害知识现用现查前言任何作物都不能完全抗除草剂的药害,只能忍耐一定剂量的除草剂。
发生除草剂药害的可能原因包括:1、雾滴挥发和漂移:高挥发性除草剂如短侧链苯氧羧酸类(2,4-D);二硝基苯胺类(氟乐灵);硫代氨基甲酸酯类(禾草丹);苯甲酸类(百草敌);广灭灵等﹤100um的雾滴极易挥发和漂移。
敌稗与2,4-d、有机磷、氨基甲酸酯、及硫代氨基甲酸酯农药混用,会严重抑制导致敌稗分解的芳基酰胺酶活性。
4、药械性能不良或作业不标准5、误用6、除草剂降解产生有毒物质:在通气不良的嫌气性土壤中,过量使用杀草丹形成脱氯杀草丹造成水稻矮化7、异常不良的环境条件8、作物品种:荠菜型油菜对草除灵高度敏感。
除草剂作用标靶、机理一览表一般来说,前面带个精字表明原来的药剂是一种混合体(不同手性异构体?),通过某种途径把其中有活性的部分提取出来之后就可以在前面冠以“精”字。
当然“高效”也行意思大体差不多。
综合起来实际就三类:干扰光合作用;破坏激素平衡;干扰细胞分裂;除草剂药害补救——只是万不得已的选择除草剂选择性的原理选择性除草剂之所以能除草和之所以会产生药害,原因根本是一个:必须弄清该品种的选择性是基于何种原理的,有是什么样的因素导致该选择原理的失效。
通常来说,除草剂的选择原理包括以下的4个方面。
㈠植物形态解剖上的差异植物外部形态和内部结构的不同,导致药剂附着量或吸收量的不同,从而产生选择性。
以茎叶处理剂为例,单子叶植物或杂草由于叶片直立狭窄,生长点包裹在叶鞘里,叶表面角质层和蜡质层较厚,药剂易滚落,因此吸收剂量少,不易被除草剂杀死。
双子叶植物生长点裸露,叶片平伸、面积大,叶表面角质层和蜡质较薄,因此着药量多,易被除草剂杀死。
另外,有些植物表皮气孔较少,叶毛较多,药剂不易附着,因而安全。
㈡植物萌发时间上的差异利用杂草与苗木发芽、出土时间的差异杀草。
在播种前或出苗前,选择五氯酚钠等残效期短、药效迅速的除草剂进行茎叶处理或土壤处理,杀死已萌发的杂草。

Aza-Diels-Alder反应合成四氢喹啉的研究进展黄洁琼;吕志锋【摘要】四氢喹啉类化合物具有广泛的生物活性,并且也是一类重要的染料中间体。
综述了近几年由N-芳基亚胺与亲双烯体经aza-Diels-Alder反应合成四氢喹啉的反应,以及由羰基化合物、胺和烯醇醚“一锅法”合成四氢喹啉的进展。
分析比较了路易斯酸催化、阳离子自由基催化、其他酸催化合成等不同合成方法的优缺点。
由羰基化合物、胺和烯醇醚“一锅法”构建四氢喹啉骨架更加简便,具有广阔的发展前景。
%Tetrahydroquinoline derivatives have a wide range of biological activities, and are also a kind of important dye intermediates. The reactions for the synthesis of tetrahydroquinoline derivatives by aza-Diels-Alder reactions between N-arylimines and dienophiles were reviewed. New developments in the “one-pot” synthesis of tetrahydroquinoline derivatives from the carbonyl compounds, amines, and enol ethers were also reviewed. Different synthetic methods, including Lewis acid catalysis, cation radical catalysis, and other acid catalysis were compared and discussed. Forming tetrahydroquinoline skeletons by “one-pot” synthesis from the carbonyl compounds, amines, and enol ethers is easier, and has broad prospects for development.【期刊名称】《广州化工》【年(卷),期】2015(000)021【总页数】5页(P5-9)【关键词】四氢喹啉;aza-Diels-Alder反应;环加成反应【作者】黄洁琼;吕志锋【作者单位】苏州大学药学院,江苏苏州 215123;江苏省建筑科学研究院有限公司,江苏南京 210008【正文语种】中文【中图分类】O625.6四氢喹啉和四氢异喹啉广泛存在于自然界,有很广泛的生物活性。

磺酰脲类除草剂是一类作用独特的除草剂,该种除草剂的开发和使用量仅次于氨基酸类除草剂,第一个磺酰脲类除草剂氯磺隆是1978年由美国杜邦公司研制成功[1],经过40年的发展,对其结构改造与修饰后开发出了一系列新品种。
我国具有自主知识产权的高效磺酰脲类除草剂是南开大学研发的单嘧磺隆和湖南化工研究院开发的甲硫嘧磺隆[2],可用于防治各种阔叶杂草和禾本科杂草,是一类高效低毒、高选择性和环境友好的除草剂[3]。
近几年由于其他除草剂突出的环境问题,磺酰脲类除草剂迅速发展,每年以2%~3%的增长率在发展[4-5],近20年来年销售额来达30.1亿美元,占全球除草剂销售额的5.9%。
随后,磺酰脲类除草剂安全剂应运而生,为磺酰脲类除草剂的开发研究注入了新的活力,它是一类具有独特性质的化学物质,又被称为解毒剂或保护剂[6-7]。
为此,笔者根据多年从事农药的研究工作经验,对磺酰脲类除草剂的应用状况、理化性质、合成方法、药剂特性、作用机理、降解方式、残留检测方法以及在实际运用中存在的问题等进行了阐述,秉承以“生态为根、农艺为本、生物农药和化学农药防控为辅”的植保新理念,为今后开发高效、低毒、低残留和对环境友好的磺酰脲类除草剂提供参考,最后对磺酰脲类除草剂的研发方向提出了指导性建议。
01磺酰脲类除草剂应用状况1.1 磺酰脲类除草剂的应用现状当前,在所有类型的除草剂中,磺酰脲类除草剂是全世界使用量最大的一类除草剂,磺酰脲类除草剂发展迅猛,2010—2017年,年增长率为13.5%,市场销量仅次于氨基酸类除草剂,2007年酰胺类除草剂的销售金额高达20多亿美元,占全球市场的11%,每年以2%的增长速度在发展,在全世界农药市场上占有重要地位[8-9]。
其中,美国是使用磺酰脲类除草剂数量和种类最多的国家,其次是中国、欧洲国家和日本[5]。
我国是磺酰脲类除草剂的使用大国,截至2017年,先后有53个磺酰脲类除草剂有效成分获得登记,登记单剂单位达620家,混剂登记单位达685家,登记产品最多的有效成分是苯磺隆。

第一章测试1【单选题】(5分)基本药物来源占比最高的是A.半合成药物B.植物药C.合成药物D.抗生素2【单选题】(5分)药物作用靶点与蛋白无关的是A.离子通道B.酶C.核酸D.受体3【单选题】(5分)药物的生物活性包括A.分子式B.分子量C.治疗作用及毒副作用D.化学结构4【单选题】(5分)下列哪个药物的合成标志着药物化学的形成A.贝诺酯B.吗啡C.对乙酰氨基酚D.阿司匹林5【多选题】(5分)与受体有关的药物分为A.氧化剂B.拮抗剂C.还原剂D.激动剂6【多选题】(5分)药物化学的任务包括A.提供使用药物的化学基础B.研究药物的作用机理C.研究药物的生产工艺D.创制新药7【判断题】(5分)现代新药研究与开发模式应用于新药研究,传统新药研究与开发模式已经被弃用A.错B.对8【判断题】(5分)中国药品通用名称是药品的常用名,是最准确的命名A.对B.错9【判断题】(5分)现代新药研发要经过靶点的识别和确证,先导化合物的筛选、优化和确定,临床前研究和临床研究几个阶段A.错B.对10【判断题】(5分)CADN的中文意思是中国药品通用名称。
A.对B.错第二章测试1【单选题】(5分)下列药物哪个是褪黑素受体激动剂A.他美替胺B.扑米酮C.扎来普隆D.氯巴占2【单选题】(5分)下列药物哪个不是GABA受体激动剂A.普罗加比B.非尔氨脂C.氨己烯酸D.加巴喷丁3【单选题】(5分)下列药物哪个不是乙酰胆碱酯酶抑制剂A.他克林B.加兰他敏C.卡巴斯汀D.奥卡西平4【单选题】(5分)芬太尼属于的化学结构类型是A.氨基酮类B.吗啡喃类C.哌啶类D.苯吗喃类5【多选题】(5分)甲氧氯普胺是中枢及外周性多巴胺D2受体拮抗剂,具有A.抗精神病作B.止吐作用C.促动力作用D.催吐作用6【多选题】(5分)作用于阿片k受体的镇痛药是A.阿尼利定B.氟痛新C.非那佐辛D.喷他佐辛7【判断题】(5分)吗啡在体内代谢时,去甲基的一步发生在7位N上。

大学药物化学考试练习题及答案41.[单选题]布洛芬属于哪类非甾体抗炎药A)芳基烷酸B)水杨酸C)3,5-吡唑烷二酮D)邻氨基苯甲酸答案:A解析:内容2.[单选题]白消安属哪一类抗格药?A)烷化剂B)抗生素C)生物碱D)抗代谢类答案:A解析:3.[单选题]下列关于洛伐他汀的说法不正确的是A)可以调节血脂B)属于前药C)结构中含酯基D)结构中含巯基答案:D解析:4.[单选题]为了缩小酸碱指示剂的变色范围,使变色更敏锐常采用的措施是( )A)多加一些指示剂B)加热C)用混合指示剂D)将滴定液稀释答案:C解析:5.[单选题]属于去甲肾上腺素重摄取抑制剂的抗抑郁药是A)氟西汀B)帕罗西汀C)丙咪嗉D)舍曲林6.[单选题]固体粉末具有颜色的药物是A)链霉素B)利福平C)红霉素D)阿司匹林答案:B解析:内容7.[单选题]不属于第三代的喹诺酮类抗菌药是A)环丙沙星B)吡哌酸C)氧氟沙星D)诺氟沙星答案:B解析:8.[单选题]甲氨蝶呤使用过量导致中毒时可使用亚叶酸钙进行解救,其目的是提供A)叶酸B)二氢叶酸C)四氢叶酸D)蝶呤酸答案:C解析:9.[单选题]下列哪个药物不作用于吗啡受体A)哌替啶B)美沙酮C)阿司匹林D)枸橼酸芬太尼答案:C解析:10.[单选题]水垢的主要成分是( )A)CaCO3B)MgCO3C)CaCO3D)AgCl答案:C解析:A)分析天平、容量瓶B)分析天平、量杯(量筒)C)台称、容量瓶D)台称、量杯(量筒)答案:D解析:12.[单选题]按化学结构分类,哌替啶属于A)生物碱类B)哌啶类C)吗啡喃类D)苯吗喃类答案:B解析:13.[单选题]苯巴比妥的结构类型A)乙内酰脲B)丙二酰脲C)吩噻嗪D)喹诺酮答案:B解析:内容14.[单选题]用0.01mol/L NaOH滴定0.01mol/L HCl,其pH突跃范围是5.3~8.7,则可选用变色范围是( )的指示剂指示终点。
A)3.1~4.4B)8.0~10.0C)9.4~10.6D)以上均可答案:B解析:15.[单选题]下列具有酰胺结构的药物是( )。


阻滞有丝分裂的抗癌药物
高玲
【期刊名称】《国际药学研究杂志》
【年(卷),期】2007(34)5
【总页数】2页(P390-391)
【关键词】有丝分裂;抗癌药物;阻滞;抑制剂;癌症治疗;分子功能;细胞分裂;肿瘤细胞【作者】高玲
【作者单位】
【正文语种】中文
【中图分类】R329.25
【相关文献】
1.以有丝分裂驱动蛋白为靶点的抗癌药物研究进展 [J], 李小荣;张颖杰
2.新一代抗癌药物的中坚——分子靶向型低分子抗癌药物 [J], 河野修已
3.微管抑制类抗癌药物——大自然抗癌药物的瑰宝 [J], 郭晓强;张晶晶
4.山东降低抗癌药物价格,实行抗癌药物专项集中采购 [J], ;
5.抗癌药物酒精饱和液肿瘤内注射疗法及其药物动力学研究─—一种肿瘤自身治疗性凝固块作为抗癌药物缓释库的新概念 [J], 于保法
因版权原因,仅展示原文概要,查看原文内容请购买。
2-巯基芳杂环与邻卤苄卤、亚磺酰胺反应的研究的开题报告研究背景和意义:2-巯基芳杂环是一类广泛存在于自然界中的有机分子,具有多样的结构和广泛的生物活性,如抗肿瘤、抗病毒、抗菌等作用。
因此,对于这类杂环的研究具有很高的学术价值和实际应用意义。
邻卤苄卤和亚磺酰胺都是常用的官能团,它们与2-巯基芳杂环的反应能够制备出一系列新的有机化合物,例如具有荧光等性质的化合物,这些化合物在生命科学、材料科学等领域中有很广泛的应用。
因此,本文将研究2-巯基芳杂环与邻卤苄卤、亚磺酰胺反应的机理和反应条件,探究制备新型有机化合物的可行性,为这类有机分子的应用提供有力的支持。
研究内容:本文将以2-巯基芳杂环为研究对象,通过邻卤苄卤或亚磺酰胺和2-巯基芳杂环的反应来制备新型有机化合物。
具体的研究内容包括以下几个方面:(1)反应的机理研究:通过理论计算、实验验证等方式,探究邻卤苄卤或亚磺酰胺和2-巯基芳杂环的反应机理。
(2)反应条件的优化:通过调节反应溶剂、温度、反应时间等条件,优化反应条件,提高反应的收率和选择性。
(3)新型有机化合物的合成:根据反应机理和反应条件,合成出一系列新型有机化合物,通过NMR、UV-vis、荧光光谱等手段对其结构和性质进行表征和分析。
预期成果:本文旨在研究2-巯基芳杂环与邻卤苄卤、亚磺酰胺反应的机理和条件,并制备出一系列新型有机化合物,为这类有机分子的应用提供有力的支持,预期成果如下:(1)明确2-巯基芳杂环与邻卤苄卤、亚磺酰胺反应的机理和条件。
(2)合成出一系列新型有机化合物,在光学、电学等方面给出详细的物化性质,探究其在生命科学、材料科学等领域的应用价值。
(3)相关成果在相关领域的期刊上发表,并在学术交流会议上发表相关成果报告,提高学术知名度和影响力。
(4)相关成果在实际应用中得到推广和应用,从而为相关领域的发展提供有力支持和推动。