溶液图像题专题训练
- 格式:doc
- 大小:291.50 KB
- 文档页数:6

专题21 电解质溶液图像分析目录一、热点题型归纳.....................................................................................................................1 【题型一】溶液稀释图像............................................................................................................1 【题型二】水电离度图像............................................................................................................3 【题型三】物质滴定曲线............................................................................................................5 【题型四】浓度比型图像............................................................................................................7 【题型五】分布系数图像............................................................................................................9 二、最新模考题组练 (11)【题型一】溶液稀释图像【典例分析】【典例1】(河南省名校联盟2021~2022学年高三3月联考)常温时,浓度均为1mol ·L -1的CH 3NH 2和NH 2OH 两种碱溶液,起始时的体积都为10mL 。
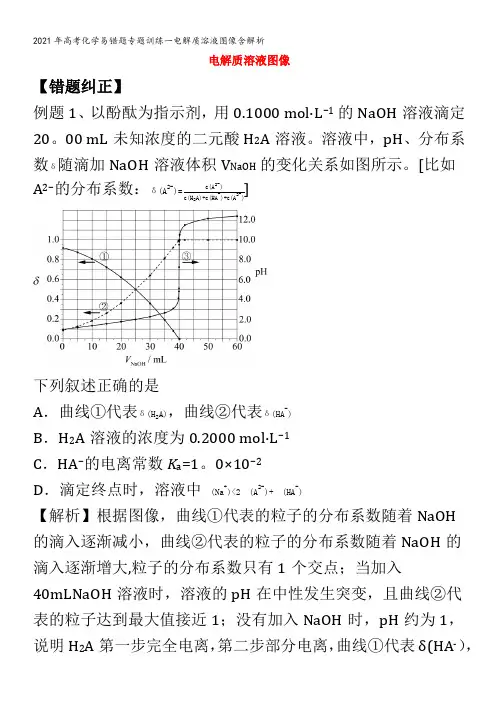
电解质溶液图像【错题纠正】例题1、以酚酞为指示剂,用0.1000 mol·L−1的NaOH溶液滴定20。
00 mL未知浓度的二元酸H2A溶液。
溶液中,pH、分布系数δ随滴加NaOH溶液体积V NaOH的变化关系如图所示。
[比如A2−的分布系数:δ(A2-)=c(A2-)]c(H2A)+c(HA-)+c(A2-)下列叙述正确的是A.曲线①代表δ(H2A),曲线②代表δ(HA-)B.H2A溶液的浓度为0.2000 mol·L−1C.HA−的电离常数K a=1。
0×10−2D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)【解析】根据图像,曲线①代表的粒子的分布系数随着NaOH的滴入逐渐减小,曲线②代表的粒子的分布系数随着NaOH的滴入逐渐增大,粒子的分布系数只有1个交点;当加入40mLNaOH溶液时,溶液的pH在中性发生突变,且曲线②代表的粒子达到最大值接近1;没有加入NaOH时,pH约为1,说明H2A第一步完全电离,第二步部分电离,曲线①代表δ(HA-),曲线②代表δ(A 2—),根据反应2NaOH+H 2A=Na 2A+2H 2O ,c (H 2A)=0.1000mol/L ×40mL 2×20.00mL =0。
1000mol/L,据此分析作答。
A .根据分析,曲线①代表δ(HA —),曲线②代表δ(A 2-),A 错误;B .当加入40。
00mLNaOH 溶液时,溶液的pH 发生突变,说明恰好完全反应,结合分析,根据反应2NaOH+H 2A=Na 2A+2H 2O,c (H 2A)=0.1000mol/L ×40mL 2×20.00mL =0.1000mol/L ,B 错误;C .根据曲线当δ(HA -)=δ(A 2—)时溶液的pH=2,则HA —的电离平衡常数K a =c(A 2-)⋅c (H +)c (HA -)=c (H +)=1×10—2,C 正确;D .用酚酞作指示剂,酚酞变色的pH 范围为8.2~10,终点时溶液呈碱性,c (OH —)>c (H +),溶液中的电荷守恒为c (Na +)+c (H +)=2c (A 2-)+c (HA —)+c (OH -),则c (Na +)>2c (A 2—)+c (HA -),D 错误;答案选C 。



专题08 图像题(测试)一、选择题1.下列图象能够正确反映其对应变化关系的是()A.将浓盐酸露置在空气中一段时间B.向稀硫酸中滴加过量的氢氧化钠溶液C.向等质量的氧化镁、氢氧化镁中,分别加入溶质质量分数相同的稀盐酸至过量D.电解水实验中,生成的氢气和氧气之间的质量关系2.下列所示的四个图象能正确反映对应变化关系的是()A.向一定量的饱和石灰水中不断加入生石灰□B.向等质量的镁和锌中加入稀盐酸至过量C.向pH=2的稀盐酸中加入pH=12的氢氧化钠溶液D.向一定量的氢氧化钾和氯化钡的混合溶液中滴加稀硫酸3.实验室使用一定质量的高锰酸钾加热分解制氧气,各物理量随加热时间变化的图像正确的是A.B.C.D.4.下列图象中正确反映了其对应操作的是()A.在盛有空气的密闭容器中点燃红磷B.向NaOH溶液中不断加入水C.将浓硫酸敞口放置在空气中D.分别向等质量的锌粉和铁粉中,加入足量且质量分数相等的稀盐酸5.向盛有定量固体的烧杯中加入某溶液,固体质量变化与如图相符的是A.MnO2中加入H2O2溶液B.Cu﹣Zn合金中加入稀HClC.CuO中加入稀H2SO4D.BaCO3中加入稀HNO36.下列图象不能正确反映其对应变化关系的是()A.电解水B.向硫酸钠与盐酸的混合溶液中逐滴滴入氢氧化钡溶液C.向氢氧化钠溶液中逐滴滴入稀硫酸溶液D.向一定量的氯化亚铁和氯化铜混合溶液中加入镁粉7.向盛有HCl和CuCl2混合溶液的烧杯中逐滴加入NaOH溶液至过量。
在该过程中,下列4个图像能正确反映烧杯内物质的某些物理量变化趋势的是A.①③B.①②④C.②④D.①②③8.下列图象不能正确反应其对应变化关系的是()A.相同质量的炭粉分别在足量的氧气和空气中燃烧B.浓硫酸长期露置在空气中C.向表面生锈的铁钉中滴加过量的稀盐酸D.向一定量氯化铜溶液中滴加氢氧化钠溶液9.下列四个图象分别对应四个变化过程,其中正确的是()A.一定量的饱和石灰水中加入氧化钙B.常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应C.向硫酸和硫酸铜的混合溶液中滴加过量的氢氧化钠溶液D.向氢氧化钾溶液中不断加水,溶液的pH与加入水的质量关系10.下列说法和判断合理的是①用作消毒剂的75%的医用酒精,是指每100体积的医用酒精中含75体积的乙醇②某温度下,一定质量的氯化钠饱和溶液不能再溶解氯化钠固体,但还能继续溶解一定质量的氯化钾③一定质量的某气体充分燃烧,生成2.2 g二氧化碳和1.8 g水,则该气体一定是一氧化碳和氢气的混合物④等质量的A、B两种物质,分别与等质量的同浓度的稀盐酸充分反应,过程如图所示。

专题7-电解质溶液图像题真题演练1. 【2021广东选择考适应性测试9】. 叠氮酸(HN 3)与NaOH 溶液反应生成NaN 3。
已知NaN 3溶液呈碱性,下列叙述正确的是A. 0.01 mol·L -1HN 3溶液的pH=2 B. HN 3溶液的pH 随温度升高而减小 C. NaN 3 的电离方程式: NaN 3= Na ++3N 3-D. 0.01 mol·L -1 NaN 3溶液中: c (H +)+ c (Na + )= c (N 3-)+ c (HN 3) 【答案】B【解析】A .由题意,NaN 3溶液呈碱性,叠氮酸根(N 3-)会发生水解,说明HN 3为弱酸,在水溶液中不能完全电离,故0.01 mol·L -1 HN 3溶液的pH>2,A 错误;B .HN 3为弱酸,电离方程式为HN 3=H + +N 3-,电离是吸热过程,升高温度促进HN 3的电离,c (H +)增大, pH 减小,B 正确;C .NaN 3是强电解质,完全电离出Na +和N 3-,电离方程式为 NaN 3= Na ++ N 3-,C 选项错误;D .0.01 mol·L -1 NaN 3溶液中:由物料守恒 c (Na +)= c (N 3-)+ c (HN 3),故D 错误。
2.2.【2021重庆市学业水平选择性考试13】 草酸H 2C 2O 4是二元弱酸。
向100 mL 0.40 mol/L H 2C 2O 4溶液中加入1.0 mol/L NaOH 溶液调节pH ,加水控制溶液体积为200 mL 。
测得溶液中微粒的δ(x)随 pH 变化曲线如图所示,δ(x)=-2-2242424c(x)c(H C O )+c(HC O )+c(C O ),x 代表微粒H 2C 2O 4、HC 2O -4或C 2O 2-4。
下列叙述正确的是A. 曲线Ⅰ是HC 2O -4的变化曲线 B. 草酸H 2C 2O 4的电离常数K= 1.0×10-1.22C. 在 b 点,c(C 2O 2-4)+2c(OH -)= c(HC 2O -4)+c(H +) D. 在c 点,c(HC 2O -4)=0.06 mol/L 【答案】B【解析】A .当酸性越强时,曲线Ⅰ表示的微粒的含量越高,可推知曲线Ⅰ是H 2C 2O 4的变化曲线,曲线Ⅱ是HC 2O -4的变化曲线,曲线Ⅲ是C 2O 2-4的变化曲线,A 错误;B .在a 点H 2C 2O 4的浓度和HC 2O -4的浓度相等,pH=1.22,则草酸H 2C 2O 4的电离常K =()()()-24224c HC O ?c H c H C O+=()c H +=10-1.22,则B 正确;C .在 b 点,c(C 2O 2-4)= c(HC 2O -4),且溶液呈酸性,若c(C 2O 2-4)+2c(OH -)= c(HC 2O -4)+c(H +),则2c(OH -)= c(H +),显然不成立,C 错误;D .在c 点,HC 2O -4的含量为0.15,而H 2C 2O 4的物质的量为0.1L× 0.40 mol/L=0.04 mol,则HC 2O -4的物质的量为0.15×0.04 mol=0.006 mol,溶液体积为0.2L ,c(HC 2O -4)=0.006 mol÷0.2L=0.03 mol/L,D 错误。
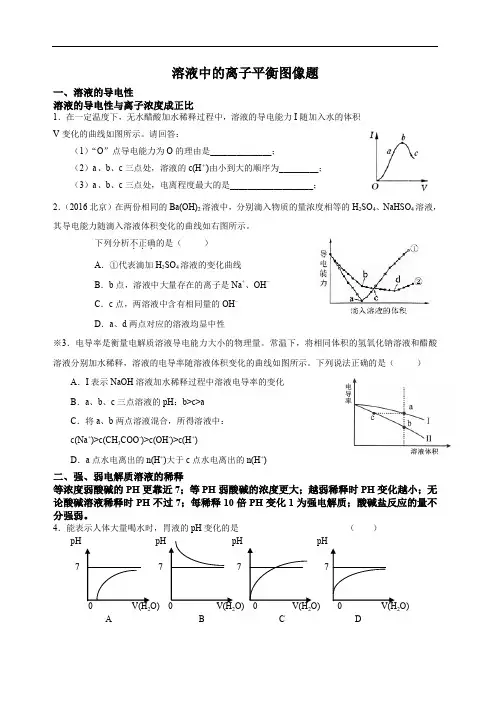
溶液中的离子平衡图像题一、溶液的导电性溶液的导电性与离子浓度成正比1.在一定温度下,无水醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。
请回答:(1)“O”点导电能力为O的理由是______________;(2)a、b、c三点处,溶液的c(H+)由小到大的顺序为_________;(3)a、b、c三点处,电离程度最大的是___________________;2.(2016北京)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如右图所示。
下列分析不正确...的是()A.①代表滴加H2SO4溶液的变化曲线B.b点,溶液中大量存在的离子是Na+、OH–C.c点,两溶液中含有相同量的OH–D.a、d两点对应的溶液均显中性※3.电导率是衡量电解质溶液导电能力大小的物理量。
常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随溶液体积变化的曲线如图所示。
下列说法正确的是()A.I表示NaOH溶液加水稀释过程中溶液电导率的变化B.a、b、c三点溶液的pH:b>c>aC.将a、b两点溶液混合,所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)D.a点水电离出的n(H+)大于c点水电离出的n(H+)二、强、弱电解质溶液的稀释等浓度弱酸碱的PH更靠近7;等PH弱酸碱的浓度更大;越弱稀释时PH变化越小;无论酸碱溶液稀释时PH不过7;每稀释10倍PH变化1为强电解质;酸碱盐反应的量不分强弱。
4.能表示人体大量喝水时,胃液的pH变化的是()7 7 7O)2222A B C D5.0.1 mol·L -1的醋酸与0.1 mol·L -1的盐酸,分别稀释相同的倍数,随着水的加入,溶液中c (H +)的变化曲线(如下图)正确的是( )6.某温度下,相同pH 值的盐酸和醋酸溶液分别加水稀释,平衡pH 值随溶液体积变化的曲线如图所示。

压轴题13水溶液中微粒变化图像题水溶液中的离子平衡是高考的重点,主要考查弱电解质的电离平衡、盐类的水解平衡、难溶电解质的溶解平衡的移动影响规律及应用,溶液中粒子浓度大小的比较,K sp、pH的计算,中和滴定的计算、指示剂的选择等。
近年来将离子反应与图像有机结合起来进行命题,很好地考查学生的观察能力、获取信息采集处理数据的能力、图形转化能力和推理判断能力。
题目不仅偏重考查粒子的浓度大小顺序,而且还侧重溶液中的各种守恒(电荷守恒、物料守恒、质子守恒)关系的考查,从而使题目具有一定的综合性、灵活性和技巧性。
预计2023年高考,对数、分布系数图象将成为水溶液中的离子平衡的高考新宠,命题设计更趋新颖灵活,综合性强,难度较大。
考查重点落在考生的读图识表能力、逻辑推理能力以及分析问题和解决问题的能力。
电解质溶液中粒子浓度大小的比较1.(2022•辽宁省选择性考试)甘氨酸(NH 2CH 2COOH)是人体必需氨基酸之一、在25℃时,NH 3+CH 2COOH 、NH 3+CH 2COO -和NH 2CH 2COO -的分布分数【如()()()()()2-2--2-2c A δA =c H A +c HA +c A 】与溶液pH 关系如图。
下列说法错误的是()A .甘氨酸具有两性B .曲线c 代表NH 2CH 2COO -C .NH 3+CH 2COO -+H 2O NH 3+CH 2COOH+OH -的平衡常数K=10-11.65D .c 2(NH 3+CH 2COO -)<c (NH 3+CH 2COOH)·c (NH2CH 2COO -)【答案】D【解析】A 项,NH 2CH 2COOH 中存在-NH 2和-COOH ,所以溶液既有酸性又有碱性,故A 正确;B 项,氨基具有碱性,在酸性较强时会结合氢离子,羧基具有酸性,在碱性较强时与氢氧根离子反应,故曲线a 表示NH 3+CH 2COOH 的分布分数随溶液pH 的变化,曲b 表示NH 3+CH 2COO -的分布分数随溶液pH 的变化,曲线c 表示NH 2CH 2COO -的分布分数随溶液pH 的变化,故B 正确;C 项,NH 3+CH 2COO -+H 2ONH 3+CH 2COOH+OH -的平衡常数()()()+-32+-32c NH CH COOH c OH K=c NH CH COO ⋅,25℃时,根据a ,b 曲线交点坐标(2.35,0.50)可知,pH=2.35时,c (NH 3+CH 2COO -)=c (NH 3+CH 2COOH),则()()--11.65+wK K=c OH ==10c H ,故C 正确;D 项,由C 项分析可知,()()()+-11.6532+--32c NH CH COOH 10=c NH CH COO c OH ,根据b ,c 曲线交点坐标坐标(9.78,0.50)分析可得电离平衡NH 3+CH 2COO -NH 2CH 2COO -+H +的电离常数为K 1=10-9.78,()()()()--9.78221+-++32c NH CH COO K 10==c NH CH COO c H c H ,则()()()()()()+--11.65-9.783222+-+--322+3c NH CH COOH c NH CH COO 10101c NH CH COO c NH CH COO c OH c H ⨯=⨯<,即c 2(NH 3+CH 2COO -)>c (NH 3+CH 2COOH)·c (NH 2CH 2COO -),故D 错误;故选D 。

电解质溶液图像专题电解质溶液的图像题,从知识载体的角度看:一可用于考查溶液中离子浓度的大小比较;二可考查溶液中离子浓度的守恒问题;三可考查有关电解质溶液的各种计算;四可结合生产和生活实际考查分离和提纯等具体的化学应用问题。
常见的图像题类型:1.pH(或pOH)—体积的变化曲线2.微粒分布分数(或系数)—pH(或pOH)的变化曲线3.浓度—浓度的变化曲线4.对数的变化曲线5.导电能力(或电导率) —体积(或浓度)变化曲线【练1】分布分数图:可以表示溶液中各种组分随pH的变化而变化的曲线。
1.25℃,c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。
下列有关离子浓度关系叙述正确的是()A.pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)B.W点表示溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)C.pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol·L-1D.向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(Na+)+c(H+)=c(CH3COOH)+c(OH-) +c(Cl-)2.草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:(1)图中曲线1表示的分布系数变化;曲线3表示的分布系数变化.现有物质的量浓度均为0.1mol/L的下列溶液:①Na2C2O4 ②NaHC2O4 ③H2C2O4 ④(NH4)2C2O4 ⑤NH4HC2O4 已知NaHC2O4溶液显酸性.(2)Na2C2O4溶液中,c(Na+)/c(C2O42-) 2 (填“>”、“=”、“<”),原因是(用离子方程式表示).(3)常温下,向10mL 0.1mol/L H 2C 2O 4溶液中滴加0.1mol/L NaOH 溶液,随着NaOH 溶液体积的增加,当溶液中c (Na +)=2c (C 2O 42-)+c (HC 2O 4-)时,溶液显 性(填“酸”、“碱”或“中”),且V (NaOH ) 10mL (填“>”、“=”或“<”).(4)下列关于五种溶液的说法中,正确的是A .溶液②中,c (C 2O 42-)<c (H 2C 2O 4)B .溶液②中,c (H 2C 2O 4)+c (OH -)=c (C 2O 42-)+c (H +)C .溶液④⑤中都符合c (NH 4+)+c (H +)=c (HC 2O 4-)+2c (C 2O 42-)+c (OH -)D .五种溶液都符合c (H 2C 2O 4)+c (HC 2O 4-)+c (C 2O 42-)=0.1mol ·L -1.(5)五种溶液中c (H 2C 2O 4)由大到小排列的顺序是具体解法:“四看三联系一注意”:四看:(1)先看图像的面与线,面要看横坐标和纵坐标的含义,线要看各组分浓度随pH 的变化趋势(2)再看图像的点,点要看起点,终点和交点对应的pH(3)点还要看最高点和最低点对应的pH 和各组分存在的pH 范围(4)最后看各条曲线相互重叠程度的大小三联系: 找出某个pH 对应的成分后再联系电离平衡和水解平衡的规律进行判断;一注意: 答题时还要特别注意在图表中没有提供的信息或潜在信息。

1.草酸()224H C O 是二元弱酸。
向1224100mL0.40mol L H C O -⋅溶液中加入11.0mol L NaOH -⋅溶液调节pH ,加水控制溶液体积为200mL 。
测得溶液中微粒的(x)δ随pH 变化曲线如图所示,()()()22242424(x)(x)H C O HC O C O c c c c δ--=++,x 代表微粒22424H C O HC O -、或224C O -。
下列叙述正确的是( )A.曲线I 是24HC O -的变化曲线B.草酸224H C O 的电离常数 1.221.010K -=⨯C.在b 点,()()()()22424C O 2OH HC O H c c c c ----+=+D.在c 点,()124HC O 0.06mol L c --=⋅2.23H CO 和224H C O 都是二元弱酸,常温下,不同pH 环境下它们不同形态的粒子的组成百分率如图所示。
下列说法错误的是( )A.由图可知,草酸酸性比碳酸要强B.反应2323CO H O HCO OH ---++的平衡常数为7.2310-C.240.1mol /LNaHC H 溶液中()()224224c C O c H C O -> D.往23Na CO 溶液中加入少量草酸溶液,发生反应2232243242CO H C O 2HCO C O ---++3.NaOH 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾2H A 的131.110aK -=⨯,263.910a K -=⨯)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。
下列叙述错误的是( )A.混合溶液的导电能力与离子浓度和种类有关B.Na +与2A -的导电能力之和大于HA -的C.b 点的混合溶液pH=7D.c 点的混合溶液中,(Na )(K )(OH )c c c ++->>4.水体中重金属铅的污染问题备受关注。

题型一 对数图像1.对数图像的含义将溶液中某一微粒的浓度[如c (A)]或某些微粒浓度的比值⎣⎢⎡⎦⎥⎤如c (A )c (B )取常用对数,即lg c (A)或lg c (A )c (B ),与溶液中的pH 或溶液的体积等关系作出的图像称为对数图像。
图像中数据的的含义为:①若c (A)=1⎣⎢⎡⎦⎥⎤或c (A )c (B )=1时,lg c (A)=0⎩⎨⎧⎭⎬⎫或lg ⎣⎢⎡⎦⎥⎤c (A )c (B )=0。
②若c (A)>1⎣⎢⎡⎦⎥⎤或c (A )c (B )>1时,lg c (A)⎩⎨⎧⎭⎬⎫或lg ⎣⎢⎡⎦⎥⎤c (A )c (B )取正值且c (A)⎣⎢⎡⎦⎥⎤或c (A )c (B )越大, lg c (A)⎩⎨⎧⎭⎬⎫或lg ⎣⎢⎡⎦⎥⎤c (A )c (B )越大。
③若c (A)<1⎣⎢⎡⎦⎥⎤或c (A )c (B )<1时, lg c (A)⎩⎨⎧⎭⎬⎫或lg ⎣⎢⎡⎦⎥⎤c (A )c (B )取负值,且c (A)⎣⎢⎡⎦⎥⎤或c (A )c (B )越大, lg c (A)⎩⎨⎧⎭⎬⎫或lg ⎣⎢⎡⎦⎥⎤c (A )c (B )越大,但数值越小。
2.常考对数图像的类型例如,有关沉淀溶解平衡的对数图像分析如下:对数图像含义已知:pM=-lg c(M)(M:Mg2+、Ca2+、Mn2+),p(CO2-3)=-lg c(CO2-3)横坐标数值越大,c(CO2-3)越小纵坐标数值越大,c(M)越小线上方的点为不饱和溶液线上的点为饱和溶液线下方的点表示有沉淀生成线上任意点,坐标数值越大,其对应的离子浓度越小【探题源·规律】[例1](2018·全国卷Ⅲ)用0.100 mol·L-1AgNO3滴定50.0 mL 0.050 0 mol·L-1 Cl-溶液的滴定曲线如图所示。
下列有关描述错误的是()A.根据曲线数据计算可知K sp(AgCl)的数量级为10-10B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=K sp(AgCl)C.相同实验条件下,若改为0.040 0 mol·L-1 Cl-,反应终点c移到aD.相同实验条件下,若改为0.050 0 mol·L-1 Br-,反应终点c向b方向移动[图解过程][解析] 根据Ag ++Cl -===AgCl ↓可知,达到滴定终点时,消耗AgNO 3溶液的体积为0.040 mol ·L -1×50.0 mL0.100 mol ·L -1=20.0 mL ,C 项错误;由题图可知,当AgNO 3溶液的体积为50.0 mL 时,溶液中的c (Cl -)略小于10-8 mol ·L -1,此时混合溶液中c (Ag +)=0.100 mol ·L -1×50.0 mL -0.050 0 mol·L -1×50.0 mL100 mL=2.5×10-2 mol ·L -1,故K sp =c (Ag +)·c (Cl -)≈2.5×10-2×10-8=2.5×10-10,A 项正确;因反应过程中有沉淀生成,溶液中必然存在平衡AgCl(s)Ag +(aq)+Cl -(aq),故曲线上的各点均满足c (Ag +)·c (Cl -)=K sp (AgCl),B 项正确;根据Ag ++Cl -===AgCl ↓可知,达到滴定终点时,消耗AgNO 3溶液的体积为0.040 0 mol ·L -1×50.0 mL0.100 mol ·L -1=20.0 mL ,C 项错误;相同实验条件下,沉淀相同量的Cl -和Br -消耗的AgNO 3的量相同,由于K sp (AgBr)<K sp (AgCl),当滴加相等量的Ag +时,溶液中c (Br -)<c (Cl -),故反应终点c 向b 方向移动,D 项正确。
溶液图像题专题训练1.右图是甲、乙两种固体物质的溶解度曲线,请你回答:(1)t 1℃时,甲的溶解度 (填“〉"、“〈”或“=”)乙的溶解度; (2)甲、乙两种物质的溶解度受温度变化影响较大的是 (3)甲中含有少量乙,要提纯甲,可采用的方法是 ; (4)t 2℃时,分别取等质量的甲、乙两种物质,均刚好配制 成饱和溶液(甲、乙完全溶解),所需水的质量关系 是甲 (填“>”、“<”或“=”)乙。
(5)t 1℃时,将15g 乙物质溶解在50g 水中,充分溶解后, 析出晶体(无结晶水) g.2.小明在家做蔗糖溶于水的实验时,观察到如右图现象。
请填空:(1)右图是蔗糖溶解度曲线,图中A 点表示意义是 。
(2)30℃时,向100g 水中加入80g 蔗糖,充分混合后所得溶液质量是g 。
(3)曲线上满足B 点溶液处于不饱和状态,可采用 方法,使溶液处在曲线C 点上。
3.A 、B 、C 三种固体都不含结晶水,如图是其溶解度曲线示意图,试回答: (1)10℃时,B 物质的溶解度 ____ A 物质的溶解度; (填“〉”或“="或“〈”);(2)将40℃时三种物质的饱和溶液降温至10℃时,无晶体析出的是 _____ 。
(3)60℃时,A 、B 两种物质 _____ (填“能”或“不能”)形成 溶质质量分数相同的饱和溶液; (4)70℃时,将A 物质充分溶解于100g 水中,可得到A 物质的饱和溶液 ______ g 。
4.固体物质A 和B 的溶解度曲线如右图。
请回答: (1)S (A)> S (B)的温度范围是 ; (2)从A 的饱和溶液中提取A ,应采用的方法是 (填写编号);Ⅰ。
冷却结晶 Ⅱ. 蒸发溶剂 Ⅲ. 过滤 (3)60℃时105 gB 的饱和溶液中含 g 固体B.5。
甲、乙、丙三种物质的溶解度曲线如右图所示,据图回答:(1)30 ℃时,三种物质的溶解度由小到大的顺序为 ;40 20A BC 8060402020406080T (℃)S (g/100g 水)(2)50 ℃时,乙物质饱和溶液的溶质质量分数是;(精确到0。
1.25℃ 时,向23Na CO 溶液中滴入盐酸,混合溶液的pH 与离子浓度变化的关系如图所示。
已知:2-3-3(CO )lgX=lg (HCO )c c 或-323(HCO )lg (H CO )c c ,下列叙述错误的是( )A.曲线n 表示pH 与-323(HCO )lg (H CO )c c 的变化关系B.当溶液呈中性时,()+-2-33c Na (HCO )2(CO )c c += C. () 6.4a123K H CO 1.010-⨯=D.25℃ 时,2323CO H O HCO OH ---++的平衡常数为 3.71.010-⨯2.室温下,将两种浓度均为10.1mol L -⋅的溶液等体积混合,假设混合后溶液的体积等于混合前两溶液的体积之和,下列各混合溶液中微粒的物质的量浓度关系正确的是( )A.323NaHCO Na CO -混合溶液(pH=10.30):()()()()233233Na 2CO 2HCO 2H CO c c c c +--=++B.324NH H O NH Cl ⋅-混合溶液(pH=9.25):()()()()432NH H NH H O OH c c c c ++-+=⋅+C.33CH COOH CH COONa -混合溶液(pH=4.76):()()()()33Na CH COOH CH COO H c c c c +-+>>> D.22424H C O NaHC O -混合溶液(pH=1.68):()()()()()222424H H C O Na C O OH c c c c c ++--+=++3.室温下某二元酸2H M 溶液中22H M HM M --、、的浓度对数lg c 随溶液pH 的变化关系如图所示。
下列分析错误的是( )A.该二元酸溶液的浓度为0.01mol/LB.HM -的水解常数的数量级为10C.pH=7时,()()2lg M lg HM 0.77c c ---=D.在NaHM 溶液中,水的电离受到抑制4.设A N 为阿伏加德罗常数值。
能量变化:4 .如图所示,打开止水夹,将液体A 滴入试管②中与固体B 接触。
若试管①中的导管口有较多气泡产生,则液体A 和固体B 的组合不可能是 ( ) A .双氧水和二氧化锰 B .水和生石灰 C .水和氢氧化钠 D .水和硝酸铵 5.如右图所示,瓶中Y 为固体,当把滴管内的液体X 滴入瓶中,导管口一定没有气泡产生的是( )7.如右下图所示,当打开分液漏斗上的活塞让水滴入大试管中,可观察到以下现象:①U 形管中a 液面上升,b 液面下降 ②烧杯中的饱和溶液有晶体析出 则大试管中的物质M 和烧杯中的 饱和溶液N 可能是A .M 是CaO 粉末,N 是Ca(OH)2溶液B .M 是浓硫酸,N 是NaCl 溶液C .M 是NH 4NO 3固体,N 是KNO 3溶液 溶液的配制9.(5分)欲配制180 g 溶质质量分数为50%的硝酸铵,实验操作如下图所示。
请回答下列问题:(1)量取所需要的水应选择 (选填“50mL”、“100mL”或“200mL”)量筒。
(2)用托盘天平称量所需的硝酸铵时,发现托盘天平的指针偏向左盘,应 (选填序号)。
A .增加适量硝酸铵固体 B .减少适量硝酸铵固体 C .调节平衡螺母(3)将硝酸铵和水依次倒入烧杯中,要用玻璃棒搅拌,其目的是 。
(4)用上述图示的序号表示配制溶液的操作顺序: 。
yx 水 水 物质M饱和溶液N 水NH 4Cl① ② ③ ④ ⑤NH 4Cl(5)在做⑤操作时,烧杯的温度(选填“升高”或“降低”)了。
13.某同学用固体氯化钾配制8%的氯化钾溶液,实验室现有①托盘天平;②量筒;③烧杯;④玻璃棒;⑤酒精灯等仪器.请按要求回答下列问题:(1)配制100g质量分数为8%的氯化钾溶液,所需氯化钾的质量为 g.(2)用托盘天平称量所需的氯化钾.托盘天平调节平衡后,接下来的操作应该是(填字母).A.先在左盘纸片上加氯化钾,后在右盘纸片上加砝码B.先在右盘纸片上加砝码,后在左盘纸片上加氯化钾.(3)配制溶液过程中,上述仪器不需要的是(填序号).(4)该同学将配制好的溶液装入试剂瓶中,请你帮助他在如图所示的标签内写好标签的内容.14.(2013•天津)溶液具有广泛的用途,根据溶液有关知识,回答下列问题:(1)在20℃时,向盛有40g氯化钠固体的烧杯中加入100g水,充分搅拌后,仍有4g固体未溶解.①所得溶液是20℃时氯化钠的溶液(填“饱和”或“不饱和”)②20℃时,氯化钠的溶解度为g.(2)现用质量分数为12%的氯化钠溶液(密度约为1.09g/cm3),配制20g质量分数为6%的氯化钠溶液.①需要质量分数为12%的氯化钠溶液mL(计算结果精确到0.1),需要水mL(水的密度为1g/cm3).②该溶液配制过程中用到的仪器除了量筒、烧杯玻璃棒外,还需要胶头滴管量取所需要的12%的氯化钠溶液时,应选用(填“10mL”或“20mL”或“50mL”)规格的量筒.③把配制好的上述溶液装入中(填“广口瓶”或“细口瓶”),盖好瓶塞并贴上标签.★溶液的均一性现有硝酸钾样品(杂质不溶于水)。
酸碱盐图像题(总12页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--选择题图像专题1.下列四个图像中,能正确表示对应变化关系的是()A.向一定量稀盐酸中加水稀释B.一定温度下,向不饱和硝酸钾溶液中加入硝酸钾C.加热一定量的高锰酸钾固体D.向盐酸和氯化镁的混合溶液中滴加氢氧化钾溶液2.下列图像不能..正确反映对应变化关系的是()3向一定体积的NaOH稀溶液中逐滴滴加稀盐酸,溶液pH变化的曲线合理的是()…………7水的质量pH00 硝酸钾的质量溶液的质量0 加热时间固体中锰元素0 氢氧化钾的质量沉淀的质量4.下列图像能正确反映其对应的实验操作的是()A.将锌片插入盛有一定量稀硫酸的烧杯中B.向一定量的稀盐酸和氯化钙的混合溶液中不断滴入碳酸钠溶液至过量C.电解水D.向盛有一定量水的烧杯中不断滴入NaOH溶液5.右图是稀HCl和NaOH溶液反应的pH变化曲线,以下说法不正确的是()A.该反应是稀HCl滴入NaOH溶液中B.ag是指加入氢氧化钠固体质量C.A点溶液的溶质为HCl和NaClD.检验B点溶液的溶质先滴加足量的Mg(NO3)2,静置后再滴入少量AgNO36.下列图像能正确反映其对应关系的是()A.某温度下,向一定量接近饱和的硝酸钾溶液中不断加入过量的硝酸钾晶体B.向稀盐酸和硫酸钠的混合溶液中加入过量的氢氧化钡溶液C.向氢氧化钠溶液中滴加过量的稀盐酸D.等质量的镁和锌同时分别放入两份溶质质量分数相同的足量稀盐酸中7.下列四个坐标示意图分别表示四个实验过程中的某些变化情况,其中肯定错误..的是()A.加热一定量碳铵(NH4HCO3)的实验,试管中固体的质量变化B.等质量的镁条和铁丝分别与足量的稀硫酸反应,产生气体的质量变化C.向一定质量的水中加入氢氧化钠时,形成的溶液pH的变化D.向盛有一定量Ba(OH)2溶液的烧杯中逐滴滴加稀硫酸,测得烧杯中溶液导电性的变化8.下列图像分别与选项中的操作相对应,其中合理的是()A.向一定量稀硫酸中滴入水B.向一定量纯碱和烧碱的混合溶液中滴入盐酸C.一定温度时向一定量饱和石灰水中加入氧化钙D.向一定量二氧化锰固体中加入过氧化氢溶液9.小亮同学在实验室中制取CO2气体后,对废液进行后续探究,他向一定质量的含CaCl2和HCl的废液中逐滴加入溶质质量分数为10%的Na2CO3溶液。
溶液图像题专题训练
1.右图是甲、乙两种固体物质的溶解度曲线,请你回答:
(1)t 1℃时,甲的溶解度 (填“>”、“<”或“=”)乙的溶解度;
(2)甲、乙两种物质的溶解度受温度变化影响较大的是
(3)甲中含有少量乙,要提纯甲,可采用的方法是 ;
(4)t 2℃时,分别取等质量的甲、乙两种物质,均刚好配制
成饱和溶液(甲、乙完全溶解),所需水的质量关系
是甲 (填“>”、“<”或“=”)乙。
(5)t 1℃时,将15g 乙物质溶解在50g 水中,充分溶解后,
析出晶体(无结晶水) g 。
2.小明在家做蔗糖溶于水的实验时,观察到如右图现象。
请
填空:
(1)右图是蔗糖溶解度曲线,图中A 点表示意义
是 。
(2)30℃时,向100g 水中加入80g 蔗糖,充分混合后所得溶液质量是 g 。
(3)曲线上满足B 点溶液处于不饱和状态,可采用 方法,使溶液处在曲线C 点上。
3.A 、B 、C 三种固体都不含结晶水,如图是其溶解度曲线示意图,试回答:
(1)10℃时,B 物质的溶解度 ____ A 物质的溶解度;
(填“>”或“=”或“<”);
(2)将40℃时三种物质的饱和溶液降温至10℃时,无晶体析
出的是 _____ 。
(3)60℃时,A 、B 两种物质 _____ (填“能”或“不能”)形成
溶质质量分数相同的饱和溶液;
(4)70℃时,将A 物质充分溶解于100g 水中,可得到A 物质的
饱和溶液 ______ g 。
40 20 A B
C 80604020020
406080T (℃)S (g/100g 水)
4.固体物质A和B的溶解度曲线如右图。
请回答:
(1)S(A)>S(B)的温度范围是;
(2)从A的饱和溶液中提取A,应采用的方法是
(填写编号);
Ⅰ. 冷却结晶Ⅱ. 蒸发溶剂Ⅲ. 过滤
(3)60℃时105 gB的饱和溶液中含 g固体B。
5.甲、乙、丙三种物质的溶解度曲线如右图所示,据图回答:
(1)30 ℃时,三种物质的溶解度由小到大的顺序
为;
(2)50 ℃时,乙物质饱和溶液的溶质质量分数是;(精
确到%)
(3) 50 ℃时,将 20克乙物质分散到40克水中,可配得溶
液质量是克;
(4)50 ℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10 ℃时所得溶液中溶质质量分数最小的是。
6.右图是A、B、C三种物质的溶解度曲线,据图回答:
(1)t1℃时A、B、C三种物质的溶解度由大到小的顺序是_____(填
写序号,下同)。
(2) 若要将C的饱和的溶液变为不饱和溶液,可以采用的方法
是,。
(3)将t2℃时A、B、C三种物质饱和溶液的温度降低到t1℃时,三种溶液的溶质质量分数由大小关系是 _。
(4)t1℃时30gA物质加入到50g水中不断搅拌形成的溶液质量是______g。
7.如图所示是A、B、C三种固体的溶解度曲线,试回答:
t3℃时,A、B、C三种物质溶解度的大小关系是。
t1℃时,150 g 水中最多溶解B 物质 g。
某固体可能是A、B、C中的某一种物质,t2℃时,取4g该固体放入10 g水中,固体全部溶解,该固体是A、B、C中的
S (g/100g水)
B
C O
A
t
50
30
t1t2t3
70
8.甲、乙、丙三种物质的溶解度曲线如右图所示。
据图回答:
(1)20℃时,甲、乙、丙三种物质的溶解度从大到小的排列
顺序为__________________;
(2)50℃时,50g乙物质加入到100克水中,充分搅拌后,
所
得溶液中溶质质量分数为_________(精确到%);
(3)50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同
时降温至0℃时,析出晶体最多的是,所得溶液中溶质质量分数最小的
是。
9.右图是A、B、C三种物质的溶解度曲线,据图回答:
(1) 30℃时A、B、C三种物质的溶解度由小到大的顺序
是(填写序号);
(2)30℃时,要配制45克A物质的饱和溶液,需A物质
克;
(3)30℃时,取等质量A、B、C三种物质的饱和溶液,温度降至10℃时,所得溶液的溶质质量分数由大到小的顺序为(填写序号)。
10.右图是甲、乙两种固体物质的溶解度曲线。
(1)t2℃时,甲物质的溶解度为;
(2)从图中你还能获得哪些信息(任填一条) _____ ;
(3)分析t1℃时,将10g乙物质放入100g水中,充分溶解后所得的溶液
是 (填“饱和”或“不饱和”)溶液。
欲使t2℃时乙物质的饱和溶液变为不饱和溶液,可采取的方法 (任填一种方法)。
11.右图是物质A、B、C的溶解度曲线,试根据图像回答:
Ⅰ.温度为℃时,三种物质溶解度大小关系是 __ ;
Ⅱ.此外由该图你还能获得的信息有
①;
②。
Ⅲ.℃时,A物质55克放入50克水,所得溶液 ______
(填饱和溶液、不饱和溶液),其溶液的溶质质量分数为 _ 。
12.右图为A、B两种物质的溶解度曲线图,回答下列问题:
⑴ t2℃时,曲线A、B的交叉点表示的含义是;
⑵ t3℃时,将30gA物质溶于50g水中,得到的溶液的溶质质
量分数为;
⑶要从A和B的混合物中分离出A,可采用的方法。
13.30℃时,分别向盛有10g水的A、B两支试管中,加入
等质量的甲、乙两种固体物质,使其充分溶解,
可观察到如右图1所示的现象。
(1)30℃时,(填“A”或“B”)试管的
溶液一定是饱和溶液。
(2)右图2中可表示甲物质的溶解度曲线的是 __ (填“a”或“b”)。
A试管中剩余的固体继续溶解可采用或的方法。
(3)测得B试管中所得溶液的质量分数为33.3%,则在℃时该溶液可以达到饱和,并在右图中画出该点。
14.右图是甲、乙两种固体物质的溶解度曲线,试回答下列相关问题。
①t2℃时,甲的溶解度为 ___ g∕100 g水,t 1℃时,甲乙两物质的溶解度大小为:甲 ___乙(填“>”、“<”、或“=”)
②若甲中含有少量乙,要提纯甲,可用的方法是。
③t2℃时,30g甲物质加入到50g水中不断搅拌,所得溶液溶质的质量分数是_______(精确到%)。
S(g/100g水)
10
20
30
40
50
t t t(℃)
甲
乙
15.右图是某固体物质的溶解度曲线
①t2℃时,该物质的溶解度是________ g/100g水。
②t1℃时,将20g该物质放入100g水中,充分溶
解后所得的溶液是 ____(填“饱和”或“不饱和”)溶液。
③将该物质的饱和溶液由t1℃升至t2℃时,溶质质量分数的变化是__________(选填“变大”、“变小”或“不变”)。
④t3℃时b点表示溶液处于_____ (填“饱和”或“不饱和”)状态。
甲
40-
20-
t(℃)
t3
b
·
S(g/100g水)
16.下图是A、B、C三种固体物质的溶解度曲线。
t1℃时,将25 gA、B、C三种固体分别加入100 g水中。
则:(1)t2℃时,A、B、C三种物质的溶解度由大到小顺序________________。
(2)t1℃时,所得三种物质的溶液中为不饱和溶液
的是___________,其溶液的溶质质量分数为______________;
(3)t3℃时,A、B、C三种物质的溶解度都为_________g/100g水;
(4)若将温度由t1℃升至 t4℃,三种溶液的溶质质量分数的
大小关系为 ________ 。
17.如图是A、B两种固体的溶解度曲线,请回答下列问题
① 10℃时,S(A) ___ S (B)。
(填“>”、“<”或“=”)
② 30℃时,B的溶解度为 ____ g/100g水;
③ A中混有少量B,提纯A可采用的方法是 ____ 。
④ 50℃时,恰好完全溶解120 g A形成饱和溶液,需要水 _______ g。