2008年全球批准上市新药回顾与展望
- 格式:doc
- 大小:96.50 KB
- 文档页数:8

利伐沙班的市场动态和临床研究进展利伐沙班(Rivaroxaban,商品名Xarelto),是全球第一个高选择性直接抑制因子Xa的口服抗凝药。
通过直接抑制因子Xa可以中断凝血瀑布的内源性和外源性途径,抑制凝血酶的产生和血栓形成。
利伐沙班由强生和拜耳公司研制开发,用于择期髋关节或膝关节置换手术成年患者的抗凝药物,以预防静脉血栓形成(VTE)。
利伐沙班片是唯一的一种疗效始终优于依诺肝素的新型口服抗凝药,日服一次,膝关节置换术后患者应连续服用12天,髋关节置换术后患者应连续服用35天。
此药物还有预防房颤患者中风的预防和其它临床疾病的潜力。
利伐沙班已在全球100多个国家获得批准,并由拜耳公司在超过75个国家成功上市。
一.研发背景:血栓是人类健康的一大杀手,但与其他更加引人关注的疾病相比,普通民众对血栓造成的危害却知之甚少。
仅静脉血栓栓塞症(VTE)每年就夺去欧盟地区50万人的生命。
静脉血栓栓塞症(VTE)是深静脉血栓形成(DVT)和肺栓塞(PE)的统称,危险性最大的是已经接受了全髋关节置换手术(THR)或全膝关节置换手术(TKR)的病人。
据估计,50%的THR病人以及60%的TKR病人在手术后会发生血栓。
在美国,华法林是目前唯一的一种获得美国FDA批准,用来预防手术后静脉血栓栓塞症及心房颤动的口服抗血栓药物。
经过50多年的临床使用,已被证明是安全有效的。
但是,华法林在使用时受到诸多限制,例如该药与许多常用药物及食品一起服用时会产生相互作用;该药的治疗作用必须由全科医生利用国际标准化比率(INR)血液测试方法进行监测,以确保病人使用恰当而又安全的剂量。
目前,以勃林格殷格翰的达比加群和拜耳的利伐沙班为代表的一大批新型药物正陆续走向市场。
第一只进入血栓治疗市场的新药是勃林格殷格翰的达比加群,该药于2008年初在欧洲推出。
紧随达比加群进入市场的是拜耳公司生产的利伐沙班,该药于2008年10月在欧洲上市。
利伐沙班是一种口服Xa因子抑制剂。

国际新药研发的前景展望随着科技的不断发展,新药的研发也进入到了一个新的时期。
国际新药研发的前景充满了无限的可能性,未来的市场将充满了机遇。
本文将从新药研发的现状、趋势和前景等多个方面进行探讨,以期为大家提供更深入的了解。
一、新药研发的现状目前,国际新药研发行业正处于一个高速发展的阶段。
据统计,全球每年都会有近5000种药物研发上市。
其中,大部分都涉及到治疗癌症、心血管疾病和神经疾病等领域。
在新药的研发中,美国、欧洲和日本等国家一直是全球的领先者。
他们在资金、技术和人才等方面的优势非常明显。
二、新药研发的趋势随着人类对健康的重视,新药研发也在不断地走向更加人性化的方向。
市场上越来越多的新药不仅是基于分子生物学的研究,也包括了生物制品和遗传工程等领域的应用。
此外,一些高科技手段,如人工智能、基因编辑技术等,也正在被广泛应用于新药的研发中。
尽管这一领域还面临许多挑战,但已经开始展现出现代世界研发新药的启示性趋势。
三、国际新药研发的发展趋势近年来,国际新药研发行业正在迈向更加个性化、准确和智能的医学时代。
世界各地研发新药的技术和能力正在不断提高,科技进步和创新思维加速推动新药研发技术和治疗领域的进步。
此外,新药的研发周期也在逐渐缩短,因为新技术和方法可以有效地加快临床试验和药物批准的时间。
国际新药研发行业将不断走向更加创新、更加高效的方向。
四、国际新药研发的前景未来,国际新药研发的前景将充满机遇和挑战。
随着新技术的发展和人类健康意识不断提高,对于新药的需求将会持续增长。
因此,新药研发行业在未来将面临更激烈的竞争和更加严苛的法规要求。
同时,人们对新药的安全性和有效性的要求也将越来越高。
今日的药物,必须传统与现代相结合,使创新更加精准,保障药品的安全性和有效性。
总之,国际新药研发正处于飞跃发展的时期,未来充满了机遇和挑战。
在全球经济一体化的大背景下,国际间的合作将成为新药研发的一个重要趋势。
同时,需要强调的是,高效率生产新药的研发模型的成功成功需要与投资人、产业界、政府和学术界紧密合作,通过技术、政策和财务支持确保按照合理的方式为所有患者获得良好的生命价值。

模拟题一一、单选题1.与第二性征有关的是:A.甲状腺激素B.雄激素C.胰岛素D.皮质醇答案:b答案要点:2.新药研制单位向国家食品药品监督管理局药品评审中心进行注册申请和技术评审必须呈报的内容之一,也是新药评价的最后阶段的是:A.新药临床前研究B.新药临床试验Ⅰ期C.新药临床试验Ⅱ期D.新药临床药理评价答案:d答案要点:3.下列哪一器官既是生殖器官也是内分泌腺:A.脑垂体B.胰岛C.肾上腺D.卵巢答案:d答案要点:4.根据IMS 估计,2005 年全球药品市场将突破:A.4000 亿美元B.5000 亿美元C.6000 亿美元D.7000 亿美元答案:c答案要点:5.关于会员公司支付被邀请参加会议的医疗卫生专业人士的随同人员(客人)的费用,下列哪项描述是正确的:A.紧急情况下:比如生病住院,可以支付并不需要发票B.对被邀请的医疗卫生专业人员的配偶可以支付费用C.对这类人员不能支付任何费用D.虽然其配偶没有被邀请参加会议,如果配偶是医疗卫生专业人士,其费用可以支付答案:c答案要点:6.“推广”在准则中是指:A.指由某会员通过各种方式——包括口头、书面、电子形式及互联网等进行的、以促进其药品的处方、推荐、供应、用于病人或为病人自用等为目的的、针对医疗卫生专业人士所进行的或组织、赞助的任何行为或活动B.只是用于推广医药产品相关活动的广告C.药师与病人之间的沟通D.药品的特殊销售答案:a答案要点:7.中国制药企业试行《药品生产质量管理规范》(GMP)始于:A.1982 年B.1992 年C.1998 年D.2000 年答案:a答案要点:姓名单位准考证号分数密封线8.如果在国际的科学大会或座谈会上需要通过展示窗或直接向出席者分发的方式传送某个尚未在会议地所在国注册或者虽注册但内容和条件与其他国家有所不同的药品的推广信息,那么关于该推广行为须满足的条件,下列哪项描述是不正确的:A.会议必须是真正国际性的科学会议,并且至少有一个参会者是来自举办会议国家以外的B.尚未在会议所在国/ 地区注册的药品的推广材料(不包括推广辅助用品)中应包含该药品已在哪些国家获得注册的适当说明,同时声明该药品尚未在该当地获得注册C.如某药品虽然在会议所在国/ 地区获得上市许可,但其推广材料中含有经会议地所在国/ 地区以外的其他国家获得批准的新的处方信息(适应症、警告等),则推广材料应同时声明该药品的注册内容和条件在各国之间有所不同D.推广材料中应明示药品已获注册的国家、及药品尚未在该当地获得注册的事实答案:a答案要点:9.下列描述中,哪项是不正确的:A.会员不得向医疗卫生专业人士提供金钱利益或其替代物(包括捐赠、奖学金、补助、赞助、咨询合同及教育或其他与其执业相关的名目)以换取后者对其药品的处方、推荐、采购、供应及对病人使用,或在将来继续进行上述活动的承诺B.也不得以任何方式或条件承诺提供或提供可能对医疗卫生专业人士的处方行为产生不正当影响的其他任何利益C.不管准则中的规定,只要律师认为不违法,医药代表可以向医疗卫生专业人士提供财务上的利益D.会员可以与医疗卫生专业人士签约,由后者提供真实的咨询服务,并向其支付合理的报酬及食宿和差旅补偿;但此类咨询服务提供的方式或条件均不应当对有关医疗卫生专业人士的处方行为产生不正当影响答案:c答案要点:10.普萘洛尔口服吸收良好,但经过肝脏后,只有30%的药物达到体循环,以致血药浓度较低,下列哪种说法较合适:A.药物活性低B.药物效价强度低C.生物利用度低D.化疗指数低答案:c答案要点:11.从___起,我国所有药品制剂和原料药实现了在GMP 条件下生产,实施药品GMP 工作取得了重大阶段性成果:A.2005 年1 月1 日B.2004 年7 月1 日C.2002 年7 月1 日D.2003 年1 月1 日答案:b答案要点:12.眼球壁分为___层A.2B.3C.4D.5答案:b答案要点:13.关于抗原和抗体的描述,下列错误的是:A.抗体就是免疫球蛋白B.过敏也称超敏反应C.变应原进入体内后能引起IgG 类抗体产生D.能刺激机体产生抗体的物质统称为抗原答案:c答案要点:14.下列各组腺体中,都属于内分泌腺的是:A.唾液腺和胰腺B.肾上腺和性腺C.甲状腺和肝脏D.胃腺和肠腺姓名单位准考证号分数密封线答案:b答案要点:15.关于细胞核的描述,以下错误的是:A.是细胞遗传和代谢活动的控制中心B.原核细胞没有核膜C.细胞可以分为原核细胞和真核细胞两大类D.当细胞分裂时,染色体便逐渐螺旋化而卷缩成一定形态的染色质答案:b答案要点:16.负责疾病预防控制和公共卫生技术管理和服务职能的单位是:A.卫生监督所B.卫生部C.SFDAD.疾病预防控制中心答案:d答案要点:17.与急性胰腺炎发病密切有关的是:A.慢性浅表性胃炎B.胆石症C.消化性溃疡D.非溃疡性消化不良答案:b答案要点:18.“会员公司”(“会员”)在准则中是指:A.所有在中国有执照的企业B.“会员公司”指药品研制和开发行业委员会的会员,而成为会员的条件之一,就是遵守本《RDPAC 准则》C.所有在中国有执照的制药企业D.所有在中国有药品销售执照的公司答案:b答案要点:19.医药代表的作用不包括:A.作为药品发明者与临床医生之间的沟通桥梁B.作为医疗卫生专业人士临床药物使用信息传递给药物发明者的信息途径C.关心工作繁忙的医生的个人事务D.给医疗卫生专业人员传递药物临床的最新进展答案:c答案要点:20.属于β2 肾上腺素受体激动剂的是:A.沙丁胺醇B.异丙托溴胺C.二丙酸倍氯米松D.孟鲁司特答案:a答案要点:21.药物作用的基本表现主要是机体器官组织:A.功能升高或兴奋B.功能降低或抑制C.兴奋和/或抑制D.产生新的功能答案:c答案要点:22.眼球包括:A.眼球壁、眼内腔和内容物、神经和血管等组织B.眼球壁、内容物、神经和血管等组织C.眼球壁、眼内腔和神经和血管等组织D.眼内腔和内容物、神经和血管等组织姓名单位准考证号分数密封线答案:a答案要点:23.新药的临床研究必须遵循的原则是:A.《中华人民共和国药品管理法实施条例》B.《赫尔辛基宣言》C.《药品注册管理办法》D.《药品生产许可证》答案:b答案要点:24.药物作用是指:A.药理效应B.药物具有的特异性作用C.对不同脏器的选择性作用D.药物对机体细胞间的初始反应答案:d答案要点:25.《药品生产质量管理规范》缩写为:A.GMPB.GCPC.GSPD.GLP答案:a答案要点:26.浆膜主要分布于:A.关节囊内层B.鼻腔C.气道D.胸膜答案:d答案要点:27.药物作用的两重性指:A.既有对因治疗作用,又有对症治疗作用B.既有副作用,又有毒性作用C.既有治疗作用,又有不良反应D.既有局部作用,又有全身作用答案:c答案要点:28.体内带有病原体,并不断向体外排出病原体的人或动物被称为:A.传染源B.传播途径C.易感人群D.健康人群答案:a答案要点:29.关于剂型的分类,下列描述错误的是:A.软膏剂为半固体剂型B.胶浆剂为液体剂型C.气雾剂为气体分散型D.栓剂为半固体剂型答案:d答案要点:30.激素所致副作用主要有:A.继发感染B.高血压C.糖尿病D.以上全对姓名单位准考证号分数密封线答案:d答案要点:31.2004 年7 月1 日起,我国全部实现GMP 条件下生产的是:A.药品制剂B.中药C.原料药D.药品制剂和原料药答案:d答案要点:32.弱酸性药物与抗酸药物同服时,比单用该弱酸性药物:A.在胃中解离增多,自胃吸收增多B.在胃中解离减少,自胃吸收增多C.在胃中解离减少,自胃吸收减少D.在胃中解离增多,自胃吸收减少答案:d答案要点:33.关于突触的描述,下列错误的是:A.突触是神经元与神经元之间特化的细胞连接B.突触也是神经元与肌细胞、腺细胞等之间特化的细胞连接C.化学性突触由突触前成分、突触间隙和突触后成分组成D.突触小泡内含有神经递质的受体答案:d答案要点:34.关于排卵期,下述哪项描述是正确的:A.宫颈粘液受雌激素影响变得稀薄,易于精子穿透,进入宫腔B.宫颈粘液受雌激素影响变得粘稠,易于精子穿透,进入宫腔C.宫颈粘液受雌激素影响变得稀薄,精子难穿透,进入宫腔D.宫颈粘液受雌激素影响变得粘稠,精子难穿透,进入宫腔答案:c答案要点:35.下列哪项不属于传染源:A.病人B.慢性病原携带者C.受染动物D.健康人群答案:d答案要点:36.下列哪项不是糖皮质激素的常见副作用:A.胃粘膜损害B.血糖升高C.过敏D.骨质疏松答案:c答案要点:37.单糖浆的含糖浓度以g/ml 表示应为多少:A.70%B.75%C.80%D.85%答案:d答案要点:38.关于液体制剂的质量要求不包括:A.液体制剂要求剂量准确、稳定,无刺激性,并具有一定的防腐能力B.均相液体制剂应均匀澄明C.非均相液体制剂应粒径小且均匀,并具有良好的再分散性D.液体制剂应是澄明溶液姓名单位准考证号分数密封线答案:d答案要点:39.肺癌一般不属于下列哪一个科的疾病:A.呼吸科B.消化科C.肿瘤科D.胸外科答案:b答案要点:40.下列药物中哪一种的吸收不受首关消除效应的影响:A.吗啡B.普萘洛尔C.氢氯噻嗪D.硝酸甘油答案:d答案要点:41.关于液体制剂的特点,下列描述正确的是:A.固体制剂制成液体制剂后,生物利用度降低B.药物分散度大,吸收快,药效发挥迅速C.液体制剂分散度大,不易引起化学降解D.不适于人体腔道给药答案:b答案要点:42.乳腺小叶和输乳管排列方向为:A.均以乳头为中心放射状排列B.均为垂直排列C.平行排列D.互相交错排列答案:a答案要点:43.关于剂型的描述,下列错误的是:A.剂型是指为适应治疗或预防的需要而将药物制备的不同给药形式B.同一种药物可以有多种剂型C.剂型指的是某一药物的具体品种D.同一药物也可制成多种剂型答案:c答案要点:44.药动学是研究:A.机体如何对药物进行处理B.药物如何影响机体C.药物发生动力学变化的原因D.合理用药的治疗方案答案:a答案要点:45.制备5%碘的水溶液,通常可采用下列哪种方法:A.制成盐类B.制成酯类C.加增溶剂D.加助溶剂答案:d答案要点:46.带状疱疹患者局部皮损水疱已破,渗出明显,宜用:A.炉甘石洗剂外用B.硼酸湿敷C.阿昔洛韦软膏外用D.万乃洛韦软膏外用姓名单位准考证号分数密封线答案:b答案要点:47.药物临床评价是指:A.对上市药品的治疗效果、不良反应等进行评估B.新药上市以后对药品的理化性质和质量的评估C.新药临床研究在未上市以前进行的临床评估D.药物药理毒理研究以便为临床使用打基础的评估答案:a答案要点:48.最新版“药品行业推广行为准则”的更新时间为:A.2008 年B.2009 年C.2010 年D.2011 年答案:d答案要点:49.下列哪种方法不能增加药物的溶解度:A.加入助溶剂B.加入非离子表面活性剂C.制成盐类D.加入助悬剂答案:d答案要点:50.药品费用是卫生总费用的重要组成部分,目前美国、欧洲各国和日本的药品费用占卫生总费用的比例大约分别为:A.15%、10%和20%B.10%、15%和25%C.10%、15%和20%D.15%、10%和25%答案:c答案要点:51.下列有关类风湿性关节炎的叙述何者错误:A.以滑膜关节发炎为特征B.可侵犯任何年龄群C.男性的罹患率较女性高D.病情会因心身压力而加重答案:c答案要点:52.利尿剂利尿作用的原理包括:A.抑制肾小球Na+的过滤B.抑制近曲小管Na+重吸收C.促进肾小管K+的分泌D.抑制肾小管对Na+、Cl-的主动重吸收答案:d答案要点:53.主管全国药品不良反应监测工作的部门是:A.卫生部B.国家药典委员会C.国家食品药品监督管理局D.国家经贸委医药管理司答案:c答案要点:54.医院主要的组织结构部门不包括:A.职能处室B.临床科室C.医技科室姓名单位准考证号分数密封线D.心内科答案:d答案要点:55.下列哪种药物属于糖皮质激素:A.可待因B.特布他林C.二丙酸倍氯米松D.沙丁胺醇答案:c答案要点:56.关于招待的描述,下列哪项是不正确的:A.所有的互动交流活动都应当选择在有助于实现科学教育的目标及会议的目的、适当的地点举办B.社交,比如娱乐或/和餐饮不能超过每人人民币300 元C.被邀请者的客人也可以参加宴请D.一般的民族舞蹈表演或本地歌手的演出(不是著名的电视或流行音乐歌星)可以称之为适度的娱乐答案:c答案要点:57.关于细胞质的描述,以下错误的是:A.指质膜以内细胞核以外的胶体物质B.细胞质内的细胞器不包括内质网C.细胞器是指细胞质内除了核以外的具有一定形态、结构和功能的物体D.有些细胞器是某些生物所特有的答案:b答案要点:58.下列哪一项不可能是突触的结构:A.轴突末梢膜B.树突末梢膜C.神经细胞膜D.神经胶质细胞膜答案:d答案要点:59.关于兴奋性的描述,以下错误的是:A.组织细胞兴奋性的高低与阈值的大小呈反变量关系B.组织细胞对刺激产生动作电位的能力称为兴奋性C.兴奋性高的组织细胞,刺激阈值较高D.刺激是指能引起机体发生一定反应的内外环境条件的变化答案:c答案要点:60.关于急性胰腺炎的发病,下列正确的描述是:A.由细菌感染引起B.由缺血引起C.与胃酸分泌过高有关D.由胰酶自身消化引起答案:d答案要点:61.关于类风湿性关节炎的表现正确的是:A.本病最终使关节骨性僵直,如掌指关节常强直于桡偏位畸形B.查体关节部位压痛,主动活动受限,被动活动无异常C.关节软骨被破坏,关节间隙狭窄,附近的骨质明显硬化D.15-20%的患者可出现类风湿结节答案:d答案要点:62.下列哪类药物具有支气管舒张作用:A.β1 受体激动剂姓名单位准考证号分数密封线B.β2 受体激动剂C.β1 受体阻滞剂D.β2 受体阻滞剂答案:b答案要点:63.关于推广信息的标准,下列描述哪项是不正确的:A.推广活动所传递的信息不得与经中国药品主管部门批准的药品标准不一致B.推广信息应当清楚、易理解、准确、全面、公正、客观、且达到足以使相对人能就有关药品的治疗价值形成自己观点的完整程度C.药品推广信息应以对所有相关证据所作的最新评估为依据并清楚地反映出相关证据事实D.可使用诸如“安全”和“无副作用”之类的描述性词句答案:d答案要点:64.药效学是研究:A.药物的疗效B.药物在体内的变化过程C.药物对机体的作用规律D.影响药效的因素答案:c答案要点:65.药理效应是:A.药物的初始作用B.药物作用的结果C.药物的特异性D.药物的选择性答案:b答案要点:66.在我国,负责全国新药试产期的临床试验(Ⅳ期)、市场药物再评价等工作的部门是:A.国家食品药品监督管理局药品评价中心B.中国药品生物制品检定所C.国家经贸委医药管理司D.卫生部答案:a答案要点:67.药物的概念是:A.预防疾病的活性物质B.防治疾病的活性物质C.治疗疾病的活性物质D.预防、诊断和治疗疾病的活性物质答案:d答案要点:68.关于样品的描述,下列哪项是不正确的:A.在准则中关于“样品”的规定是在遵守中国法律法规的前提下的B.样品上应清楚地标注“样品”或“非卖品”字样C.假如没有外观损坏,回收的样品可以销售D.会员应建立有效的控制和责任机制,包括对已交付给医药代表的样品如何管理答案:c答案要点:69.符合溃疡性结肠炎的描述是:A.以肉芽肿形成为特征性病变B.病变多局限于粘膜和粘膜下层C.形成大量腺瘤性息肉,呈现本病所特有的卵石征影像D.由金黄色葡萄球菌感染引起答案:b答案要点:70.医药代表认证的学习资料中,下列哪部分是最重要的:姓名单位准考证号分数密封线A.医疗卫生和报销制度部分B.医学科学部分C.世界与中国医药市场部分D.行为准则部分答案:d答案要点:71.乳腺手术选择放射状切口,可以减少下列哪项的损伤:A.皮肤B.纤维组织C.乳腺和输乳管D.乳晕答案:c答案要点:72.“医疗卫生专业人士”在准则中是指:A.专门销售健康产品的人B.医疗机构全体人员C.指医疗、牙科、药剂或护理领域中的专业人员,或其他任何在其专业活动中可能开具药品处方或推荐、采购、供应药品或将药品用于病人的其他人员D.从事某些专业领域的医疗专家答案:c答案要点:73.关于心脏神经支配,下列哪项描述是正确的:A.交感神经的功能是使心率降低,心肌收缩力增强B.交感神经的功能是使心率加快,心肌收缩力减弱C.副交感神经的作用是使心率降低,心肌收缩力减弱D.副交感神经的作用是使心率加快,心肌收缩力增强答案:c答案要点:74.RDPAC 第一版“药品行业推广行为准则”的发布时间为:A.1995 年B.1999 年C.2002 年D.2006 年答案:b答案要点:75.属于吸入激素的是:A.沙丁胺醇B.异丙托溴胺C.二丙酸倍氯米松D.孟鲁司特答案:c答案要点:76.下列哪项描述是正确的:A.眼球壁外层由角膜和葡萄膜组成B.眼球壁外层由角膜和巩膜组成C.眼球壁外层由角膜和视网膜组成D.眼球壁外层由葡萄膜和巩膜组成答案:b答案要点:77.ADR 的评价方法中宏观评价方法包括:A.病例对照研究、队列研究B.大型数据库和记录联接系统C.自发报告系统的评价方法D.以上都是答案:d答案要点:姓名单位准考证号分数密封线78.弱酸性药物从胃肠道吸收的主要部位是:A.胃粘膜B.小肠上段C.横结肠D.乙状结肠答案:a答案要点:79.A 型不良反应与下列哪些因素有关:A.药物吸收、分布B.药物与血浆蛋白的结合C.药物的代谢、排泄D.以上都是答案:d答案要点:80.关于推广的透明度,下列描述哪项是不正确的:A.不得将临床评估、药品上市后的监测和反应项目及获得上市许可后的研究活动等变成变相的药品推广,药品推广均须以科学和教育为目的B.对于由某公司赞助的、与药品及其使用相关的材料,无论其性质是否属于推广,均应明示该材料系由某公司赞助C.当公司以资助或其他方式安排将其推广材料刊登在杂志上,这些推广材料不得有使人误解其为独立的编者评论之嫌D.一旦临床试验获得批准,药品就可以在中国推广应用答案:d答案要点:81.关于免疫应答的描述,下列错误的是:A.这一过程包括免疫细胞对抗原分子的识别B.这一过程包括免疫细胞的活化和分化C.这一过程包括抗体性物质进入机体后激发免疫细胞活化D.这一过程包括效应细胞和效应分子的排异作用答案:c答案要点:82.关于感受器的描述,下列不正确的是:A.感受器是感受刺激的结构B.感受器是直接产生感觉的结构C.感受器能转换能量形式D.感受器参与反射和形成感觉答案:b答案要点:83.对于药品相关的网站,下列描述哪项是不正确的:A.制药公司的名称以及网页推广所针对的受众应一目了然B.内容应适于其针对的受众阅读C.其制作(内容、链接等)对其所针对的受众而言应适当、醒目D.对于某个国家的药品特殊信息不需要遵守当地的法律法规答案:d答案要点:84.洗剂不能用于下列哪种皮损:A.无渗出红斑B.水疱,无糜烂C.结节性丘疹,瘙痒D.脓疱疮,糜烂、渗液答案:d答案要点:85.急性膀胱炎感染菌多是:A.葡萄球菌B.大肠杆菌C.链球菌D.铜绿假单胞菌姓名单位准考证号分数密封线答案:b答案要点:86.关于造影剂,下列哪项描述是错误的:A.MRI 对比剂是临床上最常用的对比剂B.X 线对比剂能够用于X 线检查和CT 扫描C.X 线对比剂分为阳性和阴性两种D.会影响身体内的电磁辐射或超声波能量答案:a答案要点:87.全球药品市场从上个世纪70 年代开始至今,大致发生了如下的增长历史:A.从70 年代的15%左右的高速增长,到80 年代10%左右的增长,90 年代增长速度放缓,2004-2005 年又出现了新的高速增长B.从70 年代的缓慢增长,到80 年代15%左右的高速增长,90 年代10%左右的增长,2004-2005 年又出现了新的高速增长C.从70 年代的缓慢增长,到80 年代10%左右的增长,90 年代15%左右的高速增长,2004 -2005 年出现了增长放缓D.从70 年代的10%左右的增长,到80 年代15%左右的高速增长,90 年代增长速度放缓,2004-2005 年又出现了新的高速增长答案:a答案要点:88.关于临床药理学的描述,下列正确的是:A.是以人体和试验动物为对象,研究药物与机体相互作用规律的学科B.是以人体为对象,研究药物与机体相互作用规律的学科C.临床药理学又名药物治疗学D.药理学是临床药理学的简称答案:b答案要点:89.关于会员赞助医疗卫生专业人士出席互动交流活动应满足的条件,下列描述哪项是不正确的:A.有关互动交流活动符合本准则6.5 条关于招待活动的规定B.对医疗卫生专业人士赞助应限于对旅行、餐费、住宿及会议注册费的支付C.给医疗卫生专业人士一笔由于离开其工作而出席会议的时间补偿D.对医疗卫生专业人士提供赞助不得以其对某药品的处方、推荐或推广等义务为条件答案:c答案要点:90.药理学研究的中心内容是:A.药物的作用、用途和不良反应B.药物的作用及原理C.药物的不良反应和给药方法D.药效学、药动学及影响药物作用的因素答案:d答案要点:91.会员公司与医疗卫生专业人士的互动应专注于:A.保持关系B.销售药品C.满足个人需要D.有利于患者并改善药品的使用答案:d答案要点:92.B 型不良反应中药物方面的因素指:A.药物有效成份分解B.药物的添加剂C.药物的增溶剂D.以上都是答案:d答案要点:93.临床药理学的研究对象是:A.人体和实验动物姓名单位准考证号分数密封线B.人体C.实验动物D.药物答案:b答案要点:94.关于细胞膜的描述,以下错误的是:A.细胞膜也称质膜B.它使细胞成为具有一定形态结构的单位C.通过光学显微镜可以观察到质膜上的细微结构D.质膜对物质运输、信息传递都具有重要的作用答案:c答案要点:95.“药品”在准则中是指:A.所有在国际上销售的药品B.用于治疗病人的药物成分C.中药D.含义与《药品管理法》第102 条“药品”的定义相同答案:d答案要点:96.新时期卫生工作的方针是:A.以农村为重点,预防为主,中西医并重,依靠科技与教育,动员全社会参与,为人民健康服务,为社会主义现代化建设服务B.预防为主,以农村为重点,依靠科技与教育,动员全社会参与,为人民健康服务,中西医并重,为社会主义现代化建设服务C.中西医并重,以农村为重点,依靠科技与教育,动员全社会参与,为人民健康服务,预防为主,为社会主义现代化建设服务D.预防为主,中西医并重,依靠科技与教育,动员全社会参与,以农村为重点,为人民健康服务,为社会主义现代化建设服务答案:a答案要点:97.细胞去极化发生于:A.细胞质内B.内质网C.细胞外间质D.细胞膜上答案:d答案要点:98.下列哪项不属于内分泌腺:A.甲状腺B.肾上腺C.腮腺D.胰岛。

美国礼来公司(Eli Lilly and Company)是一家全球性的以研发为基础的医药公司,创立于1876年,总部位于美国印地安那州印第安纳波利斯市。
2008年礼来全球销售额突破200亿美元,业务遍及全球143 个国家和地区,雇佣员工四万多人。
礼来于1918年来到中国,将其第一个海外代表处设在上海。
在1993年重新回到中国。
已成为业界增长速度最快的制药公司之一。
至今,我们在苏州拥有一家独资企业:礼来苏州制药有限公司,30多家办事处,员工已超过1400人。
礼来全球研发中国总部也于2008年10月15日在上海张江高科技园区正式成立。
礼来在中国的许多医药领域居领先地位,如抗感染、中枢神经系统、肿瘤、内分泌等。
她的创新药物,不仅挽救病人生命、提高了大众的生活品质,同时也为患者、保健提供者和支付方创造了价值,降低了疾病治疗的成本。
作为全球十大制药企业之一, 礼来始终致力于履行企业社会责任。
礼来每年投入巨额资金用于回馈社会。
由于礼来在企业社会责任方面的突出贡献,礼来已连续三届荣获《商业周刊》杂志“最慷慨的公司”称号。
据《慈善纪事》(Chronicle of Philanthropy)显示,在接受调查的91家美国大型公司中,礼来2006年的捐献数量位居第六。
2007年礼来公司慈善捐赠总额约为3.15亿美元,其中包括价值约2.4亿美元的产品捐赠,均用于患者援助计划和国际人道主义事业。
2007年公司的捐赠总额大约占公司调整后收入(税前)的6%,再次使礼来成为世界最乐善好施的公司之一。
在中国,礼来也积极推动各项社会公益事业,善尽社会责任,致力成为企业公民的典范。
2008年礼来公司在华公益投入总计人民币四千余万元。
在南方周末2008中国企业社会责任评选中,礼来中国荣膺“2008世界500强企业慈善公益榜”第3名。
礼来公司有着注重内部培养的用人之道,我们愿意招聘处于职业发展初期的员工加入礼来共同成长并长期服务。
当公司出现岗位空缺时,我们能够从内部提拔员工任职或转岗。

生物制药技术的发展历程及未来趋势展望生物制药技术是一种利用生物体制备药物的技术,已经成为现代医药领域的重要领域。
该技术的发展历程可以追溯到上世纪50年代,目前发展已经取得了巨大的突破。
本文将对生物制药技术的发展历程进行回顾,并展望其未来的发展趋势。
生物制药技术的发展历程生物制药技术发源于人们对生物体内基因的探索和理解。
1953年,由于生物化学家Watson和Crick的发现,DNA结构的解析使人们开始掌握了从基因到蛋白质的过程。
1964年,根据Nirenberg和Khorana的研究,人们首次成功地合成了氨基酸序列,这为后来的基因工程技术打下了基础。
1978年,基因工程技术的成功应用标志着生物制药技术的崛起。
科学家们首次成功地将人类基因DNA转移到大肠杆菌中,并让其产生了人类胰岛素。
这项突破意味着人类可以利用这一方法生产大量的人类蛋白质,为生物制药技术的发展奠定了基础。
20世纪80年代,重组DNA技术的快速发展推动了生物制药技术的进一步发展。
这项技术使科学家们能够将感兴趣的基因从一个生物体转移到另一个生物体中,以使其表达特定的蛋白质。
这一技术为制备各种蛋白质药物提供了新的途径,如重组胰岛素、重组生长激素等。
随着基因测序技术的快速发展,21世纪初,全基因组测序的突破使得人类对基因的理解更为深入。
这一突破为生物制药技术的发展提供了新的机会。
科学家们开始研究更加复杂的细胞信号传导和代谢途径,以及研究人类疾病的基因缺陷,为新型药物的研发提供了更多可能性。
未来趋势展望未来,生物制药技术将朝着以下几个方向发展:1.个性化药物治疗:随着人类基因组学的发展,生物制药技术将更加注重个体差异化治疗。
通过基因测序等技术,可以对个人基因做出精确分析,从而为每个人提供量身定制的药物治疗方案。
2.基因编辑技术:随着基因编辑技术的不断发展,如CRISPR-Cas9技术的出现,生物制药技术将能够更精确地修复或修改患者体内的基因缺陷,为治疗基因相关性疾病提供强有力的手段。

创新药产业大盘点:未来20年最大投资机会,中国将拥有数个超千亿美元市值巨头整理丨玛丽莲西米露日前,西南证券发布了《行业步入3.0时代,中国正向创新药大国崛起》,创新药将是未来10-20年最大的投资机会,中国必将产生数个超千亿美元市值的制药巨头,数十个过千亿人民币市值的各领域龙头企业。
贝壳社对报告进行了摘编解读,以飨读者。
一、人才引进+科技进步助力中国成全球制药大国制药工业是国家战略支柱行业之一,其工业水平是一个国家综合实力的重要组成部分。
中国制药产业真正起步于本世纪初,经历了从无到有,从使用传统工艺到大规模运用现代技术的发展历程。
特别是改革开放以来,我国医药产业随着国家综合实力的提升驶入了快速发展通道。
国内医药制造工业收入从1999年的1324亿元,快速增长到了2010年的10169亿元,年复合增速达22.6%。
截至2016年底中国医药工业收入已达28062亿元,2010-2016年复合增速达18.4%,远超全球医药行业平均增速。
据IMS数据库统计,2010年中国药品市场规模位列全球第三,占比约8%,仅次于美国市场的40%和日本市场的9%。
随着以中国、印度为首的发展中国家崛起,以及政府在卫生健康产业上加大投入等有利因素驱动,以中国、巴西、俄罗斯和印度为代表的新兴医药市场正快速扩容。
据统计预测,2019年中国药品市场规模占全球份额比例将达到14%,仅次于美国38%的占比,接近欧洲五国家合计。
在人才需求方面,创新药的研发比仿制药的开发更需要全球一流人才作为支撑。
国内综合实力的不断提升和创业环境的改善,吸引着越来越多的高端留学人才归国。
以下是国家各部委以及地方政府推出的多个人才计划。
2012-2016年,中国的SCI(科学引文索引)论文数量为124.5万篇,仅次于美国。
生命科学领域的论文发表数也水涨船高,居世界第2位。
同期,中国在基于SCI数据库设计的含金量更高的统计指标数据库——ESI(基础科学指标库)评价体系中前进更快:近5年入围ESI高被引论文的数量约为上个5年的2.5倍。


全球制药近25年大事件回忆与现在相比,上世纪80年代的制药界相对简单,那时非专利药畅销的潮流尚未出现,品牌药的竞争也远不及当前剧烈,制药企业还无需为产品生命周期治理而费尽心机,如火如荼的DTC〔直面消费者〕广告还未广泛开展……从1981~2006年的25年间,全球制药界到底走了多远?从历年来的里程碑事件中,或许能够寻到答案。
大事纪年表1981年首次检测出AIDS病毒1981年6月5日美国疾病操纵中心的每周发病率和死亡率报告公布了5例患者的具体病症,此后被证实为AIDS患者。
此次公布日期被官方认定为HIV/AIDS流行的起始时刻。
首个ACE抑制剂上市百时美施贵宝公司〔Bristol-MyersSquibb〕的卡托普利〔captopril,Capoten〕获准用于治疗高血压和充血性心力衰竭,成为首个上市的血管紧张素转换酶〔ACE〕抑制剂和首批口服抗高血压药之一。
本品的上市是药物结构开发方面的重大突破。
此后10余年,ACE类药物迅猛开展,截至1997年,共计16种ACE抑制剂投进市场。
1982年首个重组DNA产品上市1982年,FDA批准了礼来公司〔EliLilly〕的重组人胰岛素〔insulin,Humulin〕,本品是全球首个采纳重组NDA技术的产品,也标志着全球首个基因工程药物的诞生。
1983年罕用药法案出台为鼓舞针对罕见疾病的药物开发,1983年美国通过罕用药法案,法案给予罕用药7年的市场独占期,并准许临床研究本钞票进行税收抵扣。
法案的出台为罕用药市场开展起到巨大的推动作用。
20年来外科手术领域的突破——环孢霉素上市至1983年肾移植手术已实施30余年,但患者仍面临体内排异咨询题的困扰,诺华公司〔Novartis〕环孢霉素〔cyclosporin,Sandimmune〕的上市特别大程度上缓解了体内免疫系统对移植器官的排异作用,本品可选择性抑制T细胞,是20年来外科手术领域的重大突破。
1984年Hatch-Waxman法案1984年通过的Hatch-Waxman法案为非专利药企业提供了诸多优惠的政策措施,实质上刺激了现代非专利药工业的开展。

按照美国食品及药品监督局(FDA)的定义,合同研究组织(Contract Research Organization,CRO)是指“a person [i.e., a legal person, which may be a corporation] that assumes, as an independent contractor with the sponsor, one or more of the obligations of a sponsor, e.g., design of a protocol, selection or monitoring of investigations, evaluation of reports, and preparation of materials to be submitted to the Food and Drug Administration." [21 CFR 312.3(b)]”。
CRO的雏形可追溯到20世纪70年代的美国的公立和私立研究机构,当时他们为制药工业界提供有限的临床前及部分临床试验服务。
到今天CRO已经发展成一个相对完备的技术服务工业体系,目前CRO提供的技术服务内容包括:新药产品开发、临床前试验及临床试验、数据管理、新药申请等,几乎涵盖了新药研发的整个过程。
2005年,全球制药企业及生物科技企业用于新药研发的投资约为570亿美元,而其中约140亿美元的业务外包给CRO进行的,比例达到25%左右。
这个数字有望在2010年增长到200亿美元。
当前,在全球新药R&D外包市场中,大型的跨国CROs占据着市场的主导地位并成为新药研发外包市场的主要驱动力。
据统计全球10个最大的上市交易的CRO拥有超过50%的市场份额,最大的公司大概占有12%的市场份额。
目前,全球CRO的市场总值约为163亿美元左右,并以每年约14%的速度增长。
我国新药研发的现状与对策2019-09-15【摘要】新药研发程度是衡量⼀个国家医药科技综合⽔平的重要体现,也是⼀个医药企业是否能做⼤做强的关系所在。
新药研发能⼒在先阶段⽇益成为医药研发的核⼼竞争⼒。
⽽⽇益困难的新药研发和研发经费以及国家政策导向使得本步履维艰的医药研发更加难上加难。
【关键词】新药研发;现状;对策1资料与⽅法1.1研究⽬的与意义随着⼊世后在WTO框架规则和TRIPs协议下,我国医药企业的主要竞争对⼿已经由国内的医药企业转变为跨国医药企业,⽽我国医药企业旧有的研发模式已经⽆法适应新时期的医药发展,必须开始⼤⼑阔斧的⾰新新药研发模式⽅能使处于新药研发初始阶段的我国医药⾏业在困难重重的形势下实现我国新药研发从仿制药向创新新药阶段跨越。
1.2研究⽅法通过查阅近些年来国内外⽂献资料,总结研究前⼈对于我国新药研发现状,提出对于我国新药研发的建议与对策。
纵观国内外新药研发的新药研发的出现的问题及对策,本论⽂简单陈述⼀下笔者对我国新药研发现状的认识与对⽇后我国新药研发出现的问题进⾏⼀下论述,阐发⾃⼰的观点。
2新药研发相关知识介绍2.1新药的定义新药的定义决定着新药审批的范围,在全球各个国家间的新药定义并不尽相同,有的国家以是否在国内⽣产过作为其是否为新药的标准,⽽有些则以是否在本国上市作为新药的标准,现在随着WTO贸易规则在全球的畅⾏,后者的更多的得到了认可。
2.2新药的注册分类按照《药品注册管理办法》规定,我国新药的注册分类分为以下四种情况:①化学药品;②中药、天然药物注册分类;③治疗性⽣物制品;④预防⽤⽣物制品。
2.3药品注册管理办法概述药品注册,是国家⾷品药品监督管理局依照《药品管理法》的规定,根据药品注册申请⼈的申请,对拟上市销售药品的安全性、有效性、质量可控性等进⾏审查,并决定是否同意其申请的审批过程。
在药品研制、⽣产、流通、使⽤的全过程监管中,药品注册管理是从源头上对药品安全性和有效性实施监管的重要⼿段,其根本⽬的是通过科学评价,保证上市药品安全有效,保障和促进公众健康。
全球医药市场新药研发与生产的发展现状摘要:近年来,随着医改的高速发展,怎么提升全球医药市场核心竞争力已经成为研究的重点。
全球医药市场新药研发与生产为了减少各种突发问题的发生,满足人们对药品安全的要求,在实际工作中需要在生产阶段完善现有的生产工艺验证模式,落实精细化的工作原则,保证新药生产能够具备较强的规范性,创新当前的工作体系。
因此相关工作人员需要严格按照新药生产的要求及标准,选择正确的工艺验证模式在实际中发挥应有的价值以及作用,全面的保证整体的验证作用,使最终数据能够具备较强的准确度,为新药的正常生产提供重要的基础。
关键词:全球医药市场;新药研发;生产;优化建议随着社会经济的不断发展,人们对健康管理要求越来越高,药品安全和食品安全逐渐扩大到大众的视野。
在此背景下制药企业在发展过程中需要优化生产阶段的验证管理模式,严格按照相关的标准选择对应的验证手段,减少各种质量问题的发生,从而为药品后续的使用提供重要的基础,提高制药企业的发展水平。
一、全球医药市场新药研发的特点和意义(一)技术难度大技术难度大是新药开发的特点之一,因为每科都需要拥有先进的技术和扎实的技术能力,新药的开发包括了药学、化学、生物学、药物分析及药理等多学科。
科研人员在新药研究的过程中必须合作努力,要尽可能多的掌握行业和生产运作等相关信息,还要剖析这些数据并做出意见反馈。
从技术上,不难看出新药开发是很困难的,对学者的专业能力要求也极高。
(二)投入的资金很多在新药的研究开发上,需要经过大量的学者从中探索,他们会利用大量的时间来进行研究,研究时间越久,投入的经费就越大。
一些国际性药业公司会将销售额的10%至15%投入到新药的开发中去。
可以看出,新药的研究需要大量的资金作为依托。
(三)专业性人才的稀缺就新药开发而言,其对专业能力的要求极高,但由于人才的稀缺,也给新药开发带来了一定的风险,新药开发需要大批量的专业人才。
但在医药企业中,不但专业人才紧缺,就连技术管理人员也十分紧俏,这也导致了项目管理的能力偏差。
抗高血压药物发展历程高血压是最常见的心血管疾病之一,也是导致充血性心力衰竭、脑卒中、冠心病、肾功能衰竭、主动脉瘤的发病率和病死率升高的主要危险因素。
在过去30年中,科研人员研究开发了几类新药来治疗高血压:60年代的利尿剂,70年代的β-受体阻滞剂,80年代的钙通道拮抗剂和血管紧张素转化酶抑制剂(ACEI)。
经过多年的临床应用,这些药物治疗效果得到了临床医生及患者的肯定。
但在临床应用过程中,这些药物的毒副作用也日渐明显。
随着人们对高血压发病机制认识的不断深入,针对新的更为有效的作用靶点的新药相继得到开发,并陆续获准上市。
20世纪80年代首个血管紧张素转化酶抑制剂(ACEI)卡托普利上市,随后上市了依那普利、赖诺普利、福辛普利等。
目前ACE抑制剂已成为临床高血压治疗的一个大类品种,俗称为普利类药物。
继普利类药物之后开发的血管紧张素Ⅱ受体拮抗剂(沙坦类)克服了ACE抑制剂可能产生的干咳等不良反应,其作用更具特异性,是目前新一类极具竞争力的高血压治疗药物。
从1994年首个血管紧张素Ⅱ受体拮抗剂氯沙坦上市至今,相继有多个单方和复方制剂获美国FDA批准上市,目前已成为高血压治疗的一线药物。
此类药物上市不久即以不可抵挡之势纷纷占领市场。
2001年,全球沙坦类药物的总销售额达56亿美元,氯沙坦、缬沙坦、厄贝沙坦和坎地沙坦进入了最畅销的200种品牌药行列,销售额合计为47.37亿美元。
其针对多种并发症如糖尿病和心力衰竭的疗效研究以及对于肾脏的有益作用也正在紧锣密鼓地进行着。
该类药物正逐渐渗透至整个心血管治疗领域,有望成为继ACE抑制剂后的又一大类极有发展潜力的降压药物。
2002年血管紧张素Ⅱ受体拮抗剂又添新成员:奥美沙坦(olmesartan,Benical)获美国FDA批准。
据IMS统计,2004年血管紧张素Ⅱ受体拮抗剂的市场销售额占据整个欧洲降压药市场的19.5%左右。
2000-2002年美国FDA批准的抗高血压药物的治疗应用,尽管新品种的上市有所放慢,但有关其新适应证以及联合用药的疗效研究则是近年来人们极为关注的热点。
新药研发的现状和未来趋势展望随着科技的飞速发展,人类对于健康和长寿的追求也日益增长。
而新药的研发则是实现这一目标的关键。
新药不仅可以治疗疾病,还能够提高生活质量,延长寿命。
本文将探讨新药研发的现状,并展望未来的趋势。
首先,我们来看一下新药研发的现状。
目前,新药的研发过程非常复杂和时间消耗巨大。
从发现一个潜在的药物分子到最终获得批准上市,整个过程可能需要花费数年甚至更长的时间。
这其中包括了大量的研究、试验和临床实验。
此外,新药研发还需要巨额的资金投入。
各种临床试验和研究会耗费大量资金,而只有很少数的候选药物最终能够成功走向市场。
然而,未来的趋势显示,新药研发将会迎来更多机遇。
科技的进步为改善生命质量提供了新的可能性。
例如,基因编辑技术的突破,使科学家能够更好地理解疾病的基因变异,并寻找到更精确的治疗方法。
此外,人工智能、大数据和机器学习等技术的应用也为新药研发提供了更多机会。
通过分析大量的生物医学数据,研究人员可以更好地预测疾病的发生和发展,并筛选出适合的药物。
在未来,新药的研发过程也将更加高效。
传统的药物研发模式非常耗时耗力,而新的技术和方法正在改变这一局面。
例如,虚拟药物筛选技术可以通过计算机模拟分子与靶点的相互作用,预测药物的疗效和副作用,从而减少研究实验的时间和成本。
基于人工智能的药物设计也有望缩短研发时间。
通过深度学习和神经网络,机器可以从海量数据中学习,快速发现潜在的药物分子结构。
此外,新药研发的未来还需要充分发挥全球化合作的力量。
疾病并不受国界限制,因此,全球范围内的合作和交流对于新药研发至关重要。
各国科研人员可以共享知识、资源和技术,加快新药的研发进程。
同时,政府和产业界也应加强合作,提供更多的资金和支持。
只有充分发挥全球化合作的优势,才能够更好地应对疾病挑战。
在未来,新药研发还可能面临一些挑战。
首先,药物审批和监管的程序亟需简化和加速。
目前,药物的上市审批过程非常繁琐,需要花费大量时间和资源。
新药研发的实际进展和期望收益医药研发是一个长期而复杂的过程,需要融合生物学、化学、医学等多个领域的知识。
从药物发现到临床试验,再到经过国家审查批准上市销售,历经多年并且涉及多个阶段的研发才能完成。
这一过程非常漫长且成本高昂,但是研制出一个能够挽救生命、改善治疗方式的新药,将会是我们社会的巨大进步。
实际进展从本质上来说,新药的研发主要是通过发现和设计化合物来治疗疾病。
根据国家药品监督管理局发布的数据,从1960年开始,全球共有超过1400个化合物上市,其中大部分用于治疗癌症、感染、自身免疫性和罕见病等领域。
纵观历史,大多数成功的新药都是通过突破性的新技术来发现的,并且他们都被证明是非常有效的治疗方法。
在目前的环境下,药物研发领域存在一些新的趋势。
一方面,众多制药公司正在放弃研发常规的小分子药物,而是将目光聚焦于更具创新性的治疗方式,例如基因治疗和细胞疗法等。
另一方面,在新型药物研发领域,研发时间也在逐渐缩短。
例如,基于肝移植药物索菲多病毒(HCV) 的直接作用抗病毒药物,几乎在十年内就从药物发现到药物上市,并且已成为治疗慢性丙型肝炎的首选药物。
期望收益药物研发的收益和回报周期是非常长的,但是如果能够成功研发出新的治疗方法,将会带来巨大的经济和社会效益。
因此,药品研发一直被认为是一项高风险、高回报的投资。
由此可见,药品研发需要大量的资金支持。
有学者认为,从一千亿美元的投资中成功研发出一件新药品的平均费用约为十年、十亿美元左右。
为了获得足够的收益,制药公司通常希望拥有自主知识产权,并且期待在市场上获得更高的利润。
此外,药物被批准上市后,制药公司需要承担人道主义责任,并确保药物的质量和安全,最终也需要保持持续的利润来维持公司的运营。
然而,在全球竞争日益激烈的药品市场中,研究开发新药的投资回报率不断下降。
因此,制药公司需要探索更多的合作方式,包括建立联合研发模式、加强技术平台共享、寻求政府支持等等。
另外,在药物平台杀手和回避市场风险方面,制药公司需要在早期进行商业推广,提供医学信息,和患者沟通,以明确产品新增加值。
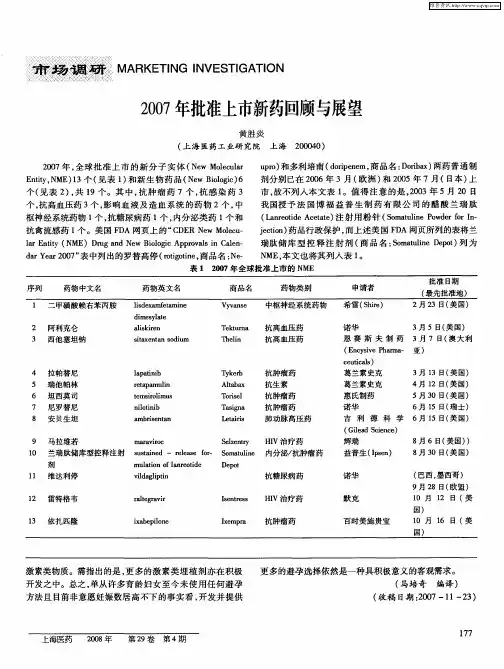
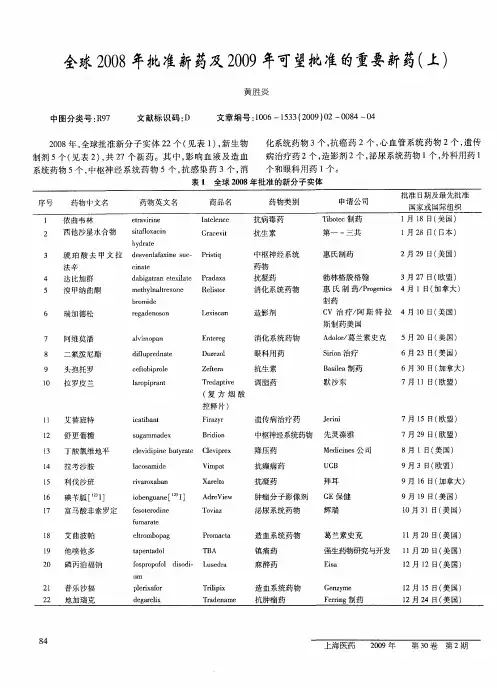
2008年全球批准上市新药回顾与展望时间:2009年03月30日14:392008年,全球批准上市的新分子实体(New Molecular Entity,NME)22个(见表1)和新生物药品(New Biologic)5个(见表2),共27个。
其中,影响血液及造血系统药物5个,中枢神经系统药物5个,抗感染药3个,消化系统药物3个,抗癌药2个,心血管系统药物2个,遗传病治疗药2个,造影剂2个,泌尿系统药物1个,外科用药1个和眼科用药1个。
美国FDA网页上的“CDER New Molecular En tity (NME) Drug and New Biologic Approvals in Calendar Year 2008”表中列出的盐酸苯达莫司汀(bendamustine hydrochloride,商品名:Treanda )、钆塞酸钠(gadoxetate disodium,商品名:Eovist)、丁苯那嗪(tetrabenazine,商品名:Xenazine)、西罗多辛(silodosin,商品名:Rapaflo)、卢非酰胺(Rufinamide,商品名:Banzel)和培格干扰素α-2b/利巴韦林(商品名:Pegpak)分别于2003年10月默克公司在德国、2004年拜耳保健制药(Bayer HealthCare Pharmaceuticals)公司在欧洲、2004年普雷斯特维克制药(Prestwick Pharmaceuticals)公司在加拿大、一些欧洲国家和澳大利亚、2006年沃森(Watson)公司在日本、2007年6月卫材(Eisai)公司以商品名Inovelon在德国、澳大利亚和斯堪的纳维亚以及2002年5月先灵葆雅公司在加拿大获准上市,故不一一列入本文表1和2中。
1 心血管药物1.1 复方烟酸/拉罗皮兰(laropiprant)控释片默沙东(Merck Sharp & Dohme)公司的复方烟酸/拉罗皮兰控释片 1 g/ 20 mg(商品名:Tredaptive),用于对脂质代谢障碍血症和原发性高胆固醇血症患者的低密度胆固醇(LDL-C,即“坏胆固醇”)、高密度胆固醇(HDL-C ,即“好胆固醇”)和甘油三酯调脂新治疗。
本品为双层片:上层为含拉罗皮兰速释层,下层为烟酸控释层。
据预测,拉罗皮兰年销售峰值可达20亿美元。
Tredaptive含有烟酸和抑制潮红新途径药拉罗皮兰。
在对4 700多例患者的临床研究中,本品降低LDL-C、升高HDL-C,还可减少甘油三酯的含量。
高LDL-C,低HDL-C和甘油三酯升高是诱发心脏病发作和休克的危险因素。
Tredaptive已获准用于治疗脂肪代谢障碍血症,特别适用于混合型脂肪代谢血症(特征是高LDL-C和甘油三酯、低HDL-C)患者和原发性高胆固醇血症(杂合遗传和非遗传)患者。
当单一采用他汀类药物降胆固醇无效时,应添加Tredaptive。
对不宜采用或患者不能耐受他汀类药物的患者,可单一采用Tredaptive治疗。
单独采用Tredaptive或与他汀类药物联合用药时,Tredaptive 2 g/40 mg服用24周可显著改善血中LDL-C、HDL-C和甘油三酯浓度。
开始研究时,一日Tredaptive 1 g/20 mg;治疗第4周后,Tredaptive 2 g/40 mg维持用药20周。
在12-24周的研究中,Tredaptive 2 g/40 mg 较安慰剂显著降低LDL-C浓度(-18%)、升高HDL-C浓度(20%)和降低甘油三酯浓度(-26%)。
Tredaptive 2 g/40 mg与辛伐他汀(20 mg或40 mg)联合用药12周降低LDL-C(-48%),升高HDL-C浓度(28%)和降低甘油三酯浓度(-33%)。
潮红较烟酸控释制剂显著减少。
患者通常对Tredaptive耐受性好,不良反应一般是轻度和暂时性的。
潮红是本品最常见的不良反应,主要出现在头、颈和上身。
其它不良反应是ALT或AST升高,眩晕,头痛,感觉异常(麻木感、刺痛或皮肤灼热),腹泻,消化不良,恶心,呕吐,红斑(皮肤红),瘙痒,荨麻疹和潮热。
1.2 丁酸氯维地平(clevidipine butyrate)静脉注射用乳剂医药公司(The Medicines Company)产品(商品名:Cleviprex),用于降低不宜口服治疗或口服治疗无效的高血压。
丁酸氯维地平静脉注射用乳剂系一新颖的静脉抗高血压药品,代表了目前治疗药品的一项新进展,为重症监护室医生提供了快速、精确控制血压的新武器。
凭藉急救室、手术室和监护室所得数据,Cleviprex向医生提供了降血压重要的新观点。
新近临床实践发现,控制血压紧急升高和降低不良反应出现的危险性间存在着重要的相关性。
Cleviprex起效快,作用消除也快,可递增剂量精确地控制血压。
与目前许多静脉注射经肾和(或)肝代谢的抗高血压药不同,Cleviprex在血液和组织中代谢,因而不在体内蓄积。
在近10年中,尚无静脉注射的抗高血压新药上市。
Cleviprex是新一代静脉注射用二氢吡啶类钙通道阻滞药。
Cleviprex率先在美国获准上市是基于对1 406例治疗和手术患者6项Ⅲ期临床研究的结果。
所有Ⅲ期临床研究均符合其主要终点指标。
Cleviprex可引起全身性低血压和反射性心动过速。
最常见的不良反应(>2%):头痛,恶心和呕吐。
2 影响血液及造血系统的药物2.1 利伐沙班(rivaroxaban)片拜耳公司产品(商品名:Xarelto),一日1次1片预防选择性髋部或膝全替换手术患者静脉栓塞发生。
利伐沙班是拜耳公司在德国Wuppertal实验室开发的,是唯一的新一类口服抗凝药中的第一个,显示疗效优于常规治疗药依诺肝素。
本品在加拿大获准上市标志着最广泛研究此类药品的一个里程碑,拜耳公司在开创抗血栓治疗药新纪元中迈出的重要一步。
据预测,本品年销售额峰值可达20亿美元。
加拿大卫生部批准本品上市是基于包括3项近1万名进行选择性髋部或膝替换手术患者广泛的RECORDⅢ期临床研究(RECORD 1,2和3)数据。
这些研究结果显示,在逐一对比的2项研究(RECORD 1和3)和利伐沙班长期(5周)给药与依诺肝素短期(2周)给药研究(RECORD 2)中利伐沙班疗效显著优于依诺肝素。
在所有这些研究中,利伐沙班与依诺肝素的用药安全性相近,包括大出血的发生率低。
2.2 艾曲波帕(eltrombopag)片葛兰素史克公司产品(商品名:Promacta),用于以用皮质激素类甾体药物、免疫球蛋白治疗无效或脾切除术后慢性特发性血小板减少性紫癜(ITP)患者的血小板减少。
因艾曲波帕是首个获准治疗成人慢性ITP患者的口服非肽类血小板生成素受体激动剂,临床前和临床研究显示刺激本品可升高血小板的骨髓巨核细胞的增生和分化。
其批准治疗ITP患者是一重要里程碑。
防止血小板被破坏一直是治疗ITP患者的主要方法。
像艾曲波帕临床研究的新进展显示,增加血小板的产生来治疗此种疾病也起着重要作用。
对慢性ITP患者随机临床研究的大量数据支持了艾曲波帕的新药申请。
此适应证是基于两项关键的短期治疗和一项正在进行长期治疗ITP患者的临床研究数据。
艾曲波帕还正在进行治疗丙型肝炎病毒、慢性肝病引起的血小板减少症和肿瘤造成的血小板减少症的研究。
2.3 达比加群(dabigatran etexilate)胶囊勃林格殷格翰(Boehriger Ingelheim)公司新颖的口服凝血酶直接抑制剂(商品名:Pradaxa),率先在德国和英国销售。
剂量规格:达比加群75 mg,110 mg,150 mg/粒。
本品获准用于预防进行选择性全髋或全膝替换手术的成人患者静脉血栓。
首个口服抗凝药Pradaxa上市标志着抗凝血治疗和预防可能致命的血栓是一重大进步和新的里程碑。
达比加群通过专一的选择性抑制凝血酶来防止血栓形成,具有起效快和抗凝血作用可预测而不需监控血液凝固等优点。
本品呈现药物与食物无相互作用,与其它药物的相互反应发生率低。
欧洲批准本品上市是基于2007年2月递交的RE-NOVATE和 RE-MODEL III期临床研究的有效性和安全性数据。
在RE-NOVATE和 RE-MODEL研究预防静脉栓塞和全髋替代手术及全膝替代手术造成死亡中,达比加群150 mg和220 mg一日1次口服的有效性和安全性如同注射依诺肝素40 mg。
独立的中心判断委员会评价了药物不让患者知晓的情况下得到的所有研究结果。
如同所有抗凝药重要的是最佳化平衡药品的有效性和安全性。
此外,还需考虑关键的出血情况、对肝脏和心脏的安全性。
在RE-NOVATE和 RE-MODEL研究中,本品大出血(包括手术处)发生率和严重性均低,与依诺肝素相似。
如同所有抗凝药重要的是最佳化平衡药品的有效性和安全性。
此外,还需考虑关键的出血情况、对肝脏和心脏的安全性。
在RE-NOVATE和 RE-MODEL研究中,本品大出血(包括手术处)发生率和严重性均低,与依诺肝素相似。
推荐达比加群常规剂量为一日1次220 mg。
术后1-4小时内口服单粒110 mg 胶囊,而后一日1次2粒胶囊(220 mg)总共10日(膝全取代手术患者)或28-35日(髋全取代手术患者)。
75岁以上和中度肾损伤患者等特殊人群推荐一日1次2粒75 mg 胶囊。
2.4 普乐沙福(plerixafor)注射液基因酶(Genzyme)公司产品(商品名:Mozobil),与粒细胞集落刺激因子(G-CSF)联合用药来促进红细胞生成素干细胞进入非霍奇金淋巴瘤(NHL)和多发性骨髓瘤(MM)患者血流以收集、随后自体移植。
本品还被获准作为罕用药物。
剂量规格普乐沙福20 mg/mL。
普乐沙福系一新颖的小分子CXCR4趋化因子受体拮抗剂,多项早期研究显示可快速有效地增加NHL和MM患者血液循环中的干细胞数。
普乐沙福治疗需干细胞移植的某些类型癌症患者是一重大进展。
由于本品有益于患者、医生和移植治疗中心将成为干细胞移植治疗方案的整体部分。
普乐沙福调动红细胞生成素干细胞从骨髓进入血流,收集、为需干细胞移植的某些类型癌症患者进行移植。
以往,移植前患者需接受处方药化疗和(或)生长因子类药物来帮助其调动红细胞生成素干细胞进入血流。
一旦此细胞进入血流,它们被收集用于移植制备。
为了完成干细胞移植,按体重必需收集约200万个干细胞/kg。
许多患者需3-4小时至数日来完成此过程。
甚至一些患者调动不了足够的干细胞,因而不能进行移植。
对许多癌症患者来说,调动干细胞是缩小癌症或治愈的唯一希望。
在普乐沙福注射剂关键的临床研究中,59%的NHL患者接受Mozobil和G-CSF联合用药治疗旨在4个或更少的单采血液成分术期间内按体重至少收集的目标数为500万个干细胞/kg,与20%接受安慰剂的患者进行比较。