第31届中国化学奥林匹克决赛理论试题及答案
- 格式:docx
- 大小:4.97 MB
- 文档页数:25

第31 屆中國化學奧林匹克(初賽)試題(2017 年8 月27 日9:00 ~ 12:00)●競賽時間3 小時。
遲到超過半小時者不能進考場。
開始考試後1 小時內不得離場。
時間到,把試卷(背面朝上)放在桌面上,立即起立撤離考場。
●試卷裝訂成冊,不得拆散。
所有解答必須寫在指定の方框內,不得用鉛筆填寫。
草稿紙在最後一頁。
不得持有任何其他紙張。
●姓名、報名號和所屬學校必須寫在首頁左側指定位置,寫在其他地方者按廢卷論處。
●允許使用非編程計算器以及直尺等文具。
第 1 題(10 分)根據條件書寫化學反應方程式。
1-1工業上從碳酸氫銨和鎂硼石[Mg2B2O4(OH)2]在水溶液中反應制備硼酸。
1-2從乏燃料提取鈈元素の過程中,利用亞硝酸鈉在強酸溶液中將Pu3+氧化為Pu4+。
1-3N aBH4與氯化鎳(摩爾比2:1)在水溶液中反應,可得到兩種硼化物:硼化鎳和硼酸(摩爾比1:3)。
1-4通過KMnO4和H2O2在KF-HF 介質中反應獲得化學法制F2の原料K2MnF6。
1-5磷化氫與甲醛の硫酸溶液反應,產物僅為硫酸鏻(鹽)。
第 2 題(10 分)2-1氨晶體中,氨分子中の每個H 均參與一個氫鍵の形成,N 原子鄰接幾個氫原子?1摩爾固態氨中有幾摩爾氫鍵?氨晶體融化時,固態氨下沉還是漂浮在液氨の液面上?2-2P4S5是個多面體分子,結構中の多邊形雖非平面狀,但仍符合歐拉定律,兩種原子成鍵後價層均滿足8 電子,S の氧化數為-2。
畫出該分子の結構圖(用元素符號表示原子)。
2-3水煤氣轉化反應[CO(g) + H2O(g) → H2(g) + CO2(g)]是一個重要の化工過程,已知如下鍵能(BE)數據:BE(C≡O) =1072 kJ·mol-1,BE(O-H) = 463 kJ·mol-1,BE(C=O) = 799 kJ·mol-1,BE(H-H) = 436 kJ·mol-1估算反應熱,該反應低溫還是高溫有利?簡述理由。



第31届中国化学奥林匹克(决赛)试题第1题(11分)1-1 1.000 g铝黄铜合金(设只含有铜、锌、铝)与0.100 moldm-3硫酸反应,在25 °C和101.325 kPa下测得放出的气体的体积为149.3 cm3,将相同质量的该合金溶于足量热浓硫酸,在相同温度和压强下测得放出的气体的提交为411.1 cm3,计算此铝黄铜合金中各组分的质量分数。
主要考察基本的计算和硫酸的酸性和氧化性。
铜不能和常温下的硫酸反应,所以第一步只有Zn和Al被H+ 氧化成Zn2+和Al3+;当硫酸温度提高浓度加大时,SO42-具有氧化性,可将Cu,Al和Zn全部氧化到最高价态,自身被还原成SO2。
计算的具体步骤很简单,如下:由已知三种组分的总质量为1.000 g,即M(Cu)n(Cu)+ M(Al)n(Al)+ M(Zn)n(Zn)= m(总)(1)合金与0.100 mol/L 的硫酸在低温下反应的方程式如下:Zn + 2 H+→ Zn2+ + H2 (g)2 Al + 6 H+→ 2 Al3+ +3 H2 (g)放出气体H2 149.3 cm3,由pV = nRTn(H2)= pV(H2) /RT(2)由上述方程式知n(Zn)+ 3/2 n(Al)= n(H2)(3)合金与0.100 mol/L 的浓硫酸在高温下反应的方程式如下:Zn + 2 H2SO4 (浓) → ZnSO4 + SO2 (g) + 2 H2O2 Al + 6 H2SO4 (浓) → Al2(SO4)3 + 3 SO2 (g) + 6 H2OCu + 2 H2SO4 (浓) → CuSO4 + SO2 (g) + 2 H2O放出气体SO2 411.1 cm3,由pV=nRTn(SO2)= pV(SO2)/RT(4)由上述方程式知:n(Zn)+ 3/2 n(Al)+ n (Cu) = n(SO2)(5)由已知M(Cu)= 63.55 g/mol,M(Al)= 26.98 g/mol,M(Zn)= 65.38 g/molR = 8.31441 J/K mol,T = 25 + 273.15 = 298.15 K,p = 101.325 kPaV(H2) = 149.3 cm3,V(SO2) = 411.1 cm3,m(总)= 1.000 g联立(1)、(2)、(3)、(4)、(5)可得n(Cu)= 1.070 ×10-2n(Al)= 1.112 ×10-3n(Zn)= 4.434 ×10-3w%(Cu)= m(Cu)n(Cu)/m(总)= 68.0%w%(Al)= m(Al)n(Al)/m(总)= 3.0%w%(Zn)= m(Zn)n(Zn)/m(总)= 29.0%1-2 向[Cu(NH3)4]SO4水溶液中通入SO2气体至溶液呈微酸性,析出白色沉淀CuNH4SO3。


Univ. Chem. 2018, 33 (5), 83−92 83收稿:2018-02-06;录用:2018-02-08*通讯作者,Email: ctw@•竞赛园地• doi: 10.3866/ 第31届中国化学奥林匹克(决赛)试题解析(二)常泰维*,戴昱民,方润亭,李宇轩,马亦然,孙泽昊,王泽淳,曾承禹,张宇婷 北京大学化学与分子工程学院,北京 100871第6题题目(14分)六亚甲基四胺(HMTA)是一个与金刚烷的结构类似的杂环多面体化合物。
广泛应用于有机合成、染料和医药等工业中。
HMTA 晶体是一种电光材料,其折射率可被外电场改变,在激光技术中具有广泛应用。
该晶体属于立方晶系,正当晶胞参数a = 7.02 × 102 pm 。
晶体结构的正视图如下图所示,其中右侧是沿a 方向的投影。
6-1 画出HMTA 分子的结构图;说明其最高对称轴的名称、方位和数目。
6-2-1 指出HMTA 晶体中作周期性重复的最小结构单元;说明1个正当晶胞中有多少个这样的结构单元。
6-2-2 写出该晶体最高对称轴的名称或记号、方向,以及特征对称元素的名称和取向。
6-3 晶体的宏观对称性与构成该晶体的分子的对称性是否完全相同?从下列物质中选择实例说明:HMTA 、CO 2、(NH 2)2CO 、Fe(C 5H 5)2、C 6H 6、C 60。
6-4-1 指出HMTA 晶体的点阵型式;说明该点阵的轴次最高的对称轴及其方向。
6-4-2 假设左图所示的正当晶胞中心的分子取向不同于顶点的分子,晶体的点阵型式是什么? 6-4-3计算每个正当晶胞中C ―H ⋯N 氢键的数目。
6-4-4 从结构化学角度简述该晶体格外稳定的原因。
6-5 计算HMTA 晶体的密度ρ。
84大学化学V ol.33分析与解答6-1六亚甲基四胺(HMTA)与金刚烷的结构类似,只须把其中的4个CH换成N原子。
其分子结构图如下:该分子的对称性与正四面体相同(正四面体的4个顶点被N原子占据,6条棱被―CH2―替代),属于T d点群。

科目 化学 年级 高三文件 aosai004.doc 考试类型 奥赛 考试时间 1999 关键词 化学竞赛标题 第31届国际化学奥林匹克竞赛理论试题 内容第一题化合物Q (摩尔质量 122.0 g mol -1) 含碳、氢、氧。
A 分题CO 2(g) 和 H 2O(l) 在 25.00 o C 的标准生成焓分别为 –393.51和–285.83kJ ·mol -1。
气体常数R 为 8.314 J ·K -1·mol -1。
(原子量: H = 1.0, C = 12.0, O = 16.0)质量为0.6000g 的固体Q 在氧弹量热计内充分燃烧,在25.000o C 下开始反应, 此时量热计内含水710.0 g 。
反应完成后温度上升至27.250 o C, 反应生成1.5144 g CO 2 (g) 和 0.2656 g H 2O(l)。
问题1-1 确定Q 的分子式,并写出Q 燃烧反应的配平的化学方程式(标明物质状 态)。
问题1-2 若水的比热为4.184 J ·g -1·K -1,反应内能变化(∆U o )为–3079kJ ·mol -1,请计算量热计的热容(不包括水)。
问题1-3 计算Q 的标准生成焓( H f o )。
B 分题在6o C 时Q 在苯和水中的分配情况见下表,表中C B 和C w 分别表示Q 在苯和水中的平衡。
假定Q 在苯中的物种是唯一的,并与浓度与温度无关。
问题1-4 假定Q 在水中是单体,通过计算说明Q 在苯中是单体还是双聚体。
问题1-5 理想稀溶液的凝固点表达式如下:fs 20f f 0f Δ.)(H X T R T T =-其中T f 是溶液的凝固点, T f 0是溶剂的凝固点, ∆H f 是溶剂的熔化热, X S 是溶质的摩尔分数,苯的摩尔质量为78.0 g mol -1。
纯苯在1大气压下的凝固点为5.40 o C ,苯的熔化热为9.89 kJ mol-1。

第31 届中国化学奥林匹克(初赛)试题(2017 年8 月27 日9:00 ~ 12:00)●时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
●试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
●允许使用非编程计算器以及直尺等文具。
第根据条件书写化学反应方程式。
1-1工业上从碳酸氢铵和镁硼石[Mg2B2O4(OH)2]在水溶液中反应制备硼酸。
1-2从乏燃料提取钚元素的过程中,利用亚硝酸钠在强酸溶液中将 Pu3+氧化为 Pu4+。
1-3N aBH4与氯化镍(摩尔比 2:1)在水溶液中反应,可得到两种硼化物:硼化镍和硼酸(摩尔比 1:3)。
1-4通过 KMnO4和 H2O2在 KF-HF 介质中反应获得化学法制 F2的原料 K2MnF6。
1-5磷化氢与甲醛的硫酸溶液反应,产物仅为硫酸鏻(盐)。
第2 题(10 分)2-1氨晶体中,氨分子中的每个 H 均参与一个氢键的形成,N 原子邻接几个氢原子?1 摩尔固态氨中有几摩尔氢键?氨晶体融化时,固态氨下沉还是漂浮在液氨的液面上?2-2P4S5是个多面体分子,结构中的多边形虽非平面状,但仍符合欧拉定律,两种原子成键后价层均满足 8 电子,S 的氧化数为-2。
画出该分子的结构图(用元素符号表示原子)。
2-3水煤气转化反应[CO(g) + H2O(g) → H2(g) + CO2(g)]是一个重要的化工过程,已知如下键能(BE)数据:BE(C≡O) =1072 kJ·mol-1,BE(O-H) = 463 kJ·mol-1,BE(C=O) = 799 kJ·mol-1,BE(H-H) = 436 kJ·mol-1估算反应热,该反应低温还是高温有利?简述理由。
2-4硫粉和 S2-反应可以生成多硫离子。
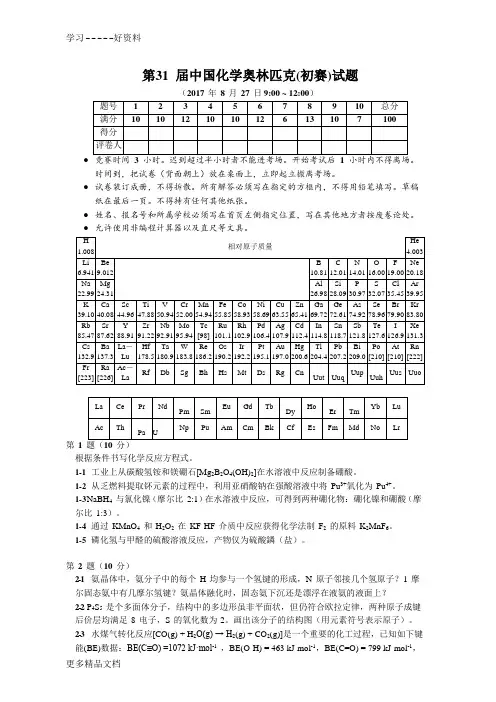

第31 届中国化学奥林匹克(初赛)试题(2017 年8 月27 日9:00 ~ 12:00)●时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
●试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
●允许使用非编程计算器以及直尺等文具。
第1根据条件书写化学反应方程式。
1-1工业上从碳酸氢铵和镁硼石[Mg2B2O4(OH)2]在水溶液中反应制备硼酸。
1-2从乏燃料提取钚元素的过程中,利用亚硝酸钠在强酸溶液中将Pu3+氧化为Pu4+。
1-3N aBH4与氯化镍(摩尔比2:1)在水溶液中反应,可得到两种硼化物:硼化镍和硼酸(摩尔比1:3)。
1-4通过KMnO4和H2O2在KF-HF 介质中反应获得化学法制F2的原料K2MnF6。
1-5磷化氢与甲醛的硫酸溶液反应,产物仅为硫酸鏻(盐)。
第2 题(10 分)2-1氨晶体中,氨分子中的每个H 均参与一个氢键的形成,N 原子邻接几个氢原子?1 摩尔固态氨中有几摩尔氢键?氨晶体融化时,固态氨下沉还是漂浮在液氨的液面上?2-2P4S5是个多面体分子,结构中的多边形虽非平面状,但仍符合欧拉定律,两种原子成键后价层均满足8 电子,S 的氧化数为-2。
画出该分子的结构图(用元素符号表示原子)。
2-3水煤气转化反应[CO(g) + H2O(g) → H2(g) + CO2(g)]是一个重要的化工过程,已知如下键能(BE)数据:BE(C≡O) =1072 kJ·mol-1,BE(O-H) = 463 kJ·mol-1,BE(C=O) = 799 kJ·mol-1,BE(H-H) = 436 kJ·mol-1估算反应热,该反应低温还是高温有利?简述理由。
2-4硫粉和S2-反应可以生成多硫离子。
在10 mL S2-溶液中加入0.080 g 硫粉,控制条件使硫粉完全反应。
