实验1 溶解热的测定 操作步骤
- 格式:doc
- 大小:42.50 KB
- 文档页数:2


实验溶解热的测定一、实验目的1.掌握采用电热补偿法测定热效应的基本原理。
2.用电热补偿法测定硝酸钾在水中的积分溶解热,并用作图法求出硝酸钾在水中的微分溶解热、积分稀释热和微分稀释热。
3.掌握溶解热测定仪器的使用。
二、实验原理物质溶解过程所产生的热效应称为溶解热,可分为积分溶解热和微分溶解热两种。
积分溶解热是指定温定压下把ImOl物质溶解在n0mol溶剂中时所产生的热效应。
由于在溶解过程中溶液浓度不断改变,因此又称为变浓溶解热,以As。
IH 表示。
微分溶解热是指在定温定压下把Imol物质溶解在无限量某一定浓度溶液中所产生的热效应,以表示.在溶解过程中浓度可视为不变,因此又称为定浓度( )τ, P,八。
溶解热,以加表示,即定温、定压、定溶剂状态下,由微小的溶质增量所引起的热量变化。
稀释热是指溶剂添加到溶液中,使溶液稀释过程中的热效应,又称为冲淡热。
它也有积分(变浓)稀释热和微分(定浓)稀释热两种。
积分稀释热是指在定温定压下把原为含Imol溶质和n0ιmol溶剂的溶液冲淡到含n02mol溶剂时的热效应,它为两浓度的积分溶解热之差。
微分冲淡热是指将ImOl溶剂加到某一浓度的无限量溶液中所产生的热效应,以∂ AsolH(-)7, p,n加。
表示,即定温、定压、定溶质状态下,由微小的溶剂增量所引起的热量变化。
积分溶解热的大小与浓度有关,但不具有线性关系。
通过实验测定,可绘制出一条积分溶解热AsolH与相对于Imol溶质的溶剂量nθ之间的关系曲线,如图所示,其他三种热效应由4solH~nO曲线求得。
设纯溶剂、纯溶质的摩尔焰分别为HmI和Hni2,溶液中溶剂和溶质的偏摩尔熔分别为HI和H2,对于由nιmol溶剂和n2m0l溶质组成的体系,在溶质和溶剂未混合前,体系总熔为:H=∏ι Hmι+∏2 Hm2(1) 将溶剂和溶质混合后,体系的总熔为:H'= m Hι+n2 H2(2) 因此,溶解过程的热效应为:∆H=∏ι (H1 -Hm1)+n2(H2-Hm2)=n1 ∆H1+n2∆H2(3)在无限量溶液中加入ImOI溶质,(3)式中第一项可以认为不变,在此条件下所产生的热效应为(3)式中第二项中的AH2,即微分溶解热。

溶解热的测定1、引言[1]1.1 实验目的(1)测量硝酸钾在不同浓度水溶液中的溶解热,求硝酸钾在水中溶解过程各种热效应。
(2)掌握量热装置的基本组合及电热补偿法测定热效应的基本原理。
(3)复习和掌握常用的测温技术。
1.2 实验原理物质溶于溶剂中,一般伴随有热效应的发生。
盐类的溶解通常包含着几个同时进行的过程:晶格的破坏、离子或分子的溶剂化、分子电离(对电解质而言)等。
热效应的大小和符号决定于溶剂及溶质的性质和它们的相对量。
在热化学中,关于溶解过程的热效应有以下几个基本概念:溶解热:在恒温恒压下,溶质 B 溶于溶剂A(或溶于某浓度溶液)中产生的热效应,用sol H ∆表示。
摩尔积分溶解热:在恒温恒压下,1mol 溶质溶解于一定量的溶剂中形成一定浓度的溶液,整个过程产生的热效应。
用sol m H ∆表示。
sol sol m B=HH n ∆∆ (1) 式中,B n 为溶解于溶剂A 中的溶质B 的物质的量。
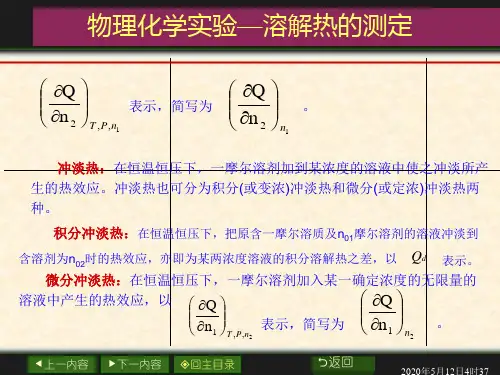
摩尔微分溶解热:在恒温恒压下,1mol 溶质溶于某一确定浓度的无限量的溶液中产生的热效应,以A sol B ,,T p n H n ⎛⎫∂∆⎪∂⎝⎭表示,简写为Asol B n H n ⎛⎫∂∆ ⎪∂⎝⎭。
稀释热:在恒温恒压下,一定量的溶剂A 加到某浓度的溶液中使之稀释,所产生的热效应。
摩尔积分稀释热 在恒温恒压下,在含有1mol 溶质的溶液中加入一定量的溶剂,使之稀释成另一浓度的溶液,这个过程产生的热效应,以dil m H ∆表示:dil m sol m2sol m1=H H H ∆∆-∆ (2)式中:sol m2H ∆、sol m1H ∆为两种浓度的摩尔积分溶解热。
摩尔微分稀释热 在恒温恒压下,1mol 溶剂加入到某一浓度无限量的溶液中所发生的热效应,以B sol A ,,T p n H n ⎛⎫∂∆⎪∂⎝⎭表示,简写为Bsol A n H n ⎛⎫∂∆ ⎪∂⎝⎭。
在恒温恒压下,对于指定的溶剂A 和溶质B ,溶解热的大小取决于A 和B 的物质的量,即()sol AB ,H nn ∆=⎰ (3)由(3)式可推导得:B Asol sol sol A B A B ,,,,+T p n T p n H H H n n n n ⎛⎫⎛⎫∂∆∂∆∆=⎪⎪∂∂⎝⎭⎝⎭ (4) BAsol sol A sol m BA B ,,,,+T p n T p n H H n H n n n ⎛⎫⎛⎫∂∆∂∆∆=⎪ ⎪∂∂⎝⎭⎝⎭ (5) 令A0Bn n n =,式(5)改写成: BAsol sol sol m 0A B ,,,,+T p n T p n H H H n n n ⎛⎫⎛⎫∂∆∂∆∆=⎪ ⎪∂∂⎝⎭⎝⎭ (6) (6)式中的sol m H ∆可由实验测定,0n 由实验中所用的溶质和溶剂的物质的量计算得到。

溶解热的测定一、实验目的1.用简单绝热式量热计测定KCl 的积分溶解热。
2.掌握量热实验中温差校正方法。
3.了解计算机在线检测温度、温差的原理及在溶解热实验中的实际应用。
二、实验原理溶解过程的温度变化用数字式贝克曼温度计测定,量热法测定积分溶解焓,通常是在具有良好绝热层的热量计中进行。
在恒压条件下,由于热量计是绝热系统,溶解过程中所吸收或放出的热全部由系统温度变化反映出来。
在热量计内,将某种盐类溶解于一定量的水中时,若测得溶解过程的温度变化△T ,则该物质的溶解焓为:11222[()]sol m TMH m C m C C m ∆∆=-++ 式中sol m H ∆为盐在溶液温度及浓度下的积分溶解焓;1m ,2m 分别为溶剂水和溶质的质量;M 为溶质的摩尔质量;1C 2C 分别为溶剂水、溶质的热容,T ∆为溶解过程的真实温差,C 为热量计的热容。
盐类的溶解过程通常包含两个同时进行的过程:晶格的破坏和离子的溶剂化。
前者为吸热过程,后者为放热过程,溶解热时这两种热效应的总和。
因此,盐溶解过程吸热还是放热,由这两个热效应得相对大小决定。
溶解热的测定在绝热式量热计中进行。
为恒压条件下,过程中吸收或放出的热全部由系统的温度变化反映出来。
为求KCl 溶于水过程的热效应,可根据盖斯定律,将实际过程分解成两步进行。
在恒压下,溶解过程放出的热p Q (即焓变H ∆)为上述设计的两个过程焓变(1H ∆和2H ∆)之和,即12H H H ∆=∆+∆ (1)因为量热计为绝热系统,0p Q H =∆=,所以在1t ℃下KCl 溶解的恒压热效应1H ∆为12221()H H K t t ∆=-∆=-- (2)式中K 是量热计与KCl 水溶液所组成体系得总热容,21()t t -为KCl 溶解过程系统的温度变化值t ∆溶解。
常用的积分溶解热是指等温等压下,将一摩尔溶质溶解于一定量溶剂中形成一定浓度溶液的热效应。
设将质量为m 的KCl 溶解于一定体积的水中,KCl 的摩尔质量为M ,则在此浓度下KCl 的积分溶解热为:1sol m H M KMH t m m ∆∆==-∆溶解(3)K 值可由电极法求取。


物理化学实验报告实验名称溶解热的测定一.实验目的及要求1.了解电热补偿法测定热效应的基本原理。
2.通过用电热补偿法测定硝酸钾在水中的积分溶解热;用作图法求硝酸钾在水中的微分冲淡热、积分冲淡热和微分溶解热。
3.掌握电热补偿法的仪器使用要点。
二.实验原理1.物质溶解于溶剂过程的热效应称为溶解热。
它有积分(或变浓)溶解热和微分(或定浓)溶解热两种。
前者是1mol溶质溶解在nomol溶剂中时所产生的热效应,以Qs表示。
后者是1mol溶质溶解在无限量某一定浓度溶液中时所产生的热效应。
即溶剂加到溶液中使之稀释时所产生的热效应称为稀释热。
它也有积分(或变浓)稀释热和微分(或定浓)稀释热两种。
前者是把原含1mol溶质和nomol溶剂的溶液稀释到含溶剂nogmol时所产生的热效应,以Q。
表示,显然。
后者是1mol溶剂加到无限量某一定浓度溶液中时所产生的热效应2.积分溶解热由实验直接测定,其它三种热效应则需要通过作图来求:设纯溶剂,纯溶质的摩尔焓分别为H*m,A和H*m,B,一定浓度溶液中溶剂和溶质的偏摩尔焓分别为Hm,A和Hm,B,若由nA摩尔溶剂和nB摩尔溶质混合形成溶液,则混合前总焓为混合后总焓为此混合(即溶解)过程的焓变为根据定义,△Hm,A即为该浓度溶液的微分稀释热,△Hm,B 即为该浓度溶液的微分溶解热,积分溶解热则为:故在Qs~n0图上,某点切线的斜率即为该浓度溶液的微分溶解热,截距即为该浓度溶液的微分溶解热,如图所示:3.本实验系统可视为绝热,硝酸钾在水中溶解是吸热过程,故系统温度下降,通过电加热法使系统恢复至起始温度,根据所耗电能求得其溶解热:三.实验仪器及药品1.仪器:NDRH-2S型溶解热测定数据采集接口装置(含磁力搅拌器、加热器、温度传感器)1套;计算机1台;杜瓦瓶1个;漏斗1个;毛笔1支;称量瓶8只;电子天平1台;研钵1个。
2.药品:硝酸钾(分析纯)。
四.实验注意事项1.杜瓦瓶必须洗净擦干,硝酸钾必须在研钵中研细。


实验一 溶解热的测定一、目的1、了解电热补偿法测定热效应的基本原理及仪器使用。
2、测定硝酸钾在水中的积分溶解热,并用作图法求得其微分稀释热、积分稀释热和微分溶解热。
3、初步了解计算机采集处理实验数据、控制化学实验的方法和途径。
二、基本原理1、物质溶解于溶剂过程的热效应称为溶解热。
它有积分(或变浓)溶解热和微分(或定浓)溶解热两种。
前者是1 mol 溶质溶解在n 0 mol 溶剂中时所产生的热效应,以Q s 表示。
后者是1 mol 溶质溶解在无限量某一定浓度溶液中时所产生的热效应,即0,,s T p n Q n ∂⎛⎫⎪∂⎝⎭。
溶剂加到溶液中使之稀释时所产生的热效应称为稀释热。
它也有积分(或变浓)稀释热和微分(或定浓)稀释热两种。
前者是把原含1 mol 溶质和n 01 mol 溶剂的溶液稀释到含溶剂n 02 mol 时所产生的热效应,以Q d 表示,显然,Q d = Q s ,n02 – Q s ,n01。
后者是1 mol 溶剂加到无限量某一定浓度溶液中时所产生的热效应,即0,,s T p nQ n ⎛⎫∂⎪∂⎝⎭。
2、积分溶解热由实验直接测定,其它三种热效应则需通过作图来求:设纯溶剂、纯溶质的摩尔焓分别为H *m ,A 和H *m ,B ,一定浓度溶液中溶剂和溶质的偏摩尔焓分别为H m ,A 和H m ,B ,若由n A mol 溶剂和n B mol 溶质混合形成溶液,则混合前的总焓为 H = n A H *m ,A + n B H *m ,B 混合后的总焓为 H ΄ = n A H m ,A + n B H m ,B此混合(即溶解)过程的焓变为 ΔH = H ΄ – H = n A (H m ,A – H *m ,A )+ n B (H m ,B – H *m ,B ) = n A ΔH m ,A + n B ΔH m ,B根据定义,ΔH m ,A 即为该浓度溶液的微分稀释热,ΔH m ,B 即为该浓度溶液的微分溶解热,积分溶解热则为:,,0,,As m A m Bm AmBB Bn H Q H H n HHn n ∆==∆+∆=∆+∆ 故在Q s ~ n 0图上,某点切线的斜率即为该浓度溶液的微分稀释热,截距即为该浓度溶液的微分溶解热。

溶解热测定姓名 学号 班级 实验日期1 实验目的(1)了解电热补偿法测定热效应的基本原理。
(2)用电热补偿法测定硝酸钾在水中的积分溶解热,通过计算或作图求出硝酸钾在水中的微分溶解热、积分溶解热和微分冲淡热。
(3)掌握用微机采集数据、处理数据的实验方法和实验技术。
2 实验原理溶解热:恒温恒压下,物质的量为2n 的溶质溶于物质的量为1n 的溶剂(或溶于某浓度溶液)中产生的热效应,用Q 表示。
积分溶解热:恒温恒压下,1mol 溶质溶解于一定量的溶剂中形成一定浓度的溶液,整个过程产生的热效应。
用s Q 表示。
微分溶解热:恒温恒压下,1mol 溶质溶于某一确定浓度的无限量的溶液中产生的热效应,以12nn Q ⎪⎪⎭⎫⎝⎛∂∂表示。
冲淡热:恒温恒压下,一定量的溶剂A 加到某浓度的溶液使之稀释所产生的热效应。
积分冲淡热:恒温恒压下,在含有1mol 溶质的溶液中加入一定量的溶剂,使之稀释成另一浓度的溶液的过程中产生的热效应,以d Q 表示。
微分冲淡热:恒温恒压下,1mol 溶剂加入到某一浓度无限量的溶液中所发生的热效应,以21n n Q ⎪⎪⎭⎫⎝⎛∂∂或20n s n Q ⎪⎪⎭⎫ ⎝⎛∂∂表示。
它们之间关系可表示为:s Q n Q =2 令021n n n= 21002n s n s n Q n n Q Q ⎪⎪⎭⎫ ⎝⎛∂∂+⎪⎪⎭⎫ ⎝⎛∂∂= ()()0201n s n s d Q Q Q -=积分溶解热s Q 可由实验测得,其他三种热效应则可通过0n Q s -曲线求得,曲线某点的切线的斜率为该浓度下的摩尔微分稀释热,切线与纵坐标的截距,为该浓度下的摩尔微分溶解热(即OC )。
显然,图中A 点的摩尔溶解热与B 点的摩尔溶解热之差为该过程的摩尔积分稀释热(即BE )。
欲求溶解过程的各种热效应,应测定各种浓度下的摩尔积分溶解热。
实验中采用累加的方法,先在纯溶剂中加入溶质,测出溶解热,然后在这溶液中再加入溶质,测出热效应,根据先后加入溶质总量可求出,各次热效应总和即为该浓度下的溶解热。

溶解热的测定一、实验目的1、用量热法测定KNO 3在水中的溶解热。
2、掌握测温量热的基本原理和测量方法。
3、了解量热法测定积分溶解热的基本原理。
二、实验原理物质溶解时常伴有热效应,此热效应称为该物质的溶解热。
物质的溶解热通常包括溶质晶格的破坏和溶质分子或离子的溶剂化。
其中,晶格的破坏常为吸热过程,溶剂化作用常为放热过程,溶解热即为这两个过程的热量的总和。
而最终是吸热或放热则由这两个热量的相对大小所决定。
温度、压力以及溶质和溶剂的性质、用量、是影响溶解热的显著因素,根据物质在溶解过程中溶液浓度的变化,溶解热分为变浓溶解热和定浓溶解热,变浓溶解热又称积分溶解热,为定温定压条件下一摩尔物质溶于一定量的溶剂形成某浓度的溶液时,吸入或放出的热量,定浓溶解热又称微分溶解热,为定温定压条件下一摩尔物质溶于大量某浓度的溶液时,产生的热量。
积分溶解热可用量热法直接测得,微分溶解热可从积分溶解热间接求得。
方法是,先求出在定量溶剂中加入不同溶质时的积分溶解热,然后以热效应为纵坐标,以溶质摩尔数为横坐标绘成曲线,曲线上的任何一点的斜率即为该浓度时的微分溶解热。
量热法测定积分溶解热,通常在被认为是绝热的量热计中进行,首先标定该量热系统的热容量,然后通过精确测量物质溶解前后因吸热或放热引起量热体系的温度变化,来计算溶解过程的热效应,并据此计算物质在该溶液温度、浓度下的积分溶解热。
1.量热系统热容量的标定用一已知积分溶解热的标准物质,在量热计中进行溶解,测出溶解前后量热系统的温度变化值ΔT S ,则量热系统的热容C 可以根据下式计算:式中m S 和M S 分别为标准物质的质量和摩尔质量,ΔH S 为标准物质在某溶液温度及浓度下的积分溶解热,此值可由手册上查得,C 为量热系统的热容。
2.积分溶解热的测定 将上式用于待测物质即得:SS S S T M H m C ∆⋅∆⋅=mTM C H ∆⋅⋅=∆式中m和M分别为待测物质的质量和摩尔质量,ΔT为待测物质溶解前后量热系统的温度变化值;C为已标定的量热系统的热容。
溶解热的测定实验报告一、实验目的1、掌握量热法测定物质溶解热的原理和方法。
2、了解温度和浓度对溶解热的影响。
3、学会使用数字贝克曼温度计和恒温槽等仪器。
二、实验原理溶解热是指在一定温度和压力下,溶质溶解于溶剂中产生的热效应。
溶解热分为积分溶解热和微分溶解热。
积分溶解热是指在定温定压下,把 1 摩尔溶质溶解在一定量的溶剂中所产生的热效应。
微分溶解热是指在定温定压下,在大量溶液中加入 1 摩尔溶质所产生的热效应。
在本实验中,采用绝热式量热法测定硝酸钾在水中的溶解热。
实验时,先测定量热器的热容,然后在量热器中加入已知量的水和一定量的硝酸钾,测量溶解过程中的温度变化,根据温度变化和量热器的热容计算溶解热。
量热器的热容可以通过已知溶解热的物质(如氯化钾)来测定。
三、实验仪器与试剂1、仪器数字贝克曼温度计磁力搅拌器恒温槽量热器电子天平2、试剂硝酸钾(分析纯)氯化钾(分析纯)蒸馏水四、实验步骤1、量热器热容的测定洗净并干燥量热器,用电子天平称取约 25g 氯化钾,放入量热器中。
用量筒量取 200ml 蒸馏水,倒入量热器中,插入搅拌棒,盖好盖子。
将数字贝克曼温度计插入量热器,启动磁力搅拌器,搅拌均匀。
观察温度计示数,待温度稳定后,记录初始温度 T1。
迅速加入氯化钾,同时启动秒表,继续搅拌,观察温度变化。
当温度升至最高点并稳定后,记录终止温度 T2。
根据氯化钾的溶解热(已知)和温度变化,计算量热器的热容 C。
2、硝酸钾溶解热的测定洗净量热器,用电子天平称取约 5g 硝酸钾。
用量筒量取 200ml 蒸馏水,倒入量热器中,插入搅拌棒,盖好盖子。
将数字贝克曼温度计插入量热器,启动磁力搅拌器,搅拌均匀。
观察温度计示数,待温度稳定后,记录初始温度 T3。
迅速加入硝酸钾,同时启动秒表,继续搅拌,观察温度变化。
当温度降至最低点并稳定后,记录终止温度 T4。
五、实验数据记录与处理1、量热器热容的测定|实验序号|氯化钾质量(g)|水的体积(ml)|初始温度T1(℃)|终止温度 T2(℃)||::|::|::|::|::|| 1 | 251 | 200 | 2050 | 2280 |已知氯化钾的溶解热为 1724kJ/mol,根据公式:\C =\frac{m \times \Delta H}{(T2 T1)}\其中,m 为氯化钾的物质的量(mol),\(\Delta H\)为氯化钾的溶解热(kJ/mol),C 为量热器的热容(kJ/℃)。
实验⼀溶解热的测定实验⼀溶解热的测定⼀、⽬的1、了解电热补偿法测定热效应的基本原理及仪器使⽤。
2、测定硝酸钾在⽔中的积分溶解热,并⽤作图法求得其微分稀释热、积分稀释热和微分溶解热。
3、初步了解计算机采集处理实验数据、控制化学实验的⽅法和途径。
⼆、基本原理1、物质溶解于溶剂过程的热效应称为溶解热。
它有积分(或变浓)溶解热和微分(或定浓)溶解热两种。
前者是1 mol 溶质溶解在n 0 mol 溶剂中时所产⽣的热效应,以Q s 表⽰。
后者是1 mol 溶质溶解在⽆限量某⼀定浓度溶液中时所产⽣的热效应,即0,,s T p n Q n。
溶剂加到溶液中使之稀释时所产⽣的热效应称为稀释热。
它也有积分(或变浓)稀释热和微分(或定浓)稀释热两种。
前者是把原含1 mol 溶质和n 01 mol 溶剂的溶液稀释到含溶剂n 02 mol 时所产⽣的热效应,以Q d 表⽰,显然,Q d = Q s,n02 – Q s ,n01。
后者是1 mol 溶剂加到⽆限量某⼀定浓度溶液中时所产⽣的热效应,即0,,s T p nQ n ??。
2、积分溶解热由实验直接测定,其它三种热效应则需通过作图来求:设纯溶剂、纯溶质的摩尔焓分别为H *m ,A 和H *m ,B ,⼀定浓度溶液中溶剂和溶质的偏摩尔焓分别为H m ,A 和H m ,B ,若由n A mol 溶剂和n B mol 溶质混合形成溶液,则混合前的总焓为 H = n A H *m ,A + n B H *m ,B 混合后的总焓为 H ? = n A H m ,A + n B H m ,B此混合(即溶解)过程的焓变为 ΔH = H ? – H = n A (H m ,A – H *m ,A )+ n B (H m ,B – H *m ,B ) = n A ΔH m,A + n B ΔH m ,B根据定义,ΔH m ,A 即为该浓度溶液的微分稀释热,ΔH m ,B 即为该浓度溶液的微分溶解热,积分溶解热则为: ,,0,,As m A m Bm AmBB Bn H Q H H n HHn n ?==?+?=?+? 故在Q s ~ n 0图上,某点切线的斜率即为该浓度溶液的微分稀释热,截距即为该浓度溶液的微分溶解热。
溶解热的测定一.实验目的1. 掌握用电热补偿法测定KNO3的积分溶解热。
2. 用作图法求KNO3的积分冲淡溶解热。
二.实验原理物质溶解过程的热效应称为溶解热,溶解热可以分为积分溶解热和微分溶解热两种。
积分溶解热系指在定温定压条件下把1摩尔溶质溶解在n0摩尔的溶剂中时所产生的热效应。
由于过程中溶液的浓度逐渐改变,因此积分溶解热也称变浓溶解热,以Qs表示。
微分溶解热系指在定温条件下把1摩尔溶质溶解在无限量的某一定浓度的溶液中时所产生的热效应,以表示。
这种热效应也可视为定温定压条件下在定量的该浓度的溶液中加入dn摩尔溶质时所产生的热效应dQ,两者之间的比值。
由于过程中溶液的浓度实际上可视为不变,因此也称为定浓溶解热。
把溶剂加到溶液中,使之冲淡,其热效应称为冲淡热。
冲淡热也分为积分冲淡热和微分冲淡热两种,通常都以对含有1摩尔溶质溶液的冲淡热而言。
积分冲淡热系指在定温定压下把含1摩尔溶质及n0摩尔溶剂的溶液冲淡到含溶剂为n02时的热效应。
微分冲淡热则指在含1摩尔溶质及n01摩尔溶剂的无限量溶液中加入1摩尔溶剂的热效应,以表示。
积分溶解热可以由实验直接测定,微分溶解热则可根据图形计算得到,如下图:图中,AF与BG分别为将1摩尔溶质溶于n01及n02摩尔溶剂时的积分溶解热Qs;BE表示在含有1摩尔溶质的溶液中加入溶剂使溶剂量由n01摩尔变到n02摩尔过程中的积分冲淡热Q d。
Q d=(Qs)n02-(Qs)n01=BG-AF曲线在A点的斜率等于该浓度溶液的微分冲淡热。
=AD/DC在绝热容器中测定热效应的方法有四种:1.先测出量热系统的热容C,再根据反应过程中测得的温度变化ΔT,由ΔT和C之积求出热效应之值。
2.先测出体系的起始温度T0,当溶解过程中温度随反应进行而降低,再用电热法使体系温度恢复到起始温度,根据所消耗电能求出热效应Q。
Q=I2Rt=IVt (焦尔)式中I为通过电阻丝加热器的电流强度(安培),V为电阻丝的两端所加的电压(伏特),t为通电时间(秒)。
实验报告电解质的溶解热实验实验报告:电解质的溶解热实验引言:电解质的溶解热是描述在溶液中电解质分子或离子溶解所释放的热量。
本实验旨在通过测定盐酸的溶解热,探究电解质的溶解过程中是否会产生热量,并对溶解热进行计算和分析。
实验步骤:1. 实验仪器:- 量热仪- 电磁搅拌器- 温度计- 热水槽2. 实验药品:- 盐酸溶液- 纯净水3. 实验操作:1) 首先,将正确比例的盐酸溶液与一定体积的纯净水混合,得到待测电解质溶液。
2) 将量热仪放入热水槽中并调至恒温状态(温度为T1)。
3) 用电磁搅拌器搅拌电解质溶液,使其达到均匀混合状态。
4) 将已搅拌的电解质溶液快速注入量热仪的量热杯中,记录下溶液的初始温度(T2)。
5) 在装有纯净水的量热杯中,同时记录下此时的温度(T3)。
6) 等待电解质溶液的温度稳定后,记录下最终温度(T4)。
数据记录与计算:1. 记录数据:- 电解质溶液的初始温度:T2- 纯净水的温度:T3- 电解质溶液的最终温度:T42. 计算步骤:1) 计算电解质的溶解热(ΔH):ΔH = mcΔT其中,m为电解质溶液的质量,c为溶液的比热容,ΔT为溶解热。
由于电解质溶液与纯净水的质量相同,所以m1 = m2。
2) 纯净水的质量:m2 = mw × Vw其中,mw为纯净水的密度,Vw为纯净水的体积。
3) 电解质溶液的质量:m1 = ρ × V其中,ρ为电解质溶液的密度,V为电解质溶液的体积。
4) 溶液的比热容:c = ΔH / (m1 × ΔT)5) 电解质的溶解热:ΔH = m1 × c × ΔT结果分析与讨论:通过实验测得电解质溶液的初始温度、纯净水的温度和最终温度后,根据上述计算步骤可以求得溶解热。
实验中使用量热仪精确测量了温度的变化,保证了实验结果的可靠性。
根据电解质溶解热的定义,如果溶解过程中会释放热量,则溶解热ΔH为负值;反之,如果消耗热量,则ΔH值为正。
实验1 溶解热的测定
注意事项:
1.本实验应确保样品充分溶解,因此实验前必须充分研磨样品。
已进行研磨和烘干处理的样品位于靠窗口
的烘箱中。
实验中每位同学使用完样品后必须及时研磨好足够的样品,并放入靠窗口的烘箱进行烘干处理,以备下一位同学使用。
2.硝酸钾加入快慢的控制,是实验成败的关键。
加得太快,会使温差过大,体系与环境的热交换加快,测
得的溶解热偏低,另外加样太快会致使磁子陷住不能正常搅拌。
加得太慢,一旦温度升到一个较高的值,即使加入所有硝酸钾也无法使温差回到零度以下,导致实验失败。
一般ΔT控制在-0.3℃左右为宜,最低不要超过-0.5℃,但要始终为负值。
实验中要时刻注意温差的变化,掌握好加料的时间和量。
在每组实验完后,温差回升到0℃以上,此时升温较快,需要及时加入较多的硝酸钾,否则温差可能再无法回到负值。
3.实验时需控制合适的搅拌速度。
搅拌太快,会以功的形式向系统中引入能量;搅拌太慢,会因水的传热
性差而导致Q s值偏低,而且硝酸钾难以完全溶解,若实验结束发现有未溶解的硝酸钾,应重做实验。
4.数据采集过程中,切记不要进行任何其它操作,否则需要重新采集数据。
5.将仪器放置在无强电磁场干扰的区域内。
6.不要将仪器放置在通风的环境中,尽量保持仪器附近的气流稳定。
实验步骤:
1.称硝酸钾26 g。
(已进行研磨和烘干处理),放入干燥器中。
2.将8个称量瓶编号。
在台称上称量,依次加入约2.5、1.5、2.5、
3.0、3.5、
4.0、4.0、和4.5 g硝酸钾,
再用分析天平称出准确数据,把称量瓶依次放入干燥器中待用。
3.量取200 mL去离子水于保温杯内,打开反应热测量数据采集接口装置的电源,将温度传感器擦干置于
空气中,预热3 min,但不要打开恒流源及搅拌器电源。
4.4个菜单项:1)参数矫正;
2)开始实验;3)数据处理;4)退出。
1)参数矫正
参数矫正菜单中有‘电压参数矫正’和‘电流参数矫正’两个子菜单项,电压参数和电流参数一般情况下不需矫正。
2)开始实验
首先选择串口com 1
搅拌器电源,把保温杯放在磁力搅拌器上,调节磁子的转速,将带有加热器及漏斗的盖子放好,测量加热器功率,并调节恒流源,使加热器功率在2.25~2.3 W之间,同时将温度传感器也放入其内。
按下回车键,测量水温。
(注意温度传感器探头不要与搅拌磁子和加热电阻丝相接触)。
这时不要再调节功率。
② 当采样到水温高于室温0.5 o C 时,按微机提示加入第一份KNO 3,同时微机会实时记下此时水温和时间。
③ 加入KNO 3后,由于溶解吸热,导致水温下降;由于加热器在工作,水温又会上升。
当系统探测到水温上升至起始温度时,根据微机提示加入第二份KNO 3,同时微机记下时间。
统计出每份KNO 3溶解后,电热补偿通电时间。
④ 重复上一步骤直至第八份KNO 3加完。
⑤ 根据微机提示关闭加热器和搅拌器。
(系统已将本次实验的加热功率和8份样品的通电累计时间值自动保存。
数据处理:
1. 计算每次加入硝酸钾后的累计质量3KNO m 和通电累计时间t 。
2. 根据溶剂的质量和加入溶质的质量,求算溶液的浓度,以n 0表示:
累
累m m /n n n 1111=101.118.02200==32KNO O
H 0 3. 计算每次溶解过程中的热效应。
Q =IUt =Kt (J)
4. 将算出的Q 值进行换算,求出当把单位物质的量的硝酸钾溶于物质的量为n 0的水中的积分溶解热Q s
Q s =3
KNO Q
n =33KNO KNO /Kt m M =3KNO 101.1Kt m 23H O 0KNO n n n
5. 将以上数据列表并作Q s ~n 0图,从图中求出n 0=80,100,200,300和400处的积分溶解热、微分溶解热和微分冲淡热。
以及n 0从80→100,100→200,200→300,300→400的积分冲淡热。
用计算机处理数据按照以下步骤进行:
(1
软件自动计算出每份样品的Q s ,n 0和n 0为80、100、200、300、400时KNO 3的积分溶解热、微分溶解热、微分冲淡热,n 0从80~100、100~200、200~300、300~400时KNO 3的积分冲淡热。
按显示器右上角的
“Q s ~n 0”
(2)如果需要保存当前数据到文件,然后根据提示输入文件名按
(3。