高三化学铁及其化合物复习
- 格式:ppt
- 大小:562.00 KB
- 文档页数:78

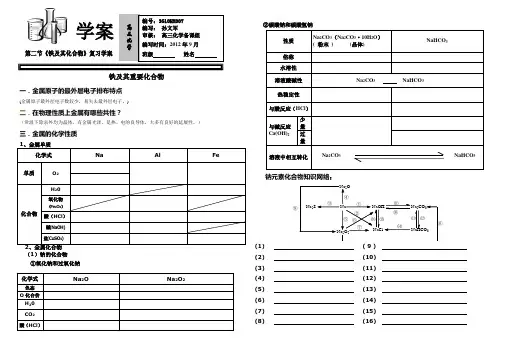
铁及其化合物一、铁的结构和性质1铁位于第 _______ 周期第 _____ 族,是过渡金属元素的代表,其原子结构示意图为 ___________ 2. 物理性质纯铁是一种 ________ 色金属,质软,是电和热的导体。
铁的化学性质(1)与非金属反应(X 2、。
2、S 等)① 与02:常温下铁被腐蚀生成铁锈,其主要成分 _____________ ;点燃 ______________________ ② 与S : __________________________ ③与12: ________________________________________ ④与% ____________________________ (2)与水的反应常温下铁与水不反应,在高温条件下与水蒸气反应,化学方程式为 (3)与酸反应① 与非氧化性酸:离子反应式 __________________________________________________________ ② 与氧化性酸:常温下,遇冷的浓 HNO 3、浓H 2SO 4钝化。
反应厂稀HN0 3过量 _____________________________________YFe 过量 _____________________1将铁屑溶于过量盐酸后,再加下列物质,会有三价铁生成的是 ( )A .稀硫酸B .氯气C .氯化锌D .氯化铜2.向盛有FeCI 3溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是 ()A .烧杯中有铜无铁B .烧杯中有铁无铜C .烧杯中铁、铜都有D .烧杯中铁、铜均无3•在氯化铁、氯化铜的混合溶液中加入铁粉,待反应结束,所剩余的固体能被磁铁吸弓I,贝U 反应后溶液中存在较多的离子是( )A.Cu 2+B.Fe 3 +C.Fe 2+D.H +4•将铁片投入下列溶液,铁片溶解且可使溶液的质量增加的是① NaN03溶液②FeC%③Cu (NO 3)2溶液④NaHS04溶液( ) A.①②B.③④C.①③D.②④5.ag 铁粉与含有H 2S04的CuS04溶液完全反应后,得到agCu,则参与反应的CuS04与H 2SO 4 的物质量之比为()A.1:7B.7:1C.7:8D.8:76•下列图象是表示铁跟一定量硝酸反应时,铁和硝酸铁之间物质的量(mol)的关系,其中正与稀HN03反应 (不会产生H£二、铁的重要化合物化学式FeO Fe2O3Fe3O4俗名色态价态与非氧化性酸反应(H )离子方程式+ 2+FeO+2H =Fe +H2O与还原剂(CO、C、H2)反应例1下列有关铁及其化合物的说法中正确的是()A .赤铁矿的主要成分是Fe3O4B .铁与水蒸气在高温下反应的产物为Fe2O3和H2C. 除去FeCl2溶液中的FeCl3杂质可以向溶液中加铁粉,然后过滤D. Fe3+与KSCN反应产生红色沉淀例2•有一铁的氧化物样品,用140mL5mol/L盐酸可恰好使其完全溶解。



《铁及其化合物的应用》高三化学复习习题讲评教案知识与技能:1、掌握铁及其化合物的基本性质;2、掌握Fe3+、Fe2+的检验及相互转化条件,掌握工业中Fe3+、Fe2+离子的除杂原理及方法3、了解新型的铁化合物及相关性质过程与方法:1、熟悉工业流程题的一般解题思路,了解实验探究的一般方法并能设计简单的实验方案,2、具有解决化学问题,进行专题信息收集、加工、输出的能力。
情感态度价值观:通过专题习题归纳,培养科学的思维方法和学习方法,促进化学的兴趣和积极性基于我对本节教材价值的认识和学生的实际学习能力,教学重点:铁及其化合物的基本性质在高考中的高频呈现点;Fe2+、Fe3+的检验及其相互转化,工业中Fe3+、Fe2+离子的除杂原理及方法;难点:Fe2+、Fe3+的检验方法及其相互转化;工业中Fe3+、Fe2+离子的除杂原理及方法。
教学方法:启发式教学法,问题讨论法等相结合的教学方法:教学过程:题组一Fe及其化合物(正确率高,简单对答案)1、下列微粒在溶液中能大量共存的是()A. Fe3+、K+、Zn2+、CO32-B. Fe2+、H+、SO42-、Cr2O72-C. Fe3+、Fe2+、NO3-、NH3. H2OD.Fe2+、NH4+、苯酚、Cl-2、(2010·全国理综Ⅰ,8)能正确表示下列反应的离子方程式的是()A.将铁粉加入稀硫酸中:2Fe+6H+===2Fe3++3H2↑B.将磁性氧化铁溶于盐酸:Fe3O4+8H+===3Fe3++4H2OC.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO-3===Fe3++2H2O+NO↑D.将铜屑加入Fe3+溶液中:2Fe3++Cu===2Fe2++Cu2+3、判断正误(2013·全国卷Ⅱ-10A)浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑()(2013·全国卷Ⅱ-10D)向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+()(2014·全国卷Ⅰ-8D)FeCl3溶液可用于铜质印刷线路板制作说明FeCl3能从含Cu2+溶液中置换出铜(2014·全国卷Ⅱ-9C )铝与Fe 2O 3发生铝热反应后固体固体物质增重( )(2015课标Ⅰ,10,6分)下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( 选项实验 现象 结论 A. 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN 溶液 有气体生成,溶液呈血红色 稀硝酸将Fe 氧化为Fe 3+B.将铜粉加入1.0 mol·L -1 Fe 2(SO 4)3溶液中 溶液变蓝、有黑色固体出现 金属铁比铜活泼题组二 Fe 2+、Fe 3+的检验(重点讲评开放性实验的解答规范)1、(2010·福建理综,25改编)工业上常用铁质容器盛装冷浓硫酸。



铁及其化合物(第一轮复习)教学设计一、基本说明1.教学内容所属模块:高中化学必修模块:《化学1》2.年级:高三年3.所用教材出版单位:江苏教育出版社4.所属的章节:第一轮复习之元素及其化合物5.教学时间:45分钟二、教学设计1.教学目标:⑴帮助学生更好地掌握铁及其化合物的主要性质、相互转化、及用途,构建铁及其化合物的知识网络。
⑵培养学生透过现象看本质的思维方法、建立并完善认知结构的思维形式和科学地探索未知世界的思维态度。
2.内容分析:元素及其化合物知识的复习,在高三总复习中占有很大的比重,如何提高其复习的效率与效果是每一位化学教师都应探讨的课题。
铁及其化合物这一内容在元素化合物知识中很有代表性,探索这一内容的复习方法对其它元素及其化合物的复习有一定的借鉴作用。
这一部分内容的知识点主要包括:铁在元素周期表中的位置、原子结构和性质;铁的氧化物、氢氧化物的性质、制备、用途;Fe2+、Fe3+离子的性质、互相转化及检验。
在复习中,要充分发挥这三个知识点的载体作用,通过对知识的复习来提高学生的素质,培养学生的能力。
3.学情分析:高三的学生已有了高一、高二知识的积累,新课程复习的重要任务就是在教师指导下,学生把各部分相应的知识按其内在的联系进行归纳整理,将散乱的知识串成线,结成网,纳入自己的知识结构之中。
4.设计思路:⑴元素及其化合物的复习要避免传统教学中为“巩固知识”而设计教学步骤的做法,应从“能力立意”的教学新理念出发,将“巩固知识”当作提高学生素质、培养学生能力的手段。
⑵从“变价”与“不变价”两条主线串联整个铁及其化合物的复习教学,构建清晰的知识网络。
⑶让学生成为课堂的主角。
教学过程中克服教师讲学生听、教师问学生答、教师出题学生做题的被动局面。
教师的作用是创设情景,提供向导,在适当的时候进行纠错、把舵。
三、教学过程四、教学反思1.高三元素化合物的复习在知识处理上要做到:高屋建瓴,纵横联系。
高屋建瓴也就是在知识把握上必须大处着眼,对某一块知识,可先从知识分类上着手,对各类知识进行归纳总结。
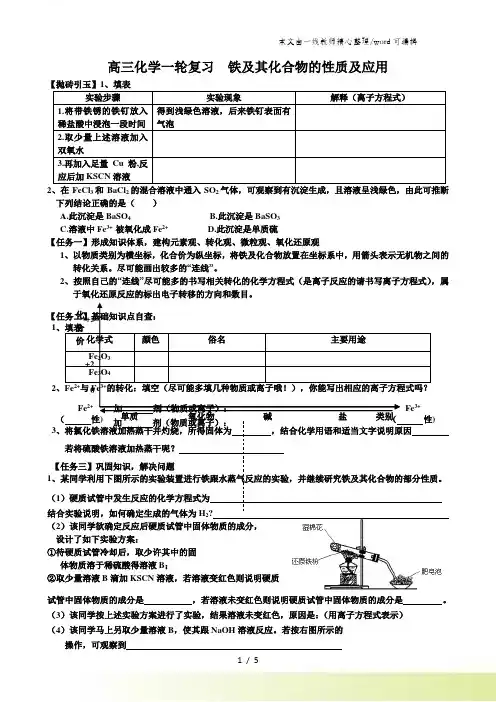
高三化学一轮复习 铁及其化合物的性质及应用 【抛砖引玉】1、填表 实验步骤 实验现象 解释(离子方程式) 1.将带铁锈的铁钉放入稀盐酸中浸泡一段时间 得到浅绿色溶液,后来铁钉表面有气泡2.取少量上述溶液加入双氧水3.再加入足量Cu 粉,反应后加KSCN 溶液2、在FeCl 3和BaCl 2的混合溶液中通入SO 2气体,可观察到有沉淀生成,且溶液呈浅绿色,由此可推断下列结论正确的是( )A.此沉淀是BaSO 4B.此沉淀是BaSO 3C.溶液中Fe 3+ 被氧化成Fe 2+D.此沉淀是单质硫【任务一】形成知识体系,建构元素观、转化观、微粒观、氧化还原观1、以物质类别为横坐标,化合价为纵坐标,将铁及化合物放置在坐标系中,用箭头表示无机物之间的转化关系。
尽可能画出较多的“连线”。
2、按照自己的“连线”尽可能多的书写相关转化的化学方程式(是离子反应的请书写离子方程式),属于氧化还原反应的标出电子转移的方向和数目。
【任务二】基础知识点自查:1、填表 化学式颜色 俗名 主要用途 Fe 2O 3 Fe 3O 42、Fe 2+与Fe 3+的转化:填空(尽可能多填几种物质或离子哦!),你能写出相应的离子方程式吗?Fe 2+ Fe 3+ ( 性) ( 性) 3、将氯化铁溶液加热蒸干并灼烧,所得固体为 ,结合化学用语和适当文字说明原因 若将硫酸铁溶液加热蒸干呢?【任务三】巩固知识,解决问题1、某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
(1)硬质试管中发生反应的化学方程式为 结合实验说明,如何确定生成的气体为H ?(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B ;②取少量溶液B 滴加KSCN 溶液,若溶液变红色则说明硬质试管中固体物质的成分是 ,若溶液未变红色则说明硬质试管中固体物质的成分是 。


铁及其化合物知识点1.物理性质:银白色,具有金属光泽;质地较软,有良好的导电性、延展性。
密度7.86 g/cm3,熔沸点较高。
能被磁铁吸引,也能被磁化。
还原铁粉为黑色粉末。
二.化学性质:1.与非金属反应1)Fe+S (I 2) FeS (FeI 2) 2)3Fe+2O 2 Fe 3O 4 3)2Fe+3Cl 2 2FeCl 3Fe 2+Fe 3+2.与水反应 3Fe + 4H 2O(g) Fe 3O 4 + 4 H 2 ↑(置换)3 与酸反应1)与非氧化性酸(盐酸、稀硫酸)反应 Fe +2H +== Fe 2+ + H 2↑2)与氧化性酸反应 :Fe+4HNO 3(稀)=Fe(NO 3)3+NO↑+2H 2O常温下,铁和冷浓硝酸、冷浓H 2SO 4发生钝化,但在加热条件下,钝化作用立即遭到破坏: Fe+6HNO 3(浓)Fe(NO 3)3+3NO 2↑+3H 2O Fe+6H 2SO 4(浓)Fe 2(SO 4)3+3SO 2↑+3H 2O4.与盐溶液反应:2Fe 3++ Cu = 2Fe 2++ Cu 2+ Fe + 2Fe 3+ = 3 Fe 2+ Fe + Cu 2+ = Fe 2+ + Cu三、铁的化合物1、铁的氧化物铁的氧化物的比较铁的氧化物FeO Fe 2O 3Fe 3O 4俗称铁红磁性氧化铁色、态黑色粉末红棕色粉末黑色晶体铁的价态+2+3+2、+3水溶性难溶于水稳定性不稳定性 6FeO+O 2=2Fe 3O 4稳定稳定与酸的反应FeO+2H +=Fe 2++H 2O Fe 2O 3+6H +=2Fe 3++3H 2O Fe 3O 4+8H +=2Fe 3++ Fe 2++4H 2O与CO 的反应Fe x O y +yCO=xFe+yCO 2制取高温熔融,过量的铁与氧气反应2Fe+O 2=2FeO Fe(OH)3的分解2Fe(OH)3=Fe 2O 3+3H 2O 铁在氧气中燃烧3Fe+2O 2=Fe 3O 42、铁的氢氧化物(1)Fe(OH)2的制备Fe(OH)2易被氧化,在制备时应注意(1)配制后的FeSO 4溶液中要加入少量铁粉;(2)配制溶液的蒸馏水以及所用NaOH 溶液均须煮沸以除去其中溶解的氧气;(3)Fe 2+容易被氧化,所以FeSO 4溶液要新配制. (4)为了防止滴加NaOH 时带入空气,可将吸收NaOH 的长滴管伸入FeSO 4溶液液面下,再挤出NaOH 溶液.(5)为了防止Fe 2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量煤油或其它密度比水小但不溶于水的有机物以隔绝空气.实验:FeSO 4溶液中加NaOH. 现象: 生成白色沉淀,后又迅速转变为灰绿色,最后生成红褐色化学方程式: FeSO 4 + 2NaOH = Fe(OH)2↓+Na 2SO 4 Fe 2++ 2OH -= Fe(OH)2↓(白色)4Fe(OH)2 + O 2 + 2H 2O = 4Fe(OH)3(红褐色) (白色→灰绿色→红褐色)(2)Fe(OH)3的制备实验:FeCl 3溶液中加NaOH 溶液. ①现象:生成红褐色沉淀②化学方程式:FeCl 3+3NaOH= Fe(OH)3↓+3NaCl Fe 3++ 3OH -= Fe(OH)3↓(红褐色)③热稳性:Fe(OH)3对热不稳定,受热能失去水生成红棕色的Fe 2O 3粉末.化学方程式: 2Fe(OH)3 Fe 2O 3 +3H 2O[小结]难溶性或微溶性的碱受热不稳定,容易分解。
铁及其化合物高三化学第一轮复习教案考点突破1、铁的化合物的相互转化关系2、铁的氧化物和氢氧化物3、Fe2+、Fe3+ 的鉴别HeFr Ra Ac. Rf Ha过渡金属第四周期,第皿族+26 2 8 144 邕Fe Te ="" Fe3+1s2s2p3s3p3d4sLi Be B C N ONa Mg Al Si P SK CaSc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As SeRb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb TeCs Ba La. Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi PoF NeCl ArBr KrI XeAt RnFe We Fe2+铁的原子结构与性质:过渡元素麻子结构特点、铁单质的性质请写出上述关系的有关反应方程式。
铁及其化合物知识网络14 \ 1'l①最外层仅有2个电子一②次外层不饱和-2e(弱氧化剂-) +2价(Fe 2+) -3e(强氧化剂。
+3价(Fe 力 偏离6e-------------- -+6 价(FeO 4 2-)接受电子对(Q、Cl2、Br2、BQ、HNQ)铁三角的应用练习1:下列各物质中,不能由组成它的两种元素单质直接化合得到的A、FeSB、Fe s O4C、Cu2sD、FeCl2练习2:在含有Cu(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合液中投入铁粉,经反应未见气体放出,析出3.2g铜,溶解的铁粉质量()A. 5.6gB. 2.8gC. 14gD. 8.4g二、铁化合物的性质+2价+3[介+2 +3介1、氧化物FeO F^Q FeA胪胪肥-------- -------- Fg+ [ 氧化剂F^+2、可溶性盐|(浅^色)[二还原齐『(黄色)8 T fi------------------ Fe(OH)Fe(OHJ3、氢氧化物(白色沉淀)(红褐色沉淀)铁的氧化物的性质比较[例二]下列离子方程式书写正确的是(D)A、FeO 与稀HNO3 反应:FeO + 2H+= Fe2++ H2OB、Fe 与FeCl3 反应:Fe + Fe3+= 2Fe2+C、Fe(OH)3与HI 酸反应Fe(OH) 3 + 3H+ = Fe3+ + 3H2。
专题1 元素及其化合物第一单元金属及其化合物(氧化还原反应)第3讲铁及其化合物一、课程标准要求1.了解铁的物理性质和化学反应。
2.了解铁的氧化物、氢氧化物的化学性质。
3.结合真实情境中的应用实例或通过实验探究,了解铁及其重要化合物的主要性质,了解它们在生产生活中的主要应用。
二、在高中化学教材体系中的地位“铁及其化合物”是高中化学必修教材中的核心内容,是高中一年级全体学生都应学习的重点化学内容。
铁元素不仅是典型的金属元素,还是重要的变价元素。
铁及其化合物与人体健康密切相关,在生产生活中也有着广泛的应用。
三、思维导图四、课时安排建议第1课时铁、铁的氧化物和氢氧化物(1课时)第2课时铁盐、亚铁盐的性质及其综合应用(1课时)第1课时铁、铁的氧化物和氢氧化物(1课时)一、教学流程活动一:构建知识体系问题1:铁单质有哪些物理性质、化学性质?[例题1] 1.判断正误,正确的打“√”,错误的打“×”。
(1)铁位于元素周期表中第4周期第ⅧB族。
()(2)室温下,Fe与浓H2SO4反应生成FeSO4。
()(3)将一定量的铁、铜的混合物加入100 mL 0.1 mol·L-1的FeCl3溶液中,充分反应后,溶液中有固体剩余,则剩余的固体中一定含有铜,可能含有铁。
()(4)Fe分别与氯气和盐酸反应所得氯化物相同。
()(5)氢氧化铁与HI溶液仅发生中和反应。
()[答案](1)×(2)×(3)√(4)×(5)×[归纳总结](一)铁元素及其原子结构1.铁位于周期表中第周期族,是一种应用最广泛的过渡金属元素;铁元素是一种典型的变价金属元素。
2.原子结构(二)铁单质1.物理性质:纯铁具有金属的共性,如具有色金属光泽,具有性、性和性,具有能被吸引的特性。
2.化学性质(1)与非金属单质的反应①与氧气反应:。
②与氯气反应:。
③与硫反应:。
(2)与水蒸气的反应:。
(3)与酸、盐的反应①与氧化性酸反应(写离子方程式):铁与过量稀硝酸反应:。
铁及其重要化合物【考情分析】本讲内容为高考的高频考点,从分值来看,铁所占的比重最大,除铁是重要的金属元素外,还取决于铁元素与生产生活的紧密联系,Fe、Fe2+、Fe3+之间的转化,以及所承载的氧化还原反应等重要知识点。
考查内容主要集中在“铁三角”,Fe与酸的反应,铁的变价、Fe(OH)2和Fe(OH)3的性质等。
考查内容能在多种题型中出现,选择、简答、实验、推断、计算都有。
【核心素养分析】1.宏观辨识与微观探析:认识铁及其化合物的性质及应用,能以“铁三角”转化关系理解变价元素的转化条件。
2.科学态度与社会责任:利用铁及其化合物的性质,科学认识铁及其化合物的提纯和制备工艺流程,形成严谨求实的科学态度和崇尚真理的意识。
3.科学探究与创新意识:能提出有价值的氢氧化亚铁及其他铁的化合物的制备方案,并进行实验探究。
【网络构建】【知识梳理】知能点一铁1.位置:铁位于元素周期表中第4周期Ⅷ族,是一种应用最广泛的过渡金属元素;铁元素是一种典型的变价金属元素。
2.结构3.铁的物理性质银白色固体,熔点较高,具有良好的导热、导电、延展性,能被磁铁吸引。
4.铁的化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
(1)与非金属单质的反应 ①与O 2的反应:常温:铁被腐蚀生成铁锈,其主要成分为Fe 2O 3。
点燃:3Fe +2O 2=====点燃Fe 3O 4。
②与Cl 2的反应:2Fe +3Cl 2=====点燃2FeCl 3。
③与S 的反应:Fe +S FeS 。
④与I 2的反应:Fe +I 2FeI 2(2)与水的反应常温下铁与水不反应,在高温条件下与水蒸气反应:3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
(3)与酸的反应(4)与某些盐溶液反应①与CuSO 4溶液反应的离子方程式:Fe +Cu 2+===Fe 2++Cu 。
②与FeCl 3溶液反应的离子方程式:2Fe 3++Fe===3Fe 2+。