生物化学氨基酸代谢知识点汇总
- 格式:docx
- 大小:1.04 MB
- 文档页数:19
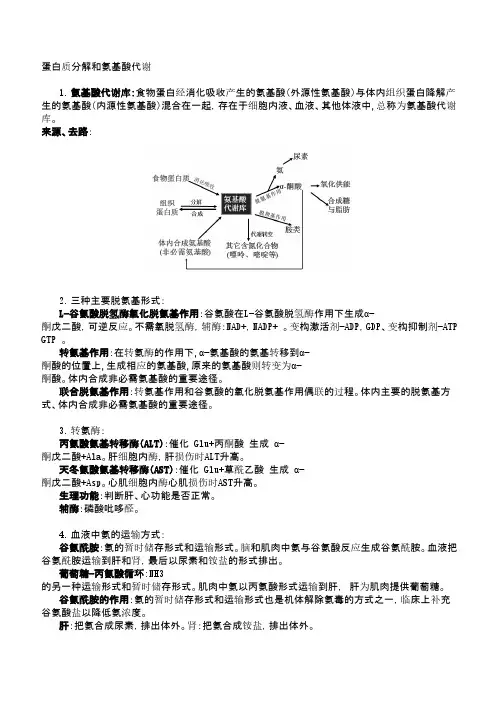
蛋白质分解和氨基酸代谢1.氨基酸代谢库:食物蛋白经消化吸收产生的氨基酸(外源性氨基酸)与体内组织蛋白降解产生的氨基酸(内源性氨基酸)混合在一起,存在于细胞内液、血液、其他体液中,总称为氨基酸代谢库。
来源、去路:2.三种主要脱氨基形式:L-谷氨酸脱氢酶氧化脱氨基作用:谷氨酸在L-谷氨酸脱氢酶作用下生成α-酮戊二酸,可逆反应。
不需氧脱氢酶,辅酶:NAD+,NADP+ 。
变构激活剂-ADP,GDP、变构抑制剂-ATP GTP 。
转氨基作用:在转氨酶的作用下,α-氨基酸的氨基转移到α-酮酸的位置上,生成相应的氨基酸,原来的氨基酸则转变为α-酮酸。
体内合成非必需氨基酸的重要途径。
联合脱氨基作用:转氨基作用和谷氨酸的氧化脱氨基作用偶联的过程。
体内主要的脱氨基方式、体内合成非必需氨基酸的重要途径。
3.转氨酶:丙氨酸氨基转移酶(ALT):催化 Glu+丙酮酸生成α-酮戊二酸+Ala。
肝细胞内酶,肝损伤时ALT升高。
天冬氨酸氨基转移酶(AST):催化 Glu+草酰乙酸生成α-酮戊二酸+Asp。
心肌细胞内酶心肌损伤时AST升高。
生理功能:判断肝、心功能是否正常。
辅酶:磷酸吡哆醛。
4.血液中氨的运输方式:谷氨酰胺:氨的暂时储存形式和运输形式。
脑和肌肉中氨与谷氨酸反应生成谷氨酰胺。
血液把谷氨酰胺运输到肝和肾,最后以尿素和铵盐的形式排出。
葡萄糖-丙氨酸循环:NH3的另一种运输形式和暂时储存形式。
肌肉中氨以丙氨酸形式运输到肝,肝为肌肉提供葡萄糖。
谷氨酰胺的作用:氨的暂时储存形式和运输形式也是机体解除氨毒的方式之一,临床上补充谷氨酸盐以降低氨浓度。
肝:把氨合成尿素,排出体外。
肾:把氨合成铵盐,排出体外。
5.鸟氨酸循环:尿素在体内合成的全过程。
(1)氨基甲酰磷酸的合成:由肝细胞线粒体中的氨基甲酰磷酸合成酶I催化合成氨基甲酰磷酸。
需有ATP提供能量。
氨基甲酰磷酸合成酶为别构酶,需要N-乙酰谷氨酸(AGA)。
而AGA是在乙酰CoA和谷氨酸在AGA合成酶催化下形成。


第七章氨基酸代谢【目的和要求】1、掌握体内氨基酸的来源与去路;氨的来源与去路;掌握氨基酸脱氨基方式及基本过程;2、掌握一碳单位的定义、种类、载体和生物学意义。
3、熟悉必需氨基酸的种类和蛋白质的营养价值与临床应用。
4、了解个别氨基酸代谢,了解氨基酸代谢中某个酶缺陷或活性低时所导致的氨基酸代谢病。
【本章重难点】1氨基酸的来源和去路2.氨的来源和去路3.鸟氨酸循环4.联合脱氨基作用学习内容第一节蛋白质的营养作用第二节氨基酸的一般代谢第三节个别氨基酸的代谢第一节蛋白质的营养作用一氨基酸的来源和去路㈠氨基酸的来源氨基酸是蛋白质的基本组成单位。
参加体内代谢的氨基酸,除经食物消化吸收来以外,还来自组织蛋白质分解和自身合成。
这些氨基酸混为一体,分布在细胞内液和细胞外液,构成氨基酸代谢库。
体内的氨基酸的来源和去路保持动态平衡,它有三个来源:⒈食物蛋白质经消化吸收进入体内的氨基酸。
组成蛋白质的氨基酸有二十种,其中有8种是人体需要而不能自身合成,必需由食物供给的,称为必需氨基酸。
它们为苏氨酸、色氨酸、缬氨酸、赖氨酸、亮氨酸、异亮氨酸,苯丙氨酸及蛋氨酸。
其余十二种氨基酸在体内可以合成或依赖必需氨基酸可以合成,称为非必需氨基酸。
食物蛋白质营养价值的高低取决于食物蛋白质所含必需氨基酸的种类、数量和比例。
种类齐全、数量大、比例与人体需要越接近,其营养价值越高。
为提高蛋白质的营养价值,把几种营养价值较低的蛋白质混合食用,必需氨基酸相互补充,从而提高氨基酸的利用率,称为蛋白质营养的互补作用。
蛋白质具有高度种属特异性,不能直接输入人体,否则会产生过敏现象。
进入机体前必先在肠道水解成氨基酸,然后吸收入血。
蛋白质的消化作用主要在小肠中进行,由内肽酶(胰蛋白酶、糜蛋白酶及弹性蛋白酶)和外肽酶(羧基肽酶、氨基肽酶)协同作用,水解成氨基酸,水解生成的二肽也可被吸收。
未被吸收的氨基酸及蛋白质在肠道细菌的作用下,进行分解代谢,其代谢过程可产生许多对人体有害的物质(吲哚、酚类、胺类和氨),此过程称为蛋白质的腐败作用。

生物化学丨氨基酸代谢氨基酸代谢蛋白质的生理功能及营养作用一、蛋白质的生理功能1.维持细胞组织的生长、更新和修补2.参与多种重要的生理活动3.氧化供能蛋白质在肠道的消化吸收及腐败作用一、胃蛋白酶作用的特点:①胃蛋白酶的最适pH为1.5—2.5;二、氨基酸的吸收氨基酸的吸收部位是小肠,主要是耗能的主动吸收过程。
三、蛋白质的腐败作用肠道细菌对未被消化的蛋白质及其消化产物所起的作用,称为腐败作用。
氨基酸的一般代谢一、转氨酶又称氨基转移酶,催化某一氨基酸的α氨基转移到另一种α酮酸的酮基上,形成转氨基反应。
其辅酶是磷酸吡哆醛。
二、氨基酸的脱氯基作用1.转氨基作用:转氨酶。
2.氧化脱氨:L—谷氨酸脱氢酶。
3.联合脱氨基作用:转氨基作用偶联L—Glu氧化脱氨,存在于肝、肾、脑等组织。
4.嘌呤核苷酸循环:存在于心肌和骨骼肌。
氨的代谢一、氨的来源1.氨基酸脱氨基作用产生的氨是体内氨的主要来源。
2.肠道吸收的氨。
3.肾小管上皮细胞分泌的氨。
二、氨的转运(一)丙氨酸-葡萄糖循环肌肉中的氨以无毒的丙氨酸形式运输到肝,丙氨酸脱下的氨在肝合成尿素,脱氨后形成的丙酮酸异生成葡萄糖经血液循环运回肌肉。
(二)谷氨酰氨的运氨作用在脑和肌肉组织,氨和谷氨酸在谷氨酰胺合成酶的催化下生成谷氨酰胺,并由血液运至肝和肾,再经谷氨酰胺酶水解成谷氨酸和氨。
血液中丙氨酸、谷氨酰氨、谷氨酸的含量相对较高。
三、氨的去路(一)在肝内合成尿素是体内氨的主要去路尿素合成过程又称鸟氨酸循环,鸟氨酸循环的要点:1.部位:肝细胞的线粒体、胞液。
2.终产物:尿素。
3.关键酶:氨基甲酰磷酸合成酶I:位于线粒体中,其激活剂为N 一乙酰谷氨酸;精氨酸代琥珀酸合成酶。

氨基酸代谢一、教学大纲基本要求蛋白质的消化、吸收,氨基酸代谢库,必需氨基酸,氮平衡,氨基酸代谢概论,氨基酸的脱氨基、转氨基、联合脱氨基作用;蛋白质降解,尿素循环,氨基酸合成代谢;氨基酸的脱羧基作用,氨基酸的碳链代谢,氨的排出、转运。
二、本章知识要点(一)氨基酸代谢概述蛋白质作为动物体的主要组成成分,总是在不断地进行着新陈代谢。
而蛋白质的基本组成单位是氨基酸,所以氨基酸代谢是蛋白质代谢的重要内容。
1.蛋白质的消化、吸收(1)蛋白质的消化动物的唾液中虽有少量唾液蛋白质酶能分解蛋白质,但在整个消化过程中,其作用不大。
蛋白质食物主要是在胃和小肠中进行消化的。
胃粘膜主细胞可分泌胃蛋白酶原,胰液能提供胰蛋白酶原、糜蛋白酶原、弹性蛋白酶原和羧基肽酶原,这些酶原激活后可转变成有活性的酶,在这些酶以及动物体所含的氨肽酶、羧肽酶和二肽酶等共同作用下,来完成日粮中蛋白质的消化过程。
(2)蛋白质的吸收在正常情况下,只有氨基酸及少量二肽、三肽能被动物体吸收进入血液。
这种吸收主要在小肠粘膜细胞上进行,肾小管细胞和肌肉细胞也能吸收,这是一个耗能、需氧的主动运输过程。
关于氨基酸吸收的机理,目前仍未完全解决。
A.Meister在1968-1969年,从肾脏研究中,提出关于氨基酸吸收的“γ-谷氨酰基循环”假说,具有一定理论意义。
他认为氨基酸吸收或向各组织、细胞内转移是通过谷胱甘肽起作用,这个过程由六步连续的酶促反应完成。
2.氨基酸的代谢库动物体吸收进入血液的氨基酸与体内游离的氨基酸构成了氨基酸代谢库。
在正常情况下,氨基酸代谢库中的氨基酸维持在一个动态平衡中。
一方面,氨基酸被消耗,或用来合成蛋白质,或合成其它含氮物质,或氧化分解提供能量;另一方面,可由体外吸收、体内合成或体内蛋白质分解所产生的氨基酸补充。
3.必需氨基酸必需AA是指机动物体内不能合成或合成量不足,必须由日粮提供的一类氨基酸,构成天然蛋白质的20种氨基酸中有10种氨基酸是多数动物的必需氨基酸:3种碱性AA(赖AA、精AA、组AA),3种支链AA(亮AA、异亮AA、缬AA),2种芳香AA(苯丙AA、色AA),1种含硫AA(甲硫AA),1种羟基AA(苏AA)。

ﻩ第九章氨基酸代谢第一节:蛋白质的生理功能和营养代谢蛋白质重要作用1.维持细胞、组织的生长、更新和修补2.参与多种重要的生理活动(免疫,酶,运动,凝血,转运)3.氧化供能氮平衡1.氮总平衡:摄入氮= 排出氮(正常成人)氮正平衡:摄入氮> 排出氮(儿童、孕妇等)氮负平衡:摄入氮<排出氮(饥饿、消耗性疾病患者)2.意义:反映体内蛋白质代谢的慨况。
蛋白质营养价值1.蛋白质的营养价值取决于必需氨基酸的数量、种类、量质比2.必需氨基酸甲来写一本亮色书、假设梁借一本书来3.蛋白质的互补作用,指营养价值较低的蛋白质混合食用,其必需氨基酸可以互相补充而提高营养价值。
第二节:蛋白质的消化、吸收与腐败外源性蛋白消化1.胃:壁细胞分泌的胃蛋白酶原被盐酸激活,水解蛋白为多肽和氨基酸,主要水解芳香族氨基酸2.小肠:胰液分泌的内、外肽酶原被肠激酶激活,水解蛋白为小肽和氨基酸;生成的寡肽继续在小肠细胞内由寡肽酶水解成氨基酸氨基酸和寡肽的主动吸收1.吸收部位:小肠,吸收作用在小肠近端较强2.吸收机制:耗能的主动吸收过程通过转运蛋白(氨基酸+小肽):载体蛋白与氨基酸、组成三联体,由供能将氨基酸、转入细胞内,再由钠泵排出细胞。
通过谷氨酰基循环(氨基酸):关键酶谷氨酰基转移酶,具体过程参P199图大肠下段的腐败作用1.产生胺:肠道细菌脱羧基作用生成胺,其中假神经递质:酪胺和苯乙胺未能及时在肝转化,入脑羟基化成β-羟酪胺,苯乙醇胺,其结构类似儿茶酚胺,它们可取代儿茶酚胺与脑细胞结合,但不能传递神经冲动,使大脑发生异常抑制。
2.产生氨:3.产生其他物质:有害(多),如胺、氨、苯酚、吲哚;可利用物质(少),如脂肪酸、维生素第三节:氨基酸的一般代谢体内氨基酸分解1.蛋白质降解速率半衰期2.真核细胞内蛋白降解两大途径:溶酶体内非依赖途径+蛋白酶体内依赖途径(泛素化过程参课本P201):①溶酶体内非依赖途径•不依赖•利用溶酶体内组织蛋白酶()•降解外源性蛋白、膜蛋白和长寿命的细胞内蛋白蛋白酶体内依赖途径(依赖泛素的降解过程)•依赖•降解异常蛋白和短寿命蛋白泛素介导的蛋白质降解过程.E1:泛素活化酶,E2:泛素结合酶,E3:泛素蛋白连接酶氨基酸代谢库1.代谢“三进四出”:进食物消化吸收,组织蛋白分解,非必需氨基酸转化出脱氨基作用,脱羧基作用,代谢转变,组织蛋白合成氨基酸分解第一步:脱氨基脱氨基方式:1.转氨基作用2.氧化脱氨基3.联合脱氨基转氨基和氧化脱氨基偶联转氨基和嘌呤核苷酸循环偶联转氨基作用:1. 定义在转氨酶()的作用下,某一氨基酸去掉α-氨基生成相应的α-酮酸,而另一种α-酮酸得到此氨基生成相应的氨基酸的过程。

氨基酸代谢蛋白质的降解1.外源蛋白质消化蛋白质通过各种消化酶变成氨基酸进入体内2.内源蛋白质的转换正常成年人的摄入氮量与排泄氮量往往相等溶酶体途径细胞内蛋白质降解发生在溶酶体。
半衰期较长的蛋白通过该途径水解泛素化-蛋白酶体途径泛素可以介导蛋白质降解, 泛素与靶蛋白结合, 在蛋白酶体中降解。
半衰期短的蛋白通过该途径, 调节蛋白也可选择该途径自杀。
氨基酸分解氨基酸需要分解掉, 成为氨和碳骨架。
即脱氨基作用。
1.氧化脱氨基作用。
指氨基酸在相应酶催化下脱氨基。
主要发生在肝脏。
分别是L-氨基酸氧化酶, D-氨基酸氧化酶, L-谷氨酸脱氢酶。
前俩属于氧化还原酶类, 需要氧气。
更为重要的是谷氨酸脱氢酶(GDH), 其辅酶是NAD+或NADP+, 将谷氨酸的氨基氧化去掉, 生成α-酮戊二酸和铵根离子和NADH。
GDH存在于线粒体基质中2.转氨基作用。
该酶需要磷酸吡哆醛作为辅酶。
将一个氨基酸的氨基转到另一个酮酸上, 自己变成酮酸, 反应恰好把羰基换成氨基。
转氨酶在线粒体内外都有。
有了这个反应和氧化脱氨基作用, 我们就有新的手段。
3.联合脱氨基作用, 只需要把所有氨基转到α-酮戊二酸上生成谷氨酸, 再用GDH解决谷氨酸即可,除了直接用GDH, 还可以用嘌呤核苷酸循环解决。
氨的去向氨的去向一个是直接排出体外, 氨出外或者尿素出外, 另一个就是重新利用。
水生动物以氨排出, 脊柱动物以尿素排出, 鸟类和爬行类以尿酸排出尿素循环尿素循环主要发生在哺乳动物肝细胞中。
1.尿素的预备反应, 形成氨甲酰磷酸。
消耗一个二氧化碳, 一个氨,2分子ATP,酶为氨甲酰磷酸合酶(GPS-1),存在于肝细胞的线粒体基质中, 为了配合该酶, 需要有源源不断的氨来源, 因此线粒体基质中也配备了大量的谷氨酸脱氢酶。
另外还有GPS-2存在于所有细胞的胞液中。
2的氨供体是谷氨酰胺。
可以说, 肝细胞中的线粒体每天做的最主要的事就是合成氨甲酰磷酸。
合成这一步的目的是好转氨基。



第七章氨基酸代谢一、名词解释1.γ-谷氨酰基循环:指通过谷胱苷肽的代谢作用将氨基酸吸收和转运到体内的过程。
2.尿素循环:指氨与CO2 通过鸟氨酸、瓜氨酸、精氨酸生成尿素的过程。
3.生糖与生酮氨基酸: 指在体内既能转变成糖又能转变成酮体的一类氨基酸。
4. 甲硫氨酸循环:甲硫氨酸循环指甲硫氨酸经S腺苷蛋氨酸、S腺苷同型半胱氨酸、同型半胱氨酸,重新生成甲硫氨酸的过程。
5.高氨血症:肝功能严重损伤时尿素合成障碍导致血氨浓度升高。
6.食物蛋白质互补作用:指两种或两种以上营养价值较低的蛋白质食物混合食用,则必须氨基酸间可相互补充,从而提高营养价值。
7. 一碳单位:指某些氨基酸分解代谢过程中产生含有一个碳原子的基团,包括甲基、亚甲基、甲烯基、甲炔基、甲酰基和亚氨甲基等。
8.必需氨基酸:指体内需要而不能自身合成,必须由食物提供的一类氨基酸。
9.苯酮酸尿症:指体内苯丙氨酸羟化酶缺陷,苯丙氨酸不能正常转变成酪氨酸,因此苯丙氨酸经转氨基作用生成苯丙酮酸、苯乙酸等,并从尿中排出的一种遗传性疾病。
10.丙氨酸-葡萄糖循环:指通过丙氨酸和葡萄糖在肌肉和肝之间进行氨转运的过程。
11.泛素化标记:是一种依赖ATP参与在胞浆中进行的蛋白质标记过程,标记多个泛素化分子后由蛋白酶体将其标记蛋白分解成多肽小分子物质。
补充:1.LDL 受体:广泛地分布于体内各组织细胞表面,能特异地识别和结合LDL,主要生理功能是摄取降解LDL并参与维持细胞内胆固醇平衡二、填空题1.肝细胞参与合成尿素的两个亚细胞部位是(线粒体)和(胞浆)。
2.甲硫氨酸循环中,产生的甲基供体是(S腺苷甲硫氨酸),甲硫氨酸合成酶的辅酶是(维生素B12)。
3.血液中转运氨的两种主要方式是:(丙氨酸)和(谷氨酰胺)。
4. 泛酸在体内经肠道吸收后几乎全部用于( )的合成,该物质是( )的辅酶。
5.肝细胞参与合成尿素中两个氮原子的来源,第一个氮直接来源于(氨),第二个氮直接来源于(天冬氨酸)。
小节练习第三节氨基酸的一般代谢2015-07-07 71802 0一、体内蛋白质分解生成氨基酸体内的蛋白质处于不断合成与降解的动态平衡。
成人体内的蛋白质每天约有1%~2%被降解,其中主要是骨骼肌中的蛋白质。
蛋白质降解所产生的氨基酸,大约70%~80%又被重新利用合成新的蛋白质。
(一)蛋白质以不同的速率进行降解不同的蛋白质降解速率不同。
蛋白质的降解速率随生理需要而变化,若以高的平均速率降解,标志此组织正在进行主要结构的重建,例如妊娠中的子宫组织或严重饥饿造成的骨骼肌蛋白质的降解。
蛋白质降解的速率用半寿期(half-life,t1/2)表示,半寿期是指将其浓度减少到开始值的50%所需要的时间。
肝中蛋白质的t1/2短的低于30分钟,长的超过150小时,但肝中大部分蛋白质的t1/2为1~8天。
人血浆蛋白质的t1/2约为10天,结缔组织中一些蛋白质的t1/2可达180 天以上,眼晶体蛋白质的t1/2更长。
体内许多关键酶的t1/2都很短,例如胆固醇合成的关键酶HMG-CoA还原酶的t1/2为0.5~2小时。
为了满足生理需要,关键酶的降解既可加速亦可滞后,从而改变酶的含量,进一步改变代谢产物的流量和浓度。
(二)真核细胞内蛋白质的降解有两条重要途径细胞内蛋白质的降解也是通过一系列蛋白酶和肽酶完成的。
蛋白质被蛋白酶水解成肽,然后肽被肽酶降解成游离氨基酸。
1.蛋白质在溶酶体通过ATP非依赖途径被降解溶酶体的主要功能是消化作用,是细胞内的消化器官。
溶酶体含有多种蛋白酶,称为组织蛋白酶(cathepsin)。
这些蛋白酶对所降解的蛋白质选择性较差,主要降解细胞外来的蛋白质、膜蛋白和胞内长寿蛋白质。
蛋白质通过此途径降解,不需要消耗ATP。
2.蛋白质在蛋白酶体通过ATP依赖途径被降解蛋白质通过此途径降解需泛素的参与。
泛素是一种由76个氨基酸组成的小分子蛋白质,因其广泛存在于真核细胞而得名。
泛素介导的蛋白质降解过程是一个复杂的过程。
生物化学氨基酸代谢知识点汇总————————————————————————————————作者:————————————————————————————————日期:第九章氨基酸代谢第一节:蛋白质的生理功能和营养代谢蛋白质重要作用1.维持细胞、组织的生长、更新和修补2.参与多种重要的生理活动(免疫,酶,运动,凝血,转运)3.氧化供能氮平衡1.氮总平衡:摄入氮= 排出氮(正常成人)氮正平衡:摄入氮> 排出氮(儿童、孕妇等)氮负平衡:摄入氮< 排出氮(饥饿、消耗性疾病患者)2.意义:反映体内蛋白质代谢的慨况。
蛋白质营养价值1.蛋白质的营养价值取决于必需氨基酸的数量、种类、量质比2.必需氨基酸-----甲来写一本亮色书、假设梁借一本书来3.蛋白质的互补作用,指营养价值较低的蛋白质混合食用,其必需氨基酸可以互相补充而提高营养价值。
第二节:蛋白质的消化、吸收与腐败外源性蛋白消化1.胃:壁细胞分泌的胃蛋白酶原被盐酸激活,水解蛋白为多肽和氨基酸,主要水解芳香族氨基酸2.小肠:胰液分泌的内、外肽酶原被肠激酶激活,水解蛋白为小肽和氨基酸;生成的寡肽继续在小肠细胞内由寡肽酶水解成氨基酸氨基酸和寡肽的主动吸收1.吸收部位:小肠,吸收作用在小肠近端较强2.吸收机制:耗能的主动吸收过程○1通过转运蛋白(氨基酸+小肽):载体蛋白与氨基酸、Na+组成三联体,由ATP供能将氨基酸、Na+转入细胞内,Na+再由钠泵排出细胞。
○2通过r-谷氨酰基循环(氨基酸):关键酶----r--谷氨酰基转移酶,具体过程参P199图大肠下段的腐败作用1.产生胺:肠道细菌脱羧基作用生成胺,其中假神经递质:酪胺和苯乙胺未能及时在肝转化,入脑羟基化成β-羟酪胺,苯乙醇胺,其结构类似儿茶酚胺,它们可取代儿茶酚胺与脑细胞结合,但不能传递神经冲动,使大脑发生异常抑制。
2.产生氨:3.产生其他物质:有害(多),如胺、氨、苯酚、吲哚;可利用物质(少),如脂肪酸、维生素第三节:氨基酸的一般代谢体内氨基酸分解1.蛋白质降解速率---半衰期2.真核细胞内蛋白降解两大途径:○1溶酶体内ATP非依赖途径+○2蛋白酶体内ATP依赖途径(泛素化过程参课本P201):①溶酶体内ATP非依赖途径•不依赖ATP•利用溶酶体内组织蛋白酶(cathepsin)•降解外源性蛋白、膜蛋白和长寿命的细胞内蛋白○2蛋白酶体内ATP依赖途径(依赖泛素的降解过程)•依赖ATP•降解异常蛋白和短寿命蛋白泛素介导的蛋白质降解过程.E1:泛素活化酶,E2:泛素结合酶,E3:泛素蛋白连接酶氨基酸代谢库1.代谢“三进四出”:进---食物消化吸收,组织蛋白分解,非必需氨基酸转化出---脱氨基作用,脱羧基作用,代谢转变,组织蛋白合成氨基酸分解第一步:脱氨基脱氨基方式: 1.转氨基作用2.氧化脱氨基3.联合脱氨基转氨基和氧化脱氨基偶联转氨基和嘌呤核苷酸循环偶联转氨基作用:1. 定义在转氨酶(transaminase)的作用下,某一氨基酸去掉α-氨基生成相应的α-酮酸,而另一种α-酮酸得到此氨基生成相应的氨基酸的过程。
2.反应式:大多数氨基酸可参与转氨基作用,但赖氨酸、脯氨酸、羟脯氨酸除外。
3.转氨酶组成和分布:谷丙转氨酶(或称丙氨酸转氨酶,ALT,GPT),主要分布在肝;谷草转氨酶(或称天冬氨酸转氨酶,AST,GOT),主要分布在心脏. 血清转氨酶活性,临床上可作为疾病诊断和预后的指标之一4.作用机制: 转氨酶的辅酶是磷酸吡哆醛5. 转氨基作用的生理意义: 转氨基作用不仅是体内多数氨基酸脱氨基的重要方式,也是机体合成非必需氨基酸的重要途径。
通过此种方式并未产生游离的氨.氧化脱氨基(L-谷氨酸氧化脱氨基作用):不需氧的L-谷氨酸脱氢酶催化,主要分布在肝,脑,肾联合脱氨基:两种脱氨基方式的联合作用,使氨基酸脱下α-氨基生成α-酮酸的过程。
○1转氨基和氧化脱氨基偶联(脱氨基,合成非必需氨基酸主要方式,存在于肝,肾)○2转氨基和嘌呤核苷酸循环偶联(存在于肌肉组织)氨基酸分解第二步:a-酮戊二酸转化或分解①经氨基化生成非必需氨基酸②转变成糖及脂类(记少不记多:生酮要来亮盏灯,生糖生酮落一本色书)甘氨酸、丝氨酸、缬氨酸、组氨酸、精氨酸、羟脯氨酸、丙氨酸、谷氨酸、谷氨酰胺、蛋氨酸、天冬氨酸、天冬酰胺、脯氨酸、半胱氨酸类别氨基酸生糖氨基酸生酮氨基酸亮氨酸、赖氨酸生糖兼生酮氨基酸异亮氨酸、苯丙氨酸、酪氨酸、苏氨酸、色氨酸氨基酸生糖及生酮性质的分类③ 氧化供能:α-酮酸在体内可通过TAC 和氧化磷酸化彻底氧化为H 2O 和CO 2,同时生成ATP氨基酸、糖及脂肪代谢的联系第四节:氨的代谢血氨性质体内的氨主要在肝合成尿素(urea)而解毒。
正常人体生理血氨浓度47-65μmol/L血氨的“三来四去”来源:①氨基酸脱氨基作用产生的氨是血氨主要来源, 胺类的分解也可以产生氨②肠道吸收的氨○3肾小管上皮细胞分泌的氨主要来自谷氨酰胺去路:①在肝内合成尿素,主要的去路②合成非必需氨基酸及其它含氮化合物③合成谷氨酰胺④肾小管泌氨:肾小管上皮细胞分泌的NH3在酸性条件下生成NH4+,随尿排出氨的转运1.转运形式:丙氨酸、谷氨酰胺骨骼肌丙酮酸-葡萄糖循环肝生成尿素丙氨酸-葡萄糖循环谷氨酰胺的运氨作用骨骼肌,脑谷氨酰胺合成肝或肾谷氨酰胺酶水解谷氨酸+氨氨基酸代谢中几大重要循环:1.r-谷氨酰基循环(见前文书P199)2.丙酮酸-葡萄糖循环(P207)3.尿素生成鸟氨酸循环(P211)4.甲硫氨酸循环(P215)尿素合成1.关键酶:精氨酸代琥珀酸合成酶2.定位:肝,胞液+线粒体3.原料:2 分子氨,一个来自于游离氨,另一个来自天冬氨酸4.耗能:3 个ATP,4 个高能磷酸键(其中一个ATP生成AMP)5.反应结果:鸟氨酸催化氨生成二氧化碳和尿素6.主要步骤:○1CO2 + NH3 + H2O + 2ATP缩合生成氨基甲酰磷酸○2氨基甲酰磷酸与鸟氨酸反生成瓜氨酸○3瓜氨酸与天冬氨酸反应生成精氨酸代琥珀酸○4精氨酸代琥珀酸裂解生成精氨酸与延胡索酸○5精氨酸水解释放尿素并再生成鸟氨酸6.合成调节:高蛋白质膳食促进尿素合成AGA激活CPS-I启动尿素合成精氨酸代琥珀酸合成酶活性促进尿素合成7.合成障碍疾病:高血氨症,氨中毒血氨浓度升高称高氨血症,高氨血症脑功能障碍,称氨中毒。
起因:肝功能严重损伤或尿素合成酶的遗传缺陷肝性脑病(详细内容参人代黄色教材)定义:肝性脑病是继发于严重肝炎,以代谢絮乱为基础的中枢神经系统功能失调综合征,其主要临床表现是意识障碍、行为失常和昏迷。
发病机制:1.氨中毒学说2.假性神经递质学说3.氨基酸代谢失衡学说4.GABA学说5.神经毒物协同学说治疗:1.消除病因2.减少肠内毒物的生成和吸收3.促进有毒物质的代谢,纠正氨基酸代谢的絮乱4.肝移植5.其他对症治疗第五节:个别氨基酸的代谢脱羧基作用1.普遍反应步骤:氨基酸脱羧酶胺醛羧酸2.生成各种胺:GABA,组胺,5-羟色胺,多胺,牛黄酸○1谷氨酸经谷氨酸脱羧酶催化生成γ-氨基丁酸:GABA(γ-氨基丁酸)是抑制性神经递质,对中枢神经有抑制作用○2牛磺酸:○3组胺:生理作用:强烈的血管舒张剂增加毛细血管的通透性刺激胃蛋白酶及胃酸的分泌○45-羟色胺:○5多胺:调节细胞生长在生长旺盛的组织(如胚胎、再生肝、肿瘤组织)含量较高,其限速酶鸟氨酸脱羧酶活性较强一碳单位生成1.定义:某些氨基酸代谢过程中产生的只含有一个碳原子的基团,称为一碳单位2.载体:四氢叶酸做为一碳单位运载体,在N5,N10位结合3.形式:一碳单位主要来源于氨基酸代谢4.转变:5.生理功能:作为合成嘌呤和嘧啶的原料把氨基酸代谢和核酸代谢联系起来含硫氨基酸代谢:含硫氨基酸:甲硫氨酸,半胱氨酸,胱氨酸(一)甲硫氨酸的代谢1.甲硫氨酸与转甲基作用产生SAM(S—腺苷甲硫氨酸),SAM为体内甲基的直接供体2. 甲硫氨酸循环甲硫氨酸循环生理意义:为机体甲基化反应提供甲基,N5—CH3—FH4 为甲基的间接供体。
3. 肌酸的合成:甘氨酸为骨架,精氨酸提供脒基,SAM提供甲基,终产物为肌酸酐(二)半胱氨酸与胱氨酸的代谢1. 半胱氨酸与胱氨酸的互变2. 硫酸根的代谢含硫氨基酸氧化分解均可产生硫酸根,但半胱氨酸是体内硫酸根的主要来源体内硫酸根代谢重要产物之一PAPS作用:参与硫酸软骨素、硫酸角质素等物质的合成,参与肝脏的生物转化3.半胱氨酸转变为牛磺酸芳香族氨基酸代谢芳香族氨基酸:苯丙氨酸,酪氨酸,色氨酸(一)苯丙氨酸和酪氨酸的代谢生成:苯乙酸,多巴胺,黑色素,尿黑酸代谢流程图:参书本P219图相关疾病:帕金森病,白化病,尿黑酸症,苯酮酸尿症(二)色氨酸代谢苯酮酸尿症(更多信息参人代黄色P63)1.定义:体内苯丙氨酸羟化酶缺陷,苯丙氨酸不能正常转变为酪氨酸,苯丙氨酸经转氨基作用生成苯丙酮酸、苯乙酸等,并从尿中排出的一种遗传代谢病。
2.临床表现:智力缺陷,毛发和皮肤较正常人略浅,尿液和汗液伴鼠臭味治疗:低苯丙氨酸膳食3.大概机制:支链氨基酸代谢(略)。