NCCN 卵巢癌指南(2015.1 最新版)解析
- 格式:doc
- 大小:57.50 KB
- 文档页数:10

血清 IL-2、 IL-4、 IL-6在卵巢癌中的诊断[摘要]目的:探讨血清IL-2、IL-4、IL-6在卵巢癌中诊断价值。
方法:选取本院收治的105例卵巢癌为实验组,40例卵巢巧克力囊肿为良性对照组,进行血清IL-2、IL-4、IL-6测定,比较其相关性,绘制ROC曲线。
结果:卵巢癌组血清IL-2、IL-4、IL-6水平高于良性组,均具有较高的AUC。
结论:血清IL-2、IL-4、IL-6在卵巢癌中具有较高的诊断价值。
[关键词]IL-2;IL-4;IL-6;卵巢癌卵巢癌是女性癌症相关死亡的第五大原因,其风险随着年龄的增长而增加,其中不到15%的上皮性卵巢癌是由遗传易感性引起的,其中包括BRCA1/2基因突变携带者。
早期卵巢癌是一种无症状的疾病,尽管在筛查技术、外科手术和化疗方面取得了进展,仍然是全世界最致命的妇科癌症。
虽然人们对卵巢癌的病理生理学有一定的了解,辅助技术也得到了改进,但目前为止,还没有一种特异的标记物使卵巢癌的早期发现。
因此,与其他妇科癌症相比,5年生存率较低,因为大多数患者诊断为晚期[1]。
炎症是一种多方面的状态,涉及持续免疫反应的各种组织变化。
肥胖、基因改变、荷尔蒙失调与高水平的炎症标志物有关。
炎症的改变涉及多方面途径而影响癌症细胞的增殖及凋亡,从而参与肿瘤的发展与侵袭。
越来越多的证据发现白细胞介素类因子与肿瘤的关系最密切,尤其在抗肿瘤方面,甚至影响肿瘤患者的预后。
但目前关于IL-2、IL-4、IL-6在卵巢癌中诊断评估较少,本研究为临床研究提供证据支持。
1.资料与方法1.1一般资料选自2019年5月至2020年2月本院收治的105例卵巢癌为实验组,40例卵巢巧克力囊肿为对照组。
纳入标准:实验组符合《NCCN卵巢癌临床实践指南》中诊断标准,良性对照组病理检查确诊为卵巢巧克力囊肿。
1.2方法实验方法:离心后采集血浆,应用瑞斯凯尔的流式荧光发光法测定血清IL-2、IL-4、IL-6。

卵巢癌晚期化疗⽅案如何选择?腹腔化疗vs静脉化疗GOG252研究最初在2016年SGO会议上报道,在初治卵巢癌晚期患者中评价腹腔化疗和静脉化疗对患者PFS的影响。
在随访84.8个⽉后,全⽂于2019年4⽉发表在JCO上。
本期⼩编特邀上海瑞⾦医院的冯炜炜医⽣解读这项研究背景3期临床研究GOG172的结果显⽰,对于接受了最佳肿瘤减灭术的III期卵巢癌,输卵管癌,原发性腹膜癌患者,相⽐TP⽅案,静脉紫杉醇+腹腔顺铂/紫杉醇腹腔化疗(IP)⽅案组患者的PFS和OS有显著延长。
NCCN指南也将IP⽅案纳⼊化疗推荐中。
但是腹腔化疗给药⽅式复杂且毒性反应增加,临床应⽤未能普及。
基于JGOG3016研究结果,GOG252选择了紫杉醇周疗+卡铂3周⽅案作为对照。
研究开始之初,贝伐单抗GOG218和ICON-7研究初步结果公布,基于这两项研究的数据,GOG252研究在所有研究组中加⼊了贝伐单抗。
研究设计⾸先介绍⼀下临床研究设计。
这是⼀项在美国开展的多中⼼开放标签,随机3期临床研究。
纳⼊新诊断的II⾄IV期上⽪性卵巢癌,输卵管癌或原发性腹膜癌患者,分期⼿术和最⼤细胞减灭术后12周内⼊组。
对照组卡铂IV⽅案:紫杉醇80mg/m2IV,周疗+ 卡铂AUC6 IV,D1,每21天⼀疗程,共6个cycle,同时贝伐单抗15mg/kg IV,第2个周期开始持续到第22个周期。
卡铂IP组⽅案为:紫杉醇80mg/m2 IV,周疗+卡铂AUC6,IP,D1,21天⼀个周期,共6个周期,同时加上贝伐单抗。
顺铂IP组⽅案为:紫杉醇135mg/m2 IV,D1+顺铂75 mg/m2,IP,D2+紫杉醇60mg/m2,IP,D8,21天⼀个周期,6个疗程。
同时加上贝伐单抗。
需注意的是GOG252研究均加⼊了贝伐单抗,这个和GOG172不同;此外顺铂腹腔化疗的剂量也不⼀样,GOG252顺铂75mg/m2,GOG172⽤的剂量是100mg/m2。



1、2014NCCN卵巢癌指南对于BEP方案的论述;2、2014年NCCN卵巢癌指南手稿中对于未成年患者手术的论述,不做全面分期也是合理的(小朋友没有做全面分期)。
该项建议主要依据参考文献321和322制订。
两研究评价了不同分期范围对于卵巢恶性生殖细胞肿瘤患者预后的影响,321所有患者均为年轻患者(年龄1.4-20岁)。
321结果显示I-IV期卵巢恶性生殖细胞肿瘤患者手术+化疗后,患者的预后与分期范围无关。
322研究了是否行淋巴结切除术和淋巴结阳性与否与患者预后的关系,结果显示做不做淋巴结清扫和淋巴结是否阳性均不影响患者的预后。
两研究作者推断其原因为肿瘤对于化疗药物极其敏感。
这一结论也得到Pediatric Oncology Group 和Children’s Study Group的确认和支持。
3、NCCN指南推荐PEB方案的依据来自4篇文章,5项研究。
①1970-1980年进行的临床研究确认PEB方案对卵巢恶性生殖细胞肿瘤极为敏感,最初的方案为顺铂+博来霉素+长春新碱。
1987年新英格兰医学杂志发表的文章显示将长春新碱换为VP16能够更好的改善患者的预后并减少毒副反应。
(研究太老了,找不到原文)②MD Anderson Cancer Center学者在恶性生殖细胞肿瘤患者中开展的研究再次证实了PEB方案的疗效。
研究结果1990年发表在JCO中(影响因子16分),该研究使用的方案如下:BLM 10-15mg 第1天起,Qd×3天持续静脉给药;VP-16 100mg/m2第1天起,Qd×3天;顺铂100mg/m2 第1天用药。
未成年人BLM 使用10mg。
4周疗,3-6疗程。
③GOG发起的一项多中心研究回顾性研究,在卵巢恶性生殖细胞肿瘤患者中(11-53岁)再次评价了PEB方案的疗效,并再次证实了上述两项研究的结果,该研究1994年发表在JCO中(影响因子16分)。
该项研究提到的方案就是NCCN指南中推荐的方案,疗程数为3疗程。

最新FIGO2021归癌报告:卵巢癌、输卵筐癌、腹膜癌诊治指南解读{全文)1概述卵巢恶性肿瘤可以发生于任何年龄。
20岁以下女性中生殖细胞肿瘤最常见。
交界性肿瘤常好发于30余岁到40余岁的女性,发病年龄较上皮性浸润癌患者旱10岁以上。
卵巢上皮性癌绝大多数发生于50岁以后。
卵巢上皮性肿瘤总发病率波动于(9~17)/10万,在高收入国家中发病率最高。
发病率随年龄增加而成比例升高,多数卵巢癌发生在60~64岁的群体中。
在低收入国家中,患者的中位年龄要小10岁。
卵巢上皮性癌较确定的致病危险因素为生育因素。
来生育女性罹患卵巢上皮性癌的风险是己生育女性的2倍。
生育年龄旱、旱绝经和使用口服避孕药可降低发生卵巢癌的风险,但这些因素与输卵筐癌之间的关系尚不明确。
以往认为输卵筐癌罕见,但已高证据提示,不少高级别浆液性卵巢癌和腹膜癌源于输卵筐伞端。
输卵筐受累可分为3种类型:第1种可见明显的输卵筐筐腔内肿物,肉眼可见输卵营包块,包括输卵筐上皮内癌(原位癌),可能起源于输卵管;第2种是与输卵筐上皮内癌相关的广泛播散性浆液性癌,可能不存在肉眼可见的输卵筐内膜肿吻;第3种为预防性输卵管卵巢切除时发现的输卵管上皮内癌,这种情况应诊断为原发性输卵筐癌,并对患者进行相应的处理。
无论遗传风险高低,可发现多数阜期浆液性癌存在于输卵筐。
2组织学分类大多数卵巢癌为上皮来源。
国际妇产科联盟(FIGO)采用世界E生组织(WHO)卵巢上皮性癌组织学分类方法。
分为:(1)浆液性肿瘤。
(2)黠液性肿瘤。
(3)内膜样肿瘤。
(4)透明细胞肿瘤。
(5)伯纳勒肿瘤。
(6)来分化癌(属于恶性上皮结构肿瘤,但芭伺分化极差,无法分入任何一组)。
(7)混合型上皮性肿瘤(肿瘤由5种常见上皮性肿瘤中的2种或以上组成,具体种类通常会明确说明)。
(8)腹膜癌或原发部位不明确的浆液性癌:病理为高级别浆液性癌,外观上卵巢和输卵筐被附带累及旦官们并非原发部位。
浆液性癌是最常见的类型。

腹腔内贝伐珠单抗联合腹腔热灌注化疗治疗卵巢癌腹腔积液的效果和安全性探讨[摘要]目的:探讨腹腔内贝伐珠单抗联合腹腔热灌注化疗治疗卵巢癌腹腔积液的效果和安全性。
方法:随机选取2020年3月至2022年9月在我院住院的卵巢癌腹水患者50例为实验组,50例为对照组,共100例。
对照组治疗方法采用腹腔内热灌注化疗,实验组采用腹腔内贝伐珠单抗联合腹腔热灌注化疗治疗。
经统计学对照反应药物临床疗效及不良反应。
结果:实验组临床治疗总有效率要明显优于对照组。
结论:腹腔内贝伐珠单抗联合腹腔内热灌注化疗可有效降低卵巢癌腹水患者的病灶体积且毒副作用较轻。
[关键词]:贝伐珠单抗;热灌注化疗;卵巢癌;腹腔积液;治疗效果卵巢癌是生长在卵巢上的恶性肿瘤,其中90% ~ 95%是原发性卵巢癌,另外5% ~ 10%是转移到卵巢的原发癌[1]。
卵巢癌早期患者症状隐匿,不易察觉且症状也不特异。
因此,早期诊断卵巢癌有一定的困难。
在治疗时,60% ~ 70%的患者处于晚期,晚期患者疗效不佳。
因此,虽然卵巢癌的发病率低于宫颈癌和子宫内膜癌在妇科恶性肿瘤中排名第三,但死亡率却高于宫颈癌和子宫内膜癌和妇科恶性肿瘤排名第一,是严重威胁妇女健康的最大疾病。
经研究显示[2],患者腹腔热灌注化疗联合贝伐珠单抗能较好的抑制肿瘤生长。
因此,本文选取2020年3月-2022年9月我院收治的100例卵巢癌腹腔积液患者展开研究,具体细则如下。
1资料与方法1.1 临床资料将2020年3月~2022年9月我院住院的卵巢癌腹水患者100例,随机分为实验组与对照组,各50例。
年龄在42~66岁,平均年龄54岁。
对照组年龄在44~67岁,平均年龄53岁。
这两个组中患者的基础病例差异性不显著(P>0.05),有可比性。
本研究经医院伦理委员会批准审核可以施行。
纳入标准:①符合《卵巢癌临床实践指南(第一版)》诊断标准[3];②预计生存期大于3个月;③ PS 评分(体力状况评分)大于等于2分;④均已签署知情同意书。

2023卵巢癌全程管理指南与实践70%的卵巢癌患者确诊时处于晚期,70%的患者在一线治疗达到临床缓解后2年内复发。
晚期卵巢癌患者容易多次复发,随着复发次数增加,PFS 和PFI 逐渐缩短,珀敏感最终转变成箱耐药;且化疗累积毒性随每个周期增加。
既往卵巢癌的治疗模式以手术+化疗为主,近年来研究发现,PARP 抑制剂维持治疗能够显著改善患者的预后。
本文中,济宁医学院附属医院彭存旭教授对卵巢癌的全程管理进行了详细介绍。
一、卵巢癌的全程管理模式卵巢癌发病率降低,但现患率升高的原因:诊断的准确率提高 基因检测的广泛应用 新辅助化疗的应用 手术彻底性(RO)的提高 腹腔热灌注化疗的应用死亡典拉期∣J.尼拉麻J. FDAMWTmMJW渗断.手术评估、影像学检意奥拉伯利士贝伐球单质.尼拉阚:FDA 获批3βntf7二漱手术iUR卢卡帕利:FDACUttSS特治疗化疗的规范贝伐珠单抗进入一线及维持治疗PARP抑制剂维持治疗的应用多种生物药物的联合应用二、手术治疗(-)手术可以最大限度减轻肿瘤负荷旨在通过减瘤手术尽可能切除更多肿瘤细胞;无可见残留病灶是诊断晚期卵巢癌后患者长期生存的最重要预测因素。
多项研究均显示,对于晚期卵巢癌患者,RO的患者生存期最长,获益最大。
另有研究显示,满意的肿瘤细胞减灭术每增加10%,生存率将提高5.5%β基于美国国家癌症数据库研究结果:不考虑肿瘤负荷的前提下,应该首选PCS,不能手术者可以推荐NACT ePCS-RO组的预后最好,mOS达到62.5个月;PCS-R1组和NACT-RO组的生存率基本相当;NACT-R1组预后最差,mOS为29.8个月。
(二)NACT+IDS或PDS的选择对于晚期卵巢癌患者x EORTC-NCIC.CHORUS.SCORPION这3项大型多中心、前瞻性、随机对照研究证实NACT-IDS获益。
来自中国学者的META分析显示:新辅助化疗组围手术期结果更好,满意肿瘤减灭术率更高,而不影响患者的PFS和OS e1、新辅助化疗选择时机:患者年老或其他情况不能耐受广泛的手术时;评估不太可能直接达到RO切除时;基于手术团队经验。

卵巢癌患者围手术期管理专家共识完整版卵巢癌病死率约为50%,居妇科恶性肿瘤之首。
绝经后女性为卵巢癌的主要患病人群,据统计中老年患者约占卵巢癌患者的半数以上。
由于老年患者各器官功能出现不同程度的下降、对自身健康状况不敏感、医疗条件受限等因素,大多数就诊时已为晚期,因而多预后不良。
同时,高龄也是增加围手术期病死率的独立危险因素。
老年患者多数有较多的合并症,以及容易出现术后并发症,使得卵巢癌手术等治疗更加复杂化。
近日,中国老年保健协会妇科肿瘤专业委员会发布了老年卵巢癌患者围手术期管理专家共识(2024年版)。
本共识中针对老年患者多数有较多的合并症,以及容易出现术后并发症,给予对应结论及建议。
世界卫生组织(W HO)对老年人的定义为60周岁以上人群,美国国立综合癌症网络(NCCN)老年肿瘤指南中对于老年人的定义为65周岁以上的人群。
结合我国目前社会经济发展现状和妇科肿瘤的自身特点,本共识将老年卵巢癌界定为年龄≥65周岁的患者。
01 术前评估1.1多学科诊疗因卵巢癌治疗存在复杂性和长期性,多学科诊疗(MDT)模式显得尤为重要。
术前应根据患者一般情况、肿瘤扩散程度、手术可能涉及的范围,进行多学科诊疗及讨论。
推荐意见:推荐对所有拟行肿瘤细胞减灭术的老年卵巢癌患者均在术前进行多学科讨论,提前进行干预及制定相应的应对措施(推荐级别:1类)。
1.2 综合评估老年综合评估(CGA)是通过多学科评估方法对老年患者的身体精神状态、心理健康状态、社会经济状况、营养状况、多重用药等多个维度健康状态进行的测量和评估。
除了老年综合评估,对于拟行手术的患者,需评价其活动状态(PS),以了解其一般健康状况和对治疗的耐受能力。
美国东部肿瘤协作组(ECOG)制定了一个较简化的活动状态评分表(表2)。
将患者的活动状态分为0~5级,共6级。
一般要求患者评分≤2分,才能考虑手术、化疗等治疗。
推荐意见:建议所有老年卵巢癌患者在入院后、住院期间、出院随访工作中常规开展CGA评估,应当贯穿于治疗的始终(推荐级别:1类)。

老年卵巢癌诊治中国专家共识完整版卵巢癌是最常见的妇科恶性肿瘤之一,2022年全球新发病例达32.46万例,死亡病例为20.7万例,中国新发病例为6.11万例,死亡病例为3.26万例,病死率居妇科恶性肿瘤之首[1-2]。
老年卵巢癌患者定义为65岁及以上的患者。
据统计,卵巢癌患者确诊时的平均年龄为63岁,其中年龄在65岁及以上的患者约占46%,死亡超过70%[3]。
老年卵巢癌患者往往合并症多,手术及化疗耐受性差,总体预后差。
年龄增加是老年卵巢癌患者生存率降低的独立危险因素之一,患者的年龄标准化1年相对生存率:65~69岁为57%,70~74岁为45%,80~84岁为33%[3]。
2021年中国第七次人口普查数据显示,我国65岁及以上老年人口数为1.9亿人,预计2060年将达到3.98亿人[4-5]。
随着人口老龄化的不断加重,研究制定针对老年患者有效的诊疗方案迫在眉睫。
因此,为规范中国老年女性卵巢癌的诊治,中国老年学和老年医学学会妇科分会组织专家依据循证医学证据,结合临床诊疗经验,形成以下中国专家共识,指导临床实践(表1)。
1. 老年卵巢癌的筛查及基因检测1.1 筛查老年卵巢癌往往发现时期别更晚,肿瘤级别更高,具有更强的侵袭性,导致更低的存活率[6]。
因此,老年卵巢癌的早期诊断显得尤为重要。
应重视卵巢癌相关的临床症状,如腹胀、盆腔或腹部疼痛、腹围增加等。
而对于高危人群[乳腺癌易感基因(breast cancer susceptibility gene,BRCA)突变携带、林奇综合征及有家族史等患者],盆腔检查、经阴道超声和CA125联合检测是目前最常用的筛查模式[7-8]。
研究表明,BRCA1基因突变携带者患卵巢癌的终生风险为54%,BRCA2基因突变携带者为23%[9]。
对于BRCA基因突变携带的老年女性,如无手术禁忌证且预期寿命大于6个月,本共识推荐行降低风险的输卵管卵巢切除术(risk reducing salpingo-oophorectomy,RRSO)[10]。
卵巢癌肿瘤细胞减灭术发表时间:2011-10-26 18:28 发表者:廖汪洋11609人已读卵巢癌是目前最常见的妇科恶性肿瘤之一,其死亡率和复发率都最高。
对于卵巢癌的患者,我们可以通过一些手段来延长患者的生存时间,而手术的地位在卵巢癌的治疗当中是不可替代的。
肿瘤细胞减灭术是治疗卵巢肿瘤的常用手术方法。
这节将介绍卵巢癌肿瘤细胞减灭术的相关知识。
一、前言卵巢癌是最常见的妇科恶性肿瘤之一。
在我国,可能宫颈癌还是最多的,但是卵巢癌是最疼痛的,因为死亡率最高,复发率也最高。
实际上,宫颈癌复发要比卵巢癌复发难治的多,卵巢癌复发我们至少能延长她的生存时间,而宫颈癌复发我们很难。
卵巢癌的手术治疗在妇科肿瘤手术治疗当中是最具挑战性的。
我们常说宫颈癌的手术是有定式的,而卵巢癌的手术一个人一个样,很有难度。
它的手术的地位在卵巢癌的治疗当中是不可替代的。
没有一个很好的手术,是不可能有一个相对好一点的效果。
二、初次肿瘤细胞减灭术(Primary Cytoreductive Surgery)(一)初次肿瘤细胞减灭术的目的初次肿瘤细胞减灭术的目的是明确卵巢癌的诊断;手术分期;最大限度地切除肿瘤,这主要是那些晚期卵巢癌患者。
(二)肿瘤细胞减灭术或大块切除术的定义和含义肿瘤细胞减灭术(Cytoreductive Surgery)或大块切除术(Debulking Surgery ),实际是指那些对于晚期的卵巢癌的病人以最大限度地切除肿瘤为目的的手术措施。
肿瘤细胞减灭术的真正含义是:(1)最大限度的切除肿瘤,尽量的能够达到切净;(2)如果无法切净,也要想尽一切办法把残留的肿瘤的最大直径缩小到1 cm以下。
为了达到这个目标,实际甚至可以不择手段。
现在有很多的手术方法。
(三)新版的NCCN实践指南的相关规定最新版的NCCN实践指南中给我们提供了很多的信息:全面分期手术是临床I 期患者的标准术式;对于Ia和Ic期患者,希望保留生育功能,可以行保留生育功能的全面分期手术;肿瘤细胞减灭术是临床II、III或IV期患者的标准术式;对于不适合手术的晚期患者,可以行先期化疗,再行中间型肿瘤细胞减灭术,但是化疗前必须有病理证实。
最新NCCN子宫肿瘤临床实践指南2022(第1版)解读重点内容2021年11月4日,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)公布了《2022 NCCN子宫肿瘤临床实践指南(第1版)》。
现对新版指南进行简要介绍及讨论。
1 2022年指南(第1版)主要更新(1)首次根据组织学分类将高危类型的子宫内膜癌按相应的诊治流程进行管理,细化规范了这部分患者的临床诊疗。
(2)在子宫肉瘤部分,新增了对子宫腺肉瘤的治疗推荐,并根据肉瘤成分是否过度生长进行分流管理。
(3)新增了子宫腺肉瘤的美国癌症联合委员会(American Joint Committee on Cancer,AJCC)分期。
2 分类和分期子宫肿瘤分为恶性上皮性肿瘤(癌)和恶性子宫间叶细胞肿瘤(肉瘤),前者包括子宫内膜样癌,浆液性、透明细胞癌和癌肉瘤等;后者包括低级别和高级别子宫内膜间质肉瘤,未分化子宫肉瘤和子宫平滑肌肉瘤等。
采用第8版AJCC分期和国际妇产科联盟(FIGO )2009分期标准,子宫内膜癌、子宫平滑肌肉瘤及子宫内膜间质肉瘤分期同前(详见本刊2018年第34卷第12期),新增的子宫腺肉瘤AJCC分期见表1~3。
3 子宫内膜癌3.1 术前辅助检查包括血常规、肝肾功检查、生化检查、内膜活检、病理会诊及影像学检查,有条件者进行基因检测。
3.2 子宫内膜样腺癌的治疗3.2.1 保留生育功能指征和方法保留生育功能只适用于子宫内膜样腺癌,子宫内膜浆液性癌、透明细胞癌、癌肉瘤和子宫肉瘤不能保留生育功能。
符合下列所有条件才能保留生育功能:(1)分段诊刮标本经病理专家核实,病理类型为子宫内膜样腺癌,G1级。
(2)MRI检查(首选)或经阴道超声检查发现病灶局限于子宫内膜。
(3)影像学检查未发现可疑的转移病灶。
(4)无药物治疗或妊娠禁忌证。
(5)经充分告之保留生育功能并非子宫内膜癌的标准治疗方式。
近日,美国肿瘤综合协作网(National Comprehensive Cancer Network,NCCN)公布了《2015 NCCN子宫肿瘤临床实践指南(第二版)》。
相比2014年指南而言,2015年第二版与第一版指南在临床实践方面的更新相同,仅在讨论部分新版指南做了相应的更新,现对新版指南进行简要解读。
一、2015年指南(第二版)主要更新1. 新版指南将旧版指南中的“FIGO 2010分期”修正为“FIGO 2009分期”。
2. 讨论中新增“病理学”部分,强调术后病理诊断的内容及流程,指出术前活检病理标本确定的组织学分级与术后子宫切除标本的组织学分级不一定相符合。
有研究提示有15%-20%的术前标本在术后组织学分化会升级。
术中肉眼判断切除子宫标本浸润肌层的深度的准确性也与组织学分级有关,一个研究提示G1的准确度为87.3%,G2为64.9%,G3为30.8%。
结合近期的研究表明利用前哨淋巴结显像的病理超分期技术(如连续切片及免疫组织化学法)以提高肿瘤微转移病灶检测准确率的潜在重要性。
3. 对于怀疑肿瘤扩散到子宫外的子宫内膜癌患者,可考虑术前新辅助化疗。
4. 放疗原则上指出阴道残端愈合后应尽早开始术后辅助放疗,最好不超过术后12周。
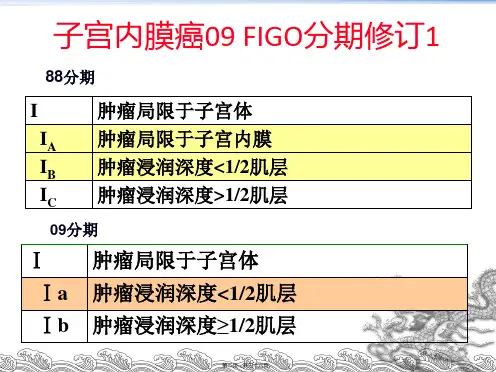
二、分期新版指南采用FIGO 2009子宫内膜癌和子宫肉瘤的分期标准(表1,表2)。
表1 FIGO 2009子宫内膜癌分期表2 FIGO 2009子宫平滑肌肉瘤和子宫内膜间质肉瘤分期注:Ⅲ期是指肿瘤病灶浸润腹腔内组织而不仅仅是子宫底突向腹腔;子宫癌肉瘤的分期和子宫内膜癌相同。
三、2015 NCCN子宫肿瘤诊疗指南(第二版)主要内容对于子宫肿瘤患者,术前建议进行的辅助检查包括血常规、内膜活检及胸片,非必要性检查包括肝肾功检查、生化检查。
如果患者年龄<50岁且有明显的子宫内膜癌和/或结直肠癌家族史,可考虑进行遗产学咨询和基因诊断。
(一)子宫内膜样腺癌1. 子宫内膜样腺癌的初始治疗对于子宫内膜癌,治疗前大致可分三种情况:肿瘤局限于子宫体;肿瘤侵犯宫颈;肿瘤超出子宫外。
NCCN 卵巢癌指南(2015.1 最新版)1. II、III、IV期病人完成了初始全部治疗、获得完全缓解后可考虑加入第二辅助治疗,帕唑帕尼作为IIB类推荐。
2. 手术原则中加入了妇科医生在手术记录中应记录的内容。
3. BRAC/HOBC综合征采用降低风险的输卵管-卵巢切除术方案(RRSO)。
4. 加入如下方案,主要适用于老人或是PS评分差患者:紫杉醇60mg/m2静滴超过1小时,卡铂AUC2静滴超过30分钟,每周一次共18周(I类)。
5. 治疗药物反应中将使用抗组胺药改为使用H1阻滞剂抗组胺药。
6. 复发疾病优选治疗中加入奥拉帕尼。
7. 少见卵巢癌病理类型中BEP方案可用于生殖细胞肿瘤的治疗。
概述卵巢恶性肿瘤包括几种组学类型,上皮型卵巢癌约占90%的恶性卵巢肿瘤,NCCN指南中讨论了上皮型卵巢癌和少见组织学类型,后者包括卵巢低恶性潜能肿瘤(LMP)、恶性生殖细胞肿瘤、癌肉瘤(卵巢恶性混合性苗勒氏瘤[MMMTs])和恶性性索-基质肿瘤。
NCCN指南中还讨论了输卵管癌和原发腹膜癌,这二种肿瘤较少见,治疗与上皮型卵巢癌相似,但少见组织学类型卵巢癌治疗与卵巢癌不完全相同。
卵巢癌是美国妇科肿瘤的首要死亡原因,是女性癌症死亡的第五大原因,只有不足40%的卵巢癌女性可以治愈。
卵巢癌的发生率随着年龄增加,60-70年龄段发病率最高,中位诊断年龄63岁,70%诊断时为进展期疾病。
流行病学研究已鉴定了卵巢癌的危险因素。
怀孕和第一次生产≤25岁、使用口服避孕药和母乳喂养可以减少30%-60%风险;从未生育过、>35岁怀孕和第一次生产则增加卵巢癌风险。
有数据显示激素治疗和盆腔炎症性疾病可能会增加卵巢癌风险。
卵巢刺激体外受孕增加卵巢LMP肿瘤风险。
肥胖看起来与最具侵袭性的卵巢癌类型无关。
有BRCA1和BRCA2基因型、受林奇综合征影响的家族史(病人有2个或更多的一级亲属患有卵巢癌)与早期发病有关,此类病人占5%的卵巢癌病人。
高危女性(或有BRCA1或有BRCA2突变)预防性卵巢输卵管切除可以减少卵巢癌和输卵管癌,但可能患原发性腹膜癌。
有时预防性卵巢输卵管切除术后会发现隐匿性卵巢癌,说明要仔细的病理学检查。
手术风险包括肠道、膀胱、子宫、血管损伤。
最近研究显示输卵管是一些卵巢癌和原发腹膜癌的起源。
环境因素与卵巢癌的发生尚无结论性的结果。
检查因为卵巢癌的位置和大多数上皮型癌症的生物学特征,导致很难在早期可治愈阶段诊断卵巢癌。
但是评估新诊断卵巢癌病人的症状可以作为参考,以便高风险发展为卵巢癌的病人更早获得诊断。
提示卵巢癌可能的症状包括:腹胀、盆腔或腹部疼痛、进食困难或易饱感、尿路刺激症状,如果症状是新发且频繁出现的(>12天/月)则应警惕。
医生发现病人上述症状群时要考虑可能为卵巢癌所致。
但也有证据显示使用上述症状检查既不敏感也不特异,特别是早期疾病。
研究显示多模式检查可能会增加检出率,如超声、CA125。
随机数据并不支持普通人群常规检查卵巢癌。
但对某些高危人群如BRCA突变,有家族史者可采用CA125监测和阴道内超声检查。
分期疾病的分期、分级对预后和治疗推荐非常重要。
根据FIGO和AJCC分期可分为I-IV期,大多数病人为III期疾病。
病理分级是重要的预后因素,主要用于早期疾病选择治疗。
除了I期1级,其它病人都应鼓励进入临床试验。
原发腹膜腺癌采用卵巢癌分期系统,输卵管癌则采用独立的FIGO和AJCC分期系统。
FIGO最近更新了卵巢癌、输卵管癌和腹膜癌的分期,AJCC也同意如上分期,但更新需到2016年,SGO对最新的FIGO分期进行了阐述,具体可参见网址https://。
附加说明NCCN指南不能囊括所有可能的临床变化,也不倾向用于替代好的临床判断或个体化治疗。
只有总的原则是必需遵守的。
上皮型卵巢癌程序推荐1. 未诊断的盆腔肿块对怀疑盆腔肿块、腹水、腹胀等症状且没有其它恶性肿瘤表现者应行超声、腹部CT/MRI及实验室检查,肿瘤标志物包括CA125、AFP、抑制素、beta-HCG等。
超声主要用于初始评估,CT对评估转移比较有意义,MRI对超声显示恶性可能的改变有进一步的明确作用,PET/CT对性质不明的病灶可能有意义。
通常细针活检(FNA)不应用于卵巢癌早期病人,以免撕裂囊膜致使恶性细胞进入腹膜,但FNA对肿块较大且不能手术者是必要的。
其它癌症方面,应当排除如肠癌、子宫癌、胰腺癌或淋巴瘤等,良性卵巢和非卵巢情况也应除外,如浆液性囊腺瘤。
特异性的标志物如HE4和CA125可能对确定盆腔肿物良恶性有一定参考意义。
FDA同意使用HE4和CA125评估妇女盆腔肿块为卵巢癌的风险,但NCCN 委员会不推荐使用这些标志物决定尚未诊断盆腔肿物的状态。
原发腹膜和输卵管癌通常是术后才能诊断,术前诊断通常需要活检。
原发腹膜癌和输卵管癌的处理方式与上皮型卵巢癌一致。
虽然没有直接证据表明胸部影像学检查是必需的,但委员会成员认为手术术前分期应是完全评估病人的一部分。
其它诊断研究如消化道评估并不常规推荐,只在某些特殊临床情况下可能有用。
2. 既往曾诊断过恶性肿瘤经组织学活检或既往曾诊断过卵巢癌的病人常会转诊至NCCN所属癌症中心,通常病人已接受过细胞减灭术和全面分期。
然而有时病人转诊是因为手术切除不完全或是分期不完全。
诊断和未诊断病人的推荐检查程序一致。
上皮型卵巢癌有4种主要组织学亚型:浆液性、内膜样、粘液样和透明细胞,浆液性为大多数。
各种组织学类型的初起治疗没有差别,都按上皮型卵巢癌处理。
I期透明细胞癌的处理按照I期3级上皮型卵巢癌处理。
最近透明细胞癌、粘液癌或低级别肿瘤的分子特征研究显示这些组织学类型肿瘤的突变类型与高级别肿瘤不一样。
卵巢癌根据分子改变可分成1型、2型,未来的研究可能会依据上述分型进行。
目前治疗上述组织学类型疾病主要采用化疗,靶向治疗主要用于临床试验,鼓励病人接受靶向治疗。
转诊后推荐重新病理回顾研究,CAP关于卵巢癌病人标本的检查有明确的流程,对病理报告很有帮助。
3. 初始治疗对考虑卵巢癌的病人应进行恰当的手术分期和细胞减灭术,然后大部分病人进行全身化疗。
初始手术治疗应当是全面分期的开腹手术,包括经腹子宫全切除术(TAH)和双侧输卵管、卵巢切除术(BSO)。
推荐妇瘤专科医生进行初始手术治疗。
年轻希望生育的病人,对I期和低危卵巢肿瘤(分期早、低级别侵袭性肿瘤、卵巢LMP肿瘤)可行单侧输卵管、卵巢切除术(USO)。
全面手术分期排除隐匿的高级别病灶,大约30%病人在全面分期手术后分期上调。
选择性病人可采用更小侵袭性技术进行手术分期。
医生倾向对播散广泛者开腹手术,侵袭性较小的手术可用于预防性输卵管、卵巢切除术。
(1)细胞减灭术细胞减灭术是II、III、IV期病人的初始治疗推荐,虽然是标准治疗,却是根据回顾性研究数据进行的推荐。
这个程序是卵巢癌、输卵管癌或原发腹膜癌的手术治疗的一部分,以期全面分期并获得最大的细胞减灭,使残留病灶小于1cm或切除所有可见的疾病并保证有充足的边缘。
残留病灶结节最大直径或厚度小于1cm的患者行减灭术效果理想,对可耐受的病人也推荐扩大切除上腹部卵巢癌转移。
应对病人采用较小侵袭性程序评估减灭术的可行性。
应尽最大努力去除所有病灶,进入腹部后抽吸腹水或进行腹腔灌洗寻找细胞学证据。
对明显的卵巢外疾病,细胞学评估腹水和灌洗液并不会改变分期和治疗。
应当执行子宫切除术和BSO。
虽然推荐大部分病人行全子宫切除,保留宫颈的子宫切除对某些病人也是合适的。
具有包膜的肿块应完整移除,可疑或增大淋巴结也应切除。
肿瘤结节超过盆腔,小于等于2cm(IIIb)者应进行双侧盆腔和主动脉周围淋巴结切除。
年轻病人手术后迅速进入绝经期,应给予支持治疗减轻潮热和其它症状。
进展期卵巢癌病人经过完全去块手术,数据显示总生存在接受淋巴结切除者中增加。
较低残留病灶者是腹膜内治疗的适应症,应考虑手术时放置IP导管。
良好的细胞减灭术可包括如下内容:根治性盆腔切除、肠切除、横膈或其它腹膜表面剥离、脾切除、部分肝切除、胆囊切除、部分胃切除或膀胱切除、输尿管膀胱吻合术、远端胰腺切除或阑尾切除。
(2)新辅助化疗新辅助治疗后行细胞减灭术的获益仍有争议。
对III/IV期大肿瘤且不适合手术的病人应考虑进行,启动新辅助治疗前应明确病理学诊断。
新辅助治疗指的是药物、放疗或其它治疗以降低癌症手术前的肿瘤负荷。
NCCN卵巢癌指南编委的意见是潜在可切除卵巢癌病人如果要推荐新辅助化疗必需获得更多的数据支持,在美国首选仍是减瘤手术。
(3)分期不完全的病人对以往分期不完全的病人、II-IV期有不可切除残留病灶的病人应考虑在3-6个疗程化疗后再完成手术。
根据手术结果可行术后化疗。
肿瘤减灭术推荐用于所有II-IV期怀疑有潜在可切除残留病灶的病人。
(4)化疗大多数上皮型卵巢癌病人接受术后化疗,也称作辅助治疗。
推荐Ia或Ib 1级肿瘤病人可以观察,此类病人单纯手术生存超过90%。
如果Ia或Ib2级肿瘤病人考虑观察,则推荐采用手术分期程序。
初起化疗或辅助治疗的推荐包括静脉±IP治疗。
所有方案都可用于上皮型卵巢癌、原发性腹膜癌和输卵管癌。
静脉/IP化疗方案推荐用于III期且经过良好去块治疗者(残留<1cm)。
II期病人也可接受IP化疗,但尚无随机试验证据支持。
III期病人使用顺铂联合紫杉醇的IP治疗可增加16个月的生存。
紫杉醇联合卡铂、多西他赛联合卡铂都是可选的静脉治疗方案,后者更适合易出现神经病变的患者,如糖尿病患者。
治疗周期数根据疾病分期而有变化,对进展期病人(II-IV期)推荐6-8周期化疗,而早期病人则3-6周期化疗,一些医生认为对浆液性组织学病人6周期化疗可能会有更多获益。
推荐方案如下:(1)紫杉醇175mg/m2>3小时静脉输入,第1天,然后卡铂,剂量AUC5-7.5,静脉输入>1小时,第1天,21天一周期,6周期。
(2)剂量-密度紫杉醇80mg/m2>1小时静脉输入,第1、8、15天,卡铂剂量AUC6,静脉输入>1小时,第1天,21天一周期,6周期。
(3)多西他赛60-75mg/m2>1小时静脉输入,然后卡铂,剂量AUC5-6,静脉输入>1小时,第1天,21天一周期,6周期。
上述方案也可用于新辅助化疗。
推荐的IP化疗方案紫杉醇135mg/m2>3小时静脉输入,第1天,顺铂75-100mg/m2 IP第2天,紫杉醇60mg/m2 IP第8天,21天一周期,共6周期。
上述方案有不同的毒性改变。
多西他赛联合卡铂增加中性粒细胞减少风险,静脉紫杉醇联合卡铂与外周神经病有关,剂量密度紫杉醇增加贫血风险。
IP紫杉椁联合顺铂与白细胞减少、感染、疲劳、肾毒性、腹部不适和神经毒性有关。
IP方案治疗中使用较低的顺铂剂量或分次使用可能有助于减少毒性。
考虑IP方案治疗的病人应有正常的肾功能,较好的PS评分,无既往健康问题可能在治疗期间加重。