LipofectAMINE2000 Fugene6转染细胞的效率比较_张宝
- 格式:pdf
- 大小:294.63 KB
- 文档页数:3

LIPOFECTAMINE2000转染试剂转染步骤转染是指将外源DNA或RNA导入到目标细胞中的过程,LIPOFECTAMINE2000是一种常用的转染试剂。
下面是使用LIPOFECTAMINE2000进行转染的详细步骤:步骤一:细胞处理1.1培养要转染的细胞株,并确保细胞达到70%-80%的密度。
1.2使用无菌PBS洗涤细胞,将细胞悬浮于含有10%FBS的完全培养基中。
1.3通过计数细胞数来得到适当的细胞密度,以确保每个孔或皿中有足够的细胞进行转染。
步骤二:DNA/RNA和转染试剂的配制2.1在无菌离心管中配制DNA/RNA和转染试剂的混合液。
按照试剂的说明书中的推荐比例将DNA/RNA和转染试剂混合在一起,并使用无菌PBS 或者培养基和其它试剂进行稀释。
2.2轻轻摇晃混合液,避免产生气泡。
步骤三:转染3.1将配制好的转染混合液加入到每个孔或皿中,并轻轻摇晃培养皿/板使其均匀分布。
3.2将细胞和转染试剂混合液共孵育4-6小时,在37℃的CO2培养箱中进行转染反应。
转染时间可以根据目标细胞的特性进行调整。
步骤四:更换培养基4.14-6小时后,将转染混合液完全去除,并用预温热的完全培养基洗涤细胞,以去除未吸附的DNA/RNA和转染试剂。
4.2加入足够的完全培养基来覆盖细胞,尽量减少液体涡流,以避免对转染效率的不良影响。
步骤五:细胞培养和分析5.1将培养皿/板放回37℃的CO2培养箱中,并进行适当的培养条件。
5.2根据实验需要的时间点收集转染后的细胞进行后续的实验和分析。
需要注意的是,转染步骤中的各种参数(例如细胞密度、转染试剂的浓度和比例等)可能因不同的实验目的和目标细胞而有所不同。
因此,在具体操作中请参考所使用转染试剂和目标细胞的说明书,并根据实验需要进行相应的优化。

lipofectamine2000原理Lipofectamine2000是一种常用于转染细胞的试剂,它的原理是通过脂质体介导的转染技术,将外源DNA或RNA导入到细胞内。
这种转染方法被广泛应用于基因功能研究、蛋白表达和基因治疗等领域。
脂质体是由脂质分子组成的小囊泡,可以与细胞膜融合并释放其内部所带的DNA或RNA分子。
Lipofectamine2000是由一种阳离子脂质和一种阴离子脂质组成的复合物,这种复合物能够与DNA 或RNA形成稳定的复合体。
当Lipofectamine2000和DNA或RNA共同存在于培养基中时,它们会自发地结合在一起,形成脂质体-核酸复合物。
脂质体-核酸复合物具有良好的转染效果,主要有以下几个原因。
首先,脂质体可以提供稳定的保护作用,保护DNA或RNA免受外界环境的影响。
其次,脂质体能够与细胞膜融合并被细胞摄取,将DNA或RNA导入到细胞内。
此外,Lipofectamine2000还可以增加细胞膜的通透性,使DNA或RNA更容易进入细胞。
Lipofectamine2000的使用方法相对简单。
首先,将所需的DNA 或RNA与Lipofectamine2000按照一定比例混合,形成脂质体-核酸复合物。
然后将复合物加入到细胞培养基中,与细胞共同孵育一段时间。
在此过程中,脂质体-核酸复合物与细胞相互作用,将DNA或RNA导入到细胞内。
最后,可以利用适当的实验方法检测转染效果,如荧光显微镜观察、PCR检测等。
尽管Lipofectamine2000在转染实验中具有诸多优势,但也存在一些局限性。
首先,该方法对细胞类型有一定的选择性,不同细胞株对Lipofectamine2000的响应程度不同。
其次,脂质体-核酸复合物的稳定性较差,容易受到环境因素的影响。
此外,Lipofectamine2000的转染效率可能受到多种因素的影响,如DNA或RNA浓度、孵育时间等。
为了提高转染效率,研究人员还不断改进Lipofectamine2000的配方和使用方法。

Invitrogen阳离子转染试剂Lipofectamine 2000细胞转染实验步骤注意事项2010-07-10 16:16Invitrogen的细胞转染试剂:Lipofectamine 2000Lipofectamine 2000是最为人熟知的转染产品之一。
已知可为517种细胞(见下面连接地址)提供高转染效率(表达转基因细胞的百分数)和活性(细胞抽提物中转入基因的酶产物活性)。
特点两个关键性特点使得Lipofectamine 2000试剂的转染步骤快速简便:(1)DNA-阳离子脂质体试剂的复合体可以直接加入到细胞培养基中,有血清也不怕(2)转染后不需要除去Lipofectamine 2000试剂,无需换培养基操作流程事实上Lipofectamine系列产品操作流程都是又快又简单:稀释DNA 以及Lipofectamine 2000,混合2种稀释液保温20分钟,加入培养细胞中孵育24-96小时检测结果。
下面是Invitrogen提供的详细流程和注意事项。
转染前一天,胰酶消化细胞并计数,细胞铺板,使其在转染日密度为90%。
细胞铺板在0.5ml含血清,不含抗生素的正常生长的培养基中。
对于每孔细胞,使用50μl无血清培养基(如OPTI-MEMⅠ培养基)稀释0.8μg-1.0μg DNA。
对于每孔细胞,使用50μl OPTI-MEMⅠ培养基稀释1μl-3μl LIPOFECTAMINE 2000试剂。
Lipofectamine 2000稀释后保温5分钟(在30分钟内同稀释的DNA 混合。
保温时间过长会降低活性。
)注意:即使Lipofectamine 2000使用OPTI-MEMⅠ稀释,细胞也可以使用D-MEM培养。
如果D-MEM做为Lipofectamine 2000的稀释液,必须在5分钟内同稀释的DNA混合。
混合稀释的DNA(第2步)和稀释的Lipofectamine 2000(第3步)。
在室温保温20分钟。

各种转染方法比较转染方法原理主要应用特点主要的厂家及产品DEAE-葡聚糖法带正电的DEAE-葡聚糖与核酸带负电的磷酸骨架相互作用形成的复合物被细胞内吞瞬时转染相对简便、重复比磷酸钙好,但对细胞有一定的毒副作用,转染时需除血清且一般只用于BSC-1,CV-1,COS细胞系Sigma-Aldrich(DEAE-DextranTransfection Kit)DNA复合物吸附细胞膜稳定转染,染瞬转染不适用于原代细胞(所需的DNA浓度较高),操作简便但重复性差,有些细胞不适用细胞建议用CSCL梯度离心,转染是拷贝数较多GIBCO BRL,Promega阳离子脂质体法带正电的脂质体与核酸带负电的磷酸基团形成复合物,然后脂质体上剩余的电核与细胞膜上的唾液酸残基的负电核结合;另一种解释是通过细胞是内吞作用而被进入细胞。
(若DNA浓度过高,中和脂质体表面电核,而降低了与细胞的结合能力)稳定转染,瞬时转染,所有细胞使用方法简单,可携带大片段DNA,通用于各种类型的裸露DNA或RNA,能转染各种类型的细胞,没有免疫原性。
虽在体外基因转染中有很高的效率,但在体内,能被血清清除,并在肺组织内累积,诱发强烈的抗炎反应,导致高水平的毒性,这在很大程度上限制了其应用Invitrogen(Lipofectamine2000,Lipofectamine,Lipofectin,LipofectaminePlus,Cellfectin)Roche(Dosper,DOTAP,FuGENE6)CPG Biotech Co(GeneLimoPlus,GeneLimo Super)Promega(Transfast,Tfx,Transfectam)阳离子聚合物带正电的聚合物与核酸带负电的磷酸基团形成带正电的复合物后与细胞表面带负电的蛋白多糖相互作用,并通过内吞作用进入细胞。
稳定转染,瞬时转染,所有细胞除了具有阳离子脂质体的转染效率高,操作简单,适用范围广,重复性好等特点外,还具有在体内,转染效率高,细胞毒性低等特点,是新一代的转染试剂。

Invitrogen阳离子转染试剂Lipofectamine 2000细胞转染实验步骤注意事项2010-07-10 16:16Invitrogen的细胞转染试剂:Lipofectamine 2000Lipofectamine 2000是最为人熟知的转染产品之一。
已知可为517种细胞(见下面连接地址)提供高转染效率(表达转基因细胞的百分数)和活性(细胞抽提物中转入基因的酶产物活性)。
特点两个关键性特点使得Lipofectamine 2000试剂的转染步骤快速简便:(1)DNA-阳离子脂质体试剂的复合体可以直接加入到细胞培养基中,有血清也不怕(2)转染后不需要除去Lipofectamine 2000试剂,无需换培养基操作流程事实上Lipofectamine系列产品操作流程都是又快又简单:稀释DNA 以及Lipofectamine 2000,混合2种稀释液保温20分钟,加入培养细胞中孵育24-96小时检测结果。
下面是Invitrogen提供的详细流程和注意事项。
转染前一天,胰酶消化细胞并计数,细胞铺板,使其在转染日密度为90%。
细胞铺板在0.5ml含血清,不含抗生素的正常生长的培养基中。
对于每孔细胞,使用50μl无血清培养基(如OPTI-MEMⅠ培养基)稀释0.8μg-1.0μg DNA。
对于每孔细胞,使用50μl OPTI-MEMⅠ培养基稀释1μl-3μl LIPOFECTAMINE 2000试剂。
Lipofectamine 2000稀释后保温5分钟(在30分钟内同稀释的DNA 混合。
保温时间过长会降低活性。
)注意:即使Lipofectamine 2000使用OPTI-MEMⅠ稀释,细胞也可以使用D-MEM培养。
如果D-MEM做为Lipofectamine 2000的稀释液,必须在5分钟内同稀释的DNA混合。
混合稀释的DNA(第2步)和稀释的Lipofectamine 2000(第3步)。
在室温保温20分钟。

LIPOFECTAMINE2000转染试剂转染步骤1.准备转染试剂:取出存储在-20℃的LIPOFECTAMINE2000试剂,并将其溶解在适量的去离子水或者PBS缓冲液中,制备转染试剂。
2. 根据实验需要确定转染的质粒DNA量和细胞数量。
一般来说,每个转染需要1-2ug的质粒DNA,细胞密度则根据细胞类型的不同而有所变化。
3.将准备好的转染试剂和质粒DNA混合在一起。
首先将质粒DNA加入到含有LIPOFECTAMINE2000的管中,并轻轻混合均匀,然后将混合物静置15-30分钟,使其形成脂质-DNA复合物。
4.在脂质-DNA复合物静置的同时,准备待转染的细胞。
将细胞用无血清培养基洗涤一次,并将其悬浮在新的无血清培养基中。
5.将静置好的脂质-DNA复合物滴加到细胞中。
将脂质-DNA复合物滴加到含有细胞的培养皿中,并轻轻摇晃培养皿,使复合物均匀分布在细胞表面。
6.将转染后的细胞培养在37℃的CO2培养箱中孵育。
具体培养时间视实验需求而定,一般来说,24-48小时后可以进行下一步实验。
7. 检测转染效率。
可以通过荧光显微镜观察细胞内是否表达了目的基因或荧光标记,也可以采用Western blotting或者RT-PCR等方法进行进一步的检测。
总的来说,LIPOFECTAMINE2000转染试剂转染步骤相对简单,但需要注意的是在每一步操作中都要轻柔并避免产生气泡,以确保脂质-DNA复合物可以均匀地与细胞相结合,从而提高转染效率。
同时,在实验过程中需要注意质粒DNA的质量和浓度,以及细胞的健康状态,这些因素都会对转染效果产生影响。
希望以上介绍对您有所帮助,祝您实验顺利。

Lipofectamine TM 2000CAT. NO. 11668-027 Size: 0.75mlCAT. NO. 11668-019 Size: 1.5 ml4℃储存(不要冻存)说明:Lipofectamin TM 2000是核酸(DNA或RNA)转染真核细胞的一个专用的试剂盒,其有如下优点:●对各种细胞及细胞板(如96孔板)都有高的转染效率,在 的细胞系数据库中有各种细胞转染成功的实例。
●在含有或是不含有血清的培养基中,DNA- Lipofectamin TM 2000复合物能够直接加给细胞。
●在转染之后不需要除去复合物以及添加或是更换培养液,但在培养4-6小时后需要除去复合物。
关于转染的一些重要建议:1.不要用即将要介绍的转染程序进行RNAi的转染实验。
在/rnai上有转染步骤,登陆后点击说明。
2.对于大多数细胞系,转染复合物中DNA(μg)与Lipofectamine TM2000(μl)的比例在1:2到1:3之间,最好达到最优化的比例。
注意:在混合之前,我们建议用Opti-MEM I 低血清培养基(Cat: NO.31985-062)(reduced serum medium)稀释Lipofectamine TM 2000和DNA.3.为了实现高的转染效率、高的目的基因表达水平以及低水平细胞毒效应,受体细胞最好达到高的浓度:在转染时,细胞的培养液的混浊度建议为90%-95%并最优化混浊度。
此外,在实验过程中保证相同的接种条件。
4.为避免细胞死亡,在培养基中不要加抗生素。
、5.由于一些无血清复合物(如CD239、SFM II、VP-SFM)会抑制阳离子脂质体介导的转染,因此有必要检测一下无血清培养基和Lipofectamine TM 2000的相容性。
转染步骤(用于DNA):按照如下步骤在24孔板中转染哺乳动物细胞。
对于其它种类细胞板请参照转染量度标准。
步骤中均按照一个细胞孔的量给出质量和体积。

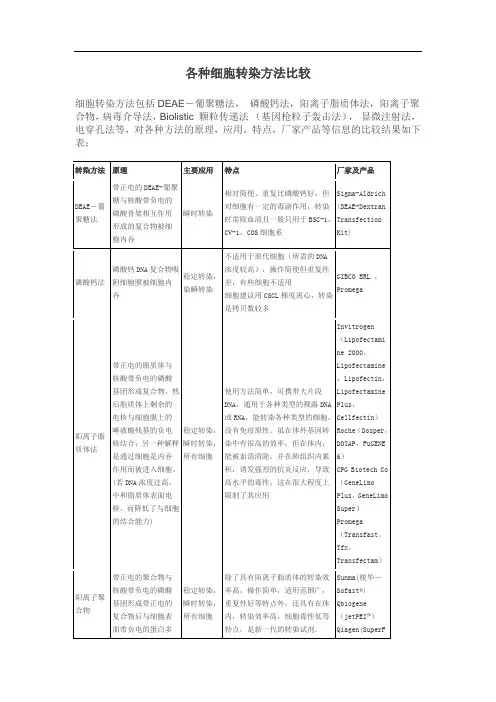
各种细胞转染方法比较细胞转染方法包括DEAE-葡聚糖法,磷酸钙法,阳离子脂质体法,阳离子聚合物,病毒介导法,Biolistic 颗粒传递法(基因枪粒子轰击法),显微注射法,电穿孔法等,对各种方法的原理,应用,特点,厂家产品等信息的比较结果如下表:转染方法原理主要应用特点厂家及产品DEAE-葡聚糖法带正电的DEAE-葡聚糖与核酸带负电的磷酸骨架相互作用形成的复合物被细胞内吞瞬时转染相对简便、重复比磷酸钙好,但对细胞有一定的毒副作用,转染时需除血清且一般只用于BSC-1,CV-1,COS细胞系Sigma-Aldrich(DEAE-DextranTransfectionKit)磷酸钙法磷酸钙DNA复合物吸附细胞膜被细胞内吞稳定转染,染瞬转染不适用于原代细胞(所需的DNA浓度较高),操作简便但重复性差,有些细胞不适用细胞建议用CSCL梯度离心,转染是拷贝数较多GIBCO BRL ,Promega阳离子脂质体法带正电的脂质体与核酸带负电的磷酸基团形成复合物,然后脂质体上剩余的电核与细胞膜上的唾液酸残基的负电核结合;另一种解释是通过细胞是内吞作用而被进入细胞。
(若DNA浓度过高,中和脂质体表面电核,而降低了与细胞的结合能力)稳定转染,瞬时转染,所有细胞使用方法简单,可携带大片段DNA,通用于各种类型的裸露DNA或RNA,能转染各种类型的细胞,没有免疫原性。
虽在体外基因转染中有很高的效率,但在体内,能被血清清除,并在肺组织内累积,诱发强烈的抗炎反应,导致高水平的毒性,这在很大程度上限制了其应用Invitrogen(Lipofectamine 2000,Lipofectamine,Lipofectin,LipofectaminePlus,Cellfectin)Roche(Dosper,DOTAP,FuGENE6)CPG Biotech Co(GeneLimoPlus,GeneLimoSuper)Promega(Transfast,Tfx,Transfectam)阳离子聚合物带正电的聚合物与核酸带负电的磷酸基团形成带正电的复合物后与细胞表面带负电的蛋白多稳定转染,瞬时转染,所有细胞除了具有阳离子脂质体的转染效率高,操作简单,适用范围广,重复性好等特点外,还具有在体内,转染效率高,细胞毒性低等特点,是新一代的转染试剂。
脂质体介导法转染肿瘤细胞效率的优化潘宁;章蔼然;侯颖春【期刊名称】《生物技术》【年(卷),期】2008(18)6【摘要】目的:研究优化影响脂质体转染效率的因素,以提高脂质体转染效率,为相关研究和应用提供参考。
方法:以绿色荧光蛋白(GFP)作为报告基因,采用脂质体Lipofectamine2000包裹pU6H1-GFP-FAK重组质粒转染Caco-2细胞,研究了细胞接种密度、DNA用量、脂质体与DNA的比例、脂质体-DNA复合物的形成时间、细胞与脂质体复合物的孵育时间、血清的有元及细胞的传代次数等因素对脂质体转染效率的影响。
结果:2—5次细胞传代,2×10^5接种密度、4μgDNA用量、2.5:1的脂质体与DNA比例、30min脂质体-DNA复合物形成时间以及6h细胞与复合物孵育时间,转染效率最高。
血清在本实验室条件下并不影响转染效率。
结论:实验获得的优化条件可以明显提高脂质体对肿瘤细胞的转染效率,可作为有关研究或应用的参考。
【总页数】4页(P47-50)【关键词】脂质体;细胞转染;转染效率;肿瘤细胞【作者】潘宁;章蔼然;侯颖春【作者单位】陕西师范大学生命科学学院肿瘤细胞分子生物学实验室【正文语种】中文【中图分类】Q782;R735.35【相关文献】1.优化阳离子脂质体介导的组织因子小干扰RNA转染HEK-293的转染条件 [J], 张园;李志樑;邱健;易绍东;董凤英2.电穿孔转染法与脂质体转染法对K562和HepG2细胞转染效率的影响 [J], 隋娟;张高丽;李平法;于海川3.阳离子脂质体介导小干扰RNA转染EOMA细胞时转染条件的优化 [J], 周晓彤;沈振亚;于曙东;余云生;叶文学;黄浩岳;焦鹏;滕小梅4.脂质体介导法转染体细胞效率的优化 [J], 侯颖;李文蓉;谭立新;牛志刚5.阳离子脂质体介导的转染:血清对于表达及转染效率的影响 [J], 李克深因版权原因,仅展示原文概要,查看原文内容请购买。
两种常用转染试剂转染siRNA至HL-60细胞转染效率的比较王巍;张晓希;刘新光【摘要】目的比较两种常用转染试剂转染小干扰RNA(siRNA)至悬浮细胞的转染效率及对细胞毒性的影响.方法以羧基荧光素(FAM)标记的siRNA为报告基因,以lipofectamine 2000和siPORT NeoFX为转染试剂,用流式细胞仪检测转染效率,倒置显微镜观察细胞形态,MTT法检测细胞存活率.结果 siRNA>100 nmol/L 时,lipofectamine 2000的转染效率高于siPORT NeoFX(P<0.05);siRNA<100 nmol/L时,前者低于后者(P<0.05).siRNA终浓度及转染试剂用量相同时,lipofectamine 2000组HL-60细胞存活率与SiPORT NeoFX组比较,差异无统计学意义(P>0.05).结论在使用高浓度siRNA时,lipofectamine 2000对HL-60细胞有较高的转染效率和较小细胞毒性.%Objective To compare the transfection efficiency and cytotoxicity between two cationic transfection reagents. Methods Small interfering RNA(siRNA) marked with FAM as a report gene,lipofectamine 2000 and siPORT NeoFX were used as the transfection reagents. Flow cytometer,microscope and MTT assay were used to detect transfection efficiency and cytotoxicity. Results The transfection efficiency of lipofectamine 2000 was higher than siPORT NeoFX when siRNA was over 100 nmol/L(P<0.05) ,otherwise with siRNA under 100 nmol/L(P<0. 05). At the same siRNA concentration and transfection reagent volume, there was no significant difference of vial cells ratios between two groups(P>0.05). Conclusion lipofectamine 2000is an effective and safe transfection reagent to HL-60 cells when siRNA is over 100 nmol/L.【期刊名称】《重庆医学》【年(卷),期】2011(040)004【总页数】4页(P313-314,318,封2)【关键词】脂质体;转染;RNA,小分子干扰【作者】王巍;张晓希;刘新光【作者单位】广东医学院临床血液检验学教研室,东莞,523808;中国人民解放军第四二二医院,广东湛江,524023;广东医学院检验医学研究所,东莞,523808【正文语种】中文RNA干扰(RNA interference,RNAi)是指在进化过程中高度保守的、由双链RNA 诱发的、同源mRNA高效特异性降解的现象[1-3]。
转染效率低的常见原因及其解决方案收藏HepG2用lipo2000在我们实验室做的转染效率很高的,可以到70-80%,不必担心。
不需要用电转,磷酸钙法也可以有40-50%的操作上主要注意:1,细胞铺板时的状态很重要,应该在铺板前尽量消化为单细胞悬液,trypsin+EDTA充分吹打即可2,转染前1天铺板,待转染时密度刚好达到80-90%,不能太低,但是也不能长过(细胞成团,堆积)。
最好是刚刚长满,此时还在对数生长期3,加入的质粒要去除内毒素,plasmid:lipo约为1:0.5-1:5。
实际上采用说明书的推荐量就很好,1:2.54,用前自己好好看一遍说明书,哈哈HepG2细胞的确相对于CHO等细胞而言转染效率比较低,但也只是相对。
据我们实验室的经验,用lipofectamine 2000转染HepG2完全没有问题,无论是瞬时转染还是稳定转染,也无论是转一个质粒还是共转染两个质粒(转两个以上没有试过)。
但有些问题需要注意一下:1、lipofectamine 2000毒性比较大,所以建议转染6 h后换去转染培养基;2、采用先铺板再转染的方式比采用同时转染的方式效率会高,但需根据实验需要设计,如果采用前种方式,细胞的汇合度一定要在80%以上再转染(说明书上好像是达到90%);3、采用0.25%的trypsin+0.02%EDTA消化细胞传代,弯头吸管稍加吹打,可使细胞分散的很均匀,消化的时间一定要掌握好,时间不够不易吹下且对细胞造成机械损伤,消化过了成片脱落,再想吹打成单细胞悬液就不容易了;4、根据脂质体介导细胞转染的原理,在质粒提取时要除去内毒素,否则会降低转染效率;5、对于转染时DNA和脂质体的量说明书上有个推荐的范围,DNA (μg):Lipofectamine™ 2000 (μl) =1:0.5 ~ 1:5,可在此范围内设几个梯度摸索一下,从而找到最适比例;6、转染时用于稀释脂质体和DNA的培养基一定是无血清的,血清会干扰转染,还有脂质体稀释液和DNA稀释液要充分混匀并孵育足够时间,以使脂质体将DNA颗粒包裹好进入细胞质粒浓度多少?一般不低于1微克/微升,这是效率底的常见原因质粒是4ug ,lifpo2000 10ul是一个孔的?加入转染试剂细胞是否有损失你的详细步骤是否可以写一下我有点不懂你的细胞饥饿和转染时间是什么意思,但是我可以说说我做转染的过程,我用的是HELA和sf9,转染试剂是lipofectamin2000是invitrogen公司的,转染前一天铺板,细胞密度要高使得转染当天密度达到80-90%,质粒是1ug/孔(6孔板),转染试剂是3ul/孔,不加血清培养基分别稀释之后混合约30min,之后直接将质粒和转染试剂混合液加入含血清培养基的细胞中48h 后观察荧光,转染效率还是很高的。
Lipofectamine2000细胞转染protocol1、预处理:转染前一天,换液,胰酶消化细胞并计数,25c㎡的培养瓶中长满细胞可达5×10^6/mL,取3-4×10^5细胞铺在2mL的培养基中(不含双抗含血清),使其在转染时密度为90-95%(张老师做法:在细胞传代时用1mL胰酶消化,再加入4mL培养基(不含双抗含血清)中和。
800rpm,离心5min,5Ml培养基(不含双抗含血清)吹散后计数,留取1mL继续培养,其余按所需分装到4个6孔板,没孔加培养基至2mL)。
2、质粒DNA配制:每孔2ug质粒DNA,用无血清双抗OPTI-MEN培养基稀释至250ul;多孔可批量配制。
质粒DNA配好后,涡旋,瞬离。
3、Lipofect配制:每孔5ul lipofect试剂,用OPTI-MEN培养基稀释至250ul温和混匀,温室放置5min;多孔可批量配制。
4、将稀释的质粒DNA和Lipofect,混合在一起(配制后30min内混合),室温保温20min,保证每孔总体积500ul。
溶液可能变浑浊,但不影响转染。
(DNA-Lipofect复合物室温下6小时内保持稳定)。
5、将前天孵育的6孔板取出,处理细胞。
用移液管吸去上清(注意从边缘吸取,尽可能不要吸去贴附细胞)。
6、每孔2mLPBS清洗1遍,注意移液管要对着边缘加液,不可吹起细胞。
7、每孔用1mLDMEM清洗2遍。
8、每孔先加入OPTI-MEN0.9mL,再加500ulDNA-Lipofect复合物,摇动培养版,轻轻混匀(加质粒DNA时注意不要碰管壁)。
9、置入CO2培养箱,在6h后更换培养液,弃去上清,加入2mL不含双抗的DMEM。
10、再次置入CO2培养箱,72小时后,吸收上清至50mL离心管。
500转,10min 离心,取上清1mL/管(1.5mL进口EP管)分装标注,冻存-80°。
另取200ul 至2mLEP管检测HBsAg定量。