新教材必修二化学精品 第六章 本章知识体系构建
- 格式:docx
- 大小:663.44 KB
- 文档页数:1

化学必修 2 模块教材分析普通高中化学课程标准(实验)化学 2 有三个一级主题:物质结构基础、化学反应与能量、化学与可持续发展,对应的教材在内容设置上包括四章,分别是第一章:物质结构和元素周期律,第二章:化学反应与能量,第三章:有机化合物,第四章:化学与可持续发展。
《化学 2》在化学 1 的基础上突出物质结构和元素周期律的作用,强调化学变化与能量的关系,同时通过有机化合物的知识来进一步认识化学结构和反应的关系。
最终将化学与可持续发展这一大背景相联系,更加显现化学的重要性。
化学 2 的主要特点是突出化学理论:原子结构、元素周期律,以元素知识为基础,将其应用于理论:化学反应反应与能量、有机化合物知识、化学与社会等。
化学 2 在整个化学教材中起一种承前启后的作用。
承前是指化学1所学的元素知识在化学 2 第一章物质结构元素周期律中、在第四章化学与可持续发展中又遇到,化学 2 的学习是对前面知识的一种复习和拓展。
如在化学 1中第三章金属及其化合物中学习了 Na、 Al 、 Mg、 Cu 的性质,在第四章非金属及其化合物中学习了Cl 等元素。
在化学2 的物质结构周期律中有碱金属当然主要是Na,有卤素,主要有Cl ,而在化学与可持续发展中 Na、 Al 、 Mg、 Cu、 Fe、 Cl、 Br 、I 等都有。
而启后是指通过对化学 2 的学习,为学习后面选修模块的知识打下一定的基础。
化学 2 所学的知识在选修模块中都要继续学习。
如物质结构元素周期律对应了物质结构与性质,化学反应与能量对应了化学反应原理,有机化合物对应了有机化学基础,化学与可持续发展对应了化学与生活、化学与技术。
下面分章讨论。
1物质结构元素周期律1.1地位和功能物质结构和元素周期律是化学中的重要理论知识,也是中学化学中的重要内容。
通过这部分知识的学习,可以使学生对所学元素化合物等化学知识进行综合、归纳,从理论进一步认识、理解。
同时,也作为理论指导,为学生继续学习化学打基础。

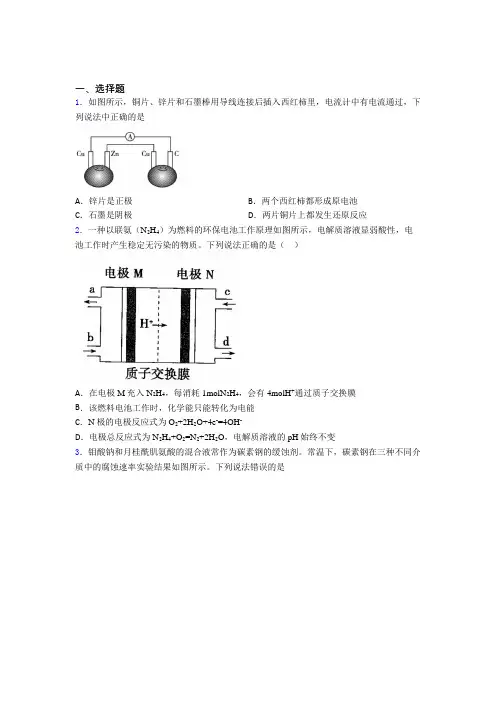
一、选择题1.如图所示,铜片、锌片和石墨棒用导线连接后插入西红柿里,电流计中有电流通过,下列说法中正确的是A.锌片是正极B.两个西红柿都形成原电池C.石墨是阴极D.两片铜片上都发生还原反应2.一种以联氨(N2H4)为燃料的环保电池工作原理如图所示,电解质溶液显弱酸性,电池工作时产生稳定无污染的物质。
下列说法正确的是()A.在电极M充入N2H4,每消耗1molN2H4,会有4molH+通过质子交换膜B.该燃料电池工作时,化学能只能转化为电能C.N极的电极反应式为O2+2H2O+4e-=4OH-D.电极总反应式为N2H4+O2=N2+2H2O,电解质溶液的pH始终不变3.钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。
常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。
下列说法错误的是A.()H c+越大,腐蚀速率越快B.当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是浓硫酸使铁钝化C.要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为2:1SO,使碳素钢的盐酸中的腐蚀速率明D.酸溶液较低时,Cl-对碳素钢的腐蚀作用大于2-4显快于硫酸4.对可逆反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),下列叙述正确的是A.达到化学平衡时,6v正(O2)=5v逆(H2O)B.化学反应速率关系是:2v正(NH3)=3v逆(H2O)C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大D.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态5.下列有关反应热的说法正确的是A.在化学反应过程中,吸热反应需不断从外界获得能量,放热反应不需从外界获得能量B.甲烷的燃烧热ΔH=-890 kJ·mol-1,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890 kJ·mol-1C.已知:S(s)+O2(g)=SO2(g)ΔH1=-Q1 kJ·mol-1,S(g)+O2(g)=SO2(g)ΔH2=-Q2 kJ·moI-1,则Q1<Q2D.已知常温常压下:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)ΔH=-57.3 kJ·mol-1,则有:H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)ΔH=-114.6 kJ·mol-16.在一定条件下,A气体与B气体反应生成C气体。



专题6化学反应与能量变化第一单元 化学反应速率与反应限度 (1)第1课时 化学反应速率及影响因素 (1)第2课时 化学反应的限度 (5)微专题1 化学反应速率和反应限度图像题分析 (9)第二单元 化学反应中的热 (10)第三单元 化学能与电能的转化 (16)第1课时 化学能转化为电能 (16)第2课时 化学电源 (20)第一单元 化学反应速率与反应限度第1课时 化学反应速率及影响因素基础知识一、化学反应速率1.化学反应速率及其表示方法(1)概念:化学反应速率是用来衡量化学反应过程进行快慢程度的物理量。
(2)表示方法:可用单位时间内反应物浓度的减少或者生成物浓度的增加(均取正值)来表示。
(3)计算:表达式为v =Δc Δt 或v =Δn V ·Δt。
式中:Δc 为浓度的变化量,一般以mol·L -1为单位;Δt 为时间,一般以s 或min 为单位。
(4)常用单位:mol·L -1·s -1或mol·L -1·min -1。
2.规律对于同一反应,用不同的物质来表示反应速率,其比值一定等于化学方程式中相应的化学计量数之比。
如对于反应:m A(g)+n B(g)p C(g)+q D(g),v (A)∶v (B)∶v (C)∶v (D)=m ∶n ∶p ∶q 。
微点拨:(1)一个确定的化学反应涉及反应物、生成物等多种物质,因而定量表示一个化学反应的反应速率时,必须指明是用哪一种反应物或哪一种生成物来表示。
(2)无论是用某一反应物表示还是用某一生成物表示,其化学反应速率都取正值,而且是某一段时间内的平均速率,不是某一时刻的瞬时速率。
(3)在一定温度下,对于固体和纯液体物质来说,其单位体积里的物质的量不会改变,即它们的物质的量浓度为常数,故一般不用固体或纯液体物质来表示反应速率。
在体积为100 mL 的溶液中,发生下列反应:16H ++2MnO -4+10Br -===2Mn 2++5Br 2+8H 2O 。


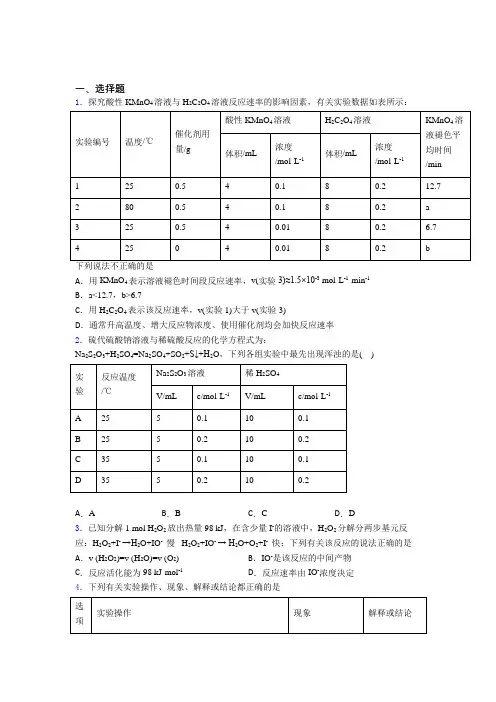
一、选择题1.探究酸性KMnO4溶液与H2C2O4溶液反应速率的影响因素,有关实验数据如表所示:A.用KMnO4表示溶液褪色时间段反应速率,v(实验3)≈1.5×10-3 mol·L-1·min-1B.a<12.7,b>6.7C.用H2C2O4表示该反应速率,v(实验1)大于v(实验3)D.通常升高温度、增大反应物浓度、使用催化剂均会加快反应速率2.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是( )A.A B.B C.C D.D3.已知分解1 mol H2O2放出热量98 kJ,在含少量I-的溶液中,H2O2分解分两步基元反应:H2O2+I- →H2O+IO- 慢 H2O2+IO- → H2O+O2+I- 快;下列有关该反应的说法正确的是A.v (H2O2)=v (H2O)=v (O2) B.IO-是该反应的中间产物C.反应活化能为98 kJ·mol-1D.反应速率由IO-浓度决定4.下列有关实验操作、现象、解释或结论都正确的是A 用坩埚钳夹持一片未打磨的薄铝片,在酒精灯火焰上加热,铝不能滴落下来,好像有一层膜兜着铝熔点高,没能熔化B将H2在充满Cl2的集气瓶中燃烧集气瓶口上方有白烟生成H2、Cl2化合生成HClC 取两支试管,分别放入一小片打磨过的铝片,再分别加入3mL20%的盐酸和氢氧化钠溶液都有气体产生前者生成氢气,后者生成氧气D 相同温度条件下,向两支试管中分别加入2mL质量分数为3%和6%的H2O2溶液,再分别加入等量二氧化锰粉末,比较H2O2的分解速率6%的H2O2溶液试管中产生气泡的速率较快相同条件浓度大H2O2分解速率快A.A B.B C.C D.D5.三元电池成为2019年我国电动汽车的新能源,其充电时总反应为:LiNi x Co y Mn z O2+6C(石墨)=Li1-a Ni x Co y Mn z O2+Li a C6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。


(名师选题)部编版高中化学必修二第六章化学反应与能力带答案知识汇总笔记单选题1、用一根铁钉与30mL0 .3mol⋅L−1硫酸反应制取H2,若要增大反应速率,可采取的措施是①适当升高温度②改用30mL18mol⋅L−1硫酸③改用40mL0 .3mol⋅L−1硫酸④改用30mL1 .0mol⋅L−1硫酸⑤滴入少量CuSO4溶液A.①②③④B.①④⑤C.①②④D.②④⑤2、在有催化剂加热的恒容密闭容器中进行反应:2SO2(g)+O2(g)⇌2SO3(g)。
下列叙述正确的是A.平衡时,SO2的浓度保持不变B.平衡时,O2的转化率等于100%C.SO2的消耗速率和SO3的生成速率相等时,该反应达到平衡D.达到平衡时,体系中一定存在:c(SO2):c(SO3):c(O2)=2:2:13、已知:2H2(g)+O2(g)=2H2O(g) ΔH13H2(g)+ Fe2O3(s)=2Fe(s)+ 3H2O(g) ΔH22Fe(s)+ 1 .5O2(g)=Fe2O3(s) ΔH32Al(s)+ 1 .5O2(g)=A12O3(S) ΔH42Al(s)+ Fe2O3(s)=Al2O3(s)+ 2Fe(s) ΔH5下列关于上述反应恰变的判断正确的是A.ΔH1<0,ΔH3>0B.ΔH5<0,ΔH4<ΔH3C.ΔH1=ΔH2+ΔH3D.ΔH3=ΔH4+ΔH54、设N A为阿伏加德罗常数的值,下列叙述正确的是A.l mol/L HNO3溶液中,H+的数目为N AB.5 .6 g铁与足量氯气反应转移电子的数目为0 . 3N AC.Cu-Zn (硫酸溶液)原电池中,正极产生1 . 12 LH2时,转移的电子数应等于0 . 1N AD.46 g NO2和N2O4的混合气体中含有分子的数目为N A5、用N A表示阿伏伽德罗常数的值,下列说法确的是A.1 L 1mol/L的氨水中含有NH3·H2O分子的数目为N AB.过量的Cu与含0 .2 mol HNO3的浓硝酸反应,转移电子的数目大于0 .1N AC.标准状况下,2 .24LSO3所含的原子总数为0 .4N AD.1molN2与3molH2一定条件下充分反应,生成NH3的分子数为2N A6、一定温度下,在某恒容的密闭容器中加入炭和水蒸气,建立化学平衡:C(s)+H2O(g)⇌CO(g)+H2(g)。
一、选择题1.一定温度下,向容积为4L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,下列对反应的推断合理的是A.该反应的化学方程式为3B+4C⇌6A+3DB.反应进行到1s时,υ(A)=υ(D)C.反应进行到6s时,各物质的反应速率相等D.反应进行到6s时,B的平均反应速率为0.025mol⋅(L⋅s)−12.某同学用下图所示装置探究原电池的工作原理,并推出下列结论,正确的是A.Cu质量减少B.Zn用作负极C.电子由Cu并经导线流向Zn D.该装置将电能转换为化学能3.反应2NO2(g)O2(g)+2NO(g),一定条件下,将NO2置于恒容密闭容器中发生上述反应。
下列能说明反应达到平衡状态的是()A.气体密度保持不变B.混合气体颜色保持不变C.O2和NO的体积比保持不变D.每消耗2molNO2的同时生成2molNO4.下列实验操作能达到实验目的的是选项实验操作实验目的A用铂丝蘸取某碱金属的盐溶液灼烧,观察现象证明其中含有K+B 将等浓度等体积的KI溶液和FeCl3溶液混合,充分反应后滴入KSCN溶液溶液中存在平衡:3+-2+22Fe+2I2Fe+IC用稀硫酸和锌粒制取H2时,加几滴CuSO4溶液CuSO4作反应的催化剂D蒸发铝与稀盐酸反应的溶液制备无水AlCl3A.A B.B C.C D.D5.在一定条件下,A气体与B气体反应生成C气体。
反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则下列叙述正确的是A.该反应的化学方程式为3A+B2CB.在t1~(t1+10)s时,v(A)=v(B)=0C.t1 s时反应物A的转化率为60%D.0~t1内A应的反应速率为v(A)=0.4mol/(L*s)6.反应A→C分两步进行,①A→B △H1;②B→C △H2。
反应过程能量变化曲线如图所示(E1、E2、E3、E4表示活化能,且E1>E3)。
下列说法正确的是A.两步反应的△H均大于0B.A→B反应的△H1=E1-E2C.三种物质的稳定性:B>A>C D.反应速率:A→B>B→C7.工业合成三氧化硫的反应为2SO2(g)+O2(g)⇌2SO3(g) ∆H=-198kJ/mol,反应过程可用如图模拟(表示O2,表示SO2,表示催化剂)。
一、选择题1.有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下,由此可判断这四种金属的活动性顺序是实验装置部分实验现象a极质量减小,b极质量增加b极有气体产生,c极无变化d极溶解,c极有气体产生电流计指示,导线中电流从a极流向d极A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c 2.5.6 g铁粉与100 mL 1mol/L的稀盐酸反应时,为了使反应平缓进行且不改变H2的产量,可以使用如下方法中的①NaOH溶液②改用200mL 0.5mol/L的盐酸③加NaCl溶液④CuSO4固体⑤加CH3COONa固体⑥加NH4Cl固体A.②③⑤B.②⑤⑥C.①②⑥D.①②⑤3.N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应为:N2O(g)+CO(g)CO2(g)+N2(g)ΔH,有关化学反应的物质变化过程如图1所示,能量变化过程如图2所示,下列说法正确的是()A.由图1、2可知ΔH=ΔH1+ΔH2=ΔE2-ΔE1B.反应中加入Pt2O+可使反应的焓变减小C.由图2可知正反应的活化能小于逆反应的活化能D.1molN2O和1molCO的总能量小于1molCO2和1molN2的总能量4.下列实验操作能达到实验目的且现象描述正确的是选项实验操作及现象实验目的A 向无色溶液中滴加FeCl3溶液和CCl4,振荡、静置,下层显紫红色证明溶液中含有I-B 向某溶液中先加入少量氯水,然后加入KSCN溶液,溶液变为血红色证明溶液中含有Fe2+C在盛有漂白粉的试管中滴入70%的硫酸,立刻产生黄绿色气体证明硫酸具有还原性D 将3 LSO2和1 LO2混合通过灼热的V2O5充分反应,产物先通入BaCl2溶液,有白色沉淀,再通入品红溶液,溶液褪色验证SO2与O2的反应为可逆反应.A.A B.B C.C D.D5.已知:①S(g) +O2(g)= SO2(g) △H1②S(s)+O2(g)=SO2(g) △H2,下列说法正确的是A.硫燃烧过程中将化学能转化全部为热能B.相同条件下,1 mol S(s) 比l mol S(g) 燃烧更剧烈C.两个过程的能量变化可用下图表示,△H1<△H2<0D.两个反应中反应物的总键能都比生成物的总键能小6.对丙烷进行溴代反应,反应一段时间后得到如下结果:2CH3CH2CH3+Br2127−−−−→光,℃CH3CH2CH2Br(3%)+CH3CHBrCH3(97%)+2HBr已知:正丙基结构简式CH3CH2CH2-、异丙基结构简式(CH3)2CH-,反应机理中链转移决速步为RH+Br·→R·+HBr,其反应势能变化如图所示。
一、选择题1.过量铁与少量稀硫酸反应,为了加快反应速率,但是又不影响生成氢气的总量,可以采取的措施是A.加入适量NaCl溶液B.加入适量的水C.加入几滴硫酸铜溶液D.再加入少量稀硫酸2NH3的正、逆反应速率可用各反应物或生成物浓度2.可逆反应3H2+N2高温、高压催化剂的变化来表示,下列各关系中能说明反应已达到平衡状态的是A.v正(N2)=v正(H2)B.v正(N2)=v逆(NH3)C.2v正(H2)=3v逆(NH3)D.v正(N2)=3v逆(H2)3.“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg(OH)2。
下列关于该电池的说法错误的是A.镁片作为正极B.食盐水作为电解质溶液C.电池工作时镁片逐渐被消耗D.电池工作时实现了化学能向电能的转化4.利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO3)2,其部分工艺流程如图:下列说法不正确的是A.上述工艺中吸收过程:尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋,其目的是使尾气中NO、NO2提高吸收效率B.滤渣的主要成分为Ca (NO2)2C.为提高Ca(NO2)2的产率及纯度,则n(NO):n(NO2)应控制为 1:1D.生产中溶液需保持弱碱性5.100mL6mol•L-1的硫酸和过量的锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,不可向溶液中加入的试剂是A.碳酸钠固体B.加CH3COONa固体C.水D.硫酸锌溶液6.两电极用导线连接插入电解质溶液中(不考虑溶液中溶解的氧气的影响),你认为不能构成原电池的是( )选项 A B C D 电极材料 Zn Fe Cu Al 电极材料 Cu Zn Ag Sn 电解质溶液 CuCl 2 溶液 H 2SO 4 溶液 CuSO 4 溶液NaOH 溶液A .AB .BC .CD .D7.一定温度下,在一个容积为2L 的密闭容器中发生反应4A(s)3B(g)2C(g)D(g)++,经2min 达到平衡状态,此时B 反应了1.2mol ,下列说法正确的是A .充入2N (不参与反应)使压强增大可加快反应速率B .0~2min 内,A 的平均反应速率为110.4mol L min --⋅⋅C .平衡状态时,B 、C 的反应速率相等D .0~2min 内,C 的平均反应速率为110.2mol L min --⋅⋅8.最近报道的一种处理酸性垃圾渗滤液并用其发电的示意图如图(注:盐桥可使原电池两极形成导电回路)。