螯合能力-钙镁离子-铁离子
- 格式:docx
- 大小:17.07 KB
- 文档页数:3

螯合分散剂的检测一.实验准备1.仪器设备:滴定架,容量瓶(500mL),三角瓶(250mL),碘量瓶(250mL),量筒(100mL),移液管(10mL),温度计,称量瓶,恒温烘箱,电子天平(1/1000),磁力搅拌器2.染化药品:EDTA(二钠),固体氢氧化钠,三氯化铁,氯化钙,螯合分散剂,钙指示剂,中性皂片3.溶液制备:(1)C(EDTA)=0.01mol/L标准溶液:准确称取 1.86gEDTA(100%)于烧杯中,加少量水充分溶解后,洗入500mL容量瓶中,加水至刻度,标定后使用。
(2)200g/L氢氧化钠溶液:用30%氢氧化钠(400g/L)稀释一倍。
(3)C(NaOH)=2.5mol/L氢氧化钠溶液:准确快速称取10g固体氢氧化钠,溶解冷却,并稀释至100mL。
(4)C(CaCl2)=0.05mol/L氯化钙标准溶液(5)C(CaCl2)=0.25mol/L氯化钙标准溶液(6)C(FeCl3)=0.25mol/L的三氯化铁溶液(7)0.5%钙指示剂溶液二.操作步骤1.钙离子螯合值或螯合能力测试。
(1)精确称取试样0.25-0.50g(以100%计)于称量瓶中,加蒸馏水溶解后,洗入500mL容量瓶中,加入C(CaCl2)=0.05mol/L氯化钙标准溶液50mL,加蒸馏水稀释至刻度,充分振荡摇匀,放置20min后,用定性滤纸干过滤。
(2)吸取上述滤液50mL于250mL三角烧瓶中,加入C(NaOH)=2.5mol/L氢氧化钠溶液2mL,加钙指示剂2-3滴,用EDTA标准溶液滴至由酒红色变为蓝色为终点。
(3)计算钙螯合值或钙螯合能力E。
平行测试3次,取平均值。
E=100.08*(50*C0-10*C1*V)/m*p式中:E-钙螯合值或螯合能力,mg/g; 100.08-碳酸钙的毫摩尔质量; C0-氯化钙的摩尔浓度0.05mol/L; C1-EDTA标准溶液浓度,mol/L; m-试样重g; p-试样的有效浓度(4)记录测试结果,并填写测试报告。

螯合剂种类总结及其在不同pH下的对金属离子的螯合能力比较螯合剂的种类及其在不同pH值条件下螯合剂的螯合常数一、螯合剂与螯合物具有可供配位孤电子对的分子、原子或离子的化合物能够与具有空轨道的金属离子形成配位键,该化合物称为络合物,如能与配位金属离子形成环状结构的化合物称为螯合剂,形成的络合物称为螯合物。
螯合剂中至少含有一对孤电子对,而金属离子必须有空的价电子轨道,孤电子对填充入金属离子空轨道,电子对属2个原子共享,形成配位键,中心金属离子空轨道杂化。
不同的提供孤电子对的配位体分别与不同金属离子形成正四面体、正六面体、正八面体的螯合物。
1.类型1.1无机类螯合剂聚磷酸盐螯合剂:主要是三聚磷酸钠(STPP)、六偏磷酸钠、焦磷酸钠为主,含磷酸基空间配位基团。
特点:高温下会发生水解而分解,使螯合能力减弱或丧失。
而且其螯合能力受pH值影响较大,一般只适合在碱性条件下作螯合剂。
1.2有机类螯合剂形态分析表明螯合剂提取的重金属主要来源于可交换态或酸溶态、还原态和氧化态。
1.21羧酸型(1)氨基羧酸类:含羧基和胺(氨基)配位基团,如乙二胺四乙酸(EDTA),氨基三乙酸(又称次氮基三乙酸NTA),二亚乙基三胺五乙酸(DTPA )及其盐等。
如:EDTA的4个酸和2个胺(一NRR )的部分都可作为配体的齿,两个氮原子和四个氧原子可提供形成配位键的电子对。
特点:络合能力强,络合稳定常数大,耐碱性好,但分散力弱且不易被生物降解。
(2)羟基羧酸类含羟基、羧基配位基团这类羧酸主要是柠檬酸(CA)、酒石酸(TA)和葡萄糖酸(GA)。
特点:可生物降解,在酸性条件下羟基与羧基不会离解为氧负离子,因而络合能力很弱,不适宜在酸性介质中应用。
(3)羟氨基羧酸类这类酸用作螯合剂的典型代表是羟乙基乙二胺三乙酸(HEDTA)和二羟乙基甘氨酸(DEG)。
特点:大多易于生物降解,在pH=9的弱碱性条件下可螯合铁离子,但对其他离子螯合能力较差。
1.22有机多元膦酸羟基亚乙基-1,1-二膦酸(HEDP )、氨基三亚甲基膦酸(ATMP)、二乙烯三胺五亚甲基膦酸(HTPMP)、三乙烯四胺六亚甲(TETHMP)、双(1,6-亚己基)三胺五亚甲基膦酸(BNHMTPMP)、多氨基多醚基四亚甲基膦酸(PAPEMP)。



万方数据万方数据第13卷第21期2009 年12月香港理工大學學報 Vol.13 No.21 Dec 2009各種螯合劑的螯合值對照表紡織與成衣研發中心黃偉雄彙整鈣離子螯合值測定------鉻黑T指示劑絡合滴定法準確稱取一定量樣品(約0.1 g~0.2 g),將其用少量蒸餾水溶解,再移取10 mL氯化鈣標準溶液(0.100 moL/L)於上述溶液中,間歇震盪後,加10 ml氨-氯化銨緩衝溶液和3~4滴鉻黑T指示劑,然後用0.050moL/L EDTA 標準溶液滴定,以溶液從酒紅色變為純藍色為終點。
以下式計算樣品的鈣螯合值:鈣離子螯合值C=螯合劑所螯合的CaCO3品質/所用螯合劑品質=100.08×(10C1-C2V)/m式中C1為CaCl2標準溶液的濃度,mol/L;C2為EDTA標準溶液的濃度,mol/L;V為滴定時消耗EDTA標準溶液的體積,mL;m為樣品品質,g。
表一,室溫40℃各種pH值條件下鈣離子螯合值:名稱(測試樣品均折算成100%有效含量)測試條件40℃PH=7測試條件40℃PH=11測試條件40℃PH=13氨基三甲叉膦酸ATMP 910 mg/g 670 mg/g 320 mg/g 乙二胺四甲叉膦酸鈉EDTMPS 638 mg/g 550 mg/g 280 mg/g 羥基乙叉二膦酸HEDP 833 mg/g 610 mg/g 197 mg/g 二乙烯三胺五甲叉膦酸DTPMPA 850 mg/g 660 mg/g 155 mg/g 聚丙烯酸鈉PAAS 350 mg/g 370 mg/g 370 mg/g 乙二胺二鄰羥苯基乙酸鈉EDDHA-Na 845 mg/g 700 mg/g 318 mg/g 三聚磷酸鈉275 mg/g 275 mg/g 288 mg/g 焦磷酸鈉188 mg/g 190 mg/g 192 mg/g 磷酸三鈉160 mg/g 155 mg/g 147 mg/g 檸檬酸鈉330 mg/g 280 mg/g 190 mg/g 葡萄糖酸鈉280 mg/g 290 mg/g 285 mg/g 酒石酸鉀鈉420 mg/g 330 mg/g 280 mg/g 2-膦酸丁烷-1,2,4-三羧酸PBTCA 680 mg/g 320 mg/g 180 mg/g 2-羥基膦酸基乙酸HPAA 600 mg/g 120 mg/g 90 mg/g 己二胺四甲叉膦酸HDTMPA 790 mg/g 90 mg/g 33 mg/g 雙1,6-亞己基三胺五甲叉膦酸BHMTPMPA 630 mg/g 470 mg/g 325 mg/g 二乙醯胺四乙酸鈉EDTTI-Na 1150 mg/g 840 mg/g 305 mg/g 聚天冬氨酸鈉PASP 455 mg/g 280 mg/g 106 mg/g 聚環氧琥珀酸鈉PESA 390 mg/g 330 mg/g 285 mg/g 馬來酸-丙烯酸共聚物MA-AA 620 mg/g 410 mg/g 288 mg/g第13卷第21期2009 年12月香港理工大學學報 Vol.13 No.21 Dec 2009馬來酸-丙烯酸共聚物MA-AA 620 mg/g 410 mg/g 288 mg/g二乙烯三胺五乙酸五鈉DTPA5Na 420 mg/g 180 mg/g 85 mg/g次氮基三乙酸NTA 480 mg/g 330 mg/g 260 mg/g亞氨基二乙酸IDA 460 mg/g 190 mg/g 70 mg/g矽酸鈉模數=1 270 mg/g 280 mg/g 320 mg/g矽酸鈉模數=3 380 mg/g 335 mg/g 360 mg/g鐵離子螯合值----磺基水楊酸顯色測定待測樣品溶液配製:準確稱取待測樣品5.000 g,加去離子水溶解,移至500mL容量瓶中定容至刻度,搖勻備用待測。

不同pH值条件下螯合剂对铁、钙、镁等离子的螯合常数一,螯合分散剂用途纺织工业:1,退浆在退浆液中添加螯合剂,不管使用哪种退浆方法,可使退浆效率大大提高。
这是因为它把与浆料反应的金属离子络合以后,提高了浆膜的可溶胀性,也提高了浆料与退浆剂的可反应性,从而很容易从织物上去除。
2,前处理主要用作双氧水漂白的稳定剂,控制双氧水缓慢平稳的分解,提高双氧水利用率;同时防止金属离子导致的局部剧烈分解,引起织物纤维断裂形成破洞。
3,染色染色过程使用的水、芒硝、纯碱、氯化钠等都含有一定的杂质,在杂质的影响下,染料会引起沉淀。
特别是鲜艳的色系染色时,加入螯合剂可使色泽更加鲜艳,而对染料的磨擦牢度及匀染没有不良影响。
在染硫化染料时,更可防止起铜镜面的效果出现。
造纸工业:金属离子在纸浆漂白过程中引起的反应沉淀结垢,漂白剂无效分解,纸浆返黄等不良后果,纸浆漂白工艺中也需要使用螯合剂减少漂白的副作用,避免Fe3+离子与纸浆中的酚基团反应形成深颜色的复合物,保护纤维,提高纸浆白度,减少纸浆返黄。
循环水阻垢:在水处理中需要螯合剂用作循环冷却水和锅炉水的阻垢缓蚀剂,特别是针对含碳酸钡高的油田注水和冷却水、锅炉水的阻垢缓蚀剂。
清洗领域:无论是在工业清洗还是民用洗衣粉等日化产品,都需要螯合剂改善水质,提高净洗效果。
二,螯合剂的选用螯合剂种类繁多,如何选择适合的螯合剂则是我们最头疼和迷惑的地方,螯合力-稳定系数K是重要的参考指标,稳定系数K值越大,表明螯合剂对该离子的螯合能力越大。
下图为不同螯合剂对铁、钙、镁离子的螯合常数K值。
酸碱(pH值)对螯合剂螯合力影响在大多数使用螯合剂的工艺里面,工作液往往为酸性或碱性,因此pH值对螯合剂的影响对于螯合剂的选择与应用,尤为重要。
因此绘制出不同pH值条件下的螯合力曲线图,具有重要的实际意义,从而可以根据实际应用工艺条件,选择适合的螯合剂。
图表1铁离子螯合值(螯合值K)与pH曲线图表2钙离子螯合值(螯合值K)与pH曲线图表3镁离子螯合值(螯合值K)与pH曲线三,几种螯合剂的综合应用评价无机磷酸盐类:三聚磷酸钠以及焦磷酸钠是常用的螯合剂,自身带有弱碱性质,多用于洗衣粉添加剂。

螯合剂的种类及其在不同pH值条件下螯合剂的螯合常数一、螯合剂与螯合物具有可供配位孤电子对的分子、原子或离子的化合物能够与具有空轨道的金属离子形成配位键,该化合物称为络合物,如能与配位金属离子形成环状结构的化合物称为螯合剂,形成的络合物称为螯合物。
螯合剂中至少含有一对孤电子对,而金属离子必须有空的价电子轨道,孤电子对填充入金属离子空轨道,电子对属2个原子共享,形成配位键,中心金属离子空轨道杂化。
不同的提供孤电子对的配位体分别与不同金属离子形成正四面体、正六面体、正八面体的螯合物。
1.类型1.1无机类螯合剂聚磷酸盐螯合剂:主要是三聚磷酸钠(STPP)、六偏磷酸钠、焦磷酸钠为主,含磷酸基空间配位基团。
特点:高温下会发生水解而分解,使螯合能力减弱或丧失。
而且其螯合能力受pH值影响较大,一般只适合在碱性条件下作螯合剂。
1.2有机类螯合剂形态分析表明螯合剂提取的重金属主要来源于可交换态或酸溶态、还原态和氧化态。
1.21羧酸型(1)氨基羧酸类:含羧基和胺(氨基)配位基团,如乙二胺四乙酸(EDTA),氨基三乙酸(又称次氮基三乙酸NTA),二亚乙基三胺五乙酸(DTPA)及其盐等。
如:EDTA的4个酸和2个胺(—NRR′)的部分都可作为配体的齿,两个氮原子和四个氧原子可提供形成配位键的电子对。
特点:络合能力强,络合稳定常数大,耐碱性好,但分散力弱且不易被生物降解。
(2)羟基羧酸类含羟基、羧基配位基团这类羧酸主要是柠檬酸(CA)、酒石酸(TA)和葡萄糖酸(GA)。
特点:可生物降解,在酸性条件下羟基与羧基不会离解为氧负离子,因而络合能力很弱,不适宜在酸性介质中应用。
(3)羟氨基羧酸类这类酸用作螯合剂的典型代表是羟乙基乙二胺三乙酸(HEDTA)和二羟乙基甘氨酸(DEG)。
特点:大多易于生物降解,在pH=9的弱碱性条件下可螯合铁离子,但对其他离子螯合能力较差。
1.22有机多元膦酸羟基亚乙基-1,1-二膦酸(HEDP)、氨基三亚甲基膦酸(A TMP)、二乙烯三胺五亚甲基膦酸(HTPMP)、三乙烯四胺六亚甲(TETHMP)、双(1,6-亚己基)三胺五亚甲基膦酸(BNHMTPMP)、多氨基多醚基四亚甲基膦酸(PAPEMP)。

螯合剂知识一、螯合剂的概念由一个简单正离子(称为中心离子)和几个中性分子或离子(称为配位体)结合而成的复杂离子叫配离子(又称络离子),含有配离子的化合物叫配位化合物。
在配合物中中心离子与配位体通过配位键结合。
配位键是一种特殊的共价键,通常的共价键是由两个成键·原子绷出一个电子形成共同电子对的,而在配位键中是由一个原子提供电子对,另一原手提供攀删道形成的。
为了区别把共价键用“一”表示,如H·+·H =H:H(H—H),配位键奶删“←”表示,箭头指向提供空轨道的原子,如Cu+NH3=CuNH3(Cu←NH3)。
如果配位体中只有一个配位原子,则中心离子与配位体之间只能形成一个配位键。
而有些配位体分瑚中含有两个以上的配位原子而且这两个原子间相隔着两至三个其他非配位原子时,:这个硼体就可以与中心离子(或原子)同时形成两个以上的配位键,并形成一个包括两个配位剿五元或六元环的特殊结构,把这种配合物称为螯合物。
螯合物比一般配合物更稳定。
把能形成螯合物的配位体叫整合剂。
螯合剂包括无机和有机两类。
它们在清洗过程中蕉着重要用途。
二、无机金属离子螯合剂聚磷酸盐螯合剂的缺点是它们在高温下会发生水解而分解,使螯合能力减弱或丧失。
而且其螯合能力受pH值影响较大,兰般只适合在碱性条件下作螯合剂。
一般说来这些无机螯合剂对重金属离子特别是铁离子的螯合能力较差。
由于以上缺点,使无机螯合剂的用途受到限制,通常只用于对钙、镁离子螯合,所以常作为硬水软化剂。
三、有机金属离子螯合剂能与重金属离子起螯合作用的有机化合物很多,如羧酸型、有机多元膦酸等。
1.羧酸型在清洗剂中使用的羧酸型螯合剂主要有氨基羧酸类和羟基羧酸类等。
(1)氨基羧酸类氨基羧酸用作螯合剂的有乙二胺四乙酸(EDTA),氨基三乙酸(又称次氮基三乙酸NTA),二亚乙基三胺五乙酸及其盐等。
它们对钙、镁离子均有较强的螯合作用。
从单位质量的三种酸螯合钙离子的数量看,以NTA螯合最多,ZDTA其次,DTPA再次。
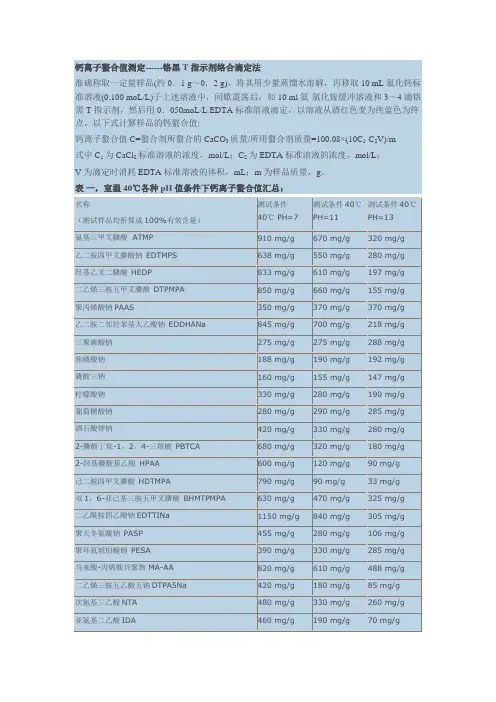
钙离子螯合值测定------铬黑T指示剂络合滴定法
准确称取一定量样品(约0.1 g~0.2 g),将其用少量蒸馏水溶解,再移取10 mL氯化钙标准溶液(0.100 moL/L)于上述溶液中,间歇震荡后,加10 ml氨-氯化铵缓冲溶液和3~4滴铬黑T指示剂,然后用0.050moL/L EDTA标准溶液滴定,以溶液从酒红色变为纯蓝色为终点。
以下式计算样品的钙螯合值:
钙离子螯合值C=螯合剂所螯合的CaCO3质量/所用螯合剂质量=100.08×(10C1-C2V)/m
式中C1为CaCl2标准溶液的浓度,mol/L;C2为EDTA标准溶液的浓度,mol/L;
V为滴定时消耗EDTA标准溶液的体积,mL;m为样品质量,g。
表一,室温40℃各种pH值条件下钙离子螯合值汇总:。

2022年氯碱电解工艺考试题及答案1、在离子膜烧碱工艺中,螯合树脂工作一段时间后,螯合能力丧失,树脂()。
(C)A、由氢型转化为钠型B、由钠型转化为氢型C、由钠型转化为钙型2、螯合树脂吸附钙镁离子的最佳PH值是()。
(C )A、1. 5-8B、5-6C、9-9.53、综合应急预案应当包括本单位的应急组织机构及其职责、预案体系及响应程序、()、应急培训及预案演练等主要内容。
(A )A、事故预防及应急保障B、编制依据和目的C、应急预案管理4、离子膜电解工艺中,盐水中的铁离子含量超过()mg∕L时,即会导致螯合树脂中毒。
(C )A、1B、0.5C、0. 15、化学品安全技术说明书中“理化特性”一栏内容不包括()。
(C )A、外观与性状B、PH 值C、成分组成 6、《使用有毒物品作业场所劳动保护条例》规定,用人单位应当按照规定对从事使用高毒物品作业的劳动者()。
(B )A、进行调离B、进行岗位轮换C、妥善安置7、一氧化碳的伤害途径为()。
(B)A、皮肤接触吸收B、呼吸道吸入C、消化道食入8、氯化氢在水中溶解时,溶液温度O。
( B )A、不变B、升高C、降低9、在中暑的几种类型中,最为凶险的是()。
(C)A、热衰竭B、热痉挛C、热射病10、为避免乙块分解爆炸,严禁采用下列0容器中。
(B)A、不锈钢容器B、含铜量70%的铜合金制造盛乙块的容器C、含铁量超过70%的铁质容器 11、液氯系统压缩机停车后,手工盘车的频率为至少每O一次。
(C )A、月B、半月C、周12、个人防护措施属于第()级预防。
(C )A、三B、二C、一13、爆炸浓度范围随原始压力、温度的降低而()。
(A )A、变窄B、变宽C、不变14、影响人的身体健康,导致疾病或对物造成慢性损害的因素,称为Oo ( A )A、有害因素B、危险因素C、隐患15、液氯钢瓶称重磅秤称重误差应小于()kg。
( A )A、±1B、±316、消防给水管道应保持充水状态。
金属螯合剂一、螯合剂的概念由一个简单正离子(称为中心离子)和几个中性分子或离子(称为配位体)结合而成的复杂离子叫配离子(又称络离子)含有配离子的化合物叫配位化合物。
在配合物中中心离子与配位体通过配位键结合。
配位键是一种特殊的共价键通常的共价键是由两个成键·原子绷出一个电子形成共同电子对的而在配位键中是由一个原子提供电子对另一原手提供攀删道形成的。
为了区别把共价键用“一”表示如H·+·H H H(H—H)配位键奶删“←”表示箭头指向提供空轨道的原子如Cu+NH3 CuNH3(Cu←NH3)。
如果配位体中只有一个配位原子则中心离子与配位体之间只能形成一个配位键。
而有些配位体分瑚中含有两个以上的配位原子而且这两个原子间相隔着两至三个其他非配位原子时这个硼体就可以与中心离子(或原子)同时形成两个以上的配位键并形成一个包括两个配位剿五元或六元环的特殊结构把这种配合物称为螯合物。
螯合物比一般配合物更稳定。
把能形成螯合物的配位体叫整合剂。
螯合剂包括无机和有机两类。
它们在清洗过程中蕉着重要用途。
二、无机金属离子螯合剂聚磷酸盐螯合剂的缺点是它们在高温下会发生水解而分解使螯合能力减弱或丧失。
而且其螯合能力受pH值影响较大兰般只适合在碱性条件下作螯合剂。
一般说来这些无机螯合剂对重金属离子特别是铁离子的螯合能力较差。
由于以上缺点使无机螯合剂的用途受到限制通常只用于对钙、镁离子螯合所以常作为硬水软化剂。
三、有机金属离子螯合剂能与重金属离子起螯合作用的有机化合物很多如羧酸型、有机多元膦酸等。
1羧酸型在清洗剂中使用的羧酸型螯合剂主要有氨基羧酸类和羟基羧酸类等。
(1) 氨基羧酸类氨基羧酸用作螯合剂的有乙二胺四乙酸(EDTA)氨基三乙酸(又称次氮基三乙酸NTA)二亚乙基三胺五乙酸及其盐等。
它们对钙、镁离子均有较强的螯合作用。
从单位质量的三种酸螯合钙离子的数量看以NTA螯合最多ZDTA其次DTPA 再次。
IDS钙镁锌锰铜螯合性能实验报告I D S螯合性能测定实验报告一、实验背景本次实验,主要研究可生物降解的亚氨基二琥珀酸四钠(简称IDS)的螯合性能,通过对比IDS与EDTA的钙、镁、锌、锰的螯合值,为IDS开拓应用领域提供数据支持。
二、实验方法1.钙螯合值测定方法准确称取一定量样品(约1.0g—2.0g)于250mL锥形瓶中,加入约90mL蒸馏水溶解,再移取10mL0.5mol/LNa2CO3于上述溶液中,间歇震荡后,加稀NaOH 溶液至样品溶液特定PH。
用浓度为0.1mol/L的CaCl2标准溶液滴定至锥形瓶中透明溶液出现沉淀时,即为终点,记录下消耗CaCl2标准溶液的体积。
下式为计算样品的钙螯合值(C Ca)。
C Ca=螯合剂所螯合的CaCO3质量/所用螯合剂质量=100.08*C*V/mC为CaCl2标准溶液浓度,mol/L;V为滴定时消耗CaCl2标准溶液体积,mL;m为样品质量,g。
注:由于EDTA、HEDP显酸性,需要将EDTA、HEDP调为中性后,再加入Na2CO3溶液。
当PH<9时CaCl2的消耗量大,浓度换成0.2mol/LCaCl2标准溶液便于操作。
2.镁螯合值测定方法准确称取一定量样品(约0.5g—1.0g)于250mL锥形瓶中,加入约90mL蒸馏水溶解。
再移取10mL0.5mol/LNa2CO3于上述溶液中,间歇震荡后,滴加稀NaOH溶液或稀HCl溶液至酸度计测量PH 值到指定数值。
用0.5mol/L MgCl2溶液滴定至锥形瓶中透明溶液出现沉淀时,记录下消耗溶液的体积,并计算出镁螯合值。
螯合能力用螯合值Dc表示,Dc:单位质量螯合剂在不同PH值时,所能螯合的碳酸镁的质量,mg/g。
Dc=螯合剂所螯合的MgCO3质量/所用螯合剂质量=84*V*C/mV为滴定消耗的镁标准溶液的体积,mL;C为滴定的镁标准溶液的浓度,mol/L;m为样品质量,g。
注:由于EDTA显酸性,需要将EDTA调为中性后,再加入Na2CO3溶液。
铁离子螯合能力测定
1.溶液配制
2mM FeCl2:
称取0.02g FeCl2.4H2O,定容至50mL。
5mM 菲洛嗪
称取0.05g 菲洛嗪,定容至20mL。
10% 柠檬酸
称取5g柠檬酸,定容至50mL
2.测定步骤
在试管中分别加入1mL样品,加蒸馏水至5mL,同时加入0.1mL 2mM的FeCl2和0.2mL 5mM的菲洛嗪溶液,反应10min后于562nm下测定吸光值。
以0.1mg/mLBHA、BHT及10%的柠檬酸作为阳性对照。
还原力测定
1.溶液配制
2M磷酸缓冲液(pH6.6):
1.95g NaH2PO4.2H2O,
2.68g Na2HPO4.12H2O,定容至100mL。
1%铁氰化钾
0.5g铁氰化钾,定容至50mL。
10%三氯乙酸
5g三氯乙酸,定容至50mL。
0.1%三氯化铁
0.05g三氯化铁,定容至50mL。
2.测定步骤
在试管中分别加入0.5mL的样品。
同时加入2.5mL的磷酸缓冲液(0.2mol/L,pH6.6)和2.5mL 1%的铁氰化钾溶液。
混合物50℃水浴20min 后加入2.5mL 10%的三氯乙酸,室温静置10min。
取2.5mL反应液,加入2.5mL 蒸馏水和0.5mL 0.1%氯化铁溶液。
反应10min后测定700nm处吸光值,该值越高说明样品的还原性越强。
以0.1mg/mL的BHA和BHT为阳性对照。
THANKS !!!
致力为企业和个人提供合同协议,策划案计划书,学习课件等等
打造全网一站式需求
欢迎您的下载,资料仅供参考。
去除水中钙镁离子方法去除水中钙镁离子是一项重要的水处理工艺,它可以有效地改善水质,减少水垢的堆积,保护设备,同时也对人体健康和环境保护具有重要意义。
钙镁离子是水中常见的硬水成分,其存在会导致水质硬度增加,产生水垢,影响水的使用和设备的寿命。
有效去除水中钙镁离子,已成为水处理工程中的一项重要任务。
目前,常见的去除水中钙镁离子的方法主要包括物理方法和化学方法两种。
物理方法主要包括蒸馏、反渗透和离子交换法。
蒸馏是一种利用水的沸点和不同物质的沸点不同的原理,将水蒸发后再凝结成纯净水的方法。
这种方法能够去除水中的钙镁离子,但由于成本较高,因此在工程应用中并不常见。
反渗透则是一种通过半透膜来分离水中离子和杂质的方法,通过高压将水压力驱动,使得水分子能够通过半透膜而隔离钙镁离子和其他杂质,从而达到去除的目的。
离子交换法是通过特定的树脂将水中的钙镁离子与树脂上的其他离子进行置换,从而去除水中的钙镁离子。
这些物理方法都具有一定的去除效果,但其成本和设备要求较高,限制了其在大规模应用中的推广。
化学方法则主要包括加入螯合剂、沉淀剂和络合剂等化学药剂进行去除。
螯合剂通过与钙镁离子发生配位作用,形成不溶于水的络合物,从而实现去除的目的。
沉淀剂则是通过改变水中的PH值和溶解度平衡,使得钙镁离子沉淀成固体而去除。
络合剂是通过化学络合作用将钙镁离子包裹在有机分子中而去除。
这些化学方法在工程中较为常见,其成本和设备要求相对较低,因此在大规模水处理工程中得到广泛应用。
随着科技的不断进步,新型的去除水中钙镁离子方法也在不断涌现。
利用纳米技术制备的纳米材料,其具有较大的比表面积和特殊的化学性质,可以在水处理过程中高效去除钙镁离子。
电化学方法、超滤等新技术也为去除水中钙镁离子提供了新的途径。
去除水中钙镁离子是一项具有重要意义的水处理工艺。
各种各样的方法都有其特点和应用范围,需要根据具体的水质特点和要求,综合考虑各种因素来选择合适的方法。
edta螯合顺序EDTA螯合顺序是指在给定条件下,不同金属离子和EDTA的配位反应顺序。
EDTA是一种常用的螯合剂,可以与金属离子形成稳定的络合物,广泛应用于化学、生命科学和环境科学等领域。
了解EDTA螯合顺序对于合理选择螯合剂、控制化学反应和解析复杂的化学体系具有重要意义。
EDTA螯合顺序的研究起源于20世纪初,最初主要在铁、铜、镉和钴等金属离子的螯合反应中进行研究。
后来,研究人员逐渐发现,在不同的条件下,EDTA与不同的金属离子形成络合物的顺序也有所不同。
首先,EDTA螯合顺序与金属离子的电荷密度有关。
在相同pH条件下,金属离子的离子半径越大,电荷密度越低,螯合反应的速率越慢,因此螯合顺序也不同。
例如,在pH为7的条件下,EDTA与钙离子的络合常数最大,其次为镁、锰、铜、锌等一系列金属离子。
其次,EDTA螯合顺序还与酸碱度、络合物的稳定性和有机溶剂等因素有关。
在较低的pH下,EDTA的羧基部分更容易负载电子,成为更好的1,10-二恶二胺-4,7-二乙酸(H2EDTA)配体,从而加快了一些金属离子的螯合反应速度。
在有机溶剂中,EDTA更容易与溶剂中的金属离子形成络合物,从而限制了与水相中其他金属离子的反应。
最后,EDTA螯合顺序还受到其他离子和分子的影响。
例如,存在大量阴离子或配体的情况下,EDTA很容易与一些金属离子形成复杂的络合物,从而影响了其他金属离子螯合反应的速度和顺序。
总之,了解EDTA螯合顺序对于控制化学反应、调节金属离子的活性、加工原材料等具有重要意义。
需要强调的是,EDTA螯合顺序是一个复杂的研究领域,涉及到许多物理化学和生物化学方面的知识和实验技术。
只有深入理解和掌握了这些知识,才能更好地应用和发挥EDTA的螯合作用。
钙离子螯合值测定------铬黑T指示剂络合滴定法
准确称取一定量样品(约0.1 g~0.2 g),将其用少量蒸馏水溶解,再移取10 mL氯化钙标准溶液(0.100 moL/L)于上述溶液中,间歇震荡后,加10 ml氨-氯化铵缓冲溶液和3~4滴铬黑T指示剂,然后用0.050moL/L EDTA标准溶液滴定,以溶液从酒红色变为纯蓝色为终点。
以下式计算样品的钙螯合值:
钙离子螯合值C=螯合剂所螯合的CaCO3质量/所用螯合剂质量=100.08×(10C1-C2V)/m
式中C1为CaCl2标准溶液的浓度,mol/L;C2为EDTA标准溶液的浓度,mol/L;
V为滴定时消耗EDTA标准溶液的体积,mL;m为样品质量,g。
表一,室温40℃各种pH值条件下钙离子螯合值汇总:。