醛酮的自身羟醛缩合
- 格式:ppt
- 大小:3.04 MB
- 文档页数:139


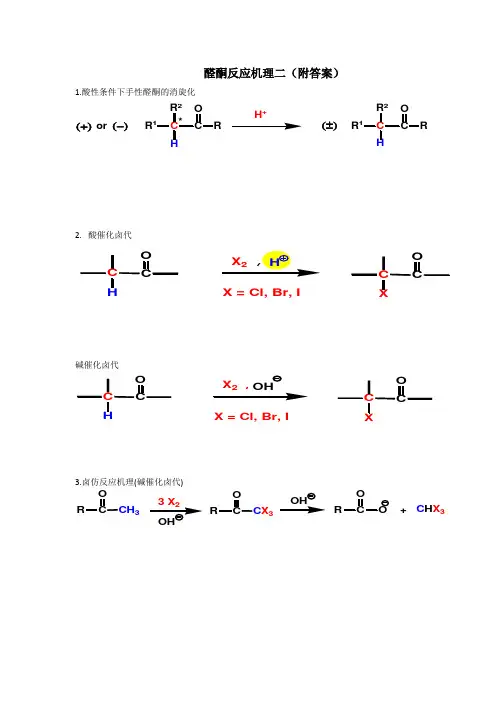
醛酮反应机理二(附答案)1.酸性条件下手性醛酮的消旋化RR 12CRR 1HR 2*H+(±)or (+)(-)2. 酸催化卤代碱催化卤代X,X = Cl, Br, I3.卤仿反应机理(碱催化卤代)3C C X 3CRC H X 3CR+OHX = Cl, Br, I4.羟醛缩合机理羟醛缩合产物的分解机理(羟醛缩合的逆反应)5.酸催化下的羟醛缩合机理:CH3CH3O2H3H3CH CH3+2Al[O(CH3)3]3OOOHOClHCl(Lewis 酸催化)6.Mannich反应(胺甲基化反应)CH 2R'+CH2O H+CHR'2NH1酸催化过氧酸氧化 —— 生成酯 ( Baeyer-Villiger 反应)(“O ”如何插入C -C 键)“O ”插入取代基多的基团一边(取代基多的基团易迁移)R 1R2R 1R 2R 122.Wolff-Kishner 还原酮羰基至亚甲基机理RR'O RCH 2R'NH -NH , Na N 2+3. Meerwein-Ponndorf 还原反应(i-PrO)AlCH 3CHOHCH 3(过量)O R'(H)ROH R'(H)4.醛酮被金属还原至醇或二醇Na or LiRR'(H)RC OH R'RC OH R'RR'O2Mg (Hg)5.Cannizzaro 反应(歧化反应)R浓 OHR RCH 2OH+H +R COOH+RCHPhHOO OHPhC O7. Benzoin 缩合反应(安息香缩合反应)8.Wittig 反应:Ph 32+R 2+Ph 32不饱和醛、酮,1. α, β-不饱和醛酮与亲核试剂的亲核加成反应。
1, 2 – 加成为主(Nu - : 强亲核试剂,如 RLi, 炔基钠, LiAlH4等)1β2. 与亲核试剂的1, 4 – 加成机理α, β-不饱和醛酮与亲电试剂的亲电加成反应 3.α, β-不饱和醛酮的羟醛缩合(插烯规则) 4.Michael加成COCC+碱4. Diels-Alder 反应+例 1:写出下列合成的路线1酸性条件下手性醛酮的消旋化RR 12CRR 1R 2*H+(±)or (+)(-)CO RR 1R R 2H H RR 1C RR 2R 1C R 1R2*2+H 3(±)H H2.酸催化卤代O+CXC烯醇化C HH 2O X+H X碱催化卤代X ,X = Cl, Br, IX = Cl, Br, ICHCXOH3.卤仿反应机理(碱催化卤代)3C C X3CR C H X3CR+OH23R3COHC H X3+2RXCHXX3HOR CHRXX4.羟醛缩合机理羟醛缩合产物的分解机理(羟醛缩合的逆反应)CCHH CHOHCOHO5.酸催化下的羟醛缩合机理:CH3O2H 3H 3CHCH 3+23)3]3O OHHCl(Lewis 酸催化)C HH+CHH +烯醇化H 2OCOH HCHHOH 2OH 2O++H +3O8. Mannich 反应(胺甲基化反应)CH 2+CH 2OR"NR"H+CH R'CH 2NR"HRCHR'H RRHC HHCR"NR"HH2CO HNH2NH2R"NR"OHR CHOHR"NR"CHR"NR"R'1酸催化过氧酸氧化——生成酯(Baeyer-Villiger反应)(“O”如何插入C-C键)“O”插入取代基多的基团一边(取代基多的基团易迁移)R1R2R1O R2R1O R2R1R2RCO O H+R1R2HH OR1C R2O HO+ OR1C R2O HOδ+~ R1OR C R2O HOH++OHR1O R2H+R1O R2(来自过氧酸)R迁移2.Wolff-Kishner 还原酮羰基至亚甲基机理R R'OR CH2R'NH-NH, Na~ 200CN2+R R'ONH2-NH2R C R'ONH-NH2R C R'OHN-NH2HOHRCR'HOH RCR'R CH2R' RCHR'N N HOHRCHR'225.Meerwein-Ponndorf 还原反应(i-PrO)AlCH 3CHOHCH3(过量)OR'(H)ROHR'(H)AlOOCHδRCOCH3C CH3+OH+AlO3)2 3333334.醛酮被金属还原至醇或二醇Na or LiR R'(H)R R'(H)e CO NaCORHR'eHO Na HRC OH RC OH RCR'O2Mg (Hg)自由基二聚RC O RC ORC OH RC OH PinacolH ORR'2eMg RC ORC O6. Cannizzaro 反应(歧化反应)RC OROHOHR +~ H ROO +HRC OH负H 迁移练习R浓 OHR RCH 2OH+H +R COOH+RCHPhHOO OHPhC O9. Benzoin 缩合反应(安息香缩合反应)8.Wittig 反应:Ph 32+R 2+Ph 3Ph 3P2R 2+Ph 3Ph 3C C O RPh 3C C R制备烯烃232OH或CH2Ph3P+3+或PPh3CH3I+PPh3+2CH3I(1) PPh32Ph323不饱和醛、酮共振式,OOE ENu Nu2.α, β-不饱和醛酮与亲核试剂的亲核加成反应。

Aldol反应反应在有机化学中的应用摘要:Aldol反应是一个重要的有机化学反应,它在有机合成中有着广泛的应用。
Aldol反应是指含有活性α氢原子的化合物如醛、酮、羧酸和酯等,在催化剂的作用下与羰基化合物发生亲核加成,得到α-羟基醛酮或酸,或进一步脱水得到α,β-不饱和醛酮或酸酯的反应。
①分子间的羟醛缩合经常被用来合成一些β-羟基化合物,如1,3-丙二醇、l,3-丁二醇和新戊二醇等。
其可作为进一步生产香料、药物等多聚物或聚对苯二甲酸乙二醇酯(PET)、聚对苯二甲酸丁二酯(PBT)和聚对苯二甲酸丙二醇酯(PTT)等高聚物的单体;缩合脱水产物α,β-不饱和醛氧化得到相应的可广泛用作精细化工生产原料的羧酸,如2,2-二羟甲基丙酸可用作水性氨脂扩链剂以及制备聚酯、光敏树脂和液晶,2-甲基-2-戊烯酸是具有水果香味的食用香料,可广泛用于食品加工业和其它日化香精产业;此外,α,β-不饱和醛完全氢化时得到饱和伯醛,可用作溶剂或制造洗涤剂、增塑剂。
②关键词:羟醛缩合有机反应应用Aldol反应的机理:Aldol反应是指含有活性α氢原子的化合物如醛、酮、羧酸和酯等,在催化剂的作用下与羰基化合物发生亲核加成,得到α-羟基醛或酸。
有α氢原子的化合物如醛、酮、羧酸和酯分子中,由于羰基的吸电子诱导作用以及碳氧双键和α碳上碳氢σ键之间的σ-π超共轭效应,使得α碳上氢上的电子云密度较低,具有较强的酸性和活性。
Aldol反应既可以在酸催化下反应,也可以在碱催化下反应。
在酸催化下,羰基转变成烯醇式,然后烯醇对质子化的羰基进行亲核加成,得到质子化的β-羟基化合物。
由于α氢同时受两个官能团的影响,其化学性质活泼,在经质子转移、消除可得α,β-不饱和醛酮或酸酯。
在碱性催化剂下,首先生成烯醇负离子,然后烯醇负离子再对羰基发生亲核加成,加成产物再从溶剂中夺取一个质子生成β-羟基化合物。
得到的β-羟基化合物在碱作用下可失水生成α,β-不饱和醛酮或酸酯。



羟醛缩合反应在有机化学中的应用摘要:羟醛缩合反应是一个重要的有机化学反应,它在有机合成中有着广泛的应用。
羟醛缩合反应是指含有活性α氢原子的化合物如醛、酮、羧酸和酯等,在催化剂的作用下与羰基化合物发生亲核加成,得到α-羟基醛酮或酸,或进一步脱水得到α,β-不饱和醛酮或酸酯的反应。
①分子间的羟醛缩合经常被用来合成一些β-羟基化合物,如1,3-丙二醇、l,3-丁二醇和新戊二醇等。
其可作为进一步生产香料、药物等多聚物或聚对苯二甲酸乙二醇酯(PET)、聚对苯二甲酸丁二酯(PBT)和聚对苯二甲酸丙二醇酯(PTT)等高聚物的单体;缩合脱水产物α,β-不饱和醛氧化得到相应的可广泛用作精细化工生产原料的羧酸,如2,2-二羟甲基丙酸可用作水性氨脂扩链剂以及制备聚酯、光敏树脂和液晶,2-甲基-2-戊烯酸是具有水果香味的食用香料,可广泛用于食品加工业和其它日化香精产业;此外,α,β-不饱和醛完全氢化时得到饱和伯醛,可用作溶剂或制造洗涤剂、增塑剂。
②关键词:羟醛缩合有机反应应用羟醛缩合反应的机理:羟醛缩合反应是指含有活性α氢原子的化合物如醛、酮、羧酸和酯等,在催化剂的作用下与羰基化合物发生亲核加成,得到α-羟基醛或酸。
有α氢原子的化合物如醛、酮、羧酸和酯分子中,由于羰基的吸电子诱导作用以及碳氧双键和α碳上碳氢σ键之间的σ-π超共轭效应,使得α碳上氢上的电子云密度较低,具有较强的酸性和活性。
羟醛缩合反应既可以在酸催化下反应,也可以在碱催化下反应。
在酸催化下,羰基转变成烯醇式,然后烯醇对质子化的羰基进行亲核加成,得到质子化的β-羟基化合物。
由于α氢同时受两个官能团的影响,其化学性质活泼,在经质子转移、消除可得α,β-不饱和醛酮或酸酯。
在碱性催化剂下,首先生成烯醇负离子,然后烯醇负离子再对羰基发生亲核加成,加成产物再从溶剂中夺取一个质子生成β-羟基化合物。
得到的β-羟基化合物在碱作用下可失水生成α,β-不饱和醛酮或酸酯。
③故羟醛缩合从机理上讲,是碳负离子对羰基碳的亲核加成。

醛和酮相关的化学反应
醛酮缩合反应即羟醛缩合反应,是指具有α-H的醛或酮,在碱催化下生成碳负离子,然后碳负离子作为亲核试剂对醛或酮进行亲核加成,生成β-羟基醛,β-羟基醛受热脱水生成α-β不饱和醛或酮。
在稀碱或稀酸的作用下,两分子的醛或酮可以互相作用,
其中一个醛(或酮)分子中的α-氢加到另一个醛(或酮)分子的羰基氧原子上,其余部分加到羰基碳原子上,生成一分子β-羟基醛或一分子β-羟基酮。
这个反应叫做羟醛缩合或醇醛缩合。
通过醇醛缩合,可以在分子中形成新的碳碳键,并增长碳链。

乙醛和丙酮羟醛缩合反应方程式乙醛和丙酮羟醛缩合反应方程式的探讨一、引言乙醛和丙酮羟醛缩合反应(Aldol缩合反应)是有机化学中一种重要的反应类型。
该反应以碳链延伸的方式,使得一个醛或酮分子与另一个醛或酮分子发生缩合,生成一个含有羟醛功能团的β-羟醛。
其方程式如下:\[CH_{3}C(=O)CH_{2}CH_{2}CHO+CH_{3}C(=O)CH_{3}\xrightarrow[ ]{NaOH} CH_{3}C(=O)CH=CHCH_{2}CHO\]二、原理Aldol缩合反应是通过羟醛根离子的形成和进一步的缩合反应进行的。
在反应中,酸碱条件下,α位活泼的羰基与酸碱共存时,羰基中的负电荷会向α位推移,形成羟醇负离子(Enolate离子)。
该负离子可以与另一个羰基发生缩合,从而形成一个α-β-不饱和醛或α-β-不饱和酮。
在乙醛和丙酮羟醛缩合反应中,乙醛中的羟醇负离子与丙酮中的羰基发生缩合,生成一个丙酮羟醛中间体。
中间体在碱性条件下发生前线按替-离子变性(碳负离子的迁移),并自发地水解产生β-羟醛产物,即所谓的乙醛和丙酮羟醛缩合产物。
三、应用1. 药物合成Aldol缩合反应在药物合成中占有重要地位。
在药物研发过程中,合成复杂有机分子时,常常需要利用这一反应来构建不对称的碳框架和引入官能团,以获得目标分子。
2. 生物学中的应用在生物学中,Aldol缩合反应也有很多应用。
在糖酵解过程中,蔗糖发酵成乙醇的过程中,乙醛和丙酮羟醛缩合反应是关键的步骤之一。
该反应还在核酮糖转化酶中发挥着重要的作用。
四、个人观点与理解正如我们所看到的,乙醛和丙酮羟醛缩合反应在有机合成和生物学领域中具有广泛的应用前景。
该反应不仅可以构建复杂的有机分子,还可以合成具有特殊生理活性的分子,为新药开发提供了重要的工具。
从动力学的角度来看,该反应的速率受到多个因素的影响,包括反应温度、溶剂性质和反应物的浓度等。
研究这些因素对反应速率的影响是深入理解和优化该反应的关键。
十一、醛酮影响亲核加成反应速率的因素常见的吸电子基团的吸电子能力:—NO 2 > —COR > —SO 2R > —COOR > —CN > —C 6H 5 > —CH =CH 2 1、羰基碳原子连有基团的体积↑,空间位阻↑,不利于 亲核试剂进攻,反应就越慢。
2、当羰基连有吸电子基时,使羰基碳上的正电性增加,有利于亲核加成的进行,吸电子基越多,反应就越快。
3、羰基上连有与其形成共轭体系的基团时,由于共轭作用可使羰基稳定化,因而亲核加成速度减慢。
4、试剂的亲核性愈强,反应愈快5、亲核试剂的体积对加成的影响LiAlH 4体积小—OH 在e 键稳定,LiBH(sec-Bu)3体积大,—OH 只能在a 键亲核加成反应一、与氢氰酸的加成反应:生成羟基氰1° 反应范围:醛、脂肪族甲基酮。
ArCOR 和ArCOAr 难反应。
2°反应的应用:α-羟基腈是很有用的中间体,它可转变为多种化合物,也是增长碳链的一种方法。
与HCN 加成的难易 电子效应 HCHO 〉RCHO 〉酮空间效应 HCHO 〉RCHO ; RCHO 〉R 2C=O ; 环内酮 〉同碳的烷酮。
二、与饱和亚硫酸氢钠的加成反应:生成羟基磺酸盐COH+ HCN羟基睛αCH 2=C-CN CH 3(CH 3)2CCN OH(CH 3)2CCOOH (CH 3)2CCH 2NH 2OHCH 2=C-COOCH 3CH3COH SO 3NaCSO 醇钠强酸强酸盐 ()(CH 3)3C HOH (CH 3)3C (CH 3)3C OH +LiAlH 490%10%LiBH(S Bu)312%88%主要决定于椅式构象中e 键的稳定.产要是进攻试剂体积庞大反式进攻有利反应的应用 a 鉴别化合物b 分离和提纯醛、酮c 用于制备羟基腈,是避免使用挥发性的剧毒物HCN 而合成羟基腈的好方法。
—SO 3Na 被—CN 取代三、与格式试剂的加成反应:生成各级醇四、与醇的加成反应:生成缩醛或酮 反应的应用: 有机合成中用来保护羰基,在加热条件下用稀酸水解:H +/H 2O 便可还原为原来的醛或酮五、与氨及其衍生物的加成反应六、与磷叶立德的加成反应:生成烯烃R C H ( R' )RC OH H SO 3( R' )O 3RCHO + Na 2SO 3 + CO 2 + H 2O RCHO + NaCl + SO 2 + H 2O 杂质不反应,分离去掉PhCHO 3H 2O PhCHSO 3Na PhCHCN HCl 67%回流OHOH OH C O δδδδC OMgX R 2R C OH +HOMgX无水乙醚R C O +ROH H R C OHHOR半缩醛+R C OR OR 缩醛R C RO +HO CH 2CH 2HO HR CRO O CH 2CH 2+H 2O2B CNOH H BNBNH 2B C N B NH 2OH (羟氨)NH 2NH 2(肼)NH 2NHC 6H 5(苯肼)NH 2NHCONH2(氨基脲)CN OH(肟)C N NH 2(腙)C N NHC 6H 5(苯腙)CNNHCONH 2(缩氨 脲)RR ′-Ph 3P C R R +CO -Ph 3PCR R CO Ph 3P O +CC R′′七、与西佛试剂(品红醛试剂)的反应:区别醛酮常用的方法还原反应一、催化氢化 :还原为醇所有不饱和键均被还原,若要保留羰基,条件为:H 2,5%Pd/C二、金属氢化物为还原剂还原:还原为醇(1)LiAlH4还原①选择性差,是强还原剂,除不还原C=C 、C ≡C 外,其它不饱和键都可被其原; ②不稳定,遇水剧烈反应,通常只能在无水醚或THF 中使用(2)NaBH 4还原 NaBH 4还原的特点:①选择性强(只还原醛、酮、酰卤中的羰基,不还原其它基团。
羟醛缩合是一种有机反应:烯醇或烯醇负离子和羰基化合物反应形成β-羟基醛或者β-羟基酮,然后发生脱水得到共轭烯酮。
羟醛缩合在有机合成当中很重要,它是形成碳碳单键的关键条件之一,罗宾逊成环反应中有一步就是羟醛缩合反应。
羟醛缩合在大学有机化学课程中常作为一个经典构建碳键的反应进行讲解,并用该反应介绍反应机理。
在普通的羟醛缩合反应中,包涵了酮的烯醇对于醛的亲核加成,形成β-羟基酮或者“羟醛”(广泛出现于各种天然产物及药物中的一种结构单元)。
羟醛缩合在生物化学中也同样广泛存在。
羟醛反应自身由醛缩酶催化,然而该反应不是正式的缩合反应,这是因为过程中并未脱除小分子。
反应在醛和酮之间发生(交叉羟醛缩合),或者在两个醛之间发生,则称为Claisen-Schmidt缩合反应。
这些反应都被冠以发现人的名字莱纳·路德维希·克莱森和J.G.施密特。
他们分别于1880和1881年发表了自己在该领域的论文。
机理:
反应的第一步为羟醛反应,第二步为脱水反应即消除反应。
当分子内有活性羧基的情况下,该脱水反应还会伴随脱羧反应。
羟醛加成产物可通过两种机理进行脱水反应:强碱如:叔丁醇钾、氢氧化钾或氢氧化钠通过烯醇机理进行反应,[10]或通过酸-催化进行的烯醇机理进行反应。
酸催化的羟醛反应机理
酸催化的脱水反应
做碱)
碱催化的羟醛反应 (图例使用−OCH
3
碱催化的脱水反应 (这里通常被错写为简单一步,见E1cB消除反应)。
羟醛的缩合-概述说明以及解释1.引言1.1 概述羟醛的缩合是一种重要的化学反应,广泛应用于有机合成领域。
羟醛(也称为醛酮)是一类化合物,含有一个碳氧双键和一个碳氢双键的官能团,具有很强的活性。
羟醛缩合指的是两个或多个羟醛分子之间发生的反应,生成一个更大的分子,并且伴随着碳-碳键的形成。
羟醛缩合反应的机理一般包括羟基的负离子产生、亲核试剂的加成和负离子的消除等步骤。
在缩合反应中,羟醛分子发生自身的缩合,可以通过内部的亲核试剂(如羟基)攻击羰基碳上的电子云,从而形成新的碳-碳键。
羟醛缩合在有机合成中具有广泛的应用。
首先,它可以用于构建碳骨架,生成各种有机化合物,如酮、糖和天然产物等。
其次,羟醛缩合反应还可用于合成杂环化合物,如吡咯、噻吩和咪唑等。
此外,羟醛缩合还可以被用作多步合成中的关键步骤,实现合成目标化合物的合成。
综上所述,羟醛缩合反应在有机化学合成中起着重要作用,具有广泛的应用前景。
对羟醛缩合反应的研究不仅有助于深入理解其反应机理,还为合成新型有机化合物提供了有力的工具。
随着合成化学的不断发展,相信羟醛缩合反应将在未来的有机合成中发挥更大的作用。
1.2文章结构1.2 文章结构本文主要介绍了羟醛的缩合反应。
文章结构如下:1. 引言1.1 概述:简要介绍了羟醛的基本概念和缩合反应的背景。
1.2 文章结构:介绍了本文的整体结构和各个章节的内容。
1.3 目的:明确了本文的目标和意义。
2. 正文2.1 羟醛的定义和性质:详细介绍了羟醛的化学结构、命名规则和一些基本性质。
2.2 羟醛缩合反应的机理:探讨了羟醛缩合反应的基本原理和常见的机理路径。
2.3 羟醛缩合在有机合成中的应用:列举了羟醛缩合在有机合成中的一些重要应用,并说明其在合成中的优势和局限性。
3. 结论3.1 总结羟醛缩合的重要性:总结了羟醛缩合在有机合成中的重要性和广泛应用的现状。
3.2 展望羟醛缩合的未来发展:对羟醛缩合反应的未来发展方向和可能的改进进行了展望。
丙醛的羟醛缩合反应方程式丙醛是一种重要的有机化合物,常用于制药和农药工业中。
它是一种醛类化合物,分子式为CH3CHO,具有强烈的刺激性气味。
在化学反应中,丙醛可以发生羟醛缩合反应,生成2,4-二甲基-3-戊酮。
羟醛缩合反应是一种常见的有机反应,也称为肉桂酸合成反应。
该反应是一种加成-消除反应,通过将醛和羟醛反应形成α, β-不饱和羰基化合物来进行。
丙醛的羟醛缩合反应方程式如下所示:
CH3CHO + CH3OH → CH3CHOHCH(OMe)CH3
该反应需要催化剂存在,一般使用碱金属醇盐或稀酸催化剂。
反应条件通常在室温下进行,反应时间为几小时。
此时,丙醛和甲醇反应生成羟乙醛,然后再通过加成-消除反应生成2,4-二甲基-3-戊酮。
羟醛缩合反应可以合成许多不同的化合物,如肉桂酸、香兰素、黄酮类化合物等。
它是一种重要的有机合成反应,被广泛应用于制药和农药工业中。
在实际应用中,丙醛的羟醛缩合反应需要注意反应条件的选择和催化剂的选择。
此外,反应过程中需要保持反应体系的纯净和稳定,以确保产物的纯度和收率。
总之,丙醛的羟醛缩合反应是一种重要的有机合成反应,具有广泛的应用前景。
我们需要不断地深入研究和探索,在实践中不断改进反应条件和催化剂,为化学工业和生物医药行业做出更大的贡献。
缩合反应第五章缩合技术本章教学设计⼯作任务通过本章的学习及本课程的实训,完成以下三个⽅⾯的⼯作任务:1. 围绕典型药品⽣产过程,会采⽤醛酮缩合法⽣产羧酸酯类产品;2. 利⽤氨甲基化技术⽣产医药中间体;3.会利⽤缩合反应技术进⾏β–苯丙烯酸、β–羟基酸酯、α,β–不饱和酸酯产品的⽣产。
学习⽬标1.掌握醛、酮化合物之间发⽣缩合反应的类型、⾃⾝缩合、交错缩合的概念、主要影响因素、反应机理及在药物合成中的应⽤。
2.掌握活性亚甲基化合物亚甲基化反应(Knoevenagel反应)的主要影响因素及反应条件,了解其在药物合成中的应⽤;3.掌握Perkin反应的反应机理,掌握其主要影响因素及反应条件,了解其在药物合成中的应⽤;4.掌握Reformatsky反应的反应机理,掌握其主要影响因素及反应条件,了解其在药物合成中的应⽤;5.熟悉酯缩合反应的类型,掌握酯—酯缩合反应机理、主要影响因素及反应条件,了解酯缩合反应在药物合成中的应⽤;学时安排课堂教学8学时现场教学4学时实训项⽬项⽬⼀:苯妥英钠的制备(安息⾹缩合)项⽬⼆:维⽣素B6中间体的制备(克莱森缩合的操作)学习⽬标1.掌握缩合技术的概念、常见的重要缩合反应的类型;2.掌握醛、酮化合物之间发⽣缩合反应的类型、⾃⾝缩合、交错缩合的概念、主要影响因素、反应机理及在药物合成中的应⽤。
第五章缩合技术第⼀节醛酮化合物之间的缩合☆⼀、羟醛缩合具有活性α–氢的醛或酮在酸或碱催化作⽤下⽣成β-羟基醛(或酮)的反应称为羟醛缩合。
其通式表⽰如下:1.同分⼦醛、酮⾃⾝缩合(1)反应历程RC H 2CR/OBRC HCR/OHBBHBRC H 2 C C H C R/OR/RO RC H 2 C C H C R/OHR/RO在羟醛缩合反应中,转变成碳负离⼦的醛或酮称为亚甲基组分;提供羰基的醛或酮称为羰基组分。
含α–活泼氢的酮分⼦间的⾃⾝缩合,因其反应活性低,加成过程中和产物的空间位阻⼤,所以其⾃⾝缩合的速度慢,平衡偏向左边。