武汉市医疗器械经营企业现场检查评定表
- 格式:docx
- 大小:54.13 KB
- 文档页数:16

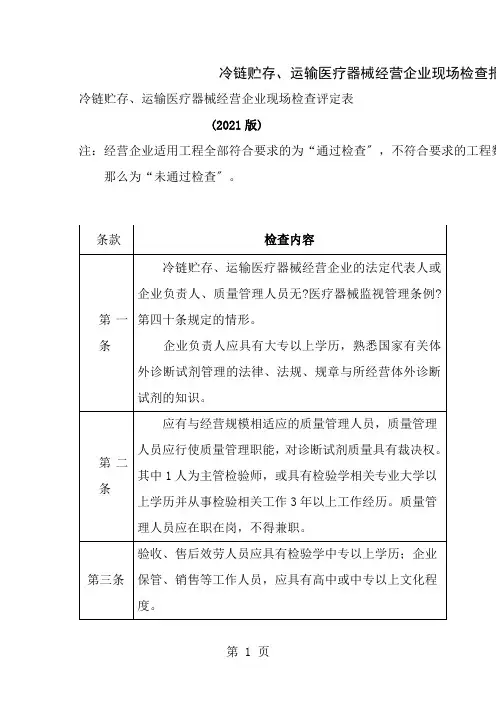
体外诊疗试剂生产公司现场查核评定表条款 查核内容与要求 不切合事实描绘5. 1※ 公司应成立生产管理和质量管理机构。
5. 2公司应明确有关部门和人员的质量管理职责。
一机 5. 3公司应装备必定数目的与产品生产和质量管理相适应的专业管理人员。
构 、5.4人 公司应有起码二名质量管理系统内审员。
员 与管6.1 公司最高管理者应付公司的质量管理负责。
理 职 责6. 2公司最高管理者应明确质量管理系统的管理者代表。
公司最高管理者和管理者代表应熟习医疗器材有关法例并认识有关标 6. 3准。
生产和质量的负责人应拥有医学检验、临床医学或药学等有关专业知 7.1识,有有关产品生产和质量管理的实践经验。
7.2 ※ 生产负责人和质量负责人不得相互兼任。
8.1 从事生产操作和检验的人员应经过岗前特意培训。
8.2应装备专职成品检验员,合格后方可上岗。
拥有专业知识背景或有关从业经验,而且查核对从事高生物活性、 高毒性、 强传染性、 强致敏性等有特别要求的产品9生产和质量检验的人员应进行登记,并保存有关培训记录。
10从事体外诊疗试剂生产的各级人员应按本实行细则进行培训和查核, 合格后方可上岗。
制产设二公司的厂房、环境、设备、设备应与体外诊疗试剂产品生产相适应。
环 备 11※设境 与 施厂区内生产环境应整齐、 厂区周边环境不该付生产过程和产质量量造成12.1影响;生产、行政、生活和协助区布局合理。
控 生 、12.2生产、研发、检验等地区应相互分开。
13.1仓储区要与生产规模相适应,各个地区应区分清楚。
13.2所有物料的名称、批号、有效期和检验状态等表记一定明确。
13.3台帐应清楚明确,帐、卡、物应一致。
仓储地区应保持洁净、14.1入的举措。
干燥和通风,并具备防昆虫、其余动物和异物混对各种物料的仓储环境及控制应切合规定的储藏要求,14.2藏条件应切合生产要求并按期监测。
并按期监测。
冷易燃、易爆、有毒、有害、拥有污染性或传染性、拥有生物活性或根源15.1 ※于生物体的物料的寄存应切合国家有关规定。



为其他医疗器械生产经营企业提供贮存、配送服务的医疗器械经营企业现场检评定表
(2017版)
注:1、经营企业适用项目全部符合要求的为“通过检查”。
有关键项目不符合要求或者一般项目中不符合要求的项目数>10%的为“未通过检查”。
食品药品监管部门根据审查情况,作出是否准予许可的书面决定。
2、关键项目全部符合要求,一般项目中不符合要求的项目数≤10%的为“限期整改”,企业应当在现场检查结束后30天内完成整改并向原审查部门一次性提交整改报告。
经复查后,整改项目全部符合要求的,食品药品监管部门作出准予许可的书面决定;在30天内未能提交整改报告或复查仍存在不符合要求项目的,食品药品监管部门作出不予许可的书面决定。
3、一般项目中不符合要求的项目数比例=一般项目中不符合要求的项目数/(一般项目数总数-一般项目中确认的合理缺项项目数)*100%。
条款53个,其中否决项21个,一般项32个。
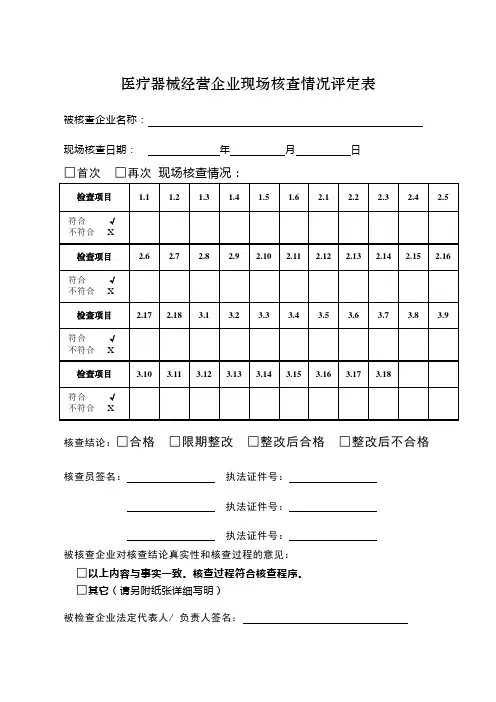
医疗器械物流企业现场检查报告。

医疗器械经销企业现场检查验收标准简介本文档旨在提供医疗器械经销企业现场检查验收的标准,以确保合规性和安全性。
以下是具体的验收标准。
验收标准1. 资质证照:- 经销企业必须具备合法的医疗器械经营资质证照,包括医疗器械经营许可证等。
- 证照的有效期应在商业经营期限内。
2. 库存管理:- 经销企业应建立完善的库存管理制度,确保医疗器械的有效控制和追溯。
- 库房和仓库应符合相关卫生和安全规定,确保器械的储存环境符合标准。
3. 质量管理:- 经销企业应建立质量管理体系,包括制定和执行相关质量控制流程。
- 企业应保证所经销的医疗器械符合国家相关的质量标准,并保证产品的质量和安全性。
4. 交货期和运输:- 经销企业应按照合同约定的交货期供货,并保证产品的安全运输。
- 运输过程中应采取适当的措施,避免产品损坏、变质或受到其他不良影响。
5. 售后服务:- 经销企业应提供优质的售后服务,及时解决客户提出的问题和需求。
- 务必建立客户投诉处理机制,及时处理并回复客户的投诉和意见。
6. 审计和报告:- 经销企业应定期进行内部审核,确保各项管理措施的有效实施。
- 必要时,应向监管机关提交相关经营报告,配合监管工作的开展。
7. 安全教育和培训:- 经销企业应定期进行安全教育和培训,加强员工的安全意识和业务能力。
- 培训内容应包括医疗器械的使用方法、安全操作规程等。
结论医疗器械经销企业现场检查验收标准在资质证照、库存管理、质量管理、交货期和运输、售后服务、审计和报告以及安全教育和培训等方面提供了具体的要求。
经销企业应按照这些标准进行自查,并及时改进不足之处,以确保合规性和安全性。

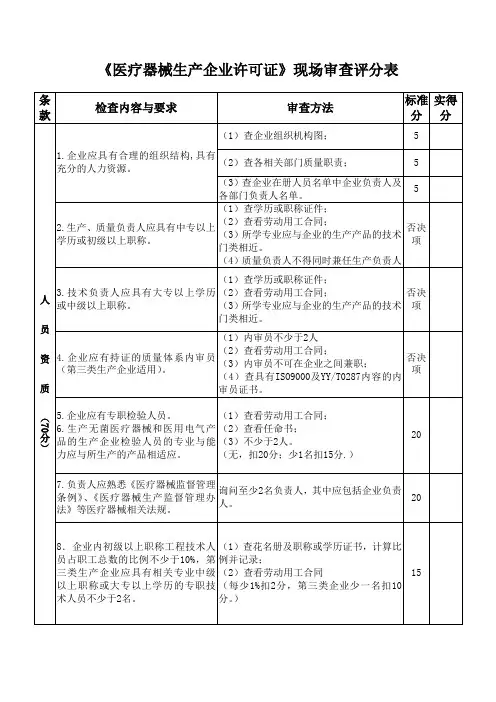
武汉市医疗器械经营企业现场检查评定表
(2017版)
检查要求:1、经营企业适用项目全部符合要求的为“通过检查”。
有关键项目不符合要求或者一般项目中不符合要求的项目数>10%的为“未通过检查”。
食品药品监管部门根据审查情况,作出是否准予许可的书面决定。
2、关键项目全部符合要求,一般项目中不符合要求的项目数≤10%的为“限期整改”,企业应当在现场检查结束后30天内完成整改并向原审查部门一次性提交整改报告。
经复查后,整改项目全部符合要求的,食品药品监管部门
作出准予许可的书面决定;在30天内未能提交整改报告或复查仍存在不符合要求项目的,食品药品监管部门作出不予许可的书面决定。
3、一般项目中不符合要求的项目数比例=一般项目中不符合要求的项目
数/(一般项目数总数-一般项目中确认的合理缺项项目数)*100%。
条款73个,其中否决项22个,一般项51个。
培
三类医疗器械经营许可证现场检查报告。
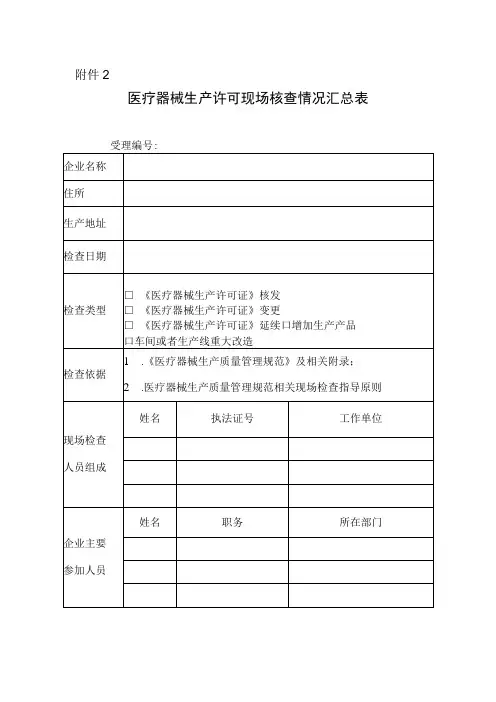
附件1:
医疗器械经营企业监督检查表
2
附件2:
医疗器械经营企业自查表
企业名称(公章):
地址:
—3—
4
附件3:
医疗器械质量安全承诺书
为促进医疗器械行业的健康快速发展,营造公平竞争、守法诚信、优质服务的市场环境,本企业向社会承诺六项内容:
一、坚持公众利益至上原则,商业利益服从于公众利益,加强质量管理,不经营无注册证、无合格证明、过期、失效、淘汰的医疗器械;
二、切实恪守“企业是医疗器械质量安全第一责任人”责任,认真执行质量管理制度,严格自律,规范经营行为;
三、严格依法从事医疗器械经营活动,做到:
1.不从无《医疗器械生产企业许可证》、《医疗器械经营企业许可证》的企业购进医疗器械;
2.不擅自变更注册地址、仓库地址;
3.不擅自扩大经营范围、降低经营条件;
4.不涂改、倒卖、出租、出借或者以其他形式非法转让《医疗器械经营企业许可证》;
5.在接受监督检查时不隐瞒有关情况、不提供虚假材料或者拒绝提供反映经营情况的真实材料。
四、严格医疗器械购销存管理,建立健全质量保证体系。
五、拒绝虚假医疗器械广告,不悬挂或发布虚假广告。
六、建立产品质量跟踪制度、不良事件报告制度,做好售后服务,收集用户意见,及时处理投诉。
以上承诺,请社会各界进行监督,若有违法违规行为,愿接受食品药品监督管理部门调查处罚。
企业名称及公章:
法定代表人签字:
年月日
本承诺保证书一式二份,一份由食品药品监督管理部门存档,一份由企业保留。
—5—。
武汉市医疗器械经营企业现场检查评定表
(2017版)
检查要求:1、经营企业适用项目全部符合要求的为“通过检查”。
有关键项目不符合要求或者一般项目中不符合要求的项目数>10%的为“未通过检查”。
食品药品监管部门根据审查情况,作出是否准予许可的书面决定。
2、关键项目全部符合要求,一般项目中不符合要求的项目数≤10%的为“限期整改”,企业应当在现场检查结束后30天内完成整改并向原审查部门一次性提交整改报告。
经复查后,整改项目全部符合要求的,食品药品监管部门作出准予许可的书面决定;在30天内未能提交整改报告或复查仍存在不符合要求项目的,食品药品监管部门作出不予许可的书面决定。
3、一般项目中不符合要求的项目数比例=一般项目中不符合要求的项目数/(一般项目数总数-一般项目中确认的合理缺项项目数)*100%。
条款 73 个,其中否决项 22 个,一般项51个。