酸性锌锰干电池优点
- 格式:ppt
- 大小:1.19 MB
- 文档页数:18

锌锰干电池反应方程式锌锰干电池是一种常见的干电池,由锌(Zn)和二氧化锰(MnO2)两种材料构成。
在锌锰干电池中,锌是负极,二氧化锰是正极,两者之间通过电解质(通常是氢氧化钾溶液)相连。
在工作过程中,锌被氧化为锌离子(Zn2+),同时放出两个电子(2e-)。
这个反应可以用如下方程式表示:Zn(s) → Zn2+(aq) + 2e-这个反应是氧化反应,锌原子失去两个电子,氧化成锌离子。
在这个反应中,锌是氧化剂,因为它氧化了其他物质,同时自己被还原。
而在正极,二氧化锰接受了锌离子释放出来的电子,同时被还原成二氧化锰酸根离子(MnO4-)。
这个反应可以用如下方程式表示:2MnO2(s) + 2H2O(l) + 2e- → Mn2O3(s) + 4OH-(aq)这个反应是还原反应,二氧化锰酸根离子接受了电子,被还原成氧化锰。
在这个反应中,二氧化锰是还原剂,因为它还原了其他物质,同时自己被氧化。
整个反应可以用如下方程式表示:Zn(s) + 2MnO2(s) + 2H2O(l) → Zn2+(aq) + Mn2O3(s) + 4OH-(aq)在这个反应中,锌被氧化成锌离子,二氧化锰被还原成氧化锰酸根离子。
同时,水(H2O)在反应过程中起到溶剂的作用,氢氧化钾(KOH)起到电解质的作用。
锌锰干电池的工作原理是利用锌离子和氧化锰酸根离子之间的电子转移来产生电流。
当锌离子氧化成锌离子时,自身释放出电子,这些电子通过外部电路流动到正极,然后和氧化锰酸根离子发生还原反应。
这个过程中,电子流动产生了电流,从而供应了外部电路中的设备或装置。
锌锰干电池具有许多优点,例如体积小、重量轻,使用方便,成本低廉等。
它广泛应用于电子设备、遥控器、闹钟等小功率电子设备中。
锌锰干电池的反应方程式描述了锌和二氧化锰之间的氧化还原反应,通过电子转移产生电流,从而提供电力。
这种干电池具有许多优点,被广泛应用于小功率电子设备中。

酸性与碱性干电池 酸性与碱性干电池 以二氧化锰为正极,锌为负极,氯化铵水溶液为主电解液的原电池。俗称干电池。在学术界中又称为勒克朗谢电池。用面粉、淀粉等使电解液成为凝胶,不流动,形成隔离层,或 的种类、电解液的组成和pH值等用棉、纸等加以分隔。锌锰电池的开始电压随使用的MnO 2 的不同而异,一般在1.55~1.75V,公称电压为1.5V。最适宜的使用温度为15~30℃。在-20℃以下的低温条件下,普通锌锰电池不能工作。 锌锰电池便于携带,使用方便,品种齐全,工艺稳定,原料丰富,价格低廉,因而长期保持化学电源产品的主要地位并能持续发展。但是它的比能量低,工作电压稳定性差,尤其在大电流密度放电时更为明显。 锌锰电池用途十分广泛,可作为电话机、信号装置、仪器仪表等所需的直流电源,以及照明、收音机、录放音机、电动玩具、计算器、助听器等日常用电器具的电源。 分类锌锰电池有多种分类方法。 ①按组合方式分:有单体电池、组合电池和复式电池 3类。单体电池按形状又可分为圆筒形、方形和扁平形 3种。根据不同的使用要求,由若干只相同型号的单体电池通过串联或并联组合在一起的称为组合电池。如层叠电池就是一种扁平形单体电池串联组成的组合电池。由两种不同型号的单体电池组合而成的,称为复式电池。各国对于锌锰电池型号的表示方法不尽相同, 其中使用比较普遍的是国际电工委员会第35技术委员会(IEC/TC35)所规定的表示方法。中国采用此法。其要点是:用字母“R”、“S”和“F”分别表示圆筒形、方形和扁平型单体电池;字母后面的阿拉伯数字表示电池的型号,每一型号代表了规定的外形尺寸;组合电池以字母前所置的数字表示串联电池的个数,并联电池的个数置于单体电池型号之后,并用短线分开。如:S4、6F22、3R20-4。复式电池的型号,一般用其所包含的组合电池来表示。 ②按结构分:采用面粉、淀粉和电解液形成的凝胶作为正负极间的隔离层的,称为糊式电池;采用浆层纸为隔离层的称为纸板电池;采用高分子薄膜材料为隔离层的称为薄膜电池。 ③按电解液的成分分:电解液以氯化铵为主体的称为氯化铵型(或铵型)电池;以高浓度氯化锌为主体的称为氯化锌型(或锌型)电池。 ④按电池的放电性能分:有普通品 (S)、高电荷量(C)和高功率(P)3种类型。分别置于电池型号的后面,以示区别。如R6P表示R6高功率电池。 原材料有以下几种。 ①二氧化锰:俗称锰粉。是正极的活性物质,直接参加电化学反应,是决定电池电荷量的主要材料。根据其制备方法可以分为天然二氧化锰、化学二氧化锰和电解二氧化锰。其中电解二氧化锰的电化学活性最高,化学二氧化锰次之。 ②石墨:正极原料之一。有显晶型(俗称鳞片状)和隐晶型(俗称土状)两种。石墨不参加电化学反应,有良好的导电性,具有吸附性和粘着性。掺入电芯中可以提高电芯的导电性。它粘着在多孔锰粉的周围吸收一定量的电液,使电芯保持一定的水分,可充分提高锰粉的利用率。 ③乙炔黑:在正极中的作用与石墨相似。它的比重很小、颗粒较细,平均直径为35~45毫微米,比表面为60~70m2/g,导电性仅次于石墨,分散性、吸水性远优于石墨。 ④锌:负极活性物质,兼作电池的容器和负极引电体,是决定电池贮存性能的主要材料。在锌片中含有少量的镉和铅。镉能增强锌的强度,铅能改进锌的延展加工性能。镉与铅均能提高氢在锌电极上的过电位,减少锌电极的自放电,减缓锌片的腐蚀和氢气的释放。锌片中若含有Cu、Fe、Ni等,将降低H2在锌电极上析出的过电位,加速电池在贮存过程中的自放电,因此这些有害杂质必须严格控制。 ⑤氯化铵:是锌锰电池电解液的主要成分。其作用是:补充放电过程中由于正极反应减少的H+;在正极中也加入一定量的固体氯化铵,以补充放电时电解液中氯化铵的减少;增强电解液的导电性。 ⑥氯化锌:用于电解液中。主要作用有:减缓锌片腐蚀,保持电解液中的水分,破坏淀粉的链状结构,加快电解液的糊化速度,减少正极电芯在放电过程中pH值的提高。 ⑦面粉、淀粉:主要作用是使电解液糊化后成为不流动的隔离层,使它既有良好的离子导电性,又能固定电芯,便于携带使用;对锌片有保护作用,可减缓锌片的腐蚀。面粉比淀粉粘性好,粘附力强,保持水分性能好,不易沉淀。所以在配制电解液时,淀粉、面粉互相搭配使用。 1.酸性干电池 原理锌锰电池的电化学反应可简单地表示为: 正极:MnO2+H++e→MnOOH 负极:Zn+2NH4Cl→Zn(NH3)2Cl2↓+2H++2e 总反应式:Zn+2MnO2+2NH4Cl→2MnOOH+Zn(NH3)2Cl2↓ 由反应式可以看出,正极二氧化锰放电时发生还原反应,使溶液中的H+浓度减少,所以电解液的pH值增高,碱性增大,使二氧化锰电极电位向负的方向移动。负极锌放电时,发生氧化反应,锌电极的浓差极化使锌电极电位向正的方向移动。因此放电时,电池电压下降。酸性干电池中,在放置时锌也会慢慢和酸性物质反应,所以不会有太长的寿命,还有酸性干电池在工作时会有水生成,稀溶液容易从电池中流出,也会导致其寿命变短,还常会腐蚀电器,在电极上出现的氢气和氨气也会影响正常的放电,所以工作性能也不是很好。而碱性干电池就不存在这些问题。 电化学体系的表示式为: 1碱性干电池 碱性干电池的负极材料是锌,正极材料是二氧化锰,电解液是氢氧化钠或氢氧化钾溶液。它的构造中间是由锌粉压制的圆柱状负极,其外缠裹着浸满氢氧化钠或氢氧化钾溶液的纤维材料,再外是由二氧化锰、碳粉及氢氧化钠或氢氧化钾溶液组成的正极。电池的外壳由惰性 金属制成与正极相连,电池的负极通过集电针与电池底部相连。 电池反应 负极反应 Zn+4OH--2e→ZnO22-+2H2O 正极反应MnO2+H2O+2e→MnO+2OH- 总反应 Zn+MnO2+2OH-→ZnO22-+MnO+H2O 碱性电池正常使用电压与常见的酸性锌锰电池相同。碱性电池的寿命长,容量大,内阻小,且不会像酸性干电池那样使用久了会泄漏。

锌锰干电池材质:
锌锰干电池是以二氧化锰为正极,锌为负极,氯化铵水溶液为主电解液的原电池,也称为勒克朗谢电池。
其材质主要包括以下几种:
1.负极材料:锌是负极的主要材料,同时也是电池的容器和引电体。
在电池的贮存过
程中,锌容易发生腐蚀和氢气释放,因此需要加入镉和铅来减缓锌片的腐蚀。
2.正极材料:二氧化锰是正极的活性物质,直接参加电化学反应,是决定电池电荷量
的主要材料。
通常认为放电时,电池中的反应如下:正极为阴极,锰由四价还原为三价;负极为阳极,锌氧化为二价锌离子结合铵根生成二铵合锌离子。
3.电解液:氯化铵水溶液是电池的主电解液,主要作用是补充放电过程中由于正极反
应减少的H+,并在正极中也加入一定量的固体氯化铵以补充放电时电解液中氯化铵的减少。
此外,氯化铵还有增强电解液导电性的作用。
4.其他材料:石墨用于正极,其不参加电化学反应,有良好的导电性,具有吸附性和
粘着性。
乙炔黑在正极中的作用与石墨相似,其比重很小、颗粒较细,平均直径为35~45毫微米,比表面为60~70m2/g,导电性仅次于石墨,分散性、吸水性远优于石墨。
面粉、淀粉使电解液成为凝胶状态,不流动,形成隔离层,或用棉、纸等加以分隔。


锌锰干电池电极反应式酸性碱性2篇锌锰干电池电极反应式酸性篇锌锰干电池是一种常见的干电池,它通常由锌和二氧化锰两个电极以及酸性电解质组成。
在这种电池中,锌被用作负极,而二氧化锰被用作正极。
当电池处于工作状态时,这两个电极会发生氧化还原反应,从而产生电能。
锌电极的反应式为:Zn(s) -> Zn2+(aq) + 2e^-而二氧化锰电极的反应式为:MnO2(s) + 2H2O(l) + 2e^- -> MnO(OH)(s) + 2OH^-综合上述两个反应式,可以得到整个锌锰干电池的反应式:Zn(s) + MnO2(s) + H2O(l) -> Zn2+(aq) + MnO(OH)(s) + OH^- 从反应式可以看出,在锌锰干电池中,锌被氧化为锌离子,而二氧化锰被还原为锰氧化物羟基。
同时,酸性电解质中的水分子也参与了反应,生成了氢氧化锰离子和氢氧化物离子。
在此反应过程中,锌是电子供体,也是电池的负极;二氧化锰则是电子受体,同时也是电池的正极。
当电路外接上负载时,锌离子会从负极离开,通过电解质中的离子迁移,进入到正极;而电子则通过外部电路从正极流向负极,完成了电流的闭合回路。
这样,锌锰干电池就能够产生电能,为我们的日常生活和电子设备提供能源。
锌锰干电池电极反应式碱性篇锌锰干电池是一种常见的干电池,它通常由锌和二氧化锰两个电极以及碱性电解质组成。
在这种电池中,锌被用作负极,而二氧化锰被用作正极。
当电池处于工作状态时,这两个电极会发生氧化还原反应,从而产生电能。
锌电极的反应式为:Zn(s) + 2OH^-(aq) -> Zn(OH)2(s) + 2e^-而二氧化锰电极的反应式为:MnO2(s) + H2O(l) + 2e^- -> Mn(OH)2(s) + 2OH^-综合上述两个反应式,可以得到整个锌锰干电池的反应式:Zn(s) + MnO2(s) + 2H2O(l) -> Zn(OH)2(s) + Mn(OH)2(s) 从反应式可以看出,在碱性条件下,锌被氧化为氢氧化锌,而二氧化锰被还原为氢氧化锰。

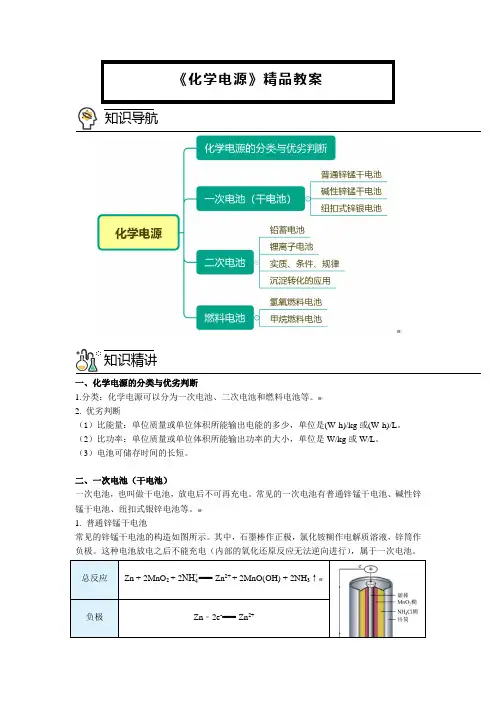
一、化学电源的分类与优劣判断1.分类:化学电源可以分为一次电池、二次电池和燃料电池等。
2. 优劣判断(1)比能量:单位质量或单位体积所能输出电能的多少,单位是(W·h)/kg 或(W·h)/L 。
(2)比功率:单位质量或单位体积所能输出功率的大小,单位是W/kg 或W/L 。
(3)电池可储存时间的长短。
二、一次电池(干电池)一次电池,也叫做干电池,放电后不可再充电。
常见的一次电池有普通锌锰干电池、碱性锌锰干电池、纽扣式银锌电池等。
1. 普通锌锰干电池常见的锌锰干电池的构造如图所示。
其中,石墨棒作正极,氯化铵糊作电解质溶液,锌筒作负极。
这种电池放电之后不能充电(内部的氧化还原反应无法逆向进行),属于一次电池。
总反应Zn + 2MnO 2 + 2NH 4+=== Zn 2++ 2MnO(OH) + 2NH 3↑负极 Zn ﹣2e -=== Zn 2+知识精讲知识导航《化学电源》精品教案2. 碱性锌锰干电池用KOH电解质溶液代替NH4Cl做电解质时,电池的比能量和放电电流都能得到显著的提高。
Zn+ 2OH-﹣2e-==Zn(OH)23. 纽扣式锌银电池锌银扣式电池,以锌为负极,银的氧化物为正极,氢氧化钾(或钠)溶液为电解液的纽扣状微型原电池Zn+Ag2O+ H2O === Zn(OH)2+2Ag三、二次电池有些电池放电时所进行的氧化还原反应,在充电时可以逆向进行,使活性物质获得再生,从而实现放电(化学能转化为电能)与充电(电能转化为化学能)的循环。
这种充电电池属于二次电池,也叫充电电池或蓄电池。
常见的充电电池有铅酸蓄电池、镍氢电池、锂离子电池等,目前汽车上使用的大多是铅蓄电池。
1. 铅蓄电池Pb+PbO2+2H2SO42PbSO4+2H2O阳极PbSO 4+2H2O-2e-===PbO2+4H++ SO42-【答案】Pb + SO42-﹣2e- === PbSO4 PbO2 + 4H+ + SO42-+ 2e- === PbSO4 + 2H2O 2. 锂离子电池工作原理Li1-x CoO2 + Li x C6LiCoO2 + 6C放电总反应Li1-x CoO2+Li x C6=== LiCoO2+ 6C 负极正极充电总反应LiCoO2+ 6C === Li1-x CoO2+Li x C6阴极阳极【答案】LiC6﹣xe-=== 6C+xLi+Li1-x CoO2 + xLi+ + xe-=== LiCoO26C+xLi++xe-=== LiC6LiCoO2 - xe-=== Li1-x CoO2 + xLi+三、燃料电池燃料电池是一种连续地将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置,具有清洁、安全、高效等特点。

锌锰电池的种类
常见的锌锰干电池有以下种类:
1、糊式锌锰干电池,由锌筒、电糊层、二氧化锰正极、炭棒、铜帽等组成。
最外面的一层是锌筒,中央是碳棒;环绕着这根碳棒的是二氧化锰粉与导电材料所构成的混合物,它与碳棒一起构成了电池的正极体。
为防止水分的蒸发,干电池的上部用石蜡或沥青密封。
2、纸板式锌锰干电池,在糊式锌锰干电池的基础上改进而成。
它以不含金属杂质的优质牛皮纸为基,用调好的糊状物涂敷其表面,再经过烘干制成纸板。
纸板式锌锰干电池的实际放电容量比糊式锌锰干电池要高出2~3倍。
标有高性能字样的干电池绝大部分为纸板式。
检测普通锌锰干电池的电量是否充足,通常有两种方法。
第一种方法是通过测量电池瞬时短路电流来估算电池的内阻,进而判断电池电量是否充足;第二种方法是用电流表串联一只阻值适当的电阻,通过测量电池的放电电流计算出电池内阻,从而判断电池电量是否充足。
锌锰干电池的分类:
1.酸性
酸性锌锰干电池是以锌筒作为负极,并经汞齐化处理,使表面性质更为均匀,以减少锌的腐蚀,提高电池的储藏性能,正极材料是由二氧化锰粉、氯化铵及碳黑组成的一个混合糊状物。
2.碱性
碱性锌锰电池简称碱锰电池,它是在1882年研制成功,1912年就已开发,到了1949年才投产问世。
人们发现,当用KOH电解质溶液代替NH4Cl做电解质时,无论是电解质还是结构上都有较大变化,电池的比能量和放电电流都能得到显著的提高。


碱性锌锰干电池简介碱性锌锰干电池是一种常用的化学电池,适用于各种便携式电子设备,如手电筒、遥控器、闹钟等。
它采用碱性电解质和锌、锰两种金属作为正负极材料,通过化学反应将储存的化学能转化为电能。
结构碱性锌锰干电池主要由外壳、正极、负极、隔膜、电解质和密封圈等组成。
外壳外壳是碱性锌锰干电池的外部保护层,通常由金属材料制成,如锡、铝或钢。
外壳的主要功能是保护内部组件免受机械损伤和外部环境的影响。
正极正极是碱性锌锰干电池的一个重要组成部分,通常由二氧化锰(MnO2)和碳混合物组成。
二氧化锰是一种优良的电极材料,具有良好的导电性能和化学稳定性。
负极负极是碱性锌锰干电池的另一个重要组成部分,通常由锌粉和氧化剂(如锰(Ⅳ)氧化物)组成。
锌具有良好的电化学性能,可以作为稳定的负极材料使用。
隔膜隔膜是用于隔离正极和负极的物质,防止两者直接接触引发电化学反应。
常见的隔膜材料包括纤维素、塑料薄膜等。
电解质电解质是碱性锌锰干电池中起到导电作用的物质,通常是由碱性溶液组成,如氢氧化钾(KOH)。
电解质在电化学反应中起到传导离子的重要作用。
密封圈密封圈用于确保碱性锌锰干电池内部的电解质不外泄,同时防止外部空气进入。
常见的密封圈材料包括橡胶和塑料。
工作原理碱性锌锰干电池的工作原理基于电化学反应。
当电池连接到电路上时,正极上的二氧化锰与负极上的锌发生反应,在电解质的作用下,电子从锌流向二氧化锰,同时离子流动,形成电流。
这个过程可以描述为以下化学反应:正极反应:MnO2 + 2H2O + 2e- → Mn(OH)2 + 2OH-负极反应:Zn + 2OH- → Zn(OH)2 + 2e-综合反应:Zn + MnO2 + 2H2O → Zn(OH)2 + Mn(OH)2这个反应过程将储存的化学能转化为电能,从而实现电池的正常工作。
优势和应用碱性锌锰干电池具有以下优势:1.高能量密度:碱性锌锰干电池相比其他类型的干电池具有较高的能量密度,可以提供更长的使用时间。

九种储能电池的优缺点储能电池是一种将电能转化为化学能并储存起来,以供随后使用的设备。
九种常见的储能电池包括铅酸电池、锂离子电池、钠硫电池、镍铁电池、镍氢电池、锌锰电池、锂空气电池、储氢电池和超级电容器。
下面将分别介绍它们的优缺点。
1.铅酸电池:优点:成本低、技术成熟、可靠性高、容量大、适用于低功率应用、可充电。
缺点:能量密度低、体积大、重量大、自放电速度快、充电时间长。
2.锂离子电池:优点:能量密度高、重量轻、体积小、自放电速度慢、可充电、循环寿命长。
缺点:成本高、安全性低、温度敏感、有一定的内阻、充电时间长。
3.钠硫电池:优点:能量密度高、循环寿命长、低自放电率、可在高温环境下工作、可高速充电、可以作为电网储能用于调峰填谷。
缺点:工作温度范围窄、需维持高温状态、成本高、存在温度波动问题、有安全隐患、电流输出不稳定。
4.镍铁电池:优点:循环寿命长、可高速充电、能耐高温、耐振动、成本低、环保。
缺点:比能量低、自放电速度快、体积大、重量大、容量低。
5.镍氢电池:优点:能量密度高、循环寿命长、重量轻、体积小、无污染、环保。
缺点:成本高、充电时间长、自放电速度快、温度敏感、电流输出不稳定。
6.锌锰电池:优点:成本低、安全性高、重量轻、体积小、可高速充电、可在高温环境下工作、适用于低功率应用。
缺点:能量密度低、循环寿命短、容量小、自放电速度快。
7.锂空气电池:优点:能量密度极高、重量轻、可高速充放电、无污染。
缺点:循环寿命短、需稀有金属催化剂、温度敏感、低功率密度、容量小、充电困难。
8.储氢电池:优点:能量密度高、可长期储存氢气、环保、可多次充放电、充电时间短。
缺点:成本高、储氢效率低、容量小、氢气泄漏、安全隐患。
9.超级电容器:优点:充放电速度快、循环寿命长、高效能、高功率密度、无污染、可在低温环境下工作、可多次充放电。
缺点:成本高、能量密度低、容量小、自放电速度快、电压误差大。
综上所述,九种储能电池各有其优缺点,根据不同应用场景的需求,选择合适的储能电池成为一项重要工作。
碱性锌锰干电池碱性锌锰干电池是一种常见的干电池,被广泛应用于各个领域。
它的主要特点是体积小巧、轻便易携带,能够为各种设备提供稳定可靠的电力支持。
本文将介绍碱性锌锰干电池的结构、工作原理、特点以及应用领域。
碱性锌锰干电池的结构主要由阴极、阳极、电解质和外壳组成。
阴极通常由一种含有氧化锌的糊状物质制成,氧化锌是此类电池中的主要活性成分,能够与碳材料形成导电网络。
阳极则由锌粒子和钴氢化物材料构成。
电解质是一种碱性溶液,常用氢氧化钠或氢氧化钾溶液。
外壳通常由金属或塑料材料制成,起到密封和固定电池内部元件的作用。
碱性锌锰干电池的工作原理是通过化学反应产生电流。
当电池连接到外部电路时,阴极的氧化锌与阳极的锌反应,产生电子和离子。
其中,电子通过外部电路向阳极流动,形成电流,而离子则通过电解质在阴极和阳极之间传递,维持化学反应进行。
这种化学反应是可逆的,可以在电池不断供电的情况下进行。
碱性锌锰干电池有着许多优点。
首先,它具有较高的能量密度,能够提供持久的电力支持。
其次,它的自放电率较低,即在不使用时电池能够保持较长的寿命。
此外,碱性锌锰干电池还具有较低的成本、良好的安全性能以及良好的环境适应性。
这些特点使得碱性锌锰干电池广泛应用于各种便携式电子设备、玩具、遥控器、闹钟等小型电子设备上。
除了家用设备,碱性锌锰干电池在军事、医疗和工业领域也有重要的应用。
在军事领域,它被广泛应用于各类装备和通信设备,为士兵提供可靠的电力支持。
在医疗领域,它被用于医用器械、电子治疗设备等,为医护人员提供必要的电力支持。
而在工业领域,它被用于各种计量仪器、自动化设备、传感器等,为工业生产提供电力支持。
尽管碱性锌锰干电池具有许多优点,但它也存在一些限制。
首先,它的输出电压相对较低,对一些高功率设备而言可能不足以满足要求。
其次,由于其内部化学反应的特性,碱性锌锰干电池在高温或低温环境下的性能可能受到限制。
此外,由于电池内部含有一些化学物质,如锌和钴,对环境造成污染的风险需要引起重视。
锌锰电池反应式锌锰电池是一种常见的原电池,其反应式为:2MnO2 + Zn → Mn2O3 + ZnO其中,MnO2为二氧化锰,Zn为锌,Mn2O3为三氧化二锰,ZnO 为氧化锌。
反应机理在锌锰电池中,二氧化锰(MnO2)和锌(Zn)是两种活性物质。
当它们接触时,发生了以下反应:Zn → Zn2+ + 2e-MnO2 + H+ + e- → MnOOH这些反应将产生电子和离子,并导致电流的流动。
在这个过程中,离子通过溶液中的离子交换膜移动。
随着时间的推移,二氧化锰被还原成三氧化二锰(Mn2O3),同时氧化锌被还原成金属锌(Zn)。
这些还原反应如下所示:MnOOH → Mn2O3 + H2O + e-ZnO + H2O + 2e- → Zn + 2OH-这些还原反应维持了正极和负极之间的电位差,并维持了电池的运行。
优点和缺点与其他类型的电池相比,锌锰电池具有以下优点和缺点:优点:1. 长寿命:锌锰电池的寿命比其他类型的电池更长。
2. 低成本:由于其简单的设计和制造过程,锌锰电池比其他类型的电池更便宜。
3. 安全性高:锌锰电池不会泄漏有害化学物质,因此使用起来更加安全。
缺点:1. 低能量密度:与其他类型的电池相比,锌锰电池的能量密度较低,因此需要更频繁地更换。
2. 不可充电:由于其设计和化学反应机制,锌锰电池不能充电。
应用由于其长寿命、低成本和高安全性,锌锰电池被广泛应用于各种设备中。
以下是一些常见应用:1. 手动闪光灯2. 遥控器3. 闹钟4. 烟雾探测器5. 备用电源6. 数字相机7. 智能手表8. 温度计总结在现代生活中,我们经常使用各种类型的电池。
其中之一是锌锰电池。
这种原始的化学反应机制可以提供持久的电力,使其成为许多设备的理想选择。
虽然它具有一些缺点,但优点仍然使其成为许多应用中的首选电池。
znmno2干电池反应式ZnMnO2干电池反应式一、引言干电池是一种常见的便携式电源,被广泛应用于各个领域。
其中,ZnMnO2干电池作为一种重要的碱性锌锰电池,具有体积小、重量轻、使用方便等优点,被广泛用于电子产品、家用电器、玩具等领域。
本文将从反应式的角度,探讨ZnMnO2干电池的原理与特点。
二、ZnMnO2干电池的反应式ZnMnO2干电池的反应式可简化为以下两个半反应:1. 阳极反应:Zn(s) → Zn2+(aq) + 2e-2. 阴极反应:2MnO2(s) + H2O(l) + 2e- → Mn2O3(s) + 2OH-(aq)三、反应机理ZnMnO2干电池的工作原理基于两个半反应的相互作用。
在阳极,锌(Zn)通过放电反应氧化成锌离子(Zn2+),同时释放出电子。
而在阴极,二氧化锰(MnO2)与水(H2O)以及电子发生还原反应,生成三氧化二锰(Mn2O3)和氢氧根离子(OH-)。
两个半反应通过电解质(通常为碱性电解质)中的离子传导实现电子的流动,从而产生电能。
四、特点与优势1. 高能量密度:ZnMnO2干电池具有较高的能量密度,能够在小体积的情况下提供持久的电力供应,适用于需要长时间使用的电子设备。
2. 长寿命:由于ZnMnO2干电池采用碱性电解质,相对于其他类型的干电池而言,其寿命更长,能够提供更持久的电能。
3. 耐高温性能好:ZnMnO2干电池具有较高的工作温度范围,可在-20℃至60℃的环境下正常工作,适用于各种气候条件下的使用。
4. 低自放电率:ZnMnO2干电池的自放电率较低,即在长时间不使用的情况下,电池内部的电能损失较小,能够更好地保存电能。
5. 环保节能:与一次性碱性电池相比,ZnMnO2干电池可重复使用,减少了电池废弃物的产生,对环境更加友好。
五、应用领域1. 电子产品:ZnMnO2干电池广泛应用于电子产品,如遥控器、手持游戏机、计算器等,为这些设备提供可靠的电力支持。