药用乳糖在一致性评价的事例
- 格式:pdf
- 大小:115.76 KB
- 文档页数:3

.320.中国抗生素杂志2019年3月第44卷第3期文章编号:1001 -8689(2019)03-0320-07乳糖酸阿奇霉素注射液质量评价侯金凤寇晋萍王光裕 刘照振李垠车宝泉李文东"(北京市药品检验所,中药成分分析与生物评价北京市重点实验室,北京102206)摘要:目的评价乳糖酸阿奇霉素注射液的质量。
方法按国家评价性抽验的总体要求,釆用法定标准检验方法与探索性研究相结合,对抽验样品进行研究,统计分析检验结果。
结果 按现行质量标准检验6批次样品,合格率为100%=探索性研究建立了专属性强、灵敏度高、简便快速的HPLC 法测定有关物质和含量。
杂质研究表明注射液中降解产物未知杂质III 为注射液中特有杂质,含量远超出限度;注射液中杂质含量显著高于注射用粉针制剂和原料,注射液pH 值在6.0-7.0范围内以及低温贮藏 条件下降解程度相对降低,但不能抑制降解过程;应用高分辨质谱对未知杂质进行了结构确证和来源分析;已知杂质活性研究 提示仅少部分杂质具有一定抑菌活性。
结论 目前乳糖酸阿奇霉素注射液的产品质量状况差,现行质量标准需提高。
注射液产 品中杂质显著高于注射用粉针制剂和原料,对现有条件的优化不能有效避免降解反应的发生,该剂型安全性存在较大风险。
关键词:乳糖酸阿奇霉素注射液;有关物质;质量评价;剂型合理性中图分类号:R97&1, R917 文献标志码:AQuality assessment of azithromycin lactobionate injectionHou Jin-feng, Kou Jin-ping, Wang Guang-yu, Liu Zhao-zhen, Li Min, Che Bao-quan and Li Wen-dong(Beijing Key Laboratory of Analysis and Evaluation on Chinese Medicine, Beijing Institute for Drug Control, Beijing 102206)Abstract Objective To evaluate the quality of azithromycin lactobionate injection. Methods According to the general requirements of national drug assessment programs, the statutory standard methods combined with exploratory researches were used to evaluate the quality of azithromycin lactobionate injection, and the results were analyzed statistically. Results All of the six batches of samples met the requirements of current specification. HPLC methods which were highly specific, sensitive and simple for the determination of related substances and content were established in the exploratory research. The impurity study results indicated that the unknown impurity III in the injection was a characteristic impurity, and the content was much higher than the limit. The total impurity content in收稿日期:2018-11-20作者简介:侯金凤,女,生于1985年,博士,主管药师,主要研究方向为抗生素类药物分析及质量控制研究,E-mail: houjinfeng_21@ •通讯作者,E-mail: sxlwd76@第一作者:侯金凤,2004—2008年就读于中国药科大学,获理学学士学位,2008-2013年就读于北京协和医学院(清华大学医学部),获理学博士学位,2013年至今就职于北京市药品检验所。


汇总:292个一致性评价药品的批文数量
导读月初,CFDA公布了关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》的有关事项(征求意见稿),要求凡在2007年10月1日前批准上市的、列入国家基本药物目录(2012年版)中的化学药品仿制药口服固体制剂,原则上应在2018年年底前完成一致性评价。
随着首批仿制药一致性评价292种基药目录药品清单出炉,各种话题热议不断。
尽管一致性评价、292种基药目录已成为烂熟于心的医药热搜词,但业内人士真正被问到292个品种具体批文数量有多少,从中能读懂什么,恐怕无从可知。
近日,药智君通过对药智药品注册与受理数据库数据统计,292种基药目录药品的批文总数共计20815份批文,排名前20的药品有10338份,约占比例50%。
其中,中间品种(批文数量排名为146)批文数量仅17份。
此外,笔者还发现了一些新的信息,之前不少行业人士片面认为品种序号是CFDA随意排列的,其实不然。
图表显示,292个品种批文数量的排名与国家既定的原文序号基本相似,前20位则完全一致。
从排序这件小事不难读懂CFDA对批文数量的良苦用心和高度关注。
292个品种的批文数量排名(左)及原文序号(右)。

仿制药一致性评价定义仿制药一致性评价是指对已经批准上市的仿制药,按与原研药品质量和疗效一致的原则,分期分批进行质量一致性评价,就是仿制药需在质量与药效上达到与原研药一致的水平。
药学研究是指通过体外溶出等分析方法对药物进行药学分析,其目的在于考察制剂的生产工艺及处方是否有需要变更,初步确认制剂与原研药的一致性。
生物等效性(bioequivalency , BE )是指在同样试验条件下试验制剂和对照标准制剂在药物的吸收程度和速度的统计学差异。
当吸收速度的差别没有临床意义时,某些药物制剂其吸收程度相同而速度不同也可以认为生物等效。
一站式服务我司作为提供专业的医药科技公司,能够提供包括:1、药学研究(CMC):包括:制剂处方工艺、质量研究(杂质及溶出曲线等)、稳定性考察等完整的药学研究过程2、生物等效性(BE):包括:寻找合作临床机构、招募受试者采血、生物样品测试及分析、数据管理及统计分析等全过程的服务3、需要进行大临床试验的品种,按照2017年已经颁布的指导原则,参照Ⅱ期、Ⅲ期临床试验的经验,提供整个临床试验的组织及监查管理服一致性评价(CMC&BE)的主要工作内容第一阶段:项目评估◆项目的市场价值◆竞争品种的多少◆是否有参比制剂◆评估需要的费用和周期◆咨询相关官员与专家◆项目立项确定进行BCSⅠ类或者Ⅲ类豁免BE的申请:高渗透性的数据与文献支持材料、体外溶出曲线数据的提供与分析,如果能够满足CFDA的2016年87号文《人体生物等效性试验豁免指导原则》就可以豁免BE研究。
第二阶段:药学研究(CMC)◆参比制剂的选择及备案◆购买参比制剂◆与参比制剂的质量对比(主要包含溶出曲线和杂质)◆药学等效判定◆处方工艺等的二次开发◆溶出曲线的对比◆处方工艺的确定及中试放大◆三批中试产品的工艺验证◆中试样品的质量和参比制剂的一致◆API的溶解性和渗透性研究(限BCS Ⅰ和BCS Ⅲ类)◆制剂稳定性和包装考察◆申报资料的撰写及整理,提供原始记录第三阶段:BE研究API的BCS分类属于Ⅱ和Ⅳ的产品必须进行BE研究,不能够豁免;BCSⅠ类或者Ⅲ类,符合豁免BE的条件可以不进行BE研究,否则就必须进行BE研究.◆BE研究方案的制定◆统计分析计划的制定◆Ⅰ期临床基地、生物样品测试单位等的确定◆伦理委员会的审核◆在CDE的BE备案◆生物样品分析方法的验证◆招募受试者◆服用药物及生物样品的采集◆生物样品的分析◆数据管理及统计分析◆撰写总结报告。

2024年药用乳糖市场发展现状摘要本文对药用乳糖市场的发展现状进行了综合分析,包括市场规模、增长趋势、竞争态势和影响因素等方面进行了深入探讨。
通过对相关数据的分析和对市场趋势的预测,得出了一些结论和建议,旨在为药用乳糖市场的进一步发展提供参考。
1. 引言乳糖是一种重要的生物活性物质,具有多种医疗和保健功能。
药用乳糖作为乳糖的一种衍生品,具有更强的药理活性和更好的生物利用度,因此在药品制造和医疗保健领域得到广泛应用。
本文将对药用乳糖市场的发展现状进行详细分析。
2. 市场规模及增长趋势药用乳糖市场的规模在过去几年中逐渐扩大,预计在未来几年将继续保持增长。
根据市场调研数据显示,2019年全球药用乳糖市场规模达到X亿美元,而2025年预计将达到X亿美元,年复合增长率为X%。
3. 市场竞争态势药用乳糖市场存在着激烈的竞争态势。
目前,市场上主要的竞争者包括国内外的药品制造企业、乳糖生产企业以及医疗保健公司。
这些企业通过不断创新、技术改进以及市场营销手段争夺市场份额。
此外,在全球范围内,药用乳糖市场呈现出分散化的竞争格局,各个地区都有一定规模的市场份额。
4. 影响因素药用乳糖市场的发展受到多种因素的影响。
首先,人们对保健品和药品的需求增加,使得药用乳糖市场得以扩大。
其次,医疗和保健行业的快速发展,推动了药用乳糖的需求增长。
另外,政府对药品和保健品行业的监管政策也会对市场的发展产生一定影响。
5. 市场前景及建议药用乳糖市场在未来几年将继续保持良好的增长势头。
随着人们对健康意识的提高和医疗保健需求的增加,药用乳糖市场有望进一步扩大。
为了在市场竞争中取得优势,企业可以加强产品研发和创新,提高产品质量和功能。
此外,积极开拓新市场、拓展销售渠道也是企业发展的重要策略。
结论综上所述,药用乳糖市场在全球范围内呈现出良好的发展势头。
市场规模不断扩大,竞争态势激烈。
企业在抓住市场机遇的同时,也要注重产品质量、创新和市场营销,以取得竞争优势。

一致性评价案例展示——奥美拉唑肠溶胶囊-片制剂处方根据原研产品的信息以及相关文献报道,原研产品采用的为微丸包衣膜控肠溶工艺,工艺较为复杂,对生产设备要求也比较高。
溶出曲线奥美拉唑肠溶胶囊的设计思路是使制剂在pH 值为 1.2 的介质溶出2h释放量≤5%,而在pH值为6.8 的介质中在规定的时间内释放量≥85%,考虑到溃疡患者肠道pH 值降低以及奥美拉唑在酸性条件下的不稳定性,故制备的肠溶制剂应该是在pH值为6.0 的介质中能缓慢释放药物。
肠溶制剂的释药行为与其处方、工艺密切相关。
因此,考察不同释放介质和条件下的药物释放行为对研究肠溶制剂的质量尤为重要。
文献“国产奥美拉唑肠溶胶囊与原研制剂的体外释放度比较”报道了五种国产奥美拉唑肠溶胶囊和原研制剂的溶出曲线对比,具体如下:在pH 为1.2 的氯化钠盐酸溶液中,5 个生产厂家的奥美拉唑肠溶胶囊均具有较好的耐酸性。
在纯化水中,Losec、A、C 在纯化水中释放度小于10%,释放度较小,B 和D 在纯化水中的释放度较大。
在pH 6.0 的磷酸盐缓冲液中,结果表明,在pH为6.0 的磷酸盐缓冲液中,在两种转速条件下,Losec 的释放速度最快,释放曲线最早达到平台期;其中样品A和C在60 min时的累积释放度低于5%;在100 r·min-1条件下样品B、D 在45 min时的累积释放度与Losec相近,但在50 r·min-1条件下国产制剂的累积释放度均低于Losec。
在pH 6.8 的磷酸盐缓冲液中,结果表明,在pH为6.8 的磷酸盐缓冲液中,在两种转速条件下,Losec 的释放速度最快,释放曲线最早达到平台期;在100 r·min-1条件下,样品A、C、D 在45 min时的累积释放度高于Losec,而在50 r·min-1条件下国产制剂的累积释放度均低于Losec。
部分国产奥美拉唑肠溶胶囊的体外释放行为与原研制剂相比存在一定的差异,这可能会导致制剂在体内生物利用度的差异。

中国药用乳糖行业市场分析报告1. 引言本文是针对药用乳糖市场的分析报告。
首先,我们将介绍药用乳糖的定义和用途。
然后,我们将探讨药用乳糖市场的规模和增长趋势。
最后,我们将分析药用乳糖市场的竞争环境和未来发展的机遇和挑战。
2. 药用乳糖的定义和用途药用乳糖是一种特殊的乳糖产品,其用途主要集中在制药行业。
乳糖是乳制品中的主要成分之一,但由于某些人群对乳糖过敏或消化不良,因此需要制造出可用于药品生产的乳糖产品。
药用乳糖在药品制造过程中起到了一定的辅助作用,具体用途包括粉状药剂的稀释剂、制造固体制剂的辅料等。
3. 市场规模和增长趋势3.1 市场规模根据市场调研数据,药用乳糖市场在过去几年中保持稳定增长。
2019年,全球药用乳糖市场规模达到X亿美元。
3.2 市场增长趋势药用乳糖市场的增长主要受以下因素影响:•药品产业的快速发展和不断升级,推动了药用乳糖市场的需求增加。
•人口老龄化问题日益严重,需要更多的药品来满足老年人的健康需求,进而推动了药用乳糖市场的增长。
•消费者对于健康食品和保健品的需求不断增加,进一步推动了药用乳糖市场的发展。
4. 竞争环境分析4.1 主要竞争对手药用乳糖市场存在几家主要竞争对手,包括但不限于以下企业:•公司A•公司B•公司C4.2 竞争力分析竞争对手在产品品质、供应链、渠道网络等方面表现出不同的优势。
公司A在产品品质上具有一定的优势,公司B在供应链管理上具备竞争力,公司C则在渠道网络拓展方面占据一定优势。
5. 未来机遇和挑战5.1 机遇随着全球医疗服务的不断改善和需求的增加,药用乳糖市场将迎来更多的机遇。
一方面,药用乳糖作为药品生产的辅助材料,在医药领域有着广阔的应用前景。
另一方面,随着健康食品和保健品市场的发展,药用乳糖作为一种健康食品成分也具备一定的增长潜力。
5.2 挑战然而,药用乳糖市场也面临着一些挑战。
首先,市场竞争激烈,需要企业提高产品质量和竞争力。
其次,药用乳糖生产过程复杂,需要符合严格的药品生产标准,这也对企业的生产能力和质量控制提出了更高的要求。

附件:
乳糖
Rutang
Lactose Monohydrate
定项下的方法试验,记录色谱图至主成分峰保留时间的2 倍。
供试品溶液的色谱图中除溶剂峰以外,如显杂质峰,各杂质峰面积的和不得大于对照溶液主峰面积的0.5 倍(0.5%)。
蛋白质与杂质吸光度取本品,精密称定,加温水溶解并定量稀释制成每1ml 中含100mg 的溶液,照紫外-可见分光光度法(通则0401),在400nm 的波长处测定吸光度,不得过0.04。
再精密量取上述溶液1ml,置10ml 量瓶中,加水稀释至刻度,照紫外-可见分光光度法(通则0401),在210~220nm 的波长范围内测定吸光度,不得过0.25;在270~300nm 的波长范围内测定吸光度,不得过0.07。
蛋白质
干燥失重取本品,置硅胶干燥器内,在80℃干燥2 小时,减失重量不得过1.0%(通则0831)。
水分取本品,以甲醇-甲酰胺(2:1)为溶剂,照水分测定法(通则0832 第一法1)测定,含水分应为4.5~5.5%。
炽灼残渣取本品,依法检查(通则0841),遗留残渣不得过0.1%。
重金属取本品3.0g,加温水20ml 溶解后,再加醋酸盐缓冲液(pH3.5)2ml 与水适量使成25ml,依法检查(通则0821 第一法),含重金属不得过百万分之五。
砷盐取炽灼残渣项下残留物,加水23ml 溶解后,加盐酸5ml,依法检查(通则0822 第一法),应符合规定(0.0002%)。

22种药用辅料微生物计数方法验证王珍; 陈莉英; 陆雯; 吴岳琴【期刊名称】《《临床检验杂志(电子版)》》【年(卷),期】2018(007)004【总页数】2页(P611-612)【关键词】微生物计数; 方法验证; 药用辅料【作者】王珍; 陈莉英; 陆雯; 吴岳琴【作者单位】绿城农科检测技术有限公司浙江杭州310051【正文语种】中文【中图分类】R927.33非无菌药品中污染的某些微生物可能导致药物活性降低甚至丧失疗效[1]。
药品尽管有良好的生产管理规范,但控制辅料的微生物水平也是影响成品微生物指标的关键因素之一。
而对于检查方法,因各种药用物料中某些成分含抑菌作用,常规方法结果可能不准确,根据《中国药典》( 2015版)的规定,供试品检查时,应根据其理化特性等因素选择计数方法,且适用性须经确认。
在仿制药一致性评价过程中,辅料作为药品关键质量属性也越来越重要[2]。
目前关于中西药制剂的微生物限度检查方法研究较多[3],对药用辅料的研究相对少。
而对有些企业开展验证工作存在时间、人力和技术上的难度。
实验研究建立并验证了22种常用药用辅料微生物计数方法,为药用辅料的生产单位建立有效可行的微生物计数方法提供科学依据。
1 材料与方法1.1 材料与仪器1.1.1 样品樱桃香精(20160316、20170320、20180205)购于杭州天使香料香精有限公司;乳糖(1711001、171102、171103)购于江苏道宁药业有限公司;硬脂酸(20180117、20180206、20180312)、硬脂酸镁(20170305、20171105)羟丙基甲基纤维素(20171215)、微晶纤维素(20140442、20140204、20140146)购于湖州展望药业有限公司;玉米淀粉(20170108、20170518、20180318)购于辽宁东源药业有限公司);糖精钠(170214、150608)购于湖南华纳大药厂股份有限公司;无水枸橼酸(100820170201、100820180201、100820180301)购于湖南尔康制药股份有限公司;滑石粉(1610106、1705130、1710009)购于广西龙胜华美滑石开发有限公司;胭脂红(12116018)购于上海染料研究所;70%山梨醇溶液(1177F、1989E、1795E)购于罗盖特(中国)精细化工有限公司;聚乙烯吡咯烷酮(PVP)K30(G62456PTO、63278275LO、G41607P70)、K25(0654705680、48709097V0、4870909720)、K90F(48415716K0、83370488Q0、62522116K0)、聚乙二醇6000(DEA4004742、DEA4005192、DEA4005276)、二氧化钛(60610、60704、60689)羟乙基纤维素(K0575、K1385、L0871)、胭脂红(423434、160961)、交联羧甲基纤维素钠(TN11823680、TN10821441)购于上海运宏化工制剂辅料技术有限公司;丙烯酸乙酯-甲基丙烯酸甲酯共聚物水分散体(NE30D)(B201320602、B130212003、B12012078)购于赢创特种化学(上海)有限公司;2号胶壳(12840154、12838128、12837714)购于浙江药联胶丸有限公司;无水胶性二氧化硅(153061714、153091414、153030814)购于上海风鸿药用辅料技术有限公司。

仿制药口服固体制剂质量和疗效一致性评价药学审评案例分析仿制药口服固体制剂的质量和疗效一致性评价是保障仿制药品质量和治疗效果的重要环节。
药学审评是评价药物原料、质量标准、制剂工艺以及药品疗效等方面的一项专业工作。
本文将通过对一例仿制药口服固体制剂质量和疗效一致性评价的药学审评案例进行分析,以展示该评价过程的具体内容。
案例背景:公司生产的仿制药口服固体制剂X与原研药物Y具有相同的活性成分和剂型,且疗效等同。
公司提交了仿制药口服固体制剂X的质量和疗效一致性评价申请,需要进行药学审评。
审评过程:1.药物成分分析:首先要对仿制药口服固体制剂X的活性成分进行分析,以验证其与原研药物Y的成分一致性。
通过质谱、红外光谱等分析技术进行定性和定量分析,比对结果与原研药物Y进行验证。
2.质量标准比对:将仿制药口服固体制剂X的质量标准与原研药物Y 进行对比,对比包括活性成分含量、杂质含量、溶解度以及其他药物特性指标。
若仿制药与原研药物在质量标准上存在差异,需要进一步评估其对药物的疗效影响。
3.制剂工艺评估:通过对仿制药制剂工艺进行评估,包括原料的选择和处理、生产工艺流程、包装材料等方面的审查,以确保其与原研药物的制剂工艺一致性。
4.固体制剂性能评价:对仿制药口服固体制剂的理化性质进行评价。
包括制剂的外观、尺寸、均匀性、重量变化、溶解度、溶出度等性质评估,并与原研药物进行对比分析。
5.体外释放试验:通过体外释放试验,评估仿制药口服固体制剂X与原研药物Y在释放速度方面的一致性。
通过体外释放试验的结果,可以得到制剂的释放曲线,判断仿制药口服固体制剂在体内的溶解和吸收情况。
6.体外生物等效性评价:最后,通过体外生物等效性评价,评估仿制药口服固体制剂X与原研药物Y在疗效方面的一致性。
根据体外生物等效性评价的结果,可以得到仿制药口服固体制剂X的药动学和药效学参数,并与原研药物进行比较。
综上所述,仿制药口服固体制剂的质量和疗效一致性评价是一项综合性的工作,需要对药物成分、质量标准、制剂工艺、固体制剂性能等方面进行评估和对比分析。

仿制药一致性评价中晶型问题全汇总药物晶型是这几年国内做仿制药的一个热门方向,尤其是仿制药的一致性评价工作开展过后,对晶型的研究更是如火如荼,各仿制药厂都开始着手研究原研的晶型,力图使自己的产品与原研的在晶型上保持一致,从而减少在一致性评价上的弯路。
晶型最头疼的无非就是:1、不一致到什么程度,是完全另一个晶型,还是混晶,这可能就得定量了,至少半定量;2、晶型变了,对溶解度有无影响?对溶出有无影响,是何种影响?对稳定性有无影响,是何种影响?对粒径、比表面积有无影响,粒径影响了之后会不会影响工艺,是何种影响?如有影响,如何通过调整处方工艺消除这些影响,达到和原研质量一致?这里面需要研究和说明的内容可就比较多啦;3、从技术上看,说明“晶型不一致”和“晶型一致”难度上是没有什么区别的,都是需要挑战制剂中晶型鉴定这个课题的,都是需要对晶型有深入的研究的。
首先谈下各国药典中对晶型的一些要求在USP、EP、中国药典中,晶型的确认和测定方法基本一致,包括了绝对测定法X单晶衍射,以及相对测定法X粉末衍射、红外、DSC、TG、熔点、拉曼等。
在中国药典中,以上检测项目各有归属。
红外、X粉末衍射归属在鉴别中,熔点归属在性状中。
在USP、EP中的鉴别项目中也有红外的检测,但描述与中国药典不一样。
1、红外,随便找到一个品种中国药典中红外鉴别这样描述:本品的红外光吸收图谱应与对照的图谱(光谱集图)一致。
USP和EP中红外鉴别这样描述:如果样品与对照品在固态获得的光谱显示出差异,则将要检查的物质和参考物质分别溶解在异丙醇(品种不一样,溶剂也不一样,这里随便举个例子)中,蒸发至干燥并使用残余物记录新的光谱。
对于多晶型药物,中国药典的描述将是一个不可逾越的坎,某些多晶型药物的红外是存在差异的,中国药典中的检测方法实际已经规定了你只能做出与对照品一致的晶型才能是合格的产品,而USP与EP则不是,将样品与对照品在相同的溶剂中重新溶解、蒸发干燥即排除了晶型的影响。

以乳糖为辅料的苯磺酸氨氯地平片工艺优化作者:孙国萍来源:《科学与财富》2018年第23期摘要:随着人们生活水平的提高,一些身体问题也逐渐出现,患有高血压,糖尿病的人数不断增加。
苯磺酸氨氯地平片作为一种治疗高血压,冠心病的药物,其药用效果关系到人们的生命安全。
在传统制药过程中,由于苯磺酸氨氯地平片中的两个试药混合在一起,导致成品的药效下降。
本文就是通过实验的方法对传统直接压片的工艺和改良后的工艺在过程中对比,观察改良后的工艺做出的苯磺酸氨氯地平片的药用效果。
关键词:苯磺酸氨氯地平片;乳糖;工艺优化一、进行工艺优化的原因苯磺酸氨氯地平是美国辉瑞公司研制的一种抗高血压的药物。
在1992年进入中国市场。
因为乳酸的溶水性良好,在服用后能快速分解,短时间内产生药效。
因此乳糖成为制作苯磺酸氨氯地平片不可缺少的辅助原料,但苯磺酸氨氯地平片中的伯氨基会与乳糖发生反应,导致按原有方式制成的苯磺酸氨氯地平片具有药效低的问题[1]。
所以国家药典委员会为了提高药效,通过实验对苯磺酸氨氯地平片进行工艺优化。
二、实验仪器和试药(一)实验所需的仪器在实验过程中,仪器作为辅助仪器是必不可少靠的,最常见仪器有试管,镊子等。
但在不同的实验中都有属于其实验的专属仪器。
在这次实验中需要准备的专属仪器有智能溶出度试验仪,紫外线光光度计,电子天平,恒温干燥箱,单冲压片机和微型颗粒机等。
在实验中仪器的使用可以最快达到想要的结果,因此仪器设备在每个实验中都起到极其重要作用。
(二)实验所需的试药为了优化苯磺酸氨氯地平片的工艺,在实验中除了必要的苯磺酸氨氯地平原料药和乳酸以外,还需要硬脂酸镁,淀粉,微晶纤维素等试药。
实验要求较高的技术性和准确性,所以应对于每种试药的用量有严格的控制,并且在加入试药的顺序也不容改变。
否则会造成严重的后果[2]。
本实验的目的是研究每种试药的用量和加入的顺序,使得产品药效达到最好。
三、实验方法(一)传统的直接压片法美国辉瑞公司的苯磺酸氨氯地平片的制成,但来了许多的便利,控制了当时的高血压的病症,拯救了部分人的生命,传统的直接压片法的主要过程为:首先将苯磺酸氨氯地平、交联聚维酮和硬脂酸镁过筛,分别过100目筛。
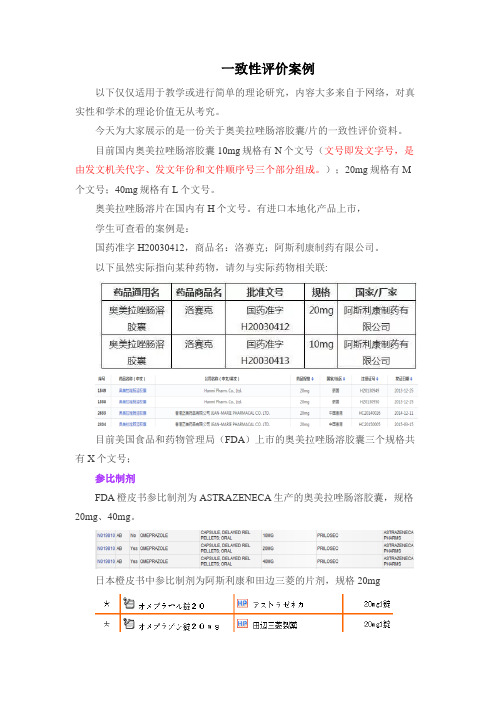
一致性评价案例以下仅仅适用于教学或进行简单的理论研究,内容大多来自于网络,对真实性和学术的理论价值无从考究。
今天为大家展示的是一份关于奥美拉唑肠溶胶囊/片的一致性评价资料。
目前国内奥美拉唑肠溶胶囊10mg规格有N个文号(文号即发文字号,是由发文机关代字、发文年份和文件顺序号三个部分组成。
);20mg规格有M 个文号;40mg规格有L个文号。
奥美拉唑肠溶片在国内有H个文号。
有进口本地化产品上市,学生可查看的案例是:国药准字H20030412,商品名:洛赛克;阿斯利康制药有限公司。
以下虽然实际指向某种药物,请勿与实际药物相关联:目前美国食品和药物管理局(FDA)上市的奥美拉唑肠溶胶囊三个规格共有X个文号;参比制剂FDA橙皮书参比制剂为ASTRAZENECA生产的奥美拉唑肠溶胶囊,规格20mg、40mg。
日本橙皮书中参比制剂为阿斯利康和田边三菱的片剂,规格20mg对原料药的药理介绍,以下为从说明书上获得的一些资料:性状:本品为白色结晶性粉末溶解度:易溶于N,N-二甲基甲酰胺中,微溶于乙醇(95%)溶液,几乎不溶于水。
解离常数(室温):pKa1(一般来说,较大的Ka值(或较少的pKa值)代表较强的酸,这是由于在同一的浓度下,离解的能力较强。
) = 4.5(针对吡啶环、采用吸光度法测定);pKa1 = 8.9(针对苯并咪唑环、采用吸光度法测定在各溶出介质中的溶解度(37℃):pH 1.2:33.0mg/mlpH 6.0:0.079mg/mlpH 6.8:0.078mg/ml水:0.091mg/ml在各溶出介质的稳定性:水:37℃条件下,2小时降解14%,6小时降解43%。
在各pH值溶出介质中:在pH1.2、pH6.0和pH6.8各溶出介质中,37℃/2小时分别降解83%、97%和8%。
光:未测定。
熔点:约150℃制剂处方根据原研产品的信息以及相关文献报道,原研产品采用的为微丸包衣膜控肠溶工艺,包衣通常味甜,但是区别于常用的胶囊的制作工艺,工艺一般比较复杂,对生产设备要求也较高。

.乳糖简介.乳糖的特性及食品中作用.乳糖在制药中的应用(一水,无水,直压).乳糖的稳定性和储存条件.乳糖的甜度一.简介乳糖是哺乳动物乳汁中特有的糖类,也因此得名。
是一种双糖,为一分子葡萄糖和一分子半乳糖缩合而成,分子较大。
在牛奶中的平均含量为4.6-4.7%。
乳糖经乳糖酶消化后形成葡萄糖和半乳糖,为人类提供营养、提供能源。
二.乳糖的特性及食品中医用二.乳糖在制药中应用药用乳糖在制药业中已使用多年,在药物制剂领域中的应用是它其中的一种主要用途。
片剂生产中,在一定量的药物中加入一种赋形剂,以增加片剂的重量和体积,是常见的一种工艺过程。
加入的这种赋形剂应是具有一定流动性并使混合物能顺利流进模孔形成片剂的无害物质。
乳糖是片剂和胶囊制剂生产中所需的重要物料。
特别是医药、营养和治疗用片剂生产中较常选用的糖类,能溶于水,无臭。
根据其吸附和吸收的特点,还可用做芳香矫味剂和着色剂以增强或控制片剂的芳香和着色。
乳糖在空气中具有高度稳定性,可长期贮藏,易于操作掌握,且与大多数活性药物成分不起作用。
根据乳糖的物理结构,片剂生产中,用它来改善片剂和胶囊剂化合物的流动性,使模孔得到均匀填充,并可能提高生产速率。
乳糖用于重压片、制粒或直接压片中有助于生产出质量优良的片剂。
由于乳糖纯白无味,它也用于皮下注射用制剂的生产。
此外,根据它的吸附和吸收性能,在片剂生产中,可用来控制矫味和着色。
由于乳糖易于掌握控制,且能提高抗生素的产量,在大多数发酵介质中,药用乳糖是其中所需糖类的首选。
药用一水乳糖一水乳糖:O-β-D-吡喃半乳糖基-(1→4)-α-D-吡喃葡萄糖一水合物[10039-26-6]分子式C12H22O11H2O分子量:360.31(一水化合)。
一水乳糖CP、USP/NF、BP:广泛用做片剂和胶翼剂的填充剂和稀释剂,也用干粉末吸入剂的稀释剂,乳糖加至冻干溶液中可增加体积并有助干冻干块状物形成。
药用乳糖为优良的填充及粘合新型辅料,不仅能提高片剂硬度,增加耐磨性能,外观光洁细腻,而且还可提高内在“溶出”性能,特别对难溶性药物具有促进体内生物利用度的作用。

2017年仿制药一致性评价口服降糖药行业分析报告2017年10月目录一、供给侧改革,大领域有望孕育大机遇 (5)1、基药口服固体制剂需在2018 年底前完成一致性评价 (5)2、一致性评价是中国医药行业的供给侧改革 (5)3、大疾病领域有望孕育大机遇 (5)二、甜蜜的诱惑,口服降糖药为有效手段 (9)1、糖尿病分型四类,2 型糖尿病患者占90%以上 (9)2、糖尿病临床诊断以静脉血浆血糖检测结果为准 (10)3、中国糖尿病患者人数约1.1 亿 (11)4、糖尿病并发症多,相关市场达千亿人民币 (11)5、糖尿病治疗首选二甲双胍,最终进入胰岛素治疗阶段 (12)6、不同口服降糖药副作用有所不同 (13)7、中国糖尿病药品市场仍以口服降糖药为主 (15)三、口服降糖药领域的一致性评价进展 (15)1、α-糖苷酶抑制剂类:规模最大的口服降糖药 (16)(1)阿卡波糖76 亿,华东医药正在进行BE 试验 (18)(2)伏格列波糖13 亿,京新药业较早备案参比制剂 (20)2、磺脲类胰岛素促泌剂:糖尿病治疗一线备选用药 (21)(1)格列美脲23 亿,扬子江已完成BE 试验 (23)(2)格列齐特16 亿,多家企业备案参比制剂 (25)3、双胍类:贯穿糖尿病治疗全过程的首选用药 (26)(1)二甲双胍40 亿,悦康药业与博雅生物已完成BE 试验 (26)4、格列奈类:非磺脲类胰岛素促泌剂 (29)(1)瑞格列奈20 亿,多家企业备案参比制剂 (30)5、噻唑烷二酮类:糖尿病治疗的二线用药 (31)(1)吡格、罗格列酮已有多家企业备案参比制剂 (32)6、DPP-4 抑制剂类:副作用少的新型口服降糖药 (34)(1)格列汀类:尚无国内企业上市 (34)四、竞争格局有望改写,寻找边际投资机会 (37)1、原研主导的竞争格局有望改写 (37)2、市场格局变化中的投资机会 (42)五、制药行业进入长周期新起点 (44)六、主要风险 (45)1、一致性评价推进进度低于预期 (45)2、政策鼓励力度低于预期 (45)一致性评价下大领域大品种有望孕育新机遇。

乳糖是一种常用的药用辅料,在药品制剂中充当多种功能的角色。
根据其性质和用途的不同,可以将乳糖药用辅料分为以下几个分类:
1. 压片辅料:乳糖可以用作一种压片辅料,用于增加药片的体积和增加药片的质量,使药片易于制剂和患者服用。
同时,乳糖作为压片辅料还可以提供辅助功能,如调节药物释放速率、增加药片的机械强度等。
2. 填充剂:乳糖可以作为一种填充剂,在制备硬胶囊剂或者混合物时,用于调节颗粒的体积和填充程度。
填充剂的作用是填充空隙,使药物颗粒或者混合物均匀地分布在胶囊内部。
3. 离散剂:乳糖在一些药物制剂中充当离散剂,用于防止粉状药物颗粒的聚集和粘连。
通过添加适量的乳糖,可以减少颗粒的静电吸引力,使药物粉末颗粒保持离散状态。
4. 溶剂:乳糖可以在一些药物制剂中作为溶剂使用。
在某些颗粒或颗粒混悬剂制剂中,乳糖可以作为溶解性较好的溶剂,有助于溶解或悬浮药物颗粒。
以上是乳糖作为药用辅料的一些常见分类。
在具体的制剂设
计和制备过程中,根据药物特性和制剂要求选择合适的乳糖用途和用量,并遵循相关法规和标准。
需要注意的是,由于个体差异和过敏反应的可能性,一些特定人群可能对乳糖过敏或不适应,因此在制剂设计和药品标签中需要明确乳糖的使用情况,以满足特定需求。
建议在使用乳糖辅料时,根据具体药物制剂和药品标签的指导使用,遵循医生或药师的建议。


289种药品列入一致性评价目录CFDA今日发布关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告(2022年第106号),指出289种化学药品仿制药口服固体制剂原则上应在2022年底前完成一至性评价。
以下全文:为贯彻落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2022〕8号),提高仿制药质量,现将有关事项公告如下:一、评价对象和实施阶段(一)化学药品新注册分类实施前批准上市的仿制药,包括国产仿制药、进口仿制药和原研药品地产化品种,均须开展一致性评价。
(二)凡2007年10月1日前批准上市的列入国家基本药物目录(2022年版)中的化学药品仿制药口服固体制剂(附件),原则上应在2022年底前完成一致性评价。
(三)上述第(二)款以外的化学药品仿制药口服固体制剂,可以自行组织一致性评价;自第一家品种通过一致性评价后,三年后不再受理其他药品生产相同品种的一致性评价申请。
二、参比制剂的选择和确定(四)药品生产企业对拟进行一致性评价的品种,参照《普通口服固体制剂参比制剂选择和确定指导原则》(食品药品监管总局公告2022年第61号)要求选择参比制剂。
(五)药品生产企业按照《仿制药质量和疗效一致性评价参比制剂备案与推荐程序》(食品药品监管总局公告2022年第99号),将选择的参比制剂向食品药品监管总局仿制药质量一致性评价办公室(以下简称一致性评价办公室)备案。
行业协会可向一致性评价办公室推荐参比制剂,原研药品生产企业、国际公认的同种药物生产企业可向一致性评价办公室申报参比制剂。
一致性评价办公室主动对参比制剂的备案、推荐和申报信息向社会公开。
食品药品监管总局及时公布推荐和确定的参比制剂信息,药品生产企业原则上应选择公布的参比制剂开展一致性评价。
(六)企业找不到且无法确定参比制剂的,由药品生产企业开展临床有效性试验。
三、一致性评价的研究内容(七)在开展一致性评价过程中,药品生产企业须以参比制剂为对照,全面深入地开展比对研究。
一致性再评价实际案例分享格列美脲片:采用颗粒乳糖Tablettose 80湿法制粒促进溶出盐酸氟桂利嗪胶囊盐酸氟桂利嗪胶囊:筛分:筛分:筛分乳糖乳糖Spherolac 100或颗粒乳糖tablettose80胶囊
粉末直接填充Lactose | ©MEGGLE
9/20/2016卡托普利片:采用Flowlac 100直接压片
马来酸依那普利片:采用Flowlac 100进行直接压片
盐酸氨溴索片:采用Flowlac 100直接压片或者Granulac200湿法制粒头孢拉定胶囊:采用Spherolac 100或者Tablettose 80干法制粒装干法制粒装胶囊胶囊
一致性再评价实际案例分享甲钴胺片:采用Flowlac 100
进行直接压片阿托伐他汀钙:Granulac70 湿法制粒
盐酸
盐酸西替利嗪片:采用西替利嗪片:采用Tablettose 80
进行直接压片Lactose | ©MEGGLE 9/20/2016多潘立酮片:采用Granulac 200湿法湿法制粒制粒
氯沙坦钾片:采用Cellactose 80或者Flowlac 100直接压片赖诺普利:flowlac1000直接压片
多奈哌多奈哌齐:齐:Flowlac100直接压片
一致性再评价实际案例分享瑞舒伐他汀:flowlac100直接压片
阿苯达唑:spherlac100湿法制粒单硝酸异山梨酯硝酸异山梨酯片和缓释片:片和缓释片:片和缓释片:采用采用Flowlac 100
直接压片Lactose | ©MEGGLE 9/20/2016特布他林片:spherlac1000湿法制湿法制粒粒优甲优甲乐:乐:Granlac200湿法制粒
特布他林片:spherlac1000湿法制粒阿苯达唑:spherlac100湿法制粒。